INTRODUCCIÓN
El 8% de los fumadores muestra alguna anomalía pulmonar intersticial (ILA: interstitial lung abnormality) en la tomografía de alta resolución de tórax (TACAR)1, término que puede definirse como imagen (vidrio esmerilado, reticulaciones, distorsión pulmonar, bronquiectasias de tracción, panalizacion y quistes no enfisematosos) en zonas no dependientes de la gravedad, identificada incidentalmente y que compromete al menos 5% del pulmón (lóbulo superior, medio o inferior)2,3. Otro grupo menciona que casi el 54% de los individuos que fuman pueden presentar patrones en vidrio esmerilado con o sin reticulación, o agrupaciones de quistes de paredes visibles, o nódulos centrilobulares mal-definidos4.
Katzenstein y cols. acuñaron el termino histopatológico “fibrosis intersticial asociada a tabaquismo (SRIF: smoking-related interstitial fibrosis) para definir una forma de fibrosis crónica intersticial que es claramente distinta a otras neumonías intersticiales y que generalmente suele ser un hallazgo incidental en tejidos pulmonares removidos por motivos dispares. De 592 especímenes de lobectomía, Kawabata y cols encontraron alteraciones intersticiales acompañados de cambios enfisematosos en 17% de los casos y las denominaron agrandamiento de espacios aéreos con fibrosis (AEAF), que en ocasiones puede simular a la neumonía intersticial usual y no pocas veces es incluida dentro del síndrome de combinación de fibrosis pulmonar y enfisema5,6.
Así como en radiología y en patología se van erigiendo términos consensuados, en el territorio clínico se ve idéntico escenario. La bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial, la neumonía intersticial descamativa, la histiocitosis pulmonar de células de Langerhans, la fibrosis pulmonar idiopática, la injuria pulmonar asociada a cigarrillos electrónicos o EVALI, la neumonía eosinofílica aguda, la combinación de fibrosis pulmonar y enfisema, la neumonía eosinofílica aguda y los síndromes de hemorragia pulmonar se aglutinan dentro de las llamadas enfermedades pulmonares intersticiales difusas asociadas a tabaquismo (EPIDAT)7,8.
El conocimiento de estas entidades tiene relevancia para su apropiado manejo clínico y aún más en el terreno de la salud pública ya que certifican otro de los tentáculos de afectación respiratoria por el humo de cigarrillo, a más de la EPOC, enfisema, bronquitis crónica, cáncer de vías aéreas, infecciones respiratorias, alteración de la maduración y crecimiento pulmonar, pobre control del asma y disminución de la función pulmonar de la madre y el niño durante el embarazo9. Presentamos tres casos de EPIDAT vistos en un hospital de referencia.
Caso 1
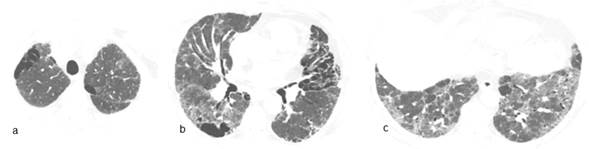
Varón de 66 años, fumador de 90 cajas/año. Taxista. Artritis reumatoide de 5 años de evolución con uso irregular de prednisona y leflunomida. Consultas previas en varios hospitales. Disnea hace 1 año progresiva hasta mínimos esfuerzos y dos episodios de sincope. Dolores de mano y rigidez matutina de articulaciones metacarpo falángicas ocasionales. Niega fiebre. Frecuencia respiratoria 20xmin, frecuencia cardiaca 98xmin; SatO2 90%; Crepitantes finos bilaterales bibasales. Leucocitos, 10800/mm3; VSG 24 mm, PCR (-), FR (++), Anti CCP (++), HIV (-). La TACAR de tórax se muestra en la figura 1. Espirometría: capacidad vital forzada (CVF) 59% del valor previsto, volumen espiratorio forzado en el primer segundo (VEF1) 67% del previsto y VEF1/CVF 78; Test de marcha de 6 minutos (TM6M): 65% recorrido de distancia prevista con SatO26%; Ecocardiografía informa presión sistólica de arteria pulmonar (PSAP) 45mmHg: Gasometría arterial: pH 7,43 PaO2 57 torr PaCO2 29 torr SatO2 90%. Se niega a internación. Se sugiere oxigenoterapia, inmunizaciones pertinentes, tratamiento para cese de tabaquismo y de enfermedad pulmonar intersticial e interconsulta con reumatología. El diagnóstico inicial es de síndrome de combinación de fibrosis pulmonar y enfisema más hipertensión pulmonar, asociados a artritis reumatoide.
Caso 2
Varón de 71 años, fumador 45 cajas/año, comerciante con Diabetes mellitus tratado con hipoglicemiantes orales. Presenta disnea a grandes esfuerzos de un año de evolución que se hace a pequeños esfuerzos desde hace 3 meses. Escasa tos seca y chillido de pecho ocasional. Frecuencia cardiaca 86 x min; SatO2 90%. Acropaquia. Se auscultan crepitantes en ambas bases hasta campo medio. La TACAR de tórax muestra calcificación coronaria extensa de la rama descendente anterior (no mostrada en la figura 2) con llamativo compromiso del parénquima pulmonar. Espirometría: CVF 66% del valor previsto, VEF1 67% del previsto y VEF1/CVF 79; Prueba de difusión de monóxido de carbono ajustada a hemoglobina (DLCOaj) 19% del previsto. Ecocardiograma: disfunción diastólica leve del ventrículo izquierdo, dilatación auricular bilateral, sin signos directos ni indirectos de hipertensión pulmonar. Se sospecha neumonía intersticial descamativa (DIP: desquamative interstitial pneumonia) y como medidas de tratamiento se sugieren: cese de tabaquismo, oxigenoterapia, broncodilatadores, rehabilitación pulmonar y tratamiento con prednisona. Meses después, ante la falta de respuesta terapéutica se agrega micofenolato.
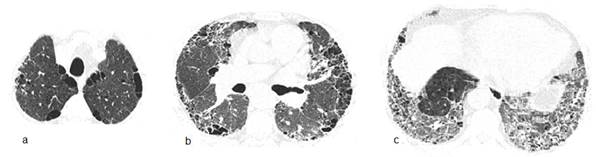
Figura 1. TACAR de tórax. (a) Enfisema paraseptal en región apical bilateral. (b) Agrandamiento de espacios aéreos periféricos en campo medio junto a espesamiento de septos interlobulares y dilatación de ramo derecho de la arteria pulmonar en el corte de campo medio. (c) Patrón de vidrio esmerilado que respeta ciertas áreas y bronquiectasias de tracción con septos ensanchados que deforman la arquitectura en las bases.
Caso 3
Varón 21 años, funcionario público, fuma 5 cajas/año, niega consumo de sustancias ilícitas, es traído a sala de urgencias por dolor agudo en hemitórax derecho acompañado de disnea intensa. Se constata neumotórax del lado derecho (Figura 3) que evoluciona favorablemente con drenaje pleural sellado bajo agua. Antecedente de cuadro similar un año atrás. Las imágenes sugieren el diagnóstico de histiocitosis de células de Langerhans. Se inicia tratamiento anti tabáquico (bupropión, terapia sustitutiva con nicotina y abordaje conductual).
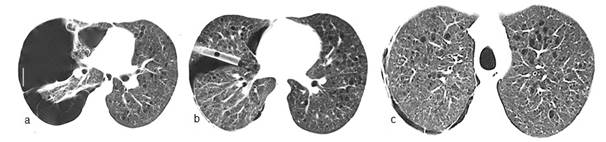
Figura 3. TACAR de tórax. (a) Neumotórax significativo a derecha y bridas a pleura que impiden el colapso total mientras que numerosos espacios quísticos se observan en campo pulmonar superior izquierdo. (b) Expansión del parénquima afectado y tubo pleural, además de notorios quistes bilaterales acompañados de nódulos. (c) Mayor profusión de nódulos en base junto a quistes en región medular con mínimo neumotórax a derecha.
DISCUSIÓN
Varias afecciones heterogéneas de las vías aéreas y del parénquima pulmonar son agrupadas dentro del término enfermedades pulmonares intersticiales difusas asociadas al tabaquismo (EPIDAT) y las mismas tienen variadas expresiones clínicas como disnea progresiva, tos productiva y/o chillido. Estos síntomas no se observan generalmente en las anomalías pulmonares intersticiales (ILA), entidad crecientemente identificada en los fumadores y que, aunque sea hallazgo incidental, confiere un peor curso clínico y mayor mortalidad a los pacientes con EPOC10. El 20% de ILA progresa a los dos años o 73% a los 5 años, pudiendo representar fibrosis pulmonar subclínica o precoz sobre todo aquellas que tienen localización subpleural11. Diferenciar las EPIDAT de las ILA constituye un gesto clínico fundamental frente a individuos fumadores que consultan por síntomas o hallazgos radiológicos casuales.
El síndrome combinado de fibrosis pulmonar y enfisema (SCFPE) generalmente se observa en hombres con alta carga de tabaquismo que refieren disnea progresiva y presentan crepitantes posterobasales a la auscultación torácica. La TACAR es el pilar diagnóstico ya que muestra el componente enfisematoso (paraseptal, centrilobular o panlobular) en la región superior y el componente intersticial (neumonía intersticial usual, neumonía intersticial no específica o neumonía intersticial descamativa) en la región inferior12. Las mediciones en espirometría no son tan características como la disminución en la DLCO y en las variables obtenidas en el TM6M13. En el caso aquí reportado podemos constatar estas características funcionales que también podrían ser expresión vectorial de la hipertensión pulmonar, entidad invocada como desenlace relevante del SCFPE14. Sin embargo, lo más resaltante es la asociación del síndrome con la artritis reumatoide (AR) en la cual debe considerarse como una manifestación diferenciada en el espectro del “pulmón reumatoide” en fumadores o ex fumadores. Generalmente y comparada al SCFPE idiopático, se da en individuos más jóvenes, puede anteceder al cuadro florido de la AR y conlleva mejor pronóstico15. Se describe que la esclerosis sistémica, la enfermedad mixta del tejido conectivo, la poliangitis microscópica, la asbestosis y la silicosis también pueden estar asociadas12.
La neumonitis intersticial descamativa, diagnostico probable del segundo caso, es una enfermedad poco frecuente que se adscribía exclusivamente al hábito de fumar, sin embargo una revisión reciente encontró que hasta el 19% puede asociarse a otras causas16. La disnea y la tos (de 13 meses de evolución en promedio) en el contexto de un patrón funcional restrictivo junto a opacidades en vidrio esmerilado en regiones inferiores a la TACAR torácica, constituyen el escenario clínico usual. La confirmación histopatológica no se realizó debido al alto riesgo que suponían los procedimientos invasivos en el paciente. Nótese que en la figura 2 hay concomitancia de enfisema paraseptal y AEAF, lo que evoca ciertas formas de SCFPE. La DIP no es tan benigna como imaginamos, ya que conlleva 25% de mortalidad con variable y heterogénea respuesta (65%) al tratamiento (cese de tabaco y corticoides) pudiendo mostrar recidiva hasta en 18% después de completar la terapia17.
La histiocitosis de células de Langerhans es una enfermedad de origen desconocido categorizada en formas localizadas (afecta hueso, piel y pulmón) y formas sistémicas. También se la conoce como histocitosis x o granuloma eosinofílico. El compromiso pulmonar exclusivo se suele ver en varones fumadores en los cuales la acumulación de las células de Langerhans en granulomas bronquiolocéntricos podría ser una respuesta reactiva (clonal o neoplásica) a algún agente aún no identificado18. Estos granulomas son expresión de la fase precoz, pues en las fases posteriores aparecen los difusos quistes con paredes finas, cuya ruptura explica que el neumotórax sea la primera manifestación de la enfermedad en 50% de las veces, como se constata en el tercer caso narrado aquí19. La TACAR ha reducido la necesidad de confirmación histopatológica y muestra que las lesiones asientan preferencialmente en regiones pulmonares medias o superiores. Las imágenes varían según la evolución de la enfermedad, predominando los nódulos o nódulos cavitados en estadios precoces y los quistes característicos en etapas tardías20.
La historia natural de la enfermedad es impredecible ya que puede retroceder en 25% de los casos, permaneciendo estable en su expresión clínica y radiológica en 50% y progresar hacia una forma destructiva extensa en los otros 25%21. El abandono del hábito tabáquico es prioritario en el manejo. Se reporta la utilidad de corticoterapia o el uso de cladribina (antimetabolito análogo de las purinas) en algunos casos. En casos avanzados hay que tener en cuenta la posibilidad del trasplante pulmonar22.
Entre 19,9% a 25,9% de los hombres y el 5% a 7,4% de las mujeres fuman en el Paraguay, donde se relata que 3354 personas mueren anualmente como consecuencia del tabaquismo. La enfermedad isquémica cardiaca, los accidentes cerebrovasculares, la EPOC y el cáncer de pulmón son usualmente los trazadores epidemiológicos en estas estimaciones23. Un estudio reciente detalla la fuerza de asociación entre la carga tabáquica (paquetes año o cigarrillos por día) y varios desenlaces de salud específicos. En este meta-análisis de relación dosis-respuesta, se demuestra que las siguientes enfermedades están asociadas con el hábito de fumar: cáncer de laringe, aneurisma aórtico, enfermedad arterial periférica, cáncer de pulmón, cáncer de faringe, EPOC, infecciones de vía aérea inferior, cáncer de páncreas, cáncer de vejiga, tuberculosis, cáncer esofágico, cáncer de cérvix, esclerosis múltiple, artritis reumatoide, lumbalgias, enfermedad cardiaca isquémica, ulcera péptica, degeneración macular, cáncer gástrico, accidentes cerebrovasculares, diabetes tipo 2, cataratas, cáncer nasofaríngeo, Alzheimer y otros tipos de demencia, enfermedades de vesícula biliar, fibrilación y flutter auricular, cáncer de labios y cavidad oral y cáncer de mama24. En este reporte presentamos tres casos de EPIDAT, un grupo de patologías que debería acrecentar el glosario de enfermedades a ser tenida en cuenta en pacientes fumadores que consultan por quejas respiratorias.
CONCLUSIÓN
Presentamos casos de síndrome de combinación de fibrosis pulmonar y enfisema, neumonitis intersticial descamativa e histiocitosis de células de Langerhans como parte del grupo de enfermedades pulmonares intersticiales difusas asociadas a tabaquismo (EPIDAT). En la historia clínica, sea en atención primaria o especializada no debe obviarse jamás el interrogatorio sobre hábito tabáquico pues el abanico de posibilidades diagnósticas inherentes es amplio, como se discute en este trabajo.