INTRODUCCIÓN
El síndrome de sepsis grave post esplenectomía (OPSI) define a todo cuadro de sepsis, neumonía grave y meningitis secundario a bacterias encapsuladas, virus, parásitos, protozoos, en pacientes con antecedentes de asplenia o hipoesplenismo 1. El hipoesplenismo y asplenia secundaria a una esplenectomía confiere un elevado riesgo de adquirir infecciones por microorganismos encapsulados (Streptococcus pneumoniae, Haemophilus influenzae tipo B, Neisseria meningitidis), 12 a 25 veces mayor en relación a la población general y que se asocian a una mortalidad superior al 80% 1-4. La incidencia en niños con asplenia o hipoesplenismo ha sido estimada en 1 de cada 175 al año, y en adultos 1 por cada 400-500 esplenectomizados al año. El mayor riesgo para desarrollar OPSI es durante los 2 primeros años posteriores a la esplenectomía, pero este se puede presentar hasta los 40 años posteriores. Por lo tanto, se considera que el riesgo de presentar sepsis en paciente asplénico es muy alto y permanente. El riesgo es mayor en menores de 16 años y pacientes cuya enfermedad subyacente se comporta como inmunodeficiencia, enfermedad hemática maligna o que recibe tratamientos que altere el estado inmunitario 5,6.
Las complicaciones más frecuentes de la esplenectomía son infecciosas. Las mismas suelen iniciar en el postoperatorio, con una incidencia de hasta 40%, además. Además, pueden presentarse infecciones graves como OPSI que suele reportarse entre 3 a 5%. El riesgo de infección, aunque comienza inmediatamente en el postoperatorio y en los primeros dos años después del procedimiento, persiste toda la vida. El manejo riguroso de las inmunizaciones, la profilaxis antibiótica y la educación del paciente son indispensables 7-12.
PRESENTACIÓN DEL CASO
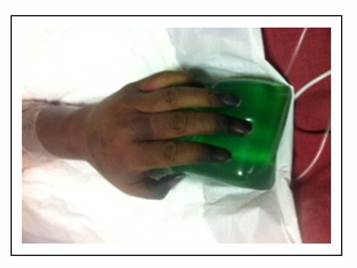
Paciente masculino de 55 años con antecedente de esplenectomía hace 30 años sin inmunización posterior ni seguimiento, quien presenta desde hace varios meses a nivel de piel petequias sin causa aparente. De manera súbita, tras la ingesta de comida copiosa (mariscos), presentó deposiciones líquidas en moderada cantidad con abundante moco, así como náusea que llega al vómito de contenido alimentario por 8-10 ocasiones. Se administró paracetamol sin lograr aliviar el cuadro, razón por la que acudió al servicio de emergencia de institución privada de la ciudad de Quito, Ecuador donde presenta, además de la sintomatología descrita, desorientación y dificultad respiratoria evidenciada por disnea con cianosis central. Debido a esto se decidió su ingreso a la Unidad de Terapia Intensiva donde presenta una presión arterial de 80/50 mm Hg, frecuencia cardiaca de 125 latidos por minuto, frecuencia respiratoria 30 respiraciones por minuto, temperatura axilar 36,8 °C, acrocianosis (Gráfico 1), saturación O2 al aire ambiente 75% que con apoyo de O2 por mascarilla incrementa hasta 85%. El control gasométrico muestra tendencia a la acidosis respiratoria y se observa inadecuada mecánica ventilatoria por lo que requirió asistencia ventilatoria.
Estudios de laboratorio al ingreso demuestran hemoglobina 17,5 g/dL, hematocrito 56,3%, plaquetas 95.000/mm3, leucocitos 14.000/mm3, neutrófilos 90%, linfocitos 5%, cayados 4%, tiempo de protrombina 29,0 segundos, tiempo de tromboplastina parcial 76,9 segundos, INR 3,02, glucosa 119 mg/dL, creatinina 4,20 mg/dL, BUN 35,47 mg/dL, lactato 10, bilirrubina total 4,05 mg/dL, bilirrubina indirecta 0,60 mg/dL, bilirrubina directa 3,45 mg/dL, procalcitonina mayor a 100 ng/mL (Tabla 1).
Se considera el diagnóstico de choque séptico post esplenectomía más disfunción multiorgánica. Se implementa terapéutica guiada por metas basadas en la campaña “Sobreviviendo a la sepsis” con infusión endovenosa de cristaloides, requerimiento de soporte con fármaco vasopresor a base de norepinefrina. Se inició esquema antibiótico empírico con meropenem 1 gramo endovenoso cada 8 horas y vancomicina 1 gramo endovenoso diario.
Tabla 1 Seguimiento de la respuesta inflamatoria por laboratorio.
| Examen | Ingreso | Día 2 | Día 3 | Día 4 | Día 10 | Día 16 | Día 19 | Día 23 | Día 27 | Día 40 |
| Procalcitonina | 100,00 | 27,60 | 3,42 | 0,87 | 0,45 | 0,35 | 0,31 | 0,41 | 1,00 | 0,35 |
| Creatinina | 4,20 | 3,22 | 3,33 | 5,42 | 3,55 | 2,73 | 1,54 | 1,60 | 1,11 | 0,43 |
| Leucocitos | 14.000 | 33.000 | 28.100 | 26.100 | 23.000 | 18.500 | 17.900 | 19.600 | 21.000 | 22.900 |
| Plaquetas | 9.500 | 10.000 | 114.000 | 227.000 | 50.2000 | 458.000 | 385.000 | 351.000 | 342.000 | 221.000 |
| pH | 7,2 | 7,32 | 7,46 | 7,4 | 7,44 | 7,44 | 7,2 | 7,34 | 7,3 | 7,4 |
En reporte de hemocultivos se evidencia Streptococcus pneumoniae, por lo que se decide desescalar antibioticoterapia a base de penicilina cristalina. Con los datos obtenidos se documenta que el paciente presenta un síndrome de OPSI por la sintomatología previa y el estado de choque desencadenado por el proceso infeccioso en un paciente esplenectomizado sin profilaxis neumocócica.
El paciente permaneció con apoyo vasopresor durante 72 horas, soporte de ventilación mecánica invasiva por 10 días, inició terapia de remplazo renal (diálisis) a los 7 días de inicio de cuadro clínico por perpetuación de fallo renal. En su evolución desarrolla cuadro de pancreatitis aguda. A los siete días posteriores al retiro de ventilación mecánica invasiva presenta signos de insuficiencia respiratoria severa por lo que fue necesario el reingreso a ventilación mecánica invasiva permaneciendo en la misma por 10 días con diagnóstico de neumonía nosocomial tardía más sepsis por catéter. Se inició terapia antimicrobiana empírica en base a ureidopenicilina, quinolonas y oxazolidinonas. La filiación microbiológica de hemocultivos realizados a los 7 días reporta Staphylococcus aureus resistente a meticilina, se continua antibioticoterapia propuesta.
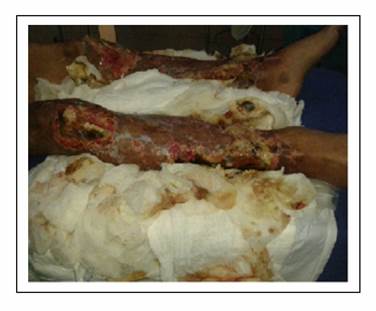
Como parte de su evolución y dentro de las complicaciones del síndrome desarrolla púrpura cutánea en cara, brazos y piernas desde su ingreso que posteriormente se tornan de características necróticas en manos, tercio distal de antebrazo, así como en tercio medio de muslo hasta tercio inferior de piernas (Gráfico 2). Por la severidad de la necrosis y ante la necesidad de plantear amputación a nivel de extremidades se realiza angiotomografía de miembros superiores e inferiores que reporta vascularización arterial en el lado derecho hasta la región de la muñeca principalmente por la arteria radial hasta la región del metacarpo y en el lado izquierdo hasta el tercio medio del antebrazo. En los miembros inferiores se logra visualizar de manera adecuada la vasculatura distal por medio de las tibiales anterior y posterior de ambos lados delimitándose parcialmente los arcos plantares. Existe importante edema de los miembros inferiores y superiores, con alteración de realce en las áreas distales, compatible con defectos de perfusión.
Debido a la progresión rápida de necrosis distal de miembros superiores e inferiores se decide realizar amputación hasta tercio medio distal de brazo y mano derecha, con formación de muñón y amputación hasta tercio medio distal de húmero izquierdo con formación de muñón, previa autorización de paciente y familiares. A pesar de las limpiezas quirúrgicas de lesiones instauradas en miembros inferiores (Gráfico 3) al igual que en los miembros superiores, la progresión de necrosis es rápida, por lo que se decide realización de amputación hasta tercio medio bilateral con formación de muñón respectivo. En el postquirúrgico mediato el paciente presenta evolución favorable, sin complicaciones ni presencia de infecciones en muñones ni heridas quirúrgicas. Desarrolla nuevo evento de repunte de infección, se considera nuevo episodio de sepsis asociada a catéter que se documenta en hemocultivo con la presencia de nuevo germen Gram negativo de tipo Enterobacter aerogenes sensible a tigacilina, con lo que completo esquema antibiótico. Presento buena evolución y fue dado de alta vivo.
DISCUSIÓN
El bazo es el principal órgano linfoide en el cuerpo. Los sinusoides que posee el bazo en su estructura filtran la sangre que circula a través de capilares los que secuestran eritrocitos senescentes y dañados de la circulación sanguínea, además de patógenos y toxinas exógenas. Las células mononucleares que se encuentran dentro de esta red capilar fagocitan a las bacterias, virus, parásitos y hongos circulantes, en particular los microorganismos no opsonizados. A dicho nivel se encuentra una gran cantidad de linfocitos B y T con un sistema de opsoninas importante que incluyen los receptores de tipo Toll, lectinas de tipo C, I y receptores scavenger tipo II, los receptores de los macrófagos con estructura colágena, los CD36, el receptor de manosa y otros como los factores del complemento. La ausencia de todos estos receptores predispone al paciente al desarrollo de bacteriemias fuera de la circulación esplénica, los antígenos polisacáridos son poco inmunogénicos en comparación con los antígenos proteicos 3,13-15. Esto contribuye a que la cobertura de polisacáridos de las bacterias pueda evadir la respuesta a receptores que participan en la presentación y opsonización de los microorganismos desempeñando un papel crítico en el control temprano de las infecciones bacterianas, virales, fúngicas y parasitarias 7,11,16. Con su fagocitosis posterior, los pacientes asplénicos pueden desarrollar sepsis con cualquier tipo de microorganismo especialmente relacionada con microorganismos encapsulados como el Streptococcus pneumoniae (mismo que participa en más del 50% de los casos), Haemophilus influenzae, Neisseria meningitidis, parásitos o bacterias intraeritrocíticos, tales como Babesia, Ehrlichia, Plasmodium, Enterococcus, Bacteroides, Salmonella, Bartonella y otras especies que ocasionalmente se han informado ser responsables de OPSI. Recientemente, también se han reportado casos debido a bacterias Gram negativas como Capnocytophaga canimorsus, transmitida a través de mordeduras de perros, gatos u otros animales. Todos estos patógenos resisten a la fagocitosis pero puede ser rápidamente superados en presencia de pequeñas cantidades de anticuerpos de tipo específico excretados a nivel del bazo. En la asplenia o el hipoesplenismo la producción de anticuerpos ante un nuevo antígeno está deteriorada y las bacterias proliferan rápidamente 7,13,17.
El patógeno más peligroso para individuos asplénicos es el S. pneumoniae, al menos el 87% de infecciones son causados por esta bacteria y tan solo el 30% de pacientes han recibido la vacuna antes de presentar OPSI. La inmunización frente a esta bacteria ha sido aceptada como una estrategia preventiva frente a infecciones en la población asplénica. Es el agente más frecuente asilado en hemocultivos (50-90%) de los pacientes con sepsis tras esplenectomía, con tendencia aumentar con la edad y en niños con hipofunción esplénica por la enfermedad de células falciformes. En general son los serotipos 6,14,18,19 y 23. Presenta una tasa de sepsis letal de 2-7%, lo que supone un riesgo 540 veces superior al de la población general, con especial incidencia en menores de 15 años. Actualmente disminuye la incidencia por la vacunación infantil con anti-HIB 4,13,18-20.
Cuadro clínico
Los síntomas son tardíos para el síndrome OPSI. Estos incluyen fatiga, pigmentación de la piel, pérdida de peso, dolor abdominal, diarrea, estreñimiento, náusea, cefalea. La neumonía y meningitis son los síntomas más frecuentes en sepsis severa, para lo que es imprescindible realizar un adecuado diagnóstico diferencial (Tabla 2).
Tabla 2 Enfermedades asociadas con hipoesplenismo o atrofia esplénica 15
| Causas congénitas: Hipoesplenismo aislado congénito Síndrome de Ivemark Síndrome de poliendocrinopatía-candidiasis-distrofia ectodérmica Autoinmunitaria Hipoparatiroidismo Síndrome de Stormorken Enfermedades gastrointestinales: Enfermedad celiaca Enfermedad inflamatoria intestinal Enfermedad de Whipple Dermatitis herpetiforme Linfangiectasia intestinal Enteritis ulcerativa crónica idiopática Enfermedades infecciosas: VIH-SIDA Meningitis neumocócica Malaria Enfermedades hepáticas Hepatitis crónica activa Cirrosis biliar primaria Cirrosis hepática e hipertensión portal Enfermedades onco-hematológicas: Hemoglobina S Trasplante de médula ósea | Enfermedad de injerto contra huésped crónica Leucemia aguda Enfermedades mieloproliferativas crónicas Formas iatrogénicas Exposición a metildopa Esteroides a dosis altas Nutrición parenteral total Irradiación a bazo Enfermedades autoinmunitarias: Lupus eritematoso generalizado Artritis reumatoide Glomerulonefritis Granulomatosis de Wegener Síndrome Goodpasture Síndrome de Sjögren Poliarteritis nodosa Tiroiditis Sarcoidosis Alteraciones en la circulación esplácnica: Trombosis de la arteria esplénica Trombosis de la vena esplénica Trombosis del tronco celiaco Misceláneas: Amiloidosis |
El cuadro es variado: puede ser de presentación lenta que simula un resfriado común en la fase temprana de la evolución, o un cuadro de sepsis sin foco evidente, de pródromo corto que progresa a sepsis grave. Una vez instalada la infección presenta una evolución muy agresiva y de rápido progreso, pasando por el coma y la muerte entre 24 y 48 horas, presentando choque séptico, hipoglicemia, acidosis marcada, hiponatremia, distrés respiratorio y coagulación vascular diseminada. Cuadros sobreañadidos muy comunes encontrados en autopsias son el Síndrome de Waterhouse-Friderichsen, insuficiencia de las glándulas suprarrenales debido a sangrado dentro de dichas glándulas y es causado por una infección meningocócica severa u otra infección bacteriana grave 2,3,21,22.
Tratamiento
El punto crítico en el manejo es el reconocimiento temprano del paciente en riesgo, seguido por un tratamiento inmediato y agresivo. Todos los pacientes asplénicos con fiebre de origen desconocido deben ser tratados como una emergencia médica. La penicilina intravenosa ha sido el tratamiento de elección, debido a que provee una excelente actividad contra neumococo y meningococo. Con el cambio en la patente de resistencia, algunos autores proponen el inicio del tratamiento con un antibiótico de amplio espectro, enfatizando el empleo de drogas con actividad contra S. pneumoniae, H. influenzae y N. meningitidis. En este sentido, la ceftriaxona constituye la droga de elección 13,21,23-26.
El déficit de volumen intravascular se debe corregir en forma agresiva. Otras modalidades terapéuticas, tales como el empleo de vasopresores o heparina para el manejo de la CID pueden estar indicadas en casos seleccionados. Se ha recomendado el empleo de corticoides hasta poder establecer la integridad de la función suprarrenal y en pacientes con meningitis 27.
Si el paciente sobrevive al episodio séptico inicial, las complicaciones de la CID pueden hacer necesaria la amputación de partes distales de las extremidades debido a la necrosis isquémica. La cirugía está indicada en presencia de gangrena de los miembros que pueden actuar como focos secundarios de infección. Las áreas de necrosis de la piel serán tratadas de la misma manera que en los quemados, con desbridamiento e implante secundario. En ocasiones puede ser necesario realizar fasciotomías. Las intervenciones quirúrgicas rara vez están indicadas en el manejo inicial, y las amputaciones, si son necesarias, se realizarán cuando el paciente haya superado la etapa de resucitación 13,28.
Prevención
En la última década diversas publicaciones han llamado la atención sobre la relevancia de esta complicación infecciosa y la importancia de distintas medidas preventivas, que se han agrupado de forma sistemática en forma de guías por parte de comités y sociedades científicas. Dichas medidas preventivas incluyen la profilaxis antibiótica, la administración de vacunas y la educación sanitaria de los pacientes. La utilización de antibióticos profilácticos es muy controvertida, debido a la falta de datos clínicos que avalen su eficacia, a la dificultad que supone tomar antibióticos de forma continuada durante años y al problema creciente de la resistencia antibiótica. En este sentido, debe tenerse en cuenta que la profilaxis debe ir dirigida fundamentalmente contra el neumococo, cuyas tasas de resistencia a la penicilina y otros antibióticos se hallan en franco aumento. De hecho, ya se han comunicado diversos casos de sepsis fulminante causados por cepas de neumococo con resistencia múltiple. Algunos autores recomiendan la profilaxis antibiótica en los niños, por lo menos durante dos años después de la esplenectomía, pero sin una clara evidencia científica; en los adultos, la tendencia creciente es la de no realizar profilaxis, sino recomendar la automedicación inmediata con antibióticos activos frente a neumococo ante la presencia de fiebre o cualquier sospecha de infección, antes de acudir a la consulta médica 4,7,8. Una pauta razonable consiste en la toma de 3 g de amoxicilina oral; es obvio que las personas en riesgo deben disponer del antibiótico en su domicilio. La inmunización mediante vacunas es una estrategia preventiva aceptada de forma universal en estos pacientes. La vacunación antineumocócica, que es la más importante, se realiza mediante la administración de la vacuna polisacárida 23 valente, que incluye más del 75% de serotipos causantes de infección en esta población. Es recomendable vacunar al paciente por lo menos dos semanas antes de la esplenectomía, ya que se cree que la eficacia de la vacuna es menor si se administra después de la intervención, así como si se administra a pacientes sometidos a quimioterapia. Asimismo, se recomienda la revacunación cada 3 a 5 años 18. Existen pocos estudios controlados que demuestren la eficacia de la vacuna antineumocócica en esta población. Los dos estudios más convincentes, uno en 280 niños y otro en 200 adultos, ambos realizados en Dinamarca, demostraron que la vacunación sistemática de todos los pacientes se asoció a la ausencia de casos de sepsis fulminante. Los únicos cuatro casos de sepsis observados en un período de 13 años fueron producidos por serotipos de neumococo no incluidos en la vacuna. En general, se acepta que la respuesta de anticuerpos no es óptima en los pacientes esplenectomizados y que en alrededor del 20% de ellos es débil o inexistente, como ocurre en otros pacientes inmunodeprimidos y en la población muy anciana. La detección de fallos vacunales, mediante la determinación seriada del título de anticuerpos, podría ser útil para identificar población no protegida y plantear estrategias alternativas. En el futuro, el uso de la vacuna antineumocócica conjugada, con mayor capacidad inmunogénica, puede suponer una ventaja. Asimismo, es conveniente plantearse la administración de las vacunas conjugadas frente al meningococo A y C y frente a H. influenzae tipo B, que es ya de uso habitual en la infancia en muchos países 13,19.
CONCLUSIÓN
La esplenectomía es un procedimiento quirúrgico frecuente en el país y es dado por varias causas entre ellas por traumatismos abdominales severos. El caso que lo presentamos y desarrollamos en esta oportunidad es un claro reflejo de la desinformación y falta de apego al seguimiento que todo paciente con asplenia e hipoesplenia debe tener y sobre todo conocer cuáles son los signos de alarma para poder acudir y recibir atención oportuna para evitar una catástrofe orgánica que pueda causar la muerte o dejar serias secuelas funcionales como es el resultado de nuestro paciente. Debería ser una política y por qué no desarrollar un programa nacional de registro, información, educación, vigilancia y prevención de todos los pacientes con esplenectomía o hipoesplenismo para reducir el riesgo de esta grave complicación, porque como se ha insistido en este trabajo, la morbilidad la discapacidad y mortalidad resultan inaceptablemente elevadas para una condición prevenible y tratable cuando se diagnostica de manera temprana y oportuna.
Por lo mencionado sería importante y creemos muy necesario se desarrolle en todo el país los criterios de profilaxis, tratamiento y seguimiento de los enfermos esplenectomizados por cualquier etiología o con hipoesplenismo, para de una manera más oportuna poder brindar una prevención adecuada y tratamiento oportuno a nuestros pacientes.