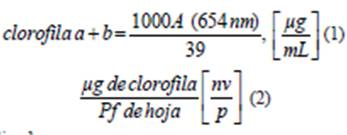INTRODUCCIÓN
El agua es considerada un importante bien y escaso en muchos países de todo el mundo. El nivel elevado de metales como, por ejemplo, cadmio, cromo y mercurio en las corrientes de agua, es una importante preocupación ambiental y para la salud pública, reduce significativamente la calidad del agua, además de causar los efectos adversos sobre los humanos y animales acuáticos (Pandey, 2016). Existen diversas fuentes de estos metales en el agua, tanto de origen natural como antropogénicas. Con el continuo crecimiento de la población mundial y con ella el incremento de industrias, a fin de satisfacer las necesidades humanas, se generan residuos y utilizan recursos en detrimento de la calidad medioambiental.
De la necesidad de proteger y preservar el medio ambiente, se han desarrollados numerosas metodologías de tratamiento de las aguas residuales, para que los contaminantes no lleguen a los cursos hídricos.
En la actualidad, se desarrollan diversas biotecnologías de remediación de aguas entre ellas la fitorremediación que hace uso de los sistemas macrófitas de diversas formas, llamados también filtros verdes o biofiltros, con el fin reducir la concentración o peligrosidad de contaminantes orgánicos e inorgánicos, de suelos, sedimentos, agua, y aire, a partir de procesos bioquímicos realizados por las plantas y microorganismos asociados a su sistema de raíz que conducen a la reducción, mineralización, degradación, volatilización y estabilización de los diversos tipos de contaminantes. Es una tecnología relativamente reciente y se percibe como una tecnología rentable, eficiente, novedosa, respetuosa con el medio ambiente e impulsada por energía solar con buena aceptación pública. La fitorremediación es un área de investigación activa actual. Se están explorando nuevos e hiperacumuladores de metal eficientes para aplicaciones en fitoremediación y fitomejoramien (Alí el at, 2013).
Las operaciones y procesos de las curtiembres, generan residuos líquidos y sólidos que se distinguen por su elevada carga orgánica y presencia de agentes químicos que pueden tener efectos tóxicos, como es el caso del sulfuro y el cromo. Las variaciones en cuanto al volumen de los residuos y la concentración de la carga contaminante se presentan de acuerdo a la materia prima procesada y a la tecnología empleada (Tancioni et al, 2000).
En nuestro país, la mayoría de las curtiembres utilizan sulfato de cromo (III) en la etapa del curti- do, aunque se realizan tratamientos para disminuir la carga de compuestos tóxicos, la concentración de cromo en el agua residual en la salida final de alguna planta de tratamiento, es aún superior a la admitida por la legislación vigente. Art. 7 Res.222/02 SEAM.
Los tratamientos de aguas residuales que involucran macrófitas flotantes, han demostrado ser eficientes en la remediación de aguas con alto contenido de nutrientes y sustancias tóxicas. Su importancia, radica en su aptitud para ser empleado en núcleos rurales, debido a su bajo consumo de energía convencional y la practicidad en el montaje y operación de los sistemas de tratamiento (Martelo& Lara Borrero, 2012)
MATERIALES Y MÉTODOS
Toma de muestras de la especie vegetal
Los ejemplares de E. crassipes fueron colectados de su ambiente natural, el Río Paraguay, en la zona de la Ciudad de San Antonio (25º26’04,1’’ S 57º33’22,4’’ W), Departamento Central Figura1. Las muestras colectadas se colocaron en envases con agua del río. Luego las plantas fueron transportadas hasta el invernadero doméstico construido para este fin, donde se retiraron las partes dañadas y restos de sustancias extrañas de las raíces y fueron lavadas con abundante agua de pozo, se colocaron en un recipiente de 1000 litros para su aclimatación y reproducción, como se muestra en la Figura 2.
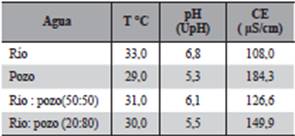
El esquema de adaptación que se muestra en la Tabla 1, consistió en la sustitución parcial del agua del río por agua del pozo, en proporciones 50:50 durante una semana, hasta llegar al 100% de agua de pozo cuyos parámetros físico-químicos se determinaron de acuerdo a los requerimientos de la NP 24 001 80/2011 Agua Potable, empleando los métodos analíticos del “Standar Methods” para análisis de aguas y aguas residuales (APHA, AWWA, 2012). Además se determinó parámetros del agua de río extraído del lugar de la colecta de Eichhornia crassipes, empleando los mismos métodos analíticos
Un ejemplar con flor, fue depositado en el Laboratorio de Análisis de Recursos Vegetales del Departamento de Biología de la Facultad de Ciencias Exactas y Naturales, para su identificación taxonómica.
Los nuevos estolones fueron separados en otros recipientes. Las plantas de Eichhornia crassipes empleadas en los ensayos, se seleccionaron en base al tamaño, peso húmedo y número de hojas.
Toma de muestra de efluente final de curtiembre
Las muestras de efluente final de curtiembre utilizadas fueron provistas por el consultor de la curtiembre PELT S.A. La misma está ubicada en la calle Buena Ventura y Paraguarí, Barrio Santa Librada de la ciudad de Yaguarón, al noroeste del departamento de Paraguarí, distante 48 km de la capital Asunción.
Se determinaron en el efluente los parámetros solicitados en el padrón de calidad de aguas en el territorio nacional resolución 222/02 artículo 7° de la SEAM El método analítico empleado fue según (APHA, AWWA, 2012).
Soluciones de cromo
Se preparó una solución madre de Cr3+ de 200 mg.L-1, a partir de una sal comercial, sulfato básico de cromo Cr(OH)SO , sustancia muy utilizada para la etapa de curtición, mediante cálculo estequiométrico utilizando los datos de las especificaciones del certificado de calidad del producto.
Ensayo de tolerancia al cromo en solución acuosa de E. crassipes
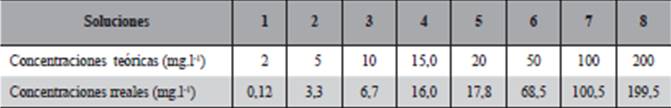
Se prepararon ocho soluciones de diferentes concentraciones que detallan en la Tabla 2 y distribuidos en frascos nuevos de polipropileno de 700 mL conteniendo 500 mL con 5 réplicas de cada concentración, en los cuales se expusieron la Eichhornia crassipes (una unidad en cada vaso) como se ilustra en la Figura 3.
Fueron seleccionadas de acuerdo al número de hojas (entre 3-4 unidades), largo del tallo (16,5±4,7 cm) y largo de la raíz (17,0±7,1 cm). De las 5 réplicas, 3 fueron seleccionados al azar para el monitoreo.
También se realizaron controles que consisten en las plantas expuestas solamente en agua de pozo (control negativo), las soluciones de cromo sin planta (control positivo) y controles de pH.
Ensayo de selección del método de extracción del cromo en las macrófitas
Como parte del trabajo se evaluaron dos metodologías de extracción del cromo captado por las plantas: Vía seca, combustión seca (o calcinación) y Vía húmeda (digestión ácida).
Para ello se utilizó una solución estándar de cromo de 20 mg.L-1 como referencia y las plantas expuestas a concentraciones altas en el ensayo de la evaluación de la tolerancia. Estas muestras de vegetales fueron lavadas con agua de pozo, colo- cadas en bandejas de aluminio y secadas a temperatura ambiente en el invernadero durante 5 días. Luego fueron transportadas al laboratorio, donde se procedió a la separación de raíz y parte aérea. Las fracciones fueron colocadas por separadas en bandejas de aluminio bien identificadas y se continuó el secado en estufa a 75 ±2 ºC durante 48 horas. Una vez terminado el periodo de secado se colocaron en un desecador durante 2 horas y posteriormente fueron molidas, mediante un molino de laboratorio. Estas fracciones molidas se guardaron en frascos de plástico con tapa hermética bien identificada hasta su posterior tratamiento por calcinación y digestión ácida.
El cromo extraído del medio líquido y de los tejidos vegetales se cuantificó mediante lecturas por espectrofotometría de absorción atómica según metodología estandarizada, llama aire-acetileno método 3111 B (APHA, AWWA, 2012)
Ensayo de remoción de cromo de efluente final de curtiembre
Al no detectarse cromo en el mismo siguiendo la técnica convencional, se agrega al efluente la so- lución madre de cromo de 200 mg.L-1 de modo a lograr una concentración final similar a la máxima tolerable por la especie.
El tiempo y las condiciones de exposición, así como los procedimientos de extracción de muestra de efluente y del material vegetal, el procesamiento de las mismas, así como de los controles y la cuan- tificación de cromo fueron iguales a los descritos en el punto anterior.
Se determinó Cr6+ al inicio y final del experimento para observar si hubo oxidación del cromo. El procedimiento se realizó conforme al método colorimétrico 3500-Cr D descripto en el (APHA, AWWA, 2012)
Determinación de clorofila
Con el fin de observar si el crecimiento de las plantas fue afectado por la presencia de Cr3+ se realizaron determinaciones de contenido de clorofila en las plantas. Para ello, se homogeneizaron 0,1 g de hoja del material vegetal fresco en 10 ml de etanol absoluto. Se centrifugaron a aproximadamente 2500 rpm durante 5 min a 15 ºC. La cuantificación de la clorofila a+b se realizó mediante lecturas espectrofotométricas a 664 nm (Wintermans & De Mots, 1965)
Los valores de absorbancia se tradujeron a mi- crogramos de clorofila/g de tejido (o microgramos/ mg), mediante los siguientes cálculos:
V: volumen de etanol usado en la extracion en ml
n: microgramos de clorofila/mL, según la ecuación (1)
Pf: peso fresco del material vegetal presente en el extracto en gramos o miligramos.
Para observar si la cantidad de clorofila se veía afectada por el tratamiento, se evaluó el contenido de clorofila en los vegetales en dos condiciones: el vegetal en agua libre de cromo (control) y los vegetales expuestos a la solución de cromo.
RESULTADOS Y DISCUSIÓN
Colecta de E. crassipes y adaptación a condiciones de cultivo
Suficientes ejemplares de E. crassipes fueron colectados de su ambiente natural, el esquema de sustitución gradual (Tabla 1), del agua del origen por el agua de adaptación resultó exitoso obteniéndose cantidad necesaria de plantas hijas para la realización de los ensayos. La temperatura, pH y conductividad eléctrica del agua del río en el momento de la colecta, el agua de pozo y las proporciones utilizados resultaron favorables para la adaptación.
Evaluación de la tolerancia E. crassipes al cromo en solución acuosa
Las plantas colocadas en las soluciones 1, 2, y 3 (de bajas concentraciones), detalladas en la Tabla 2, presentaron crecimientos normales, comportándose de manera similar al sistema control (soluciones sin cromo), es decir, desarrollaron nuevos estolones y no se observó palidez en las hojas, además vivieron hasta el final del experimento sin evidenciarse signos de deterioro.
Las plantas expuestas a la solución 4, no presentaron signos de marchitamiento en los primeros días de exposición, luego comenzaron a marchitarse, llegando a casi 70% de marchitamiento después de los 4 días. Posteriormente se mantuvieron estables sin nuevos signos de deterioro hasta el día 8, a partir del cual se manifiesta nuevamente marchitamiento seguido de una recuperación con brote de nuevas hojas.
El porcentaje de marchitamiento osciló entre 30 y 70 % durante todo el periodo de observación, llegando a un 60 % al final debido al marchitamiento de las hojas existentes desde el inicio y el desarrollo de nuevos estolones durante todo el periodo de exposición.
La recuperación de las plantas y posterior marchitamiento da indicios de que esta concentración es el límite tolerable. Las plantas en las soluciones 1 al 4, sobrevivieron hasta el final del periodo de ensayo (20 días).
Las E. crassipes que fueron expuestas a altas concentraciones, soluciones de 5 al 6, se marchitaron completamente a los 6 días de exposición sin haber desarrollado nuevos estolones. Esto indicó que estas concentraciones resultaron tóxicas para la especie, como se observa en la Figura 4.
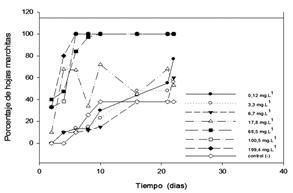
Figura 4 Tolerancia de E. crassipes a distintas concentraciones de cromo en función del tiempo de exposición evaluadas como el porcentaje de hojas muerta.
En un trabajo realizado por Gonzales et al (2017) en tolerancia al metal en cultivares de cebada y trigo, en el caso de Cr, el desarrollo de la planta y los rasgos fisiológicos se vieron significativamente afectados. Para la concentración más alta de Cr.
Ensayo de selección del método de extracción del cromo de las macrófitas
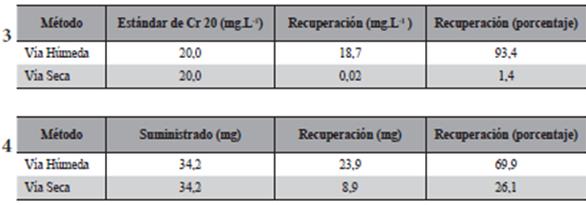
Los resultados de los dos métodos de extracción, vía seca y vía húmeda tanto para un estándar de cromo de 20 mg.L-1 y para el material vegetal seco se muestran en la Tabla 3 y Tabla4 respectivamente.
Se encontró que la cantidad de cromo recuperado en el proceso de vía húmeda fue muy superior al recuperado por vía seca, debido a que hubo menos pérdida de analito comparado con el método por vía seca. La poca recuperación del analito por vía seca podría deberse a la formación de óxidos de cromo durante la incineración de las muestras, y este es insoluble en agua y no es fácilmente atacado por ácidos o bases.
El límite de detección (LD) y de cuantificación (LQ) del mismo en parte aérea y raíces del material vegetal fueron LD (mg.g-1):0,01 y 0,1 LQ (mg.g-1):0,02 y 0,2 respectivamente.
Ensayo de capacidad de absorción de cromo por E. crassipes
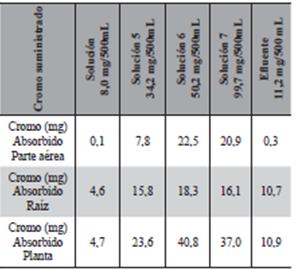
Para determinar la capacidad de absorción de cromo por parte de las plantas, se analizaron muestras expuestas a 500 mL de soluciones ,6,7y 8 que corresponden a cantidades suministrada de 34,2; 50,2 y 99,7 mg de Cr3+ por unidad del vegetal, respectivamente. Después de 6 días de exposición de las plantas a las soluciones de cromo se marchitaron completamente, es decir resultaron tóxicas para la especie.
Tablas 3-4. Recuperación de cromo por vía húmeda y vía seca. 3) a partir de la solución estándar. 4) Recuperación por vía húmeda y vía seca a partir del material vegetal.
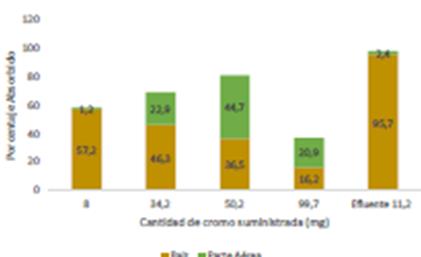
Los análisis del contenido de cromo en las par- tes aéreas de las plantas mostraron un importante aumento de la solución 6 al 7. Acumularon 7,8 a 22,5 mg. respectivamente, seguido de una leve disminución de la cantidad absorbida al aumentar la cantidad de cromo suministrada 20,9 mg. en la solución de 8 y en las raíces se mantuvo entre 15 y 18 mg en las concentraciones altas. El mayor porcentaje absorbido por unidad de vegetal se observó en el suministro de 50,2 mg de Cr3+, (ver Figura 9).
Ensayo de remoción de cromo a partir de una solución de agua de pozo
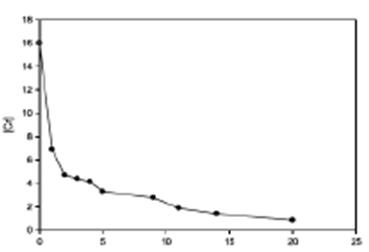
La Figura 5 muestra la variación de la concentración de cromo en la solución (inicialmente de 16,00 mg.L-1), que suministró 8,0 mg Cr+3 por cada recipi- ente que contiene 500 ml de solución y un ejemplar de la especie, Se encontró que la mayor cantidad de cromo fue absorbido en los primeros días de exposición (48 horas), luego disminuye gradual- mente en el transcurso del tiempo, quedando 1,05 mg Cr3+.L-1 al final de los 20 días y no se observó signos de fitotoxicidad.
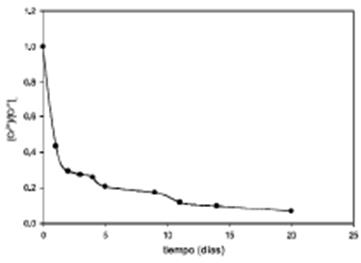
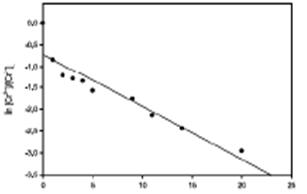
Este tipo de comportamiento se puede asimilar a una cinética de seudo primer orden, graficando la [Cr] vs t, y de acuerdo a la ecuación de cinética de 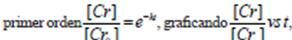 ecuación (3), en la Figura 6, se observa un decaimiento exponencial y linealizando la ecuación aplicando logaritmo natural a la ecuación de primer orden
ecuación (3), en la Figura 6, se observa un decaimiento exponencial y linealizando la ecuación aplicando logaritmo natural a la ecuación de primer orden  ecuación (4), se obtiene la pendiente de la línea recta que corresponde al valor de la constante de absorción se muestra en la Figura 7 y el tiempo de vida media aplicando la fórmula correspondiente
ecuación (4), se obtiene la pendiente de la línea recta que corresponde al valor de la constante de absorción se muestra en la Figura 7 y el tiempo de vida media aplicando la fórmula correspondiente 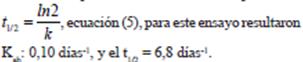
A fin de observar si hubo oxidación de la solución durante el transcurso del experimento, se realizó la determinación de Cr6+ en la solución ac- uosa inicial y al final del tiempo de exposición. En ambos casos, no se detectó la presencia del analito en la solución.
Ensayo de remoción de cromo en efluente final de curtiembre
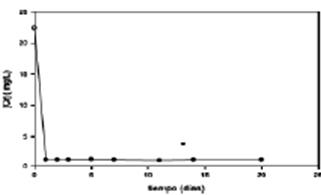
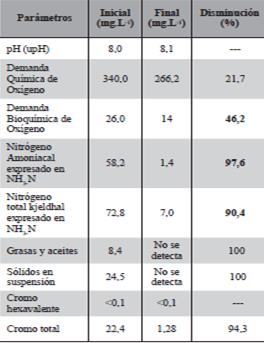
La concentración real de como en el efluente for- tificado se determinó en el momento de iniciar el ensayo arrojando como resultado 22,4 mg Cr3+.L-1 que suministró 11,2 mg Cr3+ por 500 ml de solu- ción a cada unidad vegetal y se procedió como se describió anteriormente.
Se encontró que la máxima cantidad de cromo absorbido en las primeros días de exposición, (48 horas), luego disminuyó a 1,28 mg.L-1, por debajo del máximo admisible para efluente a ser vertidos a cursos de agua, en la solución residual, manteniéndose constante en ese valor por el resto del periodo de ensayo como se observa en la Figura 8.
Mayor cantidad del cromo absorbido se encontró en la raíz del vegetal tanto para la solución como para el efluente, no obstante, hubo mayor remoción de cromo desde el efluente, en total 98,1 % de la cantidad suministrada por unidad de vegetal, se muestra en la Figura 9.
Estos comportamientos son similares a los ob- servados por Maine et al., (2001) para la remoción de cadmio con E. crassipes, a partir de una con- centración de 1 mg Cd.L-1. Dicha concentración fue disminuyendo durante todo el tiempo del ex- perimento. La mayor parte de esta reducción tomó lugar en las primeras 24 horas. A los 21 días la E. crassipes absorbió aproximadamente 72% de la concentración inicial, lo que indicó que la especie tiene una alta capacidad de remoción de Cd.
Se observan en la Tabla 6.y según el estudio realizado por Sricoth et al, (2018) el extenso sistema de raíces de las plantas mejoró la calidad del agua según lo determinó una marcada disminución de la turbidez después de 7 días de tratamiento. El contenido de DBO sirvió como un indicador útil de la calidad del agua; La DBO disminuyó en un 91% en 21 días, E. crassipes acumulo metales tanto en las raíces como en los brotes.
Factor de Translocación y bioacumulación
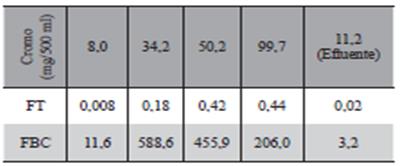
Los datos obtenidos de la Tabla 5 fueron usados para estimar los factores de translocación (FT) y Bioconcentración (FBC). El factor de translocación para el cromo en las plantas se calculó como la concentración de cromo.
en la parte aérea dividida entre la concentración en la raíz. El factor de bioconcentración fue expresado por la proporción de la concentración del metal en la raíz sobre la concentración total en el agua (Tu et al., 2003, Rizzi et al., 2004, Maldonado et al., 2011)
Las Tabla 7 presenta los FT y FBC estimados para las soluciones y del efluente, en todos los casos los factores de translocación resultaron inferiores a uno (FT <1) indicando que no hubo im- portante translocación del metal desde la raíz a la parte aérea, los factores de bioacumulacion mayor a la unidad ( FBC >1), significa acumulación del cromo trivalente en las raíces del vegetal, tanto en soluciones como en efluente y los FBC >>1 en las soluciones de concentraciones altas es sinónimo de un hiperacumuación del metal en la raíz del vegetal.
La distribución de Cr3+ en los tejidos vegetales varió con las concentraciones iniciales del mismo. A bajas concentraciones, la translocación de raíz a la parte aérea fue menor que a altas concentracio- nes, no obstante en ambos casos las raíces fueron el principal acumulador de este metal., según Faisal y Hasnain (2005) La E.Crasipes es un excelente removedor de cromo y otros metales pesados del medio Ambiente.
Los valores de FT Y FBC 0,44 y 206 son muy cercanos a los valores obtenidos por Subhashini& Swamy (2013) en la Fitorremediación de Cd y Cr de suelo contaminado usando Physalis minima Linn, al final de experimento (60 días) se observó que la acumulación de los mismos fue más alta en la raíz que en las partes aéreas, los FT y FBC estimados resultaron, Para Cd 2,17 y 51,2; para Cr 0,48 y 218. FBC 3,2 para Cr encontrado en el efluente de curtiembre (Tabla 7) es muy próximo al encontrado por Pandey (2016) en fitorremediacion en estanque de cenizas volátiles con E.crassipes, Cr (3.75) > Cu (2.62) > Cd (1.05), and Cu (1.35) en la raíz y vástago
Determinación de clorofila
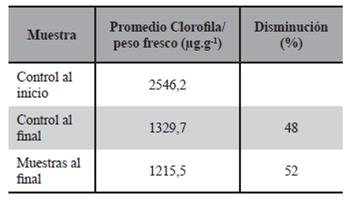
Se encontró, que a lo largo del periodo de ensayo hay una disminución de la clorofila en las plantas, tanto en los ejemplares control, como así también en las plantas que fueron expuestas en solución de cromo, siendo el porcentaje de disminución 48% y 52% respectivamente, como muestra la Tabla 8.
El análisis de varianza de los datos indicó que la disminución del contenido de clorofila en las plantas control y en las expuestas a cromo no es significativamente diferente al 95 % de confianza. La presencia de cromo en el agua no afectó sig- nificativamente el contenido de la clorofila en las plantas expuestas a 16,0 mgCr3+.L-1.
En el trabajo de Yu & Gu (2007) se demostró que el contenido clorofila en las hojas de sauce híbrido tratadas, varió con la dosis de cromo. El contenido de clorofila en las hojas de los sauces expuestos a 7,5 mg Cr.L-1 fue más alto que el de las plantas no tratadas, pero inferior a aquellas tratadas con 30,0 mg de Cr.L-1.
CONCLUSIONES
Los ejemplares de Eichhornia crassipes colectadas se adaptaron y reprodujeron satisfactoriamente y los experimentos se realizaron con los nuevos estolones seleccionados de acuerdo al tamaño, peso y número de hojas.
En cuanto al método de extracción del cromo, se encontró que la vía húmeda fue más eficiente y se utilizaron en todos los ensayos realizados.
La máxima concentración tolerable de las estudiadas resultó 17,8 mgCr3+.L-1, concentraciones inferiores se comportaron como el control y concentraciones mayores resultaron letales para esta especie.
Basado en el FBC estimados y en los análisis estadísticos de la varianza del contenido de cromo en los órganos vegetales. La E. Crassipes resultó una acumuladora de Cr3+ y translocación de Cr3+ de la raíz a las hojas es limitada por la cantidad suministrada y en las condiciones del experimento no hubo oxidación (biótica o abiótica) del cromo trivalente, ni afectó significativamente el contenido de la clorofila en las plantas.
El tratamiento propuesto en este trabajo, muestra que se logra la disminución de cromo en agua residual por debajo de los estándares de la ley. La información sugiere que la bioacumulación de Cr3+ de agua contaminada a través de la fitorremediación es una tecnología alternativa y prometedora de remediación actualmente disponible.












 uBio
uBio