INTRODUCCIÓN
La 3,4-metilendioximetanfetamina (MDMA) es una anfetamina alucinógena prototípica, fue originalmente patentada por Merck en 1914, es un estimulante y entactógeno que induce a euforia y aumento de la conciencia sensorial. En la década de 1980 se comercializó como “Éxtasis” y “E”, y el uso ilícito aumentó significativamente1. La prensa popular notó el fenómeno mundial del uso de MDMA, especialmente en las “fiestas rave”2.
Se ha demostrado que las metanfetaminas aumentan la neurotransmisión de dopamina (DA), serotonina (5-HT) y norepinefrina (NE) y disminuyen la recaptación, al entrar en las neuronas a través de los transportadores 5-HT y DA y desplazar las vesículas de almacenamiento, teniendo una mayor afinidad por los transportadores de 5-HT, lo que provoca una mayor liberación de 5-HT3.
Generando un toxídrome simpaticomimético y serotoninérgico, que ocasiona toxicidad cardiovascular grave, crisis hipertérmicas, hemorragia intracerebral, hepatotoxicidad, rabdomiólisis, vasculitis necrosante y hasta la muerte, se ha evidenciado que el uso crónico de derivados anfetamínicos está relacionado con la adicción, trastornos mentales y comportamientos de riesgo, así como generar miocardiopatía dilatada3.
Presentación del caso:
Ingresa al servicio de urgencias, paciente masculino de 23 años, en compañía de su pareja, quien refiere que ingirió 1 una pila de “éxtasis” posterior a esto presenta inestabilidad para la marcha, actitud alucinatoria, agitación, agresión hetero y autodirigida, palidez mucocutánea y pérdida del conocimiento, con posterior aparición de temblores persistentes, niega consumo de otras sustancias psicoactivas.
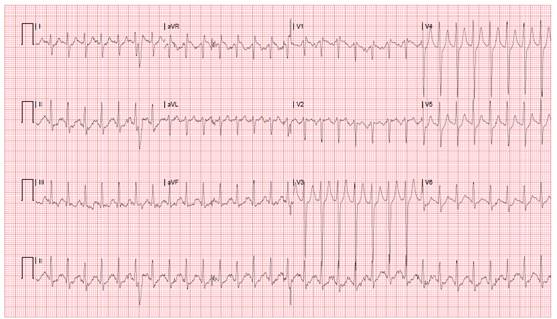
A la valoración primaria, sin protección de vía área por deterioro neurológico con Glasgow 7/15, pupilas midriáticas, hiporreactivas, hipotenso con PS 80 mmHg/PD 40 mmHg, en electrocardiograma se observa taquicardia supraventricular con FC 198 /min. (Figura 1).
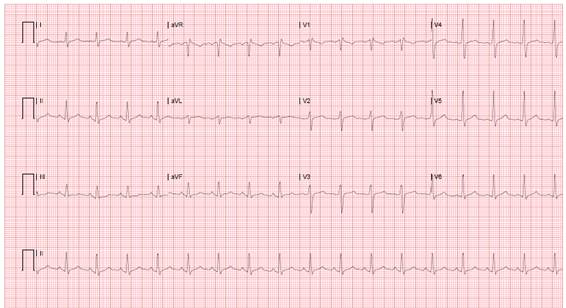
Paralelamente presenta taquipnea FR 23/min, Sat 93% e hipertermia cuantificada en 40.5°C. Ante la presencia de taquiarritmia con criterios de inestabilidad se indica cardioversión eléctrica sincronizada, con 100 Joules (2 descargas) y 150 Joules (3 descargas) y dos bolos de 150 mg de amiodarona, obteniendo ritmo sinusal (Figura 2).
Se realiza reanimación hídrica bolo de ringer lactato 20 cc/kg, aseguramiento de la vía aérea con secuencia de intubación rápida (se administra fentanilo 2 mcg/kg, midazolam 0.1mg/kg, rocuronio 1.2 mg/kg) con posterior infusión de fentanilo, midazolam y cisatracurio, parámetros ventilatorios protectores, con requerimiento de vasopresor, noradrenalina 0.1 mcg/kg/min. Con lo anterior se considera que el paciente cursa con un síndrome simpaticomimético secundario a consumo 3,4-metilendioximetanfetamina (MDMA), asociado a probable hipertemia maligna por lo que se indicó bolo de dantroleno 2.5 mg/kg IV, alto riesgo de rabdomiólisis y falla renal aguda, se solicitó tóxicos en orina, biometría hemática, función y enzimas hepática, renal, fosfocreatinquinasa total, electrolitos gasometría y radiografía de tórax, debido a la alteración del estado de conciencia se solicita tomografía de cráneo simple.
Se recibió reporte de laboratorios de ingreso (Tabla 1) con cuadro hemático con leucocitosis, gases arteriales con trastorno mixto acidosis metabólica con acidosis respiratoria, normoxemia, hiperlactatemia, albumina y calcio ( corregido) sin alteraciones, electrocardiograma control ritmo sinusal, con QT formula corregida de 432ms (Figura 2), con reporte de drogas en orina negativa para opiáceos, cocaína, cannabinoides, barbitúricos y positivos para benzodiacepinas (falseados, toma posterior a inicio de infusión) anfetamina positivos, biomarcadores troponina elevada secundario a taquiarritmia y cardioversiones múltiples versus lesión miocárdica aguda secundaria a toxicidad, CPK Total elevada sospecha de rabdomiólisis con etiología establecer cardioversión y/o efecto toxico; creatinina elevada, se optimiza aporte de líquidos a 3cc/ kg/h con lactato de ringer, con alta probabilidad de falla renal aguda, sin alteraciones de la coagulación al ingreso, se reporte radiografía de tórax y tomografía de cráneo simple normal sin alteraciones.
Al establecer manejo integral y muldisciplinario con equipo de toxicología se definió, intoxicación aguda con toxindrome simpaticomimético y serotoninérgico secundario a MDMA, asociado a contaminación con catinonas, fenetilaminas y/o otros adulterantes; en cuanto a manifestaciones serotoninérgicas presento hipertermia, tratada con medidas física, con sedación y bloqueo neuromuscular (benzodiazepinas).
Equipo de neurología considera que se debe descartar proceso isquémico secundario a respuesta vasoconstrictora simpaticomimética, por lo que se solicitó una resonancia magnética cerebral.
En contexto de paciente críticamente enfermo asociado a un toxindrome simpaticomimético y serotoninérgico continuo manejo en la unidad de cuidados intensivos, donde se suspende soporte vasopresor y continua con soporte Ventilatorio.
Paraclínicos evolutivos, (Tabla 2) CPK total en ascenso > 5 veces de su valor normal, presentando rabdomiólisis, Creatinina elevada > 3 veces de valor basal con gasto urinario de 0.1 cc/kh/h, con lesión aguda KDIGO 3 de etiología isquémica, tóxica y obstructiva por rabdomiólisis, valorado por nefrología quienes indican terapia de remplazo renal hemodiálisis.
Por persistencia de elevación anómala de la temperatura corporal de 39 grados centígrados +/- 3 a 4, se replantea concepto a hipertermia multifactorial considerando etiología por toxindrome simpaticomimético, el cual genera disfunción central de la termorregulación aumentando de esta forma la producción de calor causado por la agitación y por otra parte la estimulación de la termogénesis. Menos probable, hipertermias de origen central asociadas a evento cerebrovascular, sin criterios de hipertermia maligna en el momento, por ende, se suspende dantroleno y relajante muscular, se da manejo con antipiréticos y continua con medios físicos, no evidenciando foco infeccioso.
Hematológicamente cursa con CID (ISHT 7 puntos), sangrado activo leve por catéter central y sonda orogástrica, con INR de 1.6, plaquetas 48.000, trombocitopenia multifactorial, con consumo del fibrinógeno, requirió soporte transfusional, plasma fresco congelado (PFC) 5 UI (10 cc/kg). y 1 CUP de plaquetas, con anemia aguda de volúmenes corpusculares normales, hemoglobina de 10 g/dL sin indicación de transfundir glóbulos rojos.
Al nivel hepático se documenta elevación severa de alanino y aspartato transferasa > 15 veces de su valor normal, con índice R >5 patrón de lesión hepatocelular, bilirrubinas totales aumentadas a expensas de la directa, se considera que cursa con hepatitis multifactorial (hipóxica, tóxica, rabdomiólisis). Se considera criterios para CID dado por INR prolongado por lesión necro inflamatoria hepática multifactorial, sin criterios de King-s Collage para falla hepática, se inició manejo con N-acetilcisteína.
Al nivel cardiovascular marcada elevación de biocarmacador cardiaco troponina I y ecocardiograma transtorácico, con fracción de eyección conservada del 63% sin trastorno de la contractibilidad, se consideró injuria miocárdica secundaria a efecto de toxindrome y cardioversión eléctrica.
Para valorar estado neurológico se suspende sedación con Glasgow de 10/15, con mioclonías de Lance-Adams, lo cual confiere mal pronóstico. La resultado de resonancia magnética cerebral muestra una alteración de señal del hipocampo derecho con restricción de señal en las secuencias de difusión, hallazgo que se atribuye como primera posibilidad a la sospecha de lesión hipóxico - isquémica aguda, micro infarto isquémico reciente en la unión cortico - subcortical del lóbulo parietal derecho, se complementaron estudios con videotelemetría que reporta patrón encefalopático moderado a severo, con periodos de alertamiento y movimientos en extremidades de tipo no epiléptico.
Durante la evolución a partir del día 4to de estancia en la unidad de cuidados intensivos, mejoría y resolución de complicaciones descritas, corrección de coagulopatía, sin sangrado activo, con creatinina aún elevada sin trastorno electrolítico o ácido base, evolución favorable de su estado neurológico Glasgow 14/15, al día 5to se realiza extubación exitosa, se decide dar egreso hospitalario al día 12 de estancia hospitalaria, con control por nefrología quien define suspensión de la diálisis, con total de 16 días de requerimiento, paciente sin secuelas neuropsiquiátricas posteriores.
Tabla 2. Paraclínicos controles.
| Paraclínicos | 14/06/21 | 15/06/21 | 16/06/21 | 17/06/21 | 18/06/21 | 19/06/21 | 20/06/21 | 21/06/21 | 22/06/21 | 13/08/21 |
|---|---|---|---|---|---|---|---|---|---|---|
| Cuadro hemático | ||||||||||
| Leu | 7.500 | 6300 | 4100 | 8300 | 7800 | 8600 | 9700 | 9600 | ||
| Hb | 11,8 | 10.5 | 7.2 | 8.6 | 9.2 | 8.9 | 8.8 | 8.1 | ||
| Hto | 33,8 | 30 | 21 | 24.2 | 25.6 | 24.0 | 24.5 | 23 | ||
| Plaq | 35.700 | 48.500 | 34.000 | 79.300 | 127.600 | 174900. | 230.900 | 309.000 | ||
| Gases arteriales | ||||||||||
| pH | 7.24 | 7.50 | 7.48 | 7.48 | 7.4 | |||||
| PCO2 | 32.3 | 29.9, | 36.2, | 32.1, | 32.1 | |||||
| PO2 | 81.2 2 | 120.5 | 90.6 | 102.4 | 102.4 | |||||
| HCO3 | 13.6 | 22.9 | 26.8 | 23.5 | 23.5 | |||||
| Sat | 95% | |||||||||
| BE | 0.4 | 3.2 | 0.4, | 0.4 | ||||||
| PAFI | 20 | 401 | ||||||||
| FIo2 | 21% | 30% | 21% | 21% | ||||||
| Perfil hepático | ||||||||||
| TGO | 1675 | 1974 | 1286 | 1211 | 1753 | 1600 | 731 | 451 | 348 | |
| TGP | 1223 | 1687 | 1413 | 930 | 876 | 800 | 581 | 425 | 333 | |
| BD | 0.87 | 0.98 | 1.73 | 1.97 | 1.73 | 1.29 | 1.93 | |||
| BT | 1.6 | 2.85 | 3.70 | 3.51 | 3.05 | 2.58 | 0,82 | |||
| BI | 0.73 | 1.87 | 1.97 | 1.54 | 1.32 | 1.29 | 1.11 | |||
| Función de la coagulación | ||||||||||
| PT | 31.7/11.7 | 18.6 | 18.6 | 13.7 | 12.5 | 11.7 | 12 | |||
| PTT | 51.6 | 39.6 | 32.1 | 31.3 | 33.1 | 29.8 | 25.7 | |||
| INR | 2.7 | 1.6 | 1.6 | 1.2 | 1.1 | 1.0 | 1 | |||
| Fibrinógeno mg/dl | 152 | 215 | 216 | 269 | 354 | 360 | 369 | |||
| Creatinina mg/dl | 5.33 | 4.25 | 5.14 | 5.57 | 6.37 | 5.97 | 6.21 | 9.85 | 11.04 | 0.93 |
| BUN Mg/dl | 55.5 | 33.3 | 36.4 | 43.1 | 44.7 | 52.5 | 88.5 | |||
| CPK U/L | 20448 | 20350 | >32000 | >32000 | >32000 | 9199 | ||||
| Electrolitos | ||||||||||
| Na | 143 | 138 | 139 | 142 | 138 | 137 | 138 | 137 | ||
| K | 3.6 | K 3.6 | 4.1 | 4.1 | 3.6 | 3.8 | 3.7 | |||
| Ca | 6.5 | 7.4 | 8.5 | 8.1 | ||||||
| CL | 97 | 100 | 99 | 98 |
Fuente: elaboración propia
DISCUSIÓN
Estructura química de las anfetaminas y derivados
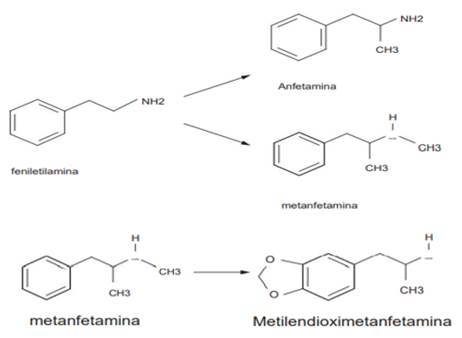
Las anfetaminas y sus derivados son aminas simpatomiméticas, de fórmula química estructural semejante a la adrenalina, la estructura química de las anfetaminas y sus derivados consiste en un anillo aromático (fen por fenilo) unido a una cadena de dos carbonos (etilo) que lleva un nitrógeno básico en el extremo distal de la cadena de carbono (amina) (Figura 3).
La metanfetamina existe como una molécula quiral con dos isómeros que incluyen levometanfetamina y dextrometanfetamina. Aunque la forma levometanfetamina carece de propiedades estimulantes del SNC, conserva sus efectos vasoactivos, simpaticomimética periféricos, la forma dextrometanfetamina es la única responsable de los efectos estimulantes al nivel del SNC observados con las metanfetaminas, a su vez estas se metabolizan en el hígado, principalmente las anfetaminas y 4-hidroximetanfetamina y tiene una vida media prolongada de 19 a 34 horas, aunque la duración de sus efectos agudos puede ser mayor a 24 horas4.
La 3,4- metilendioximetanfetamina tiene aproximadamente una décima parte del efecto estimulante del SNC que, a diferencia de la anfetamina y la metanfetamina, La MDMA es un potente estímulo para la liberación de serotonina. La concentración de MDMA requerida para estimular la liberación de serotonina es 10 veces menor que la requerida para la liberación de dopamina o norepinefrina4.
Mecanismos moleculares de las metanfetaminas y derivados
Las anfetaminas y derivados tienen un mecanismo de acción que involucra a varios neurotransmisores como son la dopamina, la serotonina, la adrenalina y la noradrenalina5.
Por lo tanto, el incremento de la liberación de dopamina en el espacio sináptico se produce tanto por bloqueo de la recaptación como por el aumento de la liberación, ya que pueden penetrar en la neurona y desplazar a la dopamina de sus depósitos citoplasmáticos no granulares (Figura 4), con la consiguiente depleción del neurotransmisor. Este aumento de dopamina en las áreas del hipotálamo lateral regula de forma dosis-dependiente la sensación de apetito. Mientras que los niveles elevados de dopamina en las vías nigroestriatales y mesocorticolímbicas han sido implicados en las propiedades psicoestimulantes y gratificantes5.
También facilitan la liberación de la noradrenalina al ser transportadas hasta las terminaciones nerviosas por el mecanismo de recaptación. Una vez en las terminaciones nerviosas son captadas por el transportador vesicular a cambio de noradrenalina, que se escapa al citosol5. Sólo actúan débilmente sobre los receptores adrenérgicos. Dicho mecanismo explicaría en parte los efectos centrales de las anfetaminas, como incremento de la actividad motora, la disminución del cansancio y los efectos periféricos que acompañan a estos fármacos, como son taquicardia, sudoración y dificultad en la micción5.
A su vez altera el transportador vesicular de monoaminas (VMAT2) que se localiza principalmente en el SNC y es el responsable del transporte de las monoaminas presentes en el citoplasma hacia las vesículas de almacenamiento. Igualmente, las anfetaminas pueden interrumpir el gradiente de protones existente en las membranas de estas vesículas sinápticas y así también su funcionamiento. De esta forma es que invierten el flujo de estos transportadores produciendo así un aumento de las concentraciones citoplasmáticas de noradrenalina, dopamina y serotonina. Puesto que el VMAT2 puede ejercer un papel relevante en la estimulación locomotriz y en las propiedades reforzantes producidas por las anfetaminas, lo que sería una diana para el desarrollo de estrategias terapéuticas para los procesos adictivos relacionados con el uso de psicoestimulantes5.
Se ha demostrado que la toxicidad sistémica después de la ingesta de metanfetaminas refleja una crisis hiperadrenergica la cual puede ser de cuadros leves a graves, se documenta hipertensión, taquicardia, agitación, las complicaciones como rabdomiólisis, insuficiencia hepatorrenal la coagulación intravascular diseminada, las disritmias, el colapso cardiovascular y la muerte son el resultado de las contribuciones entre la norepinefrina y serotonina6.
Ahora bien las complicaciones cardiovasculares (Tabla 3) son particularmente problemáticas e incluyen hipertensión maligna, taquiarritmias supraventricular, ventriculares, disección aórtica, infarto de miocardio, hipertensión pulmonar y miocardiopatía7
Tabla 3. Complicaciones cardíacas de las metanfetaminas.
| Efecto metanfetamina | Resultado cardíaco |
|---|---|
| Taquicardia, hipertensión | Hipertensión maligna |
| Vasoespasmo coronario | |
| Infarto agudo de miocardio | |
| Disección aórtica | |
| Toxicidad miocárdica | Arritmias malignas |
| Miocardiopatía asociada a metanfetamina | |
| Hipertensión arterial pulmonar | Insuficiencia cardiaca derecha |
| Agotamiento de neurotransmisores | Arritmias |
| Paro cardíaco, muerte súbita | |
| Inyección intravenosa de drogas | Endocarditis infecciosa |
Fuente: elaboración propia.
La constricción aislada de los lechos vasculares provoca isquemia orgánica localizada, además del vasoespasmo, se produce una angeítis necrosante de los vasos más pequeños involucra múltiples órganos incluido cerebro (infarto - hemorragia cerebral) corazón, intestino y riñones7.
Este estado hiperadrenérgico estimula tanto los adrenorreceptores α (que median en la vasoconstricción periférica) como los adrenorreceptores β2 (que median en la vasodilatación periférica). En consecuencia, en el tratamiento de pacientes con hipertensión y taquicardia es importante lograr el bloqueo de los receptores adrenérgicos α y β. De lo contrario, puede ocurrir un empeoramiento paradójico de la hipertensión debido a la vasoconstricción mediada por α sin oposición7.
En el contexto agudo, las benzodiazepinas reducen el aumento de catecolaminas intersinápticas y actúa centralmente para aliviar la hipertensión. Los antihipertensivos de primera línea apropiados son los que incluyen la terapia con nitratos y antagonistas alfa como la fentolamina7.
Los efectos gastrointestinales comprometen suministro vascular, ya sea por hipoperfusión sistémica o por vasoespasmo localizado8. Se ha determinado que mecanismo de la lesión hepática no está del todo claro; pudiendo ser una reacción de idiosincrasia, algunos casos están asociados con hipertermia, pero otros casos ocurren en pacientes con temperaturas normales9.
Los datos muestran que los hepatocitos expuestos a la metanfetamina sufren daños debido a las especies reactivas de oxígeno que causan el agotamiento del glutatión, la peroxidación de lípidos y la toxicidad mitocondrial. Actualmente, ninguna terapia con antídotos parece tener éxito y la atención de apoyo es el pilar de la terapia. Además, el papel del trasplante hepático en los casos de insuficiencia hepática inducida por anfetaminas no está claro y las tasas de éxito son bajas10.
Por otra parte, se resalta que la fisiopatología de la hipertermia inducida por anfetaminas es multifactorial e incluye aumento de la liberación de catecolaminas, aumento de la actividad metabólica y psicomotora y la disipación de calor alterada mediada por vasoconstricción11.
Al nivel muscular las metanfetaminas causan rabdomiólisis, el mecanismo del daño muscular no está claro, pero puede incluir agitación, actividad motora extrema, convulsiones, hipertermia, ingesta simultánea de otras toxinas (p. ejemplo; cocaína, tabaco, etanol) o una combinación de estos factores12.
La retención urinaria y la disfunción renal pueden ocurrir junto con la toxicidad por anfetamina, se cree que es secundaria a rabdomiólisis, depleción de volumen, vasculitis, hiperpirexia o una combinación de factores secundarios en lugar de toxicidad directa por fármacos13.
El MDMA se asocia a una lesión neuronal serotoninérgica, una reducción de la actividad de la enzima sintética de la serotonina, triptófano hidroxilasa y disminución del transportador de captación de la serotonina, perdida de los axones serotoninérgicos como se evidencia en los estudios histopatológicos14.
En estudios controlados en MDMA los usuarios documentaron una disminución de la concentración de ácido - 5 hidroxiindolacetico el líquido cefalorraquídeo, respuestas neuroendocrinas alteradas a los agonistas de la serotonina y disminución de la unión al transportador de serotonina, como se muestra en la tomografía de emisión por positrones. Estos estudios cuando se combinan con investigaciones clínicas que sugiere que los usuarios consumidores de MDMA tiene deterioro de la memoria y el rendimiento cognitivo y quejas psiquiátricas a largo plazo, constituyendo un caso de toxicidad neuronal serotoninérgica especialmente en los casos de dosis altas o prolongados15.
Se documentan alteraciones electrolíticas, la hiponatremia se da por aumento de la liberación de vasopresina (hormona antidiurética), y se cree que esto está relacionado con los efectos serotoninérgicos. Además, la ingesta sustancial de agua libre combinada con la pérdida de sodio por el esfuerzo físico16.
La elección y extensión de las pruebas diagnósticas debe guiarse por la anamnesis y la exploración física. En todos los pacientes con alteración del estado mental, se deben enviar muestras de sangre para análisis de glucosa, nitrógeno ureico en sangre y electrolitos. Se debe obtener un electrocardiograma en todos los pacientes para detectar taquiarritmias y se debe iniciar un monitoreo cardíaco continuo.
Serán necesarios hemograma completo, análisis de orina, perfil de coagulación, creatina fosfoquinasa, radiografía de tórax, tomografía computarizada de cráneo, ecocardiograma cardíaco y punción lumbar, según la presentación clínica.
Se dispone de inmunoensayos cualitativos en orina para anfetaminas, pero varias consideraciones limitan su utilidad en el tratamiento de pacientes con intoxicación aguda. Aunque las pruebas de orina en el punto de atención están disponibles, estas pruebas rara vez contribuyen al manejo en el entorno agudo. Una limitación importante es la alta tasa de resultados falsos positivos y falsos negativos comunes al inmunoensayo de anfetamina. En resumen, el uso de los inmunoensayos en orina no debe guiar el manejo clínico de los pacientes que presentan sospecha de toxicidad por anfetaminas y derivados5.
El tratamiento inicial de los pacientes intoxicados por anfetaminas y derivados deben ser dirigido hacia la evaluación y estabilización de la vía aérea, ventilación, circulación y control de la temperatura corporal y conocer los criterios de admisión a la unidad de cuidados intensivos.
La agitación y la agresividad pueden dificultar la valoración inicial de estos pacientes.
El control rápido de la situación es esencial por que la hipertermia significativa más la alteración en algún signo vital o laboratorio puedan requerir una terapia de emergencia, las benzodiazepinas (diazepam 5 mg o midazolam 5 - 10 mg) y butirofenonas (haloperidol 0.5 - 10 mg)(17, 18).
Existe un potencial riesgo significativo de efectos adversos farmacológicos con el uso de butirofenonas que es la prolongación del QT, dosis dependiente, reducción del umbral convulsivo, alteración de la disipación del calor y distonías, por estas posibles complicaciones se considera las benzodiazepinas como agente de primera línea para la sedación(19, 20).
En el control de la temperatura corporal las benzodiazepinas deben usarse de forma simultánea con medios físicos, si este enfoque no es exitoso el paciente puede requerir intubación y parálisis química para reducir la termogénesis muscular21.
La evidencia sólida que respalda el uso de dantroleno se limita a los casos de hipertermia maligna y efectos secundarios, incluida una debilidad significativa de los músculos respiratorios. Dados los daños potenciales del dantroleno y la limitada evidencia de apoyo, en contraste con la eficacia conocida de las medidas de apoyo actualmente no recomendamos su uso para la hipertermia inducida por anfetaminas y derivados(22, 23)
Las convulsiones deben tratarse inicialmente con benzodiazepinas, Si la actividad convulsiva persiste, se debe agregar fenobarbital o Propofol con protección de las vías respiratorias según sea necesario. La actividad convulsiva continua que no responde a las benzodiazepinas y los barbitúricos, especialmente si contribuye a una hipertermia significativa, debe tratarse con bloqueo neuromuscular seguido de monitorización electroencefalográfica y considerar la anestesia general.
Si hay déficits neurológicos focales o hallazgos no focales persistentes, como coma, se debe considerar la posibilidad de hemorragia intracraneal o infarto, y están indicado los estudios de neuroimagen como la tomografía de cráneo simple o resonancia magnética cerebral.
Para las taquiarritmias, bloqueos auriculoventriculares y prolongación del Qt Se deben tomar medidas estándar de soporte vital cardíaco avanzado, incluidos antiarrítmicos, cardioversión y desfibrilación(24, 25).
Agentes con antagonismo alfa -adrenérgico, como fentolamina (5 mg IV), o un bloqueador de los canales de calcio dihidropiridínico titulable, como nicardipino (5 mg/h en infusión IV, aumentado en 2,5 mg/h cada 15 min hasta un máximo de 15 mg/h). h) también puede ser útil para el vasoespasmo o las complicaciones de la hipertensión grave, como la disección aórtica.
El vasoespasmo puede ser recurrente y requerir un tratamiento prolongado. Con nitroprusiato (0,25 microgramos/kg/min en infusión IV, incrementado en 0,5 microgramos/kg/min cada 5 min hasta un máximo de 10 microgramos/kg/min) y nitroglicerina (400 microgramos en comprimido sublingual cada 5 min o 50 microgramos/min en infusión IV, aumentado en 10 microgramos/min cada 5 min) se puede ajustar según el efecto en casos de presión arterial elevada con marcadores de lesión de órganos terminales como elevación de enzimas cardíacas, lesión renal aguda, déficits neurológicos, cambios en la visión retinopatía o presión arterial 200/125
En el caso de la rabdomiólisis, se debe optimizar el aporte de volumen y mantenimiento de la diuresis para mantener la producción de orina de al menos 2 - 4 ml/kg/h.(26 La hemodiálisis, la hemo perfusión y la hemofiltración no desempeñan ningún papel en aumento de la eliminación de las metanfetaminas.
Ahora bien con respecto al caso clínico descrito el paciente presento un toxidrome severo secundarias a intoxicación por 3,4-METILENDIOXIMETANFETAMINA (MDMA), siendo el resultado del aumento de la neurotransmisión de dopamina (DA), serotonina (5-HT) y norepinefrina (NE) y disminución de su recaptación, clínicamente con manifestaciones simpaticomiméticas y serotoninérgicas, con complicaciones como taquicardia supraventricular, alteración del estado de conciencia desde agitación psicomotora hasta el coma Y temblores musculares lo que condiciono al aumento de la producción de calor, pues la acción simpaticomimética aumenta la termogénesis, generando hipertermia, rabdomiólisis y lesión renal aguda de origen toxico isquémico y obstructivo, curso con aumento de transaminasas, índice R>5 patrón de lesión hepatocelular , hepatitis de origen toxico isquémico, sin criterios de falla hepática aguda, desarrollo coagulación intravascular diseminada (ISHT 7 puntos) y encefalopatía hipóxico isquémica.
En este caso se evidencio la importancia de realizar una adecuada aproximación diagnostica en el servicio de urgencias, en la anamnesis, examen físico y valoración primaria, lo que permitió identificar rápidamente el toxidrome para poder realizar intervenciones vitales y prever las posibles complicaciones derivadas dado el grado severidad de toxicidad.
Ante las complicaciones múltiples potencialmente letales requirieron un manejo multidisciplinario y soporte vital avanzado desde el ingreso al servicio urgencias hasta su estancia en la unidad de cuidados intensivos, logrando impactar en la mortalidad y tener un adecuado desenlace y recuperación.
CONCLUSIÓN
El amplio conocimiento de las modificaciones a la base de feniletilamina existente permite predecir los efectos de las anfetaminas y derivados. Estos efectos se atribuyen a grados variables de selectividad que afectan a la dopamina, la norepinefrina y la serotonina.
El manejo de pacientes con toxicidad aguda de cualquiera de las anfetaminas y derivados incluye atención de apoyo, con el uso de benzodiazepinas y la anticipación de complicaciones de toxicidad adrenérgica y serotoninérgica, como hipertermia y rabdomiólisis.