INTRODUCCIÓN
Mucho se ha avanzado en el manejo de las enfermedades pulmonares intersticiales difusas (EPID), nombre que aglutina más de un centenar de entidades heterogéneas que, no obstante, comparten ciertas características clínicas y radiológicas.
La exposición de individuos susceptibles a ciertos antígenos orgánicos o no orgánicos puede provocar exageradas respuestas inmunológicas que inducen reacciones inflamatorias o fibróticas del parénquima pulmonar denominadas en su conjunto neumonitis por hipersensibilidad (NH), inicialmente conocida como alveolitis alérgica extrínseca1.
Durante mucho tiempo la clasificación contemplaba formas agudas, subagudas y crónicas, pero este catálogo no era muy consonante con los desenlaces clínicos, por lo cual un grupo de expertos de sociedades referentes proponen actualmente dos fenotipos clínicos bien diferenciados2.
La NH necesita de confirmación histopatológica en varios casos, mientras que en otros la conjunción de la clínica y los hallazgos en estudios de imagen son altamente sugerentes, pero en todos los escenarios la pista inicial es conferida por un interrogatorio inquisitivo que debe desnudar una completa historia ocupacional y lúdica explorando antecedentes de exposición continua u ocasional. Este trascendente tiempo semiológico tropieza no pocas veces con la escasa literatura regional o local sobre disparadores de la enfermedad.
En este artículo se presentan casos examinados en un hospital de referencia y se elabora una tabla de antígenos y ocupaciones locales probables a más de subrayar sumariamente los conocimientos actuales sobre el manejo de esta enfermedad.
PRESENTACIÓN DE CASOS CLÍNICOS
Caso 1. Varón de 65 años de edad, ex fumador de 1 caja por día durante 20 años, que abandonó hace 15 años y que consulta por disnea progresiva hasta moderados esfuerzos, acompañado de tos esporádica de 8 meses de evolución. Comorbilidades: hipertensión arterial larga data tratada regularmente con losartan 50mg/d; cardiopatía isquémica (infarto agudo de miocardio 3 años antes de consulta) y tratamiento regular con atorvastatina y ácido acetil-salicílico; nefrolitiasis bilateral. Historia ocupacional: labores en plantación de arroz durante 3 años (hace 15 años), labores en industria de construcción (albañil) en Buenos Aires con antecedente de exposición a polvareda de varias demoliciones de estructuras edilicias durante 7 años hasta recientes fechas. Refiere exposición a cotorrita resguardada en interiores durante 10 años (Figura 1, panel a). Al examen físico se consigna frecuencia respiratoria 22 xmin; frecuencia cardiaca 84 xmin; SatO294%. Rales crepitantes en campos de Krönig y dedos en palillo de tambor (Figura 1, panel b). Exámenes laboratoriales: hemoglobina 13,6 g%; leucocitos 6190/mm3 (neutrófilos 68%, linfocitos 14%; monocitos 11%, eosinófilos 7%); ProBNP 753pg/mL; marcadores serológicos (ANA, FR, AntiCCP, Anti-Scl 70, AntiRNP, ANCAc y ANCAp) negativos. B2 microglobulina 1720 ng/mL (normal <2220). Tomografía computarizada de tórax de alta resolución (TACAR) de tórax (Figura 1, panel c y d) que muestra compromiso pulmonar difuso. Espirometría: capacidad vital forzada (CVF) 2,68 L (56% del previsto), volumen espiratorio forzado en un segundo (VEF1) 2,43 (65% del previsto), VEF1/CVF 91. Test de marcha de 6 minutos (TM6M): 273mts (61%) con descenso de 5% en SatO2; DLCO: 3,75 mmol/min/kPa o 40% de previsto. Ecocardiografía: cardiopatía isquémica y dilatada con hipoquinesia apical y fracción de eyección de 54%, presión sistólica de arteria pulmonar 29 mmHg. Se recomienda evitar exposición a antígeno supuesto e inicia tratamiento con prednisona (50mg) y micofenolato (1g/d). Estable al año de seguimiento.
Caso 2. Varón de 62 años, ex fumador, de ½ caja por día durante 10 años, que abandonó hace 7 años, consulta en el 2018 por tos seca y disnea de 6 meses de evolución. Comorbilidades: hipertensión arterial tratado regularmente con losartán y obesidad grado II. Ganadero que desde hace meses utiliza almohada de plumas de ganso. Examen físico: frecuencia respiratoria 18xmin; frecuencia cardiaca 78xmin; SatO2 94%. Escasos crepitantes en región superior pulmón derecho. Analítica laboratorial rutinaria sin datos llamativos. ANA y FR (-). TAC de tórax: (Figura 2). Espirometría: CVF 67% previsto y DLCO 42%. TM6M: 380mts recorridos (65% del previsto) con disminución de 7% en la SatO2basal. Se sugiere evitar exposición a antígeno supuestos y tratamiento con corticoides. Paciente presenta mejoría sustancial con el correr de los años: CVF 71% previsto; DLCO 59% del previsto y TM6M 95% de la distancia prevista con disminución de la SaTO2 basal de 4%. Durante pandemia COVID-19 hay pérdida de seguimiento y empeoramiento del cuadro clínico que impone tratamiento con prednisona y micofenolato.
Caso 3. Varón de 54 años, ex fumador, de 20 cajas/año, consulta en el 2019 por disnea de 18 meses de evolución, progresiva hasta hacerse en reposo. Niega comorbilidades. Trabaja en chapería y pintura de automóviles desde hace 8 años, sin medidas de protección. Examen físico: frecuencia respiratoria 22xmin; frecuencia cardiaca 64xmin; SatO2 92%. Analítica laboratorial rutinaria sin datos llamativos. ANA y FR (-). TAC de tórax: (Figura 3). Espirometría: CVF 45% previsto y DLCO 35%. Lavado broncoalveolar: galactomanan (-), PCR Mycobacterium tbc (-). No se detectan células atípicas. Linfocitosis (20%). Se sugiere alejamiento de fuente probable de antígenos y tratamiento con corticoides e inmunosupresores que el paciente no consiente.
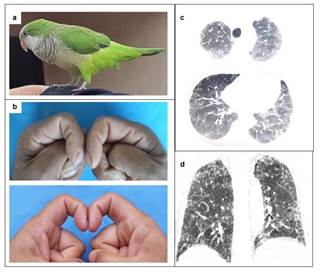
Figura 1. (a): foto de Myiopsitta monachus; (b): Dedos en palillo de tambor del paciente con el signo de Schamroth (ausencia de espacio entre dedos confrontados cuando se comparan con dedos sin acropaquia); (c): planos frontales de tomografía de cortes finos (TACAR) de tórax que muestra patrón de atenuación en mosaico distribuidas difusamente o patrón de triple densidad y septos interlobulares espesados que distorsionan ligeramente arquitectura pulmonar; (d): plano coronal de TACAR de tórax que muestra la distribución preferencial de las opacidades en regiones superiores y discretas bronquiectasias de tracción en segmentos basales a derecha.
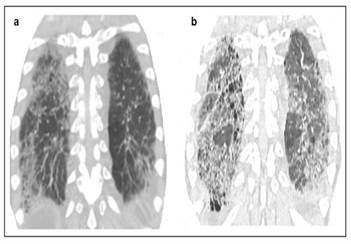
Figura 2. Plano coronal de TACAR de tórax con intervalo de 4 años entre ambas mostrando claras diferencias evolutivas. Aunque existen diferencias técnicas entre ambas imágenes se aprecia que el inicial predominio de opacidades pulmonares en zonas superiores (a) se hace homogéneo hacia regiones dependientes (b) tornándose ya ostensibles las áreas de panalización sobre fondo de patrón de atenuación en mosaico y septos interlobulares espesados que distorsionan la arquitectura.
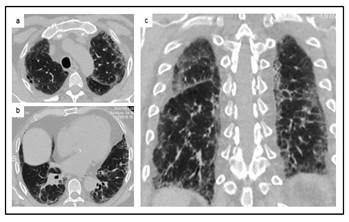
Figura 3. TAC de tórax de adulto con disnea y labores en chapería y pintura de autos que muestra espesamiento pleural apical bilateral junto a opacidades subpleurales y algunos escasos quistes que insinúan panalización en el plano frontal (a); en regiones dependientes se nota espesamiento de septos interlobulares y opacidades periféricas con bronquiectasias de tracción y distorsión de la arquitectura pulmonar (b); en el plano coronal se aprecia el compromiso preferencial de regiones superiores (c).
DISCUSIÓN
De la base de datos de la Disciplina de Neumología de la Universidade Federal de São Paulo (Brasil), desobre 3168 casos de EPID, la NH constituye la segunda causa (15%) solo después de las consecutivas a enfermedades del colágeno (17%), siendo apenas más prevalente que la fibrosis pulmonar idiopática y la sarcoidosis3.
El primer caso de NH descrito en la literatura nacional trata sobre un joven de 26 años que trabajaba en un aserradero y tenía contacto con aserrín de lapacho, cedro, petereby y ybyrapytá. Síntomas respiratorios crónicos lo llevaron a consultar y el diagnóostico se realizó por anatomía patológica. El paciente falleció por complicaciones pos-operatorias4.
La NH es una enfermedad pulmonar intersticial difusa compleja y heterogénea que resulta de una reacción inflamatoria pulmonar, tras exposición a una sustancia antigénica inhalada. Esta enfermedad puede presentar un curso inflamatorio autolimitado o recidivante o incluso de mostrar carácter progresivo recordando al curso de la fibrosis pulmonar idiopática (FPI)5.
La enfermedad puede ser inducida por una variedad amplia de antígenos, que pueden ser agrupados en seis categorías: bacterias, hongos, micobacterias, proteínas animales y vegetales, químicos y metales6. La Tabla 1 muestra los diferentes nombres de la NH y las ocupaciones o labores que deben interrogarse en busca de exposición probable.
Las guías más recientes sobre NH sugieren recopilar una completa historia de exposiciones que puedan configurar la relación temporal entre los eventuales ofensores y disparadores de la enfermedad2,7. Es interesante establecer que deben preguntarse no solo la ocupación actual, sino toda la historia ocupacional, al igual que aspectos relacionados con el ambiente domiciliar y lúdico. Este primer gesto clínico establecerá la probabilidad clínica pre-test que será modulada eventualmente con otros métodos auxiliares diagnósticos. Suele suceder que en la literatura en español es difícil encontrar una lista completa de ofensores y por este motivo la Tabla 1 se configura acorde a potenciales agentes que podríamos encontrar en nuestro medio. En los tres casos presentados aquí se han establecido fuentes probables: exposición a aves, uso de almohada de plumas y exposición a pinturas sintéticas.
Ya que la presencia de fibrosis pulmonar ha sido reconocida como un marcador pronostico, las guías de manejo han propuesto mudar radicalmente la clasificación de la NH. Como las formas crónicas no siempre son consecutivas a las formas agudas o subagudas y como estos términos conllevaban demarcaciones arbitrarias y variables, se ha decidido abandonar esta nomenclatura, reemplazándola por la siguiente clasificación: NH fibrótica y NH no fibrótica, priorizando los aspectos radiográficos e histopatológicos de la enfermedad2,7.
La TACAR de tórax evaluada por expertos en el área puede ofrecer confianza diagnóostica entre el 88-92% según algunas series8,9. Se recomiendan una serie de parámetros técnicos que garanticen una imagen adecuada con dosis de radiación baja. Un conjunto de imágenes dinámicas (una en inspiración profunda y otra luego de expiración prolongada), con cortes de 1,5 mm o menos para tomografía axial y helicoidal, son sugeridos2. Un patrón típico de NH mostrará al menos un hallazgo indicativo de enfermedad de pequeñas vías aéreas, el patrón de tres densidades (áreas de densidad normal, áreas de disminución de atenuación con vasos de calibre notoriamente disminuidos y áreas de vidrio esmerilado), áreas de atrapamiento aéreo, nódulos centrilobulares< 5mm mal definidos, espesamiento de septos interlobares con distorsión de la arquitectura, bronquiectasias de tracción, panalización no predominante, hallazgos que predominan en zona media o superior con relativo respeto de las bases10. Acorde a las guías del CHEST, basta el historial de exposición identificado y compatible, más un patrón deTACAR típico de NH para realizar un diagnóstico confiable7. Esto se vio en los dos primeros casos presentados en este reporte.
No siempre se dispone de un patrón típico en la TACAR y es entonces que se requieren de otros métodos auxiliares de diagnóstico. Uno de puntos diagnósticos más controversiales es la determinación de IgG específica para los antígenos, ya que la mayor limitación es la falta de estándares en la preparación de los mismos y los variables puntos de corte diagnóstico en los niveles de IgG cuantitativa. A más de estos análisis técnicos, no se puede diferenciar entre sensibilización y enfermedad. De igual manera, las pruebas de exposición directa son tema de controversia en las guías2,7. Sin embargo, existe una tendencia más uniforme en términos de la utilidad de la linfocitosis en el lavado broncoalveolar en casos donde la clínica y las imágenes son discordantes. Un valor de 30% apuntalaría el diagnóstico de NH, aunque la ausencia de linfocitosis no excluye la probabilidad en algunos casos5.
Como no existe una variable “patrón oro” y, ya que entran en juego diferentes factores para el manejo global de la NH, la conformación de un equipo multidisciplinar (neumólogo + radiólogo + patólogo y eventualmente otros especialistas) constituye un aspecto crítico en las instituciones que se encargan de este grupo de pacientes. En ese orden se debe subrayar que los mismos, deben prioritariamente ser remitidos a consultorios especializados, ya que la demora en el diagnóstico puede tener implicancias en los desenlaces11. La decisión de realizar biopsias (transbronquiales convencionales, por criobiopsia, por videotoracoscopia o cirugía torácica convencional) la debe realizar el consultorio especializado o el equipo multidisciplinar, teniendo en consideración la probabilidad clínica pre-test, la infraestructura disponible, la presencia de patólogos expertos, la relación entre y riesgo-beneficio de la invasión y, por supuesto, el consentimiento del paciente.
La NH tiene un curso impredecible. En una cohorte de 83 pacientes se han identificado que el 75,9% pertenecía al grupo de NH fibrótica y que, dentro de este subgrupo, el 33,3% llenaba los criterios predefinidos del fenotipo fibrosante progresivo12. Un estudio retrospectivo sobre 100 pacientes en el transcurso de 13 años, ha identificado 14 casos de exacerbaciones agudas, y el denominador común entre estos era el patrón de neumonitis intersticial usual basal13. Existe una compleja interacción de factores innatos y externos que afectan el desenlace de esta enfermedad. La edad avanzada, el sexo masculino, la predisposición genética, antígenos no identificados que en algunas series orillan el 60% de los casos, la duración de exposición al antígeno incitante, la historia de tabaquismo, baja CVF, bajo DLCO, linfocitosis no tan alta en el BAL, presencia y/o extensión de fibrosis o patrón de neumonitis intersticial usual o de neumonitis intersticial no específica en polo fibrótico en la TACAR de tórax son varios de los predictores de mala evolución. En el futuro se podría dilucidar el valor de biomarcadores serológicos como la proteína D del surfactante (SP-D), la periostina, la glicoproteína Krebs von del Lungen 6 (KL-6), la CCL-17 y la YKL-4014. La hipertensión pulmonar es una característica prevalente de la NH fibrótica y los valores de resistencia vascular pulmonar (RVP) y de distensibilidad (compliance) vascular pulmonar medidas por cateterismo derecho se asocian con la mortalidad15,16.
Los algoritmos de tratamiento más utilizados no están basados en ensayos clínicos randomizados y la evitación de antígenos junto al uso de corticoides e inmunosupresores (azatioprina, micofenolato o rituximab) es el enfoque preferencial. Solo hace algunos años se ha introducido en la discusión el uso de la pirfenidona o el nintedanib en ciertos fenotipos. El uso de oxigenoterapia domiciliar en casos de hipoxia crónica está indicado. La rehabilitación pulmonar, las vacunaciones pertinentes y los cuidados paliativos son importantes en la NH progresiva. El trasplante pulmonar es una opción en casos de compromiso severo17.
En conclusión, se presentan en este reporte tres casos de NH fibrótica y se propone un glosario de nombres y ocupaciones eventuales para el abordaje clínico en nuestro medio junto a una revisión sumaria de la literatura actual.
















