INTRODUCCIÓN
La palabra cáncer abarca una considerable cifra de enfermedades que se distinguen por el aumento de células anormales, que se dividen, crecen y se dispersan sin control en cualquier parte del cuerpo. Así mismo, las células normales se separan y mueren en un tiempo determinado1. Sin embargo, la célula cancerosa o tumoral “pierde” la posibilidad de morir y se divide casi sin restricciones. Por ende, la reproducción de las células llega a crear masas, definidas como tumores o neoplasias, que en su desarrollo pueden deshacer y reemplazar a los tejidos normales2. Para esto, se cree que los cánceres más frecuentados (estimados en 2018, ordenados descendentemente) son el Cáncer de seno, colorrectal, próstata, pulmón, tiroides, estomago, vejiga, cervicouterino, linfoma no Hodgkin3.
Por otro lado, conforme al informe “Las cifras del cáncer en España 2017” comunicado por SEOM1, la incidencia calculada de cáncer hepático en España fue de 5862 casos (4252 varones y 1610 mujeres) deduciendo el 2.4% de todos los cánceres y el noveno por orden de frecuencia. Cabe resaltar que, entre el 60 y el 90% de los hepatocarcinomas están relacionados a cirrosis, causa por el cual las células dañadas del hígado son sustituidas por tejido cicatricial. Por ende, el consumo de alcohol, es el origen no vírico que principalmente puede causar cirrosis4. Otras con menor incidencia son la aglomeración excesiva de hierro en el hígado (hemocromatosis), las aflatoxinas procedentes de un hongo capaz de contaminar ciertos alimentos, la desnutrición, y el polvo de cloruro de vinilo (relacionado más comúnmente con el angiosarcoma)1. También, las infecciones crónicas causadas por el virus de la hepatitis B y de la hepatitis C, ocasionadas por cirrosis son dos factores usualmente asociados al desarrollo del cáncer de hígado. De hecho, los individuos portadores del virus de la hepatitis B, corren un riesgo de desarrollar cáncer primario de hígado alrededor de 100 veces superior al de la población general5.
Por otro lado, el ejercicio físico es valorado como una intervención no farmacológica eficiente en el fomento del bienestar físico, mental y funcional de pacientes con cáncer6. Para esto, existen diferentes maneras de entrenamiento como por ejemplo ejercicio aeróbico, de resistencia y flexibilidad7. Habría que decir también, que la ganancia de la actividad física (AF) para pacientes oncológicos puede ser tanto fisiológicos como psicológicos. Puesto, que en actualidad, se tienen bien definidos y basados por la evidencia que integra la AF en proyectos de intervención realizados con ejercicios para pacientes, durante y luego de los tratamientos antineoplásico8. La prescripción de ejercicio en pacientes con cáncer tiene que ser personalizada, teniendo en cuenta los efectos del cáncer y del tratamiento en la capacidad funcional, en consideración al modo, intensidad, duración, frecuencia y progresión del ejercicio9.
Sobre los programas de ejercicio, se dice que tanto ejercicio aeróbico (EA) como el ejercicio de resistencia (ER), pueden favorecer a la capacidad cardiorrespiratoria, disminuir diversas condiciones asociadas al síndrome metabólico y a la supresión de peso. Sin embargo, se considera que el EA es más eficaz en disminuir la grasa visceral y mejorar la resistencia a la insulina, aunque el ER tendría mejor tolerancia y adherencia10. Dicho todo lo anterior, se plantea como pregunta de investigación de la presente investigación: ¿Cuáles son los efectos del ejercicio físico y su asociación con el riesgo de cáncer hepático?. Y, por ende, el objetivo de este estudio fue determinar los efectos del ejercicio físico en el riesgo de cáncer hepático.
MATERIALES Y MÉTODOS
Diseño
Se llevó a cabo una revisión sistemática con análisis retrospectivo y descriptivo de artículos científicos publicados en bases de datos indexadas de enero del año 2008 a diciembre del 2019. Todos los estudios con seres humanos tenían un consentimiento informado y la aprobación para que los datos se utilizaran para fines académicos.
Para la elaboración de la revisión sistemática se tomaron en cuenta las recomendaciones de la colaboración Cochrane. Así mismo, se llevó a cabo la selección de los archivos por medio de los ítems para la inclusión de estudios para las revisiones sistemáticas de la Declaración de PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)11.
Se realizó la búsqueda de estudios en las bases de datos Ebsco, Scielo, Medline, Medscape, PubMed Central, EMBASE, Redalyc, DOAJ y OVID. Además, se revisaron revistas especializadas como la National Cancer Institute, American Cancer Society, Sociedad Española de Cancerología (SEOM), Journal American Medical Association (JAMA), Journal of Internal Medicine, American College Sport of Medicine, American Physical Therapy Association (APTA).
En cuanto a la estrategia de búsqueda, combinando el uso de operadores booleanos AND y OR, fue la siguiente: (cancer and physiotherapy) OR sedentary lifestyle and physioterapy) OR oncology and physiotherapy) OR physiotherapy in oncology) AND sedentary lifestyle)) OR sedentary lifestyle in cancer) AND Exercise and cancer). Y de igual manera en el idioma español.
En el método de indagación en la literatura se confinó a investigaciones publicadas entre enero del año 2008 a diciembre del 2019 en inglés y español.
La selección de artículos establecidos fue al principio de la investigación con la finalidad de ubicar con eficacia la asociación entre el ejercicio físico y el cáncer hepático, haciendo uso de los estudios relacionados con el tema a investigar. Los artículos seleccionados debían ser publicados entre Enero del año 2008 a diciembre del 2019, donde la muestra y revisión fuera en seres humanos y animales que los resultados definieran: ¿Cuáles son los efectos del ejercicio físico y su asociación con el riesgo de cáncer hepático?.
No se filtraron datos con referente a sexo, tipo de población, ni etnia y un autor (J. P-R.) verificó el cumplimiento de las recomendaciones éticas para la investigación en humanos en cada uno de los estudios incluidos. Del mismo modo, se excluyeron documentos que luego de una valoración del título, resumen y palabras clave que no tenías las características de aprobación. Por último, se estableció un formulario para el Study eligibility form de acuerdo con el sistema PICO (P: Pacientes con cáncer hepático, I: Ejercicio, C: No ejercicio u otras intervenciones, O: Asociación o no del ejercicio con el cáncer hepático) para la práctica de la Medicina Basada en Evidencias.
Datos tales como el tipo de población, los grupos de intervención y control, procedimiento quirúrgico, tiempos del programa de rehabilitación, frecuencia de la intervención y los resultados obtenidos fueron extraídos de los estudios recolectados con anterioridad, efectuándose de esta manera, una síntesis narrativa. Además, se llevó a cabo la recabación de información de forma sistemática y homogénea por medio de la base de datos “Excel” de datos demográficos, tamaño de la muestra, número de pacientes incluidos y excluidos, periodo de seguimiento, particularidades previas y después a la intervención objeto de estudio.
La particularidad metodológica de las investigaciones fue valorada la evaluación del riesgo de sesgo de la Colaboración Cochrane. Mediante esta herramienta se definió el sesgo en la elección de estudios frente a los criterios de selección de los estudios y pérdidas de documentos. Por otro lado, también se determinó el sesgo de detección, información y otros sesgos (fuentes de obtención de la información, cantidad, naturaleza y manejo de los documentos, otros). Además, el riesgo de sesgo fue valorado mediante la escala de PEDro12 (en inglés Physiotherapy Evidence Database).
Para los estudios anexados se pretendió que los individuos tuvieran por encima de 18 años y con un diagnóstico confirmado de cáncer de hepático sin importar la tipología, pronóstico o características sociodemográficas.
RESULTADOS
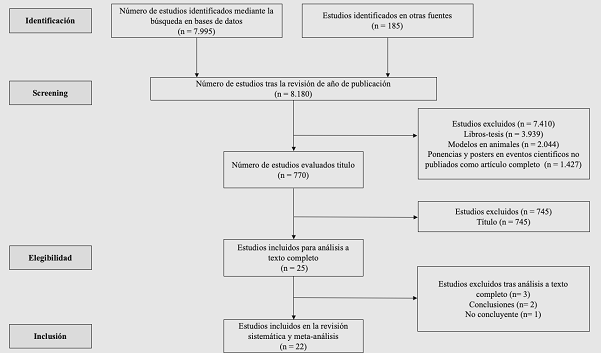
Se identificaron inicialmente 8.180 documentos tras indexar los descriptores médicos mencionados anteriormente. Después de un primer filtro tras la revisión del año de publicación quedaron 7410 estudios. Por otro lado, tras la revisión de los mismos y, ver que no cumplían con los criterios de inclusión, fueron descartados de la selección, para posteriormente, evaluar los textos completos de 25 estudios potencialmente elegibles. De estos, 22 estudios13-34 cumplieron con los criterios antes mencionados (Figura 1) y se incluyeron en la presente revisión sistemática (Tabla 1 y 2) con una muestra poblacional de 2´936.533.
Calidad de la evidencia: Resaltamos que el 100% de los estudios seleccionados obtuvieron una calificación de alta calidad metodológica y bajo riesgo de sesgo por sus calificaciones mayor a 5 en la escala PEDro. Debido que según Moseley et al.35 toda investigación con un resultado post escala PEDro de igual o mayor a 5/10 pueden ser considerados como estudios de alta calidad metodológica y bajo riesgo de sesgo (Tabla 1).
Tabla 1. Escala de PEDro para la evaluación de la calidad metodológica de los estudios incluidos en la revisión (n = 22).
| Reference | P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | P9 | P10 | P11 | Total |
| Arem et al13 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Baumeister et al14 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Inoue et al.15 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Moore et al 16 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Yun Ho et al.17 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Wen Chi-Pang et al18 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Koya et al19 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Aguiar e Silva et al20 | + | + | - | + | + | - | - | + | + | + | + | 8 |
| Piguet et al21 | + | + | - | + | + | - | - | - | + | + | + | 7 |
| Arem et al 22 | + | + | - | + | - | - | - | + | + | + | + | 7 |
| Wen CP et al23 | + | + | - | + | + | - | - | + | + | + | + | 8 |
| Behrens G. et al24 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Kaibori M. et al25 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Johnson NA et al26 | + | + | - | + | + | - | - | + | + | + | + | 8 |
| Van der Heijden GJ et al27 | + | + | - | + | - | - | - | + | + | + | + | 7 |
| Hallsworth K. et al28 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Zelber-Sagi S. et al29 | + | - | - | + | - | - | - | + | + | + | + | 6 |
| Bae JC. et al30 | + | + | - | + | - | - | - | + | + | + | + | 7 |
| Kistler KD. et al31 | + | + | + | + | - | - | - | + | + | + | + | 8 |
| Krasnoff JB. et al32 | + | + | - | + | - | - | - | + | + | + | + | 7 |
| Hannukainen JC. et al33 | - | + | - | + | - | - | - | + | + | + | + | 6 |
| St George A. et al34 | + | - | + | + | - | - | - | + | + | + | + | 7 |
PEDro (Physiotherapy Evidence Database): + Sí; - No.
P1: Criterios de elección (Este criterio influye en la validez externa, pero no en la validez interna del ensayo. Ha sido incluido en la escala PEDro para que todos los ítems de la escala Delphi estén representados en la escala PEDro. Este ítem no se utiliza para calcular la puntuación PEDro per se); P2: Asignación aleatoria; P3: Ocultamiento de la asignación; P4: Grupos similares en línea de base; P5: Cegamiento de los participantes; P6: Cegamiento de los terapeutas; P7: Cegamiento del evaluador; P8: Abandonos < 15%; P9: Análisis por intención a tratar; P10: Diferencias reportadas entre grupos; P11: Punto estimado y variabilidad reportada.
Tabla 2. Características de los estudios experimentales (n = 22)
| Autor, Año | Parámetro hepático | Tipo de ejercicio | Dieta | Intensidad del ejercicio | Tiempo | Muestra | Conclusiones |
|---|---|---|---|---|---|---|---|
| Arem et al.13 2013 (Estados Unidos) | Cáncer hepático | Cuestionario de las características demográficas, dieta, historia reproductiva y médica y estilo de vida. | - - - | - - - | - - - | 293.511 | Los resultados fueron influenciados por otros factores de estilo de vida asociados con la actividad física, incluyendo un mejor mantenimiento de la salud. |
| Baumeister et al.14 2018 (Europa) | Carcinoma hepatocelular | Cuestionario de actividad física. | Se utilizó el EPIC | - - - | - - - | 467.336 | Los resultados sugieren una asociación inversa entre la actividad física y el riesgo de carcinoma hepatocelular. |
| Inoue et al.15 2008 (Japón) | Cáncer hepático | Cuestionario de actividad física. | Cuestionario de dieta | - - - | 5 años | 79.771 | La actividad física diaria puede ser beneficioso para prevenir el desarrollo de cáncer en los hombres y las mujeres japonesas. |
| Moore C. et al.16 2016 (Estados Unidos) | Cáncer hepático | Actividad física en tiempo libre | - - - | Intensidad moderada, definida a una intensidad de 3 MET, o la intensidad vigorosa. | 18 meses | 1.44M | Los niveles de actividad física en el tiempo libre, se asocian a menores riesgos en 13 (Incluyendo cáncer hepático) de los 26 tipos de cáncer, los resultados apoyan que estas asociaciones son generalizable a diferentes poblaciones. |
| Yun Ho et al.17 2016 (Corea) | Cáncer hepático | Cuestionario de actividad física | Cuestionario de dieta | - - - | 5 años | 444.963 | Sus resultados se suman a la evidencia de los efectos beneficiosos de la preferencia de verduras en el riesgo de cáncer de pulmón y de la actividad física en los pulmones, el estómago y el riesgo de cáncer de hígado. |
| Wen Chi-Pang et al.18 2011 (Taiwan) | Cáncer hepático | Cuestionario de actividad física | Cuestionario de dieta | Bajo, medio, alto, o muy alto de actividad | 8.05 años | 416.175 | Si la cantidad mínima de ejercicio que se sugiere se cumple, la mortalidad por enfermedades del corazón, diabetes y cáncer podría reducirse. |
| Koya et al.19 2016 (Japón) | Enfermedad hepática crónica | 1. Estiramientos; 2. Entrenamiento de fuerza; 3. Práctica de equilibrio; 4. Entrenamiento de resistencia | - - - | 1. 3 min. Se mantuvo un estiramiento estático durante 10-20 seg. 2. 5 min. 60-70% del máximo de una repetición con mancuerna. 3. 4 min. de soporte en tándem. 4. 8 min. Bicicleta ergométrica o caminando. La intensidad se ajustó en 11-13 puntos de la escala de Borg y la frecuencia cardiaca. | - - - | 54 | El ejercicio terapéutico mejoró la capacidad física sin empeoramiento de la función hepática durante la hospitalización para el tratamiento de HCC en pacientes con CLD. |
| Aguiar e Silva et al.20 2012 (Brazil) | Carcinogénesis hepática | Natación | Control de ingesta de grasas | Progresivo | 8 semanas | 40 | Un protocolo de entrenamiento de natación como resultado del ejercicio posterior al acondicionamiento puede atenuar la carcinogénesis hepática bajo un régimen dietético adecuado con una menor ingesta de grasas. |
| Piguet et al21 2015 (Suiza) | Tumor hepático | Ejercicio | - - - | Progresivo | 32 semanas | 20 | Estos datos muestran un efecto beneficioso del ejercicio sobre el desarrollo de HCC en un modelo experimental de esteatohepatitis no alcohólica y ofrecen una justificación para alentar a los pacientes a la actividad física. |
| Arem et al.22 2018 (Estados Unidos) | Carcinogénesis hepática | Cuestionario de actividad física | - - - | - - - | 10 años | 296.661 | Los que mantuvieron los niveles de actividad a lo largo del tiempo tuvieron un riesgo 26 a 36% menos de cáncer de hígado y los que tuvieron mayor actividad física con el tiempo no tuvieron asociación con el riesgo. |
| Wen et al.23 2012 (Taiwan) | HCC | Ejercicio informado por el paciente | - - - | Ambos | 8.5 años | 428.584 | Se encontró una correlación positiva entre la disminución del riesgo de CHC y el grado de ejercicio. |
| Behrens G. et al.24 2013 (Estados Unidos9 | HCC y cáncer de hígado | Actividad física vigorosa por el paciente | - - - | Ambos | 10 años | 507.897 | Los resultados sugieren una disminución del riesgo de cáncer de hígado total y CHC en 36% y 44%, respectivamente. |
| Kaibori et al.25 2013 (Japón) | HCC Bajo hepatectomía | Programa de ejercicio para el paciente | Ingesta diaria de energía para el paciente: 25-30 kcal/kg de peso corporal | Ambos | 6 meses | 51 | El grupo de ejercicio no presentó problemas clínicos y una mejora significativa tanto en insulina sérica como en el índice de resistencia a la insulina. |
| Johnson et al.26 2009 (Sydney) | Contenido de lípidos | Ciclismo aeróbico | - - - | Intensidad progresiva | 4 semanas | 23 | El ejercicio aeróbico redujo los lípidos hepáticos mitigando las consecuencias metabólicas y cardiovasculares del hígado graso. |
| Van der Heijden et al.27 2010 (Houston) | Acumulación de grasa | Ejercicio aeróbico controlado | - - - | Alto | 12 semanas | 15 | La disminución de la acumulación de grasa hepática evita progresar a inflamación hepática, fibrosis y cirrosis. |
| Hallsworth et al.282011 (Reino Unido) | NAFLD | Ejercicios de resistencia | - - - | - - - | 8 semanas | 28 | El ejercicio de resistencia aumentó la sensibilidad a la insulina y mejoró la flexibilidad metabólica en la NAFLD. |
| Zelber-Sagi et al.29 2008 (Israel) | NAFLD | Surtido de actividad física - aeróbico; resistencia | Sí | Ambos | - - - | 375 | Mayor tasa de actividad se asoció con menor prevalencia de NAFLD. |
| Bae et al.30 2012 (Hospital Kangbuk Samsung) | NAFLD | Ejercicio aeróbico | - - - | - - - | 3 meses | 19,921 | El ejercicio regular se asoció con un riesgo reducido de tener NAFLD y disminución de las enzimas hepáticas en pacientes con NAFLD. |
| Kistler et al.31 2011 (Estados Unidos) | NAFLD | Surtido (aeróbico, ocio actividad física) | - - - | moderado, alto | - - - | 813 | La intensidad del ejercicio (vigoroso) se asoció inversamente con un menor riesgo de desarrollar NAFLD, gravedad NASH y fibrosis. |
| Krasnoff et al.32 2008 (San Francisco) | NAFLD | Actividad física vs ejercicio | - - - | - - - | - - - | 37 | Los niveles de actividad física optima reducen los factores de riesgo asociados y previenen la progresión de la NAFLD. |
| Hannukainen et al.33 2011 (Finlandia) | Grasa hepática | Ejercicio de acondicionamiento y actividad física general | - - - | Ambos | - - - | 18 | Mayor actividad física tenían un 23% menos de grasa hepática y por lo tanto menor riesgo de cáncer hepático e hígado graso. |
| St George et al.34 2009 (Sydney) | NAFLD | Actividad física de ocio | - - - | Baja, intensidad moderada | - - - | 141 | El aumento de actividad física mejoró significativamente los parámetros metabólicos en personas con NAFLD. |
| Total | 2´936.533 | ||||||
EPIC: Investigación Prospectiva sobre Cáncer y Nutrición de cohortes; NALFD: Enfermedad del hígado graso no alcohólico; HCC: Carcinoma hepatocelular; CLC: Enfermedad hepática crónica; BCAA: Cadena ramificada de aminoácidos
Dieta: En la actualidad, hay evidencia científica escasa para la distribución de preferencias dietéticas como carne, vegetales o mezcla de vegetales y carne (p= <0.001)17,18. Por otro lado, un estudio japonés mostró relación entre la ingesta combinada de carne y verduras con la incidencia de cáncer de colon (en los hombres, las razones de riesgo para el segundo, tercer y más alto cuartil fueron 1.00 IC95%: 0.90, 1.11), 0.96 (IC95%: 0.86, 1.07) y 0.87 (IC95%: 0.78, 0.96)15.
Tipo de entrenamiento: El entrenamiento de natación mejoró en cuestión al peso corporal y la grasa corporal (entrenados con dieta baja en grasa 380.4±9.33 vs 460.3±15.3, no entrenados con dieta baja en grasa 382.0±8.58 vs 411.1±15.4), normalizó los niveles de colesterol total, se indica que el protocolo de entrenamiento de natación como resultado del ejercicio posterior al acondicionamiento puede atenuar la carcinogénesis hepática bajo un régimen dietético adecuado con una ingesta reducida de grasas20. Por otro lado, el ejercicio aeróbico redujo los lípidos hepáticos (grasa hepática 8.9±3.2 a 5.6±1.8%; p=<0.05, grasa visceral 54.7±6.0 a 49.6±5.5cm2; p=<0,05)(26,27 en cambio en el ejercicio de resistencia aumentó la sensibilidad a la insulina (5.9±5.9 a 4.6±4.6 vs 4.7±2.1 a 5.1±2.5; p<0.05) mejoró la flexibilidad metabólica (-0.0206±0.010 vs 0.004±0.003; p<0.05)) y hubo una mayor tasa de actividad asociada con menor prevalencia en enfermedad del hígado graso no alcohólico (NAFLD) (p>0.05)28-30.
Tiempo de seguimiento: Ahora bien, en un tiempo de seguimiento de 18 meses con pura actividad física en los tiempos libres tuvo una asociación con la disminución del cáncer hepático (razón de riesgo 0.89(IC95%, 0.82-0.97))16, a comparación de un tiempo de 32 semanas de actividad física (1.8 ± 0.8 vs. 2.8 ± 2.3)21.
Riesgo: Se encontró que la actividad física se asocia con un riesgo reducido de desarrollar cánceres de hígado en la próxima década (IC95%:0.38-0.80). Es importante resaltar que el riesgo era independiente de otros factores de riesgo de cáncer de hígado, y no varió por edad, género, el hábito de fumar, el peso corporal y el consumo de alcohol (p<0.001)14. Por otra parte, la actividad física en el tiempo libre, dependiendo al tipo de intensidad de cada persona (moderada, de 3 MET o vigorosa), se asocia a un menor riesgo de cáncer y esto, incluye a personas con sobrepeso u obesidad (p=0.04 heterogeneidad p=0.02)16.
Por otro lado, el impacto de la actividad física diaria sobre el riesgo de cáncer se observó una disminución del riesgo con mayor claridad en las mujeres (odds ratio fue de 0.93; IC95%: 0.82, 1.05), 0.84 (IC95%: 0.73, 0.96) y 0.84 (IC95%: 0.73, 0.97. p=0.007) que en los hombres (IC95%: 0.90, 1.11), 0.96 (IC95%: 0.86, 1.07) y 0.87 (IC95%: 0.78, 0.96. p=0.005) especialmente entre los ancianos y aquellos que regularmente participan en deportes de ocio o ejercicio físico. Según la ubicación, disminuyeron el riesgo para cáncer de colon, hígado y páncreas en los hombres y para el cáncer de estómago en las mujeres (p=0.158 vs 0.519)15.
Actividad física: Una técnica que es sugerida durante la hospitalización para el tratamiento del carcinoma hepatocelular, es el ejercicio terapéutico, el cual mejoró la capacidad física sin empeoramiento de la función hepática (p<0.05)19. También, un estudio con 10 ratones y ejercicio por 32 semanas, donde se inició corriendo sobre una cinta rodante y su velocidad fue gradual. Estos datos muestran un efecto beneficioso del ejercicio regular sobre el desarrollo de carcinoma hepatocelular (Odds ratio 0.55 (IC95%: 0.38 a 0.80, p para la tendencia <0.001)14. Además, al comparar el nivel más alto con el más bajo de actividad física revelaron una disminución estadísticamente significativa del riesgo de cáncer de hígado (RR: 0.64, IC95%: 0,49-0,84; tendencia p <0.001), particularmente carcinoma hepatocelular (RR: 0.56, IC95%: 0.41-0.78; tendencia p<0.001)24. También, el ejercicio regular reduce las consecuencias negativas asociadas con el consumo excesivo de una dieta-energía densa, (Odds ratio 0.73, IC95%: 0.55-0.98)16 incluyendo resistencia a la insulina (5.9±5.9 a 4.6±4.6 vs 4.7±2.1 a 5.1±2.5; p<0.05)28 y disminución de la obesidad (reducción significativa del 14%; p<0.05)26.
Natación: En este apartado, se recomienda la práctica de natación, en el que se encontró una mejoría significativa en la pérdida de peso corporal después de un periodo de intervención en la muestra de estudio (entrenados con dieta baja en grasa 380.4±9.33 vs 460.3±15.3, no entrenados con dieta baja en grasa 382.0±8.58 vs 411.1±15.4) indican que el resultado del ejercicio posterior al acondicionamiento puede atenuar la carcinogénesis hepática bajo un régimen dietético adecuado con una menor ingesta de grasas20.
DISCUSIÓN
La actividad física se relaciona a un menor riesgo de carcinoma hepatocelular36. Se encontró un 45% menos de riesgo de HCC al comparar los niveles altos y bajos de actividad física total. Por otra parte, el beneficio del entrenamiento de natación fue muy bien calificado en los grupos de dieta con alta y baja en grasa, para la disminución del peso corporal y grasa corporal.
Así mismo, éstos resultados están acorde con un estudio con variación de 10 cohortes con un total de 1.384 casos que consignaron una reducción del 27% de riesgo de cáncer de hígado frente a los niveles altos y bajos de actividad física en tiempo de ocio37. Además, la certeza de casos observacionales prospectivos y ensayos controlados aleatorios recomiendan que la acción más importante por el cual la actividad física afecta positivamente el riesgo de cáncer de hígado es la reducción del peso corporal38-39. Además, se ha descubierto que, la obesidad central contabilizaría una gran proporción del efecto directo de la actividad física en HCC. Es por eso que, los mecanismos latentes, la relación entre la obesidad central y cáncer hepatobiliar, especialmente HCC, se puede procrear por medio de la acumulación abundante de grasa en el hígado que aumenta la molécula pro-inflamatoria, la leptina, y la adiponectina40.
Cabe señalar que, la actividad física no solo posee efectos benéficos frente al riesgo de cáncer hepático. Un estudio41 mostró una asociación inversa entre la actividad física y el cáncer renal, y otro, mostró la relación existente entre la actividad física y el cáncer de riñón42. Sin embargo, una que otra investigación prospectiva de cohortes no han mostrado relación alguna entre la actividad física y el riesgo de cáncer renal43,44. Rabol R. et al. menciona que en la enfermedad hepática grasa no alcohólica (EHGNA), la actividad física intensifica la síntesis postprandial de glucógeno muscular, mejora la glicemia, disminuye la lipogénesis hepática de novo, entre otras, teniendo como resultado una menor incidencia de la NAFLD45. También, se ha demostrado el impacto que tiene el ejercicio físico independiente de la pérdida de peso frente a NALFD46. Por otro lado, los programas de ejercicio, tanto ejercicio aeróbico como de ejercicio de resistencia, puede restablecer la capacidad cardiorrespiratoria, disminuir diversas condiciones asociadas con el síndrome metabólico y ayudar de la pérdida de peso. No obstante, se cree que el ejercicio aeróbico sería más efectivo en reducir la adiposidad visceral, aunque el ejercicio de resistencia tendría una mayor adherencia y tolerancia47. Así mismo, una investigación de intervención en 196 sujetos con sobrepeso y sedentarismo, cotejaron los efectos del ejercicio aeróbico y de resistencia frente a la grasa ectópica, enzimas hepáticas y resistencia a la insulina en ayunas; demostrando, que el ejercicio aeróbico trajo consigo disminuciones elocuentes de grasa en el hígado, grasa visceral, alanina aminotransferasa y la grasa abdominal total y subcutánea.
Por parte del ejercicio de resistencia, este originó una menor grasa subcutánea abdominal pero no mejoró significativamente las otras variables, y la combinación de ambos entrenamientos no produjeron efectos beneficios adicionales10. Igualmente, otra investigación10 confirmó que un puntaje más elevado de actividad física está relacionado con una tasa menor de NAFLD, lo que resulta que esta relación va más allá del efecto de mediadores potenciales como la adiponectina, la resistina, la resistencia a la insulina y los factores nutricionales. Finalmente, Tsuzuku S. et al.48 comprobaron que el entrenamiento de resistencia no instrumental, tomando como la carga el peso corporal, suele ser efectivo para reducir la grasa visceral y mejorar los perfiles metabólicos, sin pérdida de peso. Lo cual se vería reflejado a futuro, en un menor riesgo de diferentes tipos de cáncer.
En conclusión, se ha visualizado que el entrenamiento aeróbico puede aminorar los lípidos hepáticos y viscerales en individuos obesos previamente sedentarios. Además, el ejercicio regular puede moderar las consecuencias metabólicas y cardiovasculares de la obesidad, incluido el hígado graso. Así mismo, el ejercicio terapéutico también mejoró la capacidad física sin empeoramiento de la función hepática durante su hospitalización y efectivamente la evidencia recolectada y mostrada en este artículo con una muestra mayor a 2 millones de individuos que “mayores niveles de actividad física o ejercicio, se asocian con un menor riesgo de cáncer hepático”.