INTRODUCCIÓN
La disminución de la reserva ovárica (DRO) se refiere al número reducido y la calidad de los ovocitos restantes en el ovario1. La incidencia de DRO oscila entre el 6% y el 64% en mujeres infértiles de diferentes edades2. No sólo se observa una reducción del número y la calidad de los ovocitos restantes en estos pacientes, sino también hipo-respuesta ovárica, alta tasa de cancelación de ciclos de estimulación, aumento en las dosis de los estimulantes de ovulación, reducción del número de ovocitos adquiridos, disminución de la tasa de embarazo clínico y de recién nacido vivo, además una alta tasa de aborto espontáneo puede estar presente en estas mujeres después del tratamiento con fertilización in vitro (FIV) con transferencia embrionaria (TE)3,4.
Si bien una disminución del potencial reproductivo se considera parte del proceso natural de envejecimiento ovárico5, también puede ser encontrada en las mujeres jóvenes6. Las fallas repetidas de estimulación ovárica (EO), la cancelación de ciclos de EO para FIV, la indisponibilidad de embriones y el fracaso de la implantación aumentan significativamente las cargas tanto fisiológicas como psicológicas en los pacientes con DRO, especialmente en las mujeres jóvenes con DRO7.
Se han hecho varios intentos desde el año 2011 para determinar y clasificar los criterios más relevantes o significativos de la reserva ovárica y por consiguiente la respuesta esperada a la estimulación. Así surgió el grupo de Bologna8 y el grupo que establece los criterios de Poseidón9, éste último incorpora edades de menos de 35 años y pone en discusión los primeros criterios (Bologna), ya que considera mujeres que tienen entre 35 y 40 años, mientras que el Bologna solo en mujeres de 40 años o más8.
Generalmente, la reserva ovárica se evalúa de acuerdo con: i) la edad, factor más importante que afecta también a la calidad de los óvulos10; ii) el nivel basal de hormona estimulante de los folículos (FSH); iii) el recuento de folículos antrales (RFA); que con iv) la hormona antimülleriana (HAM) son los marcadores más fidedignos de reserva ovárica11.
El avance de la tecnología con la automatización de los métodos para evaluar la HAM, mejorando su sensibilidad, ha fortalecido el papel de sus niveles séricos como marcador para la DRO. La evaluación de los niveles séricos de HAM tiene cierto valor predictivo para la respuesta ovárica a la estimulación. Sin embargo, poco se sabe sobre las diferencias en la calidad de los óvulos, las tasas de embarazo clínico (EC) y las tasas de recién nacido vivo (RNV) en mujeres jóvenes con DRO (menos de 40 años).
En el país no existen registros ni estudios sobre la prevalencia de mujeres con DRO y sus resultados al someterse a técnicas de reproducción asistida, la relevancia de este estudio se basa en identificar este grupo de pacientes infértiles y determinar los resultados de reproducción asistida en la población paraguaya. Por tanto, el objetivo del presente trabajo fue investigar las tasas de embarazo y nacido vivo en pacientes infértiles menores de 40 años con disminución de la reserva ovárica medida por HAM y RFA.
MATERIALES Y MÉTODO
Estudio observacional, descriptivo, retrospectivo en el cual se analizaron mujeres infértiles menores de 40 años de edad, con baja reserva ovárica que se sometieron a tratamientos de reproducción asistida de alta complejidad en la clínica Neolife en el período agosto 2015 a setiembre 2019. Fueron incluidas todas aquellas fichas de pacientes menores de 40 años, con diagnóstico de infertilidad, que fueron sometidas a ciclos de FIV-TE durante el período mencionado, que cumplen con los criterios de baja reserva ovárica según Bologna (HAM <1,1 ng/mL) y RFA de 7 o menos8. Fueron excluidas aquellas pacientes que no culminaron el tratamiento de alta complejidad, y aquellas con fichas clínicas incompletas.
Los datos fueron recolectados través del número de identidad de los pacientes, se accedió al archivo de estos utilizando el sistema operativo VRepro® (NaturalSoft Solutions S.L., Barrio de la Vega, España) donde se encuentran registradas las historias clínicas, los estudios de laboratorio, tipo de técnica de reproducción asistida, así como los resultados de análisis embriológicos y seguimiento de los pacientes hasta la obtención del nacido vivo. Se clasificaron las historias clínicas, evolutivas y fichas de laboratorio que contenían todas las variables del estudio en cuestión, las mismas fueron exportadas a una planilla como base de datos para el análisis.
Las variables del presente estudio fueron: edad de la paciente, estratificada en menores de 35 años y de 35 a 39 años de edad; HAM, definida por resultado bioquímico en muestra de sangre, que utiliza como punto de corte un valor de <1.1 ng/mL para clasificar a las pacientes con reserva ovárica disminuida. Los valores de HAM fueron medidos por el método de quimoluminescencia (Immunotech S.A.S., Beckman Coulter, Inc., Marseille, France), número de ovocitos recuperados, definidos por la cantidad de ovocitos captados en punción y aspiración folicular guiada por ecografía; calidad de ovocitos recuperados: definida por evaluación microscópica de los óvulos obtenidos12, y número de ovocitos fertilizados.
Se calcularon las tasas de embarazo clínico y recién nacido vivo (por cada 100 pacientes sometidas a transferencia embrionaria) de acuerdo a la edad, número embriones transferidos y día de transferencia embrionaria, según hayan sido transferidos 1 o 2 o más embriones y si éstos fueron transferidos en día 3 o 5 de cultivo, respectivamente.
Análisis de datos: Los datos fueron consignados en una planilla electrónica de Excel (Microsoft, Redmond, WA, USA) y posteriormente analizados por el paquete estadístico GraphPad de Prism® (San Diego, California, USA) para Mac. La estadística descriptiva se reportó mediante media ( desviación estándar. Para comparar medias se utilizó la prueba U de Mann Whitney y para la correlación se utilizó Rho de Spearman, considerando un valor p <0,5 significativo.
Aspectos éticos: Se respetaron los principios de la ética en investigación. Se mantuvo la confidencialidad de los participantes del estudio.
RESULTADOS
Se revisó las fichas clínicas de 373 mujeres menores de 40 años sometidas a tratamientos de reproducción asistida de alta complejidad en el centro Neolife de enero 2015 a diciembre 2019, de las cuales 45 presentaron valores de HAM menores a 1,1 ng/mL, y 7 igual o menos de RFA, por tanto, con criterio de reserva ovárica disminuida, por lo tanto, la prevalencia de mujeres con DRO fue de 12%.
De las 45 pacientes con reserva ovárica disminuida, hubo embarazo clínico en el 40% (n=18), y recién nacido vivo en el 31% (n=14). En cuanto a las tasas de embarazo clínico y recién nacido vivo, calculada con base en el número de embarazos clínicos o nacidos vivos sobre el total de transferencias realizadas, se ha encontrado que la tasa de embarazo clínico en embriones transferidos en el día 3 fue de 21,8, en el día 5 de 33; mientras que las tasas de nacido vivo fueron de 17,1 y 25 para embriones transferidos en día 3 y 5, respectivamente.
Al estratificar por edad, se observó que 22 de ellas (49%) eran menores de 35 años, mientras que los 23 restantes (51%) tenían entre 35 y 40 años de edad. Las estadísticas descriptivas de este grupo de pacientes se detallan en la Tabla 1. El promedio de HAM en la población de estudio fue de 0,56 ng/mL, mientras que el promedio de recuento de folículos antrales por paciente fue de 4,73, una media de 4.4 ovocitos capturados, y 3,51 ovocitos M2 por paciente. De 198 ovocitos capturados, sólo 147 fertilizaron, 122 avanzaron a día 1 de cultivo, 92 a día 3 y sólo 20 a día 5 de cultivo. De los 92 embriones día 3, 64 fueron transferidos, y 14 de 20 embriones día 5.
Tabla 1. Características demográficas y clínicas de pacientes infértiles menores de 40 años con disminución de la reserva ovárica. (n=45)
| Características | Media ( desvío estándar |
|---|---|
| Edad | 35,0 ( 2,5 |
| HAM (ng/ml) | 0,56 ( 0,29 |
| Número de folículos (n=213) | 4,73 ( 2,38 |
| Número de ovocitos capturados (n=198) | 4,40 ( 2,11 |
| Número de ovocitos m2 (n=158) | 3,51 ( 1,97 |
| Fertilizados (n=147) | 3,26 ( 1,80 |
| Embriones en cultivo | |
| Día 1 (n=122) | 2,71 ( 1,63 |
| Día 3 (n=92) | 2,04 ( 1,47 |
| Día 5 (n=20) | 0,44 ( 1,27 |
| Embriones transferidos | |
| Día 3 (n=64) | 1,42 ( 0,81 |
| Día 5 (n=14) | 0,31 ( 0,70 |
Al comparar las variables estudiadas de acuerdo a si hubo o no embarazo clínico o recién nacido vivo, no se encontraron diferencias significativas, a excepción de la transferencia embrionaria en el día 5 (p<0,0001). Tabla 2
Tabla 2. Comparación de los valores promedio de las variables de estudio entre mujeres con embarazo clínico y con nacidos vivos (n=45)
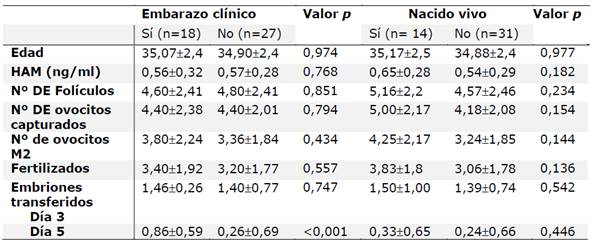
Los datos se presentan como media ± desvío estándar. Test: U de Mann Whitney, p<0,05 se consideraron estadísticamente significativos.
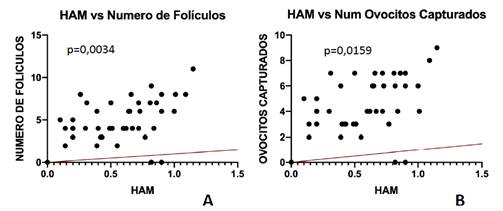
En cuanto a la correlación entre valores de HAM y resultados de ciclos de reproducción asistida de alta complejidad, se ha encontrado una correlación estadísticamente significativa entre los valores HAM con número de folículos (p=0,0034, r=0,42) y con el número de ovocitos capturados (p=0,0159; r=0,35) (Figura 1).
DISCUSIÓN
En este estudio, se investigó la tasa de embarazo clínico y de recién nacido vivo después de los ciclos de FIV-TE en pacientes menores de 40 años con disminución de la reserva ovárica (DRO). Los resultados sugieren que los pacientes con AMH menos de 1,1 ng/ml y recuento de folículos antrales (RFA) menor a 7, tienen menos folículos al final de la estimulación y menos ovocitos recuperados. Sin embargo, las tasas globales de EC y de RNV son comparables en los grupos de menos de 35 y de 35 a 40 años, lo que sugiere que no hay asociación entre la disminución de la reserva ovárica (medida con la HAM y el RFA) con los resultados del embarazo en pacientes jóvenes con DRO.
El papel de la HAM sérica en la predicción de la probabilidad de éxito de la FIV-TE sigue siendo un tema de debate. Varios metaanálisis13-15 y estudios individuales han sugerido que el bajo nivel de HAM se correlaciona con tasas más bajas de embarazos clínicos16-19. En un estudio retrospectivo de 892 mujeres sometidas a 1230 ciclos de FIV-ICSI, Brodin et al.17 mostraron un aumento en la tasa de embarazo por ciclo de FIV-TE, es decir, 10,7% para AMH <0,84 ng/ml a 30,8% para AMH >2,94 ng/ml. Del mismo modo, Merhi et al., sugirieron una 0,2 ng/ml de corte de AMH como umbral para la EC en su cohorte de estudio de 120 pacientes 20. A la luz de estos datos, algunos autores han propuesto cortes específicos de HAM para calcular la probabilidad de RNV21, así como cortes por debajo de los cuales el tratamiento se considera casi inútil22,23. Contrariamente a los hallazgos antes mencionados, varios estudios recientes han cuestionado la utilidad de la HAM como un predictor de los resultados del embarazo después de la FIV-TE24,25, lo cual se observa en el presente estudio, ya que valores de HAM en nuestra serie no se correlacionaron con aumento o disminución de tasas de EC y RNV. Sin embargo, en un estudio de 2760 pacientes sometidos a 4072 ciclos, Reichman et al. informaron que la HAM estaba correlacionada positivamente con el número de ovocitos recuperados y era un predictor robusto de la cancelación del ciclo de FIV-TE24, hallazgos también observados en el presente estudio, ya que se encontró un aumento significativo de RFA y ovocitos recuperados a mayor valor de HAM.
La determinación de los niveles de HAM no fue satisfactoria como prueba para predecir TEC y TRNV en el presente estudio, ya que no hemos encontrado resultados significativos en éstas según HAM. De hecho, en pacientes <40 años de edad con AMH indetectable, el 23,5% de los pacientes alcanzaron un RNV por FIV-TE. Almog et al. compararon 39 pacientes <30 años de edad con una respuesta ovárica deficiente (<5 ovocitos recuperados) con controles coincidentes con la edad y encontraron que el número de embriones de buena calidad, implantación, y tasas de RNV eran similares en ambos grupos26. Por lo tanto, ambos estudios sugieren que la HAM no predicen las tasas posteriores de EC y RNV27-28. Estudios en ciclos FIV-TE de ovocitos donados se encontraron también resultados similares, en un análisis de 160 ciclos de donación de ovocitos (78 donantes), los autores encontraron que la HAM predijo la respuesta a la estimulación ovárica en mujeres jóvenes seleccionadas como donantes de ovocitos, pero no predictiva de los resultados del embarazo en la población receptora16. Nuestros hallazgos corroboran además que la HAM no está asociada con los resultados del embarazo en pacientes jóvenes con DRO, es decir, la mala reserva o la mala respuesta ovárica en pacientes jóvenes no equivale a resultados deficientes de FIV-TE.
Una de las limitaciones de nuestro estudio es el tamaño de la muestra, aun habiendo analizado todos los ciclos FIV-TE del centro Neolife y Medicina Reproductiva. Sin embargo, a pesar del bajo número de pacientes en el estudio el punto fuerte radica en la evaluación de las transferencias en D3 y en D5 arrojando un resultado significativo en cuanto a TEC y TRNV a favor de las transferencias realizadas en el D5.
Estos hallazgos necesitan de más estudios, con un tamaño muestral más importante y así poder obtener la prevalencia de las mujeres infértiles con baja reserva ovárica y sus resultados reproductivos, sobre todo aportar el hallazgo significativo que fue el transferir siempre embriones en D5 para mejorar las tasas de embarazo clínico.
Más estudios similares, comparando resultados de ciclos FIV-TE en pacientes infértiles menores de 40 años con DRO versus aquellas con reserva ovárica normal deben ser realizados, con mayor tamaño de muestra para dilucidar el valor real de la HAM para predecir tasas de EC y RNV en nuestra población y así afinar el diagnóstico para trazar con estas mujeres una hoja de ruta para mejorar los resultados reproductivos.
Las tasas de embarazo clínico en pacientes jóvenes infértiles con DRO aumentan significativamente al transferir embriones en el día 5 vs día 3, por más de que se observa mayor tasa de nacidos vivos en transferencias del día 5 comparadas con día 3, esta diferencia no es significativa en la población estudiada.