INTRODUCCIÓN
Toxoplasmosis es una infección causada por un parasito protozoario, Toxoplasma gondii1. En los test serológicos para toxoplasma, el antígeno es preparado a partir de taquizoitos obtenidos del exudado intraperitoneal de ratones previamente inoculados.
El mantenimiento de T. gondii en el laboratorio usualmente depende de pasajes seriados en animales o cultivo en líneas celulares adecuadas. Ambos métodos, sin embargo, consumen tiempo y son costosos2. Los parasitólogos han mostrado un interés creciente en el desarrollo de técnicas de criopreservación para contrarrestar el mantenimiento de los parásitos en animales de laboratorio, muchos protozoos han sido preservados satisfactoriamente a bajas temperaturas sin variar su viabilidad e infectividad3.
Algunos investigadores han usado taquizoitos extraídos del exudado intraperitoneal, empleando un rango de enfriamiento de 1ºC por minuto seguido por almacenamiento a -70ºC3. La refrigeración con nitrógeno liquido a -196º C ha dado a los parasitólogos y otros trabajadores que manipulan material biológico, un método satisfactorio, para el almacenamiento de parásitos por largos periodos de tiempos. En la conservación de los parásitos se utilizan aditivos crioprotectivos o protectores químicos de las células durante su congelamiento, que pueden minimizar el efecto de la concertación del soluto y la formación de cristales de hielo. Los agentes más comúnmente utilizados son el dimethylsulfoxide (DMSO) y el glycerol.
Es importante también el rango de temperatura para minimizar el daño de congelamiento en las células o parásitos. Los agentes criopreservante parecen ser más efectivos cuando pueden penetrar en la célula y retrazar el congelamiento intracelular y minimizar el efecto de la solución4. La elección de un agente crioprotectivo depende del tipo de células a ser criopreservada. Para la mayorìa de las cèlulas el glicerol es el agente de elección debido a que es menos tóxico que el DMSO, Sin embargo, el DMSO es más penetrante y suele ser el agente de elección para células más grandes y complejas como los protozoarios5.
Hay dos principales ventajas en el almacenamiento de T. gondii por periodos prolongados: a) evitar el pasaje en serie de los parásitos en ratones para mantener la cepa y el riesgo asociado de este procedimiento que puede ser sustituido por la criopreservación. b) Las cepas de T. gondii pueden ser preservadas en varias etapas en un experimento, donde la infectividad y antigenicidad del parasito puede ser mantenida6.
El propósito de este trabajo fue evaluar la viabilidad de los parásitos de T. gondii cepa RH después de criopreservar a los 1 y 5 meses con dos tipos de criopreservantes el DMSO y el glicerol. La importancia de tener un buen criopreservante es mantener a estos parásitos vivos por largos periodos de tiempo debido a que estos son utilizados como antígenos en la preparación de reactivos de diferentes métodos de diagnóstico para la detección de anticuerpos anti T. gondii además de abaratar los costos de los mismos.
METODOLOGIA
Diseño del estudio: experimental
Población en estudio: parásitos de T. gondii cepa RH del Instituto de Investigaciones de Ciencias de la Salud (IICS) criopreservados durante 1 y 5 meses en nitrógeno líquido con DMSO y glicerol.
Control: parásitos de T. gondii cepa RH (concentración de 2.88.107 + 0.71.107parásitos/mL) que no fueron criopreservados, mantenidos por pasajes intraperitoneal sucesivos en ratones albinos.
Criopreservación: Glicerol (Biopack, Argentina) y DMSO (Sigma, St. Louis, MO) fueron utilizados como criopreservantes. RPMI 1640 medium (Sigma, St. Louis, MO) y suero fetal bovino (FBS) inactivado, fueron utilizados como medio para la criopreservación. Solución fisiológica (JP Industria Farmaceutica S.A. Brasil) con gentamicina (Gauyaki S.A. Paraguay) 10 mg/ml usada para el lavado intraperitoneal de 18 ratones infectados. Nitrógeno líquido.
Evaluación de la viabilidad los parásitos de T. gondii cepa RH criopreservados: Para evaluar la viabilidad de los parásitos de T. gondii cepa RH criopreservados, fueron utilizados 24 ratones albinos machos y hembras de 9 y 10 semanas de edad, con pesos entre 22 - 30 g, procedentes del Bioterio del IICS. Ciclo de luz - oscuridad de 12 horas, temperatura de 23 - 30ºC, fueron mantenidos dentro de la sala de animales. Los animales recibieron alimentos balanceados comerciales con agua de bebida ad libitum.
Procedimiento
Criopreservación: Se recogió el lavado intraperitoneal (i.p.) de 18 ratones infectados con T.gondii, se hizo un pool de los mismos, luego se centrifugó a 3500 rpm por 10 minutos a 4ºC, se desechó el sobrenadante. Se resuspendió con 8 ml de RPMI y se realizó una segunda centrifugación a 3500 rpm durante 5 minutos a 4º C, se desechó el sobrenadante y se resuspendió con 6 ml de RPMI conteniendo 4% FBS, lo cual se realizó bajo flujo laminar. Esta suspensión contiene 7.107 parásitos/ml. Se fraccionó 0,5 ml de la suspensión en los crioviales, a los cuales se agregaron los criopreservantes: 10% Glicerol y 1,25; 12,5 y 25% de DMSO. Los crioviales fueron incubados a temperatura ambiente por 30 minutos, luego fueron depositados en un freezer a -70º C, suspendidos en isopropanol durante 24 horas y trasferidos posteriormente a - 196ºC en nitrógeno líquido.
Evaluación de la viabilidad de los parásitos de T. gondii cepa RH criopreservados: Luego de 1 y 5 meses, las muestras criopreservadas en nitrógeno líquido fueron descongeladas en un baño María a 37º
C. Con estas muestras se procedió de la siguiente manera: las criopreservadas con Glicerol 10% y DMSO 1,25% fueron inoculadas directamente vía i.p. 0,5ml a 1 ratón por cada muestra. Las muestras criopreservadas con DMSO 12,5 y 25% fueron lavadas previamente a la inoculación, con 2,5ml de RPMI conteniendo 3% de FBS, centrifugándose a 3500 rpm por 5 minutos a 4º C, se reconstituyó el pellet con RPMI hasta un volumen de 0,5 ml y se inoculó a 1 ratón con cada muestra.
A los ratones inoculados se les observó cada 24 horas hasta la aparición de síntomas, característicos de infección por toxoplamosis, tales como: piloerección, ataxia del tres posterior, locomoción disminuida y pérdida del apetito.
Los ratones fueron sacrificados ante la aparición de los síntomas, se realiza el lavado i.p. y se evalúa la cantidad de parásitos/ml con la cámara de recuento de Neubauer. Se procedió a inocular este lavado i.p. a 1 ratón (primer pasaje), esto se realiza a cada uno de los ratones inoculados con los parásitos del criopreservado. Se observó a los ratones cada 24 horas. Este procedimiento se realizó en forma secuencial hasta obtener el pico máximo de parásitos/mL igual o mayor al control de parásitos de T. gondii cepa RH que no fueron criopreservados mantenidos en ratones.
Se evaluó la viabilidad de los parásitos: calculando la concentración de parásitos/mL en cada pasaje con los diferentes criopreservantes, comparado con la concentración de parásitos/mL del control.
Análisis estadístico
Los datos fueron evaluados con el programa estadístico GraphPad Prims 5. El test estadístico utilizado fue Anova seguido por la comparación múltiple de Tukey. El nivel de probabilidad menor a 0,05 fue considerado como significativo.
Consideraciones éticas
Los animales utilizados en este trabajo fueron cuidados, alimentados y manipulados considerando la guía Internacional de utilización de animales de experimentación CIOMS 1985. En lo posible se ha evitado todo sufrimiento y se ha utilizado el mínimo número para este ensayo7.
RESULTADOS
Los días de la aparición de síntomas, característicos de toxoplasmosis, en los ratones luego de la inoculación con el criopreservado, fueron los siguientes: 5 días para los ratones inoculados con la muestra criopreservada con Glicerol 10% y DMSO 1,25%, a los cuales se los sacrificó al 6to día; 3 días para los ratones inoculados con la muestra criopreservada con DMSO 12,5% y 25%, se los sacrificó al 4to día. El día de la inoculación con la muestra criopreservada fue denominado día cero.
La cantidad de parásitos/mL presentes en el lavado i.p. de cada uno de los ratones posterior a la inoculación con la muestra criopreservada durante 1 y 5 meses, determinados con la cámara de recuento de Neubauer se muestra en la Tabla 1.
Tabla 1. Cantidad de parásitos/mL presentes en el primer lavado i.p.
| Gly 10% | DMSO 1,25% | DMSO 12,5% | DMSO 25% | |
|---|---|---|---|---|
| 1 mes | 0,144.17 | 0,416.107 | 0,016.107 | 0,024.107 |
| 5 meses | 0,008.17 | 0,016.107 | 0,016.107 | 0,024.107 |
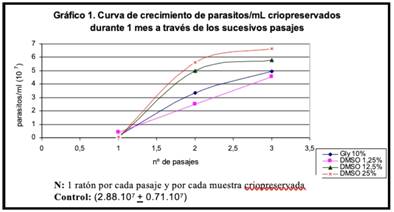
En el gráfico 1 se observa el crecimiento de los parásitos criopreservados durante 1 mes con las diferentes concentraciones de criopreservantes
Las diferencias encontradas en las concentraciones de parásitos en los diferentes pasajes con respecto al control, obtuvimos los siguientes resultados: hay diferencia significativa (p < 0.05) entre el pasaje número 1 y 3 con respecto al control, sin embargo, no encontramos diferencia significativa entre el control y el pasaje número 2.
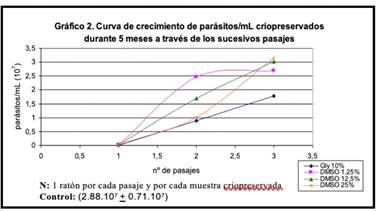
En el gráfico 2 se observa el crecimiento de los parásitos criopreservados durante 5 meses con las diferentes concentraciones de criopreservantes.
Las diferencias encontradas en las concentraciones de parásitos en los diferentes pasajes con respecto al control, obtuvimos los siguientes resultados: hay diferencia significativa (p < 0.05) entre el pasaje número 1 y 2 con respecto al control, sin embargo, no encontramos diferencia significativa entre el control y el pasaje número 3.
DISCUSION
Según Ding-Bang Lin y cols la temperatura de - 196ºC en nitrógeno líquido, es la mejor para el almacenamiento de taquizoitos de T. gondii en términos de conservación de viabilidad y virulencia de los parásitos3.
Para muchas células, el glicerol es el criopreservante de elección porque es usualmente menos tóxico que el DMSO. Sin embargo, el DMSO es más penetrante y es usualmente el agente de elección para protozoos4.
La viabilidad es la medida de la habilidad de los parásitos de crecer y reproducirse. Para algunos cultivos de protozoos, estos deben pasar por varios pasajes para asegurar su estabilidad (4). Los parásitos de T. gondii criopreservados con glicerol al 10% y las diferentes concentraciones del DMSO no presentan diferencia en cuanto a la viabilidad a los 1 y 5 meses, lo que observamos en el aumento del número de parásitos en los sucesivos pasajes.
Observamos en el lavado i.p., posterior a la inoculación, un bajo número de taquizoitos, menor al control (2.88.107 + 0.71.107) para las diferentes concentraciones del DMSO y el glycerol con la muestra criopreservada durante 1 y 5 meses.
En el segundo pasaje de las muestras criopreservadas durante un mes, la concentración de parásitos fue semejante al control, no existiendo diferencias significativas. Sin embargo, para las muestras criopreservadas durante 5 meses recién en el tercer pasaje la concentración de parásitos se iguala al control.
Los parásitos fueron aumentando a través de los sucesivos pasajes, observándose que la mayor cantidad de taquizoitos se obtuvo con concentraciones de 12.5% y 25 % del DMSO, en el tercer pasaje, tanto a los 1 como a los 5 meses.
El glicerol tuvo un comportamiento semejante al DMSO de concentración de 1.25% a los un mes, pero a los 5 meses obtuvimos menor cantidad de parásitos, con lo cual se observa la necesidad de continuar probando las muestras criopreservadas a los 12 meses de la criopreservación para constatar la viabilidad de los parásitos.
Los criopreservantes ensayados, tanto el Glicerol como el DMSO presentan comportamientos semejantes, no obstante, el DMSO a concentraciones de 12.5 y 25% ha demostrado ser mejor criopreservante. Las diferentes concentraciones ensayadas resultan efectivas y no alteran la viabilidad de los parásitos de T. gondii cepa RH criopreservados en nitrógeno líquido durante 1 y 5 meses de conservación. Es necesario aún practicar más ensayos a los 12 meses a fin de obtener el tipo y la concentración del criopreservante ideal para conservar los parásitos de T. gondii cepa RH mantenidos en nuestro laboratorio.