1. INTRODUCCIÓN
El escorpionismo, patología secundaria al envenenamiento por escorpiones de importancia médica en humanos, es un evento epidemiológico frecuente y poco conocido en el Paraguay, a pesar de las alteraciones severas que pueden producirse tras la picadura y su alta prevalencia y mortalidad en los países vecinos. El envenenamiento por escorpión puede ocurrir tanto en áreas urbanas como rurales, afectando a todas las edades, en especial a los niños y adultos mayores, las víctimas más vulnerables.
Los escorpiones son artrópodos pertenecientes a la Clase Arachnida, los cuales poseen un metasoma (región caudal) que culmina en un sexto segmento denominado telson, en cuyo interior se localizan dos glándulas productoras de veneno, el cual es inyectado a través de un aguijón en presas, predadores o humanos envenenados accidentalmente.
La escasa cantidad usualmente inyectada durante la aguijoneadura (en el orden de microlitros) y la severa neurotoxicidad asociada a los componentes de baja masa molecular del veneno de especies de importancia médica, evidencian la necesidad de implementar medidas de control y prevención del escorpionismo en las áreas en donde éstas son prevalentes, incluyendo Paraguay, en donde han ocurrido reportes de casos severos de envenenamiento, además de presentar las bases fisiopatológicas de las complicaciones que resultan de los accidentes severos1.
La mayoría de los casos de escorpionismo, a nivel global, no tienen consecuencias fatales, considerando que de las aproximadamente 2300 especies de escorpiones conocidas, sólo alrededor de 40 son de importancia médica. Sin embargo, la abundancia relativa de algunas especies, producto de su éxito evolutivo, incluyendo la partenogénesis, es elevada en algunas regiones, lo que condiciona el aumento de la probabilidad del envenenamiento2. En algunos casos, la picadura sólo provoca dolor local y sensación de ardor, sin embargo, puede resultar en un envenenamiento sistémico, poniendo en riesgo la vida del paciente, dependiendo de la toxicidad del veneno de la especie responsable3,4.
El único tratamiento aceptado globalmente para el envenenamiento escorpiónico sistémico es la aplicación de un antiveneno específico, preparado en contra de la especie responsable del accidente, o con neutralización cruzada comprobada hacia tal especie, en caso de haber sido generado a partir del veneno de especies relacionadas toxinológicamente con la misma. Las evidencias clínicas y experimentales disponibles muestran que cuando el antiveneno específico es aplicado en tiempo y forma adecuados, disminuye drásticamente la mortalidad por envenenamiento escorpiónico5,6.
Las picaduras de insectos pertenecientes a la Clase Hymenoptera, incluyendo abejas, avispas y hormigas, producen un cuadro clínico asociado con una reacción anafiláctica, el cual podría ser confundido en principio con el causado por el envenenamiento escorpiónico sistémico, por lo que es de importancia diferenciar ambas situaciones, particularmente si se desconoce la identidad del artrópodo responsable7. Un diagnóstico incorrecto resultaría en un manejo inadecuado del tratamiento y, como consecuencia, podría contribuir con el agravamiento del paciente3. El correcto diagnóstico del escorpionismo, tan pronto como haya sucedido la picadura, es crucial para un tratamiento rápido y efectivo.
Actualmente, Paraguay no cuenta con antivenenos específicos producidos en contra de las especies prevalentes en el país, a pesar de la presencia reportada de escorpiones tóxicos en zonas urbanas de la capital y áreas vecinas, y el registro de casos severos en niños. El promedio de consultas por picadura de escorpión en los centros asistenciales del área de la Gran Asunción, incluyendo el Instituto de Medicina Tropical, es de 2 por semana8. Al no contar el país con una producción propia local, se debe recurrir a los antídotos manufacturados en países vecinos, como Argentina y Brasil8,9.
Históricamente, se había estimado que las especies de escorpiones pertenecientes al género Tityus que habitan en el Paraguay (responsables de los casos de envenenamiento sistémico en la región) son las mismas compartidas con los países limítrofes, Argentina y Brasil10.
La deforestación masiva y el cambio climático son fenómenos que han sido asociados a la migración hacia áreas urbanas de varias especies de animales venenosos, incluyendo escorpiones, que anteriormente habitaban solo áreas restringidas11,12. Estos fenómenos conllevan, en un futuro cercano, al aumento de los casos de los casos de envenenamiento ofídico y escorpiónico, posiblemente incluyendo a Paraguay, en donde habitan especies venenosas cuyo hábitat está siendo alterado.
La presente revisión tiene como objetivo presentar y analizar los efectos a nivel sistémico producidos como consecuencia de la picadura de escorpiones de importancia médica, con la finalidad de contribuir con la comprensión de la fisiopatología del envenenamiento por las especies de distribución local, y coadyuvar con la evaluación de la real magnitud del problema en Paraguay.
2. MATERIALES Y MÉTODO
Se realizó una búsqueda no acotada por tiempo en las bases de datos Medline, Scopus, ISI Web of Knowledge, LILACS y SciELO, usando los siguientes términos: escorpión, veneno de escorpión, envenenamiento escorpiónico, picadura de escorpión, escorpionismo, Tityus, Scorpion, scorpion venom, scorpion envenomation y scorpion sting. La búsqueda arrojó 172 resultados correspondientes a artículos de revisión y artículos originales, relacionados con la fisiopatología y el diagnóstico diferencial del envenenamiento por escorpiones del género Tityus, publicados en inglés, español y portugués. Se incluyeron documentos adicionales identificados luego de la revisión de las referencias bibliográficas citadas por los documentos descargados, y otros existentes en los archivos de los autores del presente estudio. La evaluación de los títulos, resúmenes y textos de los documentos identificados mediante la anterior búsqueda permitió identificar 76 reportes para la extracción de la información aquí presentada.
3. EL ESCORPIONISMO EN PARAGUAY
Los escorpiones, también llamados alacranes, son artrópodos con la capacidad de producir venenos que contienen proteínas y péptidos de baja masa molecular, los cuales alteran la fisiología normal de varios sistemas orgánicos, incluyendo los sistemas nervioso, cardiopulmonar, gastrointestinal, e inmunológico. La gravedad del efecto producido en el ser humano dependerá de la toxicidad del veneno del escorpión hacia vertebrados, la edad y condición fisiológica de la víctima al momento de la aguijoneadura y la ruta de inyección del mismo, entre otros factores13.
En el país han sido reportadas, hasta el momento de esta revisión, 15 especies de escorpiones, algunos de importancia médica debido a la toxicidad del veneno en humanos, y otros cuya toxicidad en humanos no representa riesgo10 (Figura 1). Entre las especies de potencial importancia médica se encuentran aquellas pertenecientes al género Tityus, en la familia Buthidae, representado por 5 especies: Tityus trivittatus, distribuido principalmente en la región oriental del país, siendo la especie más abundante en el área urbana de Asunción; Tityus confluens, adaptada a las condiciones áridas del Chaco, donde se distribuye principalmente, aunque también habita la región oriental; Tityus bahiensis, también reportado para la región oriental; Tityus paraguayensis y Tityus matogrossensis. De estas especies, las tres primeras han sido relacionadas con accidentes severos en Argentina y Brasil, mientras que las dos últimas, pertenecientes al subgénero Archaeotityus en el género Tityus, no han sido identificadas, hasta el momento de esta revisión, como responsables de accidentes de importancia médica1. El género Bothriurus, abundante en todo el país y que al igual que el género Tityus contiene especies con hábitos domiciliarios, se distingue de aquellas por la coloración negro o marrón oscuro brillante de su exoesqueleto, por la ausencia del tubérculo subaculear en el telson y por la presencia de pedipalpos (pinzas) más cortas y robustas que en el caso de Tityus spp. (Figura 1). Los accidentes derivados de la aguijoneadura por Bothriurus spp. generalmente no son considerados de importancia médica, a diferencia de los producidos por Tityus spp., por lo que los médicos tratantes y el personal de salud deben estar familiarizados con las diferencias morfológicas entre estos dos grupos de escorpiones14.
En el Paraguay, a pesar de no ser un evento de notificación obligatoria, se han reportado durante el año 2020 más de 60 consultas por escorpionismo a nivel nacional, a causa de efectos tóxicos del veneno de escorpión, en instituciones dependientes del Ministerio de Salud Pública y Bienestar Social, siendo los departamentos de Misiones, Central y Alto Paraná aquellos con el mayor número de reportes15 (Figura 2). El envenenamiento escorpiónico registrado en el país afecta a todas las edades, desde los niños hasta los adultos mayores (Figura 3). El deseo de explorar de los niños y niñas entre 2-9 años de edad los expone a un mayor riesgo de contacto con animales venenosos.
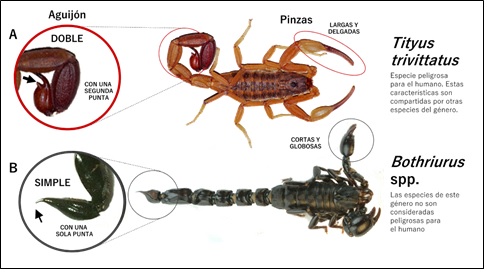
Figura 1 Diferencias morfológicas entre escorpiones que habitan Paraguay que han sido asociados a accidentes en humanos. A. Tityus trivittatus, especie de escorpión de importancia médica. B. Bothriurus sp., especie de escorpión de menor importancia médica (Fuente: Guía de Manejo Clínico para Accidentes Ofídicos y Escorpionismo, Ministerio de Salud Pública y Bienestar Social del Paraguay, 2021).
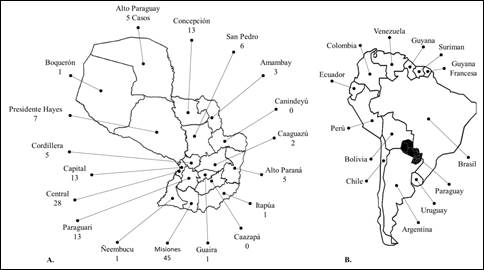
Figura 2 Escorpionismo en Paraguay. A. Número de consultas a causa de efectos tóxicos del veneno de escorpión según regiones sanitarias, durante los años 2019 y 2020. B. Ubicación geográfica del Paraguay en América del Sur15.
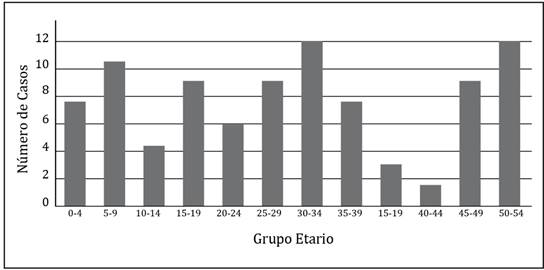
Figura 3 Consultas a causa de efectos tóxicos del veneno de escorpión según grupo etario en Paraguay. Año 202015.
4. COMPLICACIONES SISTÉMICAS ASOCIADAS AL ESCORPIONISMO SEVERO
4.1. Acción sobre canales iónicos sensibles al voltaje
Los escorpiones normalmente utilizan su veneno para paralizar a sus víctimas o para defenderse de predadores5. El veneno contiene aminoácidos libres, mucopolisacáridos, hialuronidasas, fosfolipasas, inhibidores enzimáticos y proteínas y péptidos neurotóxicos. Estos últimos son responsables de las manifestaciones asociadas a la alteración del funcionamiento del sistema nervioso periférico y sistema nervioso central que se presentan durante el envenenamiento al interactuar con los canales iónicos voltaje-dependientes de diversas células excitables5,16.
En general, los canales iónicos son proteínas transmembrana que en los mamíferos median importantes procesos como la excitación nerviosa y muscular, la secreción de hormonas y neurotransmisores, la transducción sensorial, el control del equilibrio hídrico y electrolítico, la regulación de la presión sanguínea y la proliferación celular17. Los canales iónicos sensibles al voltaje son proteínas que controlan la apertura y el cierre de los poros específicos que permiten el flujo de iones sodio, potasio, calcio y cloruro a través de las membranas celulares de los tejidos excitables (aunque también se hallan presentes en células del sistema inmunológico), dependiendo del potencial de membrana18.
Este flujo de iones mantiene la polaridad en las membranas celulares y permite, a través de los potenciales de acción, la transmisión del impulso nervioso a las terminaciones sinápticas19. Los canales iónicos son blanco de un diverso grupo de toxinas animales y de plantas que median sus efectos, estimulando o inhibiendo la función del canal17.
El veneno de los escorpiones presenta toxinas que se clasifican según su estructura, modo de acción y sitio de unión en los diferentes canales o subtipos de canales iónicos16. En base a su estructura primaria, las proteínas del veneno del escorpión son de dos clases: neurotoxinas de cadena corta, que contienen residuos de 30 a 50 aminoácidos (3000-5000 Da), y neurotoxinas de cadena larga, que contienen de 60 a 80 aminoácidos (6000-8000 Da)20. Las neurotoxinas de cadena larga son importantes desde el punto de vista médico. Se las ha clasificado en dos grupos: alfa y beta toxinas, de acuerdo al mecanismo de acción farmacológico sobre los canales de sodio voltaje-dependientes16.
El blanco farmacológico principal de las toxinas de escorpión son los canales de sodio (Nav) y potasio (Kv) sensibles al voltaje, situados a nivel de las membranas de células neuronales, musculares y en las células glandulares. Los canales Navs juegan un papel importante en la fase de despolarización del potencial de acción. Las toxinas del tipo alfa alteran el proceso de cierre de los Navs, retardando o bloqueando los mecanismos de inactivación de éstos, prolongando la duración de los potenciales de acción y la despolarización de las membranas plasmáticas en la región sináptica. Por el contrario, las toxinas del tipo beta impiden el funcionamiento normal del mecanismo de apertura de dichos canales, conocido como el proceso de activación5,20. Las toxinas de escorpión de cadena corta típicamente bloquean el filtro de selectividad de los canales Kv, impidiendo la repolarización de las membranas excitables al bloquear la salida de iones potasio. Debe notarse que las toxinas alfa y beta actúan sinérgicamente sobre los canales Navs, haciendo posible la entrada sostenida de iones sodio a la célula excitable al bloquear los procesos de inactivación y activación del canal, respectivamente. Por otro lado, las toxinas activas sobre canales Kv actúan sinérgicamente con las que actúan sobre Navs, al promover una despolarización sostenida de la membrana, produciéndose a nivel sináptico la liberación de neurotransmisores tales como acetilcolina, adrenalina, noradrenalina y sustancias peptidérgicas (por la entrada de iones calcio al terminal), que originarán los efectos tanto locales como sistémicos20 (Figura 4).
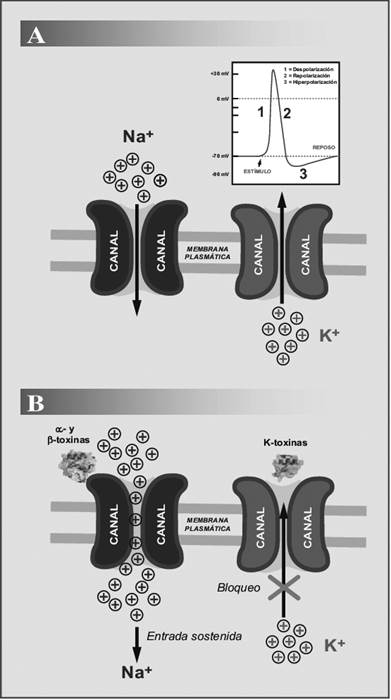
Figura 4 Esquema que muestra la acción de las toxinas de escorpión sobre los canales iónicos sensibles al voltaje. (A) Funcionamiento de los canales iónicos en condición de reposo (inserto: potencial de acción, indicando las fases de despolarización, repolarización e hiperpolarización). (B) Acción de las toxinas de veneno de escorpión (α- y β-toxinas, K-toxinas) sobre los canales de sodio (Nav) y de potasio (Kv) sensibles al voltaje en tejidos excitables21.
4.2. Manifestaciones clínicas a nivel del Sistema Nervioso
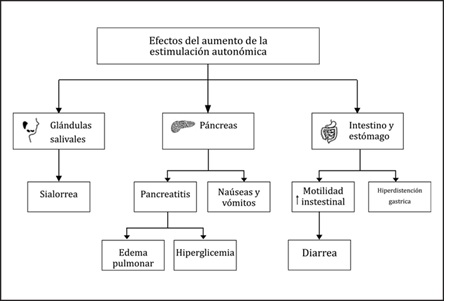
Las alteraciones producidas a nivel de los canales Nav y Kv provocan un desequilibrio en el contenido de iones sodio y potasio en los espacios tanto intra- como extracelular, con la consiguiente liberación exacerbada de neurotransmisores. La descarga masiva de catecolaminas y acetilcolina ha sido denominada "tormenta autonómica''22. Tal desequilibrio iónico además causa desbalances electrolíticos tales como hiponatremia, hipercalemia, hipocalcemia e hipocalcemia, que generan arritmias y otras manifestaciones en la conducción eléctrica a nivel cardiaco, así como la presencia de crisis convulsivas22.
En experimentos realizados en ratones en donde se emplearon toxinas escorpiónicas marcadas radiactivamente, se ha comprobado que la barrera hematoencefálica es parcialmente permeable a dichas toxinas durante el envenenamiento en el caso de ratones jóvenes23. Esto sugiere que el sistema nervioso central (SNC) no está afectado directamente por las toxinas del veneno en el caso de ratones adultos. En consecuencia, puede inferirse que las manifestaciones que se presentan en humanos adultos, después de las picaduras accidentales, corresponden a la estimulación periférica en lugar de la estimulación a nivel central. En el caso de pacientes pediátricos, está aún por demostrarse si las toxinas escorpiónicas pueden tener acceso al territorio central a través de dicha barrera23. La barrera hematoencefálica es una estructura compleja que está constituida por células del endotelio de la red capilar del SNC24. Su función principal es la de regular el intercambio de solutos entre el plasma sanguíneo y el tejido nervioso. Así pues, excepto el agua, gases solubles y pequeñas moléculas liposolubles (400-600 Da), el resto de moléculas orgánicas no puede atravesar libremente el endotelio, sino a través de sistemas de transporte específicos25. La sensibilidad de los niños pequeños al veneno puede atribuirse a la distribución del veneno en una menor masa corporal23, por lo que la cantidad de veneno inyectado puede resultar letal en estos casos.
Los efectos de las toxinas sobre los canales iónicos se producen al poco tiempo de la picadura, dado que el veneno se distribuye por el organismo muy rápidamente. La elevada cinética de difusión de las toxinas es función de su baja masa molecular y su solubilidad en fluidos biológicos. En el caso de venenos de especies del género Centruroides inyectado por la vía endovenosa, éste se absorbe totalmente en 4-7 minutos y su vida media de eliminación se encuentra entre 4 y 13 h. Por esta razón, es de vital importancia la aplicación de los antivenenos específicos tan prontamente como sea posible, en los casos de envenenamiento, particularmente pediátricos5.
Todos los síntomas del envenenamiento severo producidos luego de la picadura del escorpión son originados por la estimulación del sistema nervioso autónomo (simpático y parasimpático), como consecuencia de la tormenta autonómica generada (descarga masiva de catecolaminas y acetilcolina)5.
Las manifestaciones locales del escorpionismo comprenden dolor en el sitio de la picadura, dolor irradiado a todo el miembro afectado y sensación de entumecimiento en dicho miembro. Generalmente no hay signos locales de inflamación4,6.
Entre las manifestaciones sistémicas asociadas al sistema nervioso simpático se encuentran: hipertermia, taquipnea, taquicardia, hipertensión, arritmia, edema, hiperglucemia, diaforesis, piloerección, hiperexcitabilidad y convulsiones. Entre las manifestaciones asociadas al sistema nervioso parasimpático se encuentran: broncoconstricción, bradicardia, hipotensión, salivación, lagrimeo, micción, diarrea, disfagia y vómito16.
4.3. Manifestaciones a nivel del sistema Digestivo y Gastrointestinal
A nivel del tracto gastrointestinal, se presentan síntomas como náuseas y vómitos, que son característicos del escorpionismo severo (pudiendo ser considerada su frecuencia e intensidad como signo premonitorio de la gravedad del envenenamiento), como también un incremento en la motilidad intestinal, con la diarrea constituyendo una manifestación común en estos cuadros, generalmente asociada al mal pronóstico26.
La hiperdistensión gástrica es frecuentemente observada en ciertos estudios como la radiografía de tórax. De tal manera que resulta razonable la posibilidad de la aparición de un incremento en el volumen y contenido de pepsina del jugo gástrico, sumado a una significativa disminución del pH6. Estos efectos se explican por la acción de las toxinas sobre las fibras nerviosas colinérgicas (vagales), las cuales pueden activar tejidos inervados a través de los receptores muscarínicos M3 y M5.
Otra manifestación frecuente a nivel del sistema digestivo se presenta en las glándulas salivales, las cuales se encuentran inervadas por ambas porciones del sistema nervioso autonómico. En el caso del envenenamiento por escorpión, hay presentación de sialorrea, que consiste en una excesiva producción de saliva debido a la estimulación parasimpática de los acinos que conforman las glándulas salivales tanto mayores como menores27. Este hecho conlleva a un aumento en la producción de saliva, que se caracteriza por ser más acuosa y contar con una menor concentración de proteínas, en contraposición a la saliva viscosa y más proteica producida por la estimulación simpática de los acinos salivales28.
Una de las complicaciones de mayor importancia presentada a nivel del sistema digestivo a raíz del escorpionismo severo es la pancreatitis, producto de la acción directa del veneno sobre el páncreas exocrino y, secundariamente, a través de la activación del sistema nervioso parasimpático, el cual cuenta con un papel de suma importancia en la regulación de las funciones exocrinas y endocrinas pancreáticas29. La pancreatitis puede derivar en múltiples complicaciones a nivel sistémico, involucrando especialmente el sistema inmunológico. Además, deriva en la liberación de la fosfolipasa A2 pancreática, la cual puede degradar el surfactante de los alvéolos pulmonares30.
4.3.1. Afectación del Páncreas exocrino
A nivel exocrino, se produce la exacerbación funcional de las células acinares por hiperestimulación vagal, con liberación masiva de acetilcolina (Ach), lo que promueve la activación Ca+2-dependiente de los gránulos de zimógeno intracelulares a consecuencia de la activación de receptores muscarínicos M1 y M3. Este hecho deriva en dos cambios importantes respecto a la secreción de las células acinares pancreáticas. En primer lugar, se produce un bloqueo de la secreción en el dominio apical de las células acinares (lugar donde ocurre en situaciones normales la descarga de las vesículas conteniendo las enzimas pancreáticas), lo cual se ha planteado es debido a la alteración en la red de filamentos de actina que facilitan las funciones de secreción, o en su defecto podría deberse a una alteración de los procesos de secreción relacionada con proteínas denominadas SNARE (receptores de SNAP) localizadas en la membrana celular de las células acinares, las cuales pueden ser degradadas por la acción directa de metaloproteasas específicas presentes en el veneno de escorpión31. No obstante, las enzimas pancreáticas se siguen produciendo y se pueden activar intracelularmente (en el interior del acino), hecho que puede provocar daño celular irreversible32 (Figura 5).
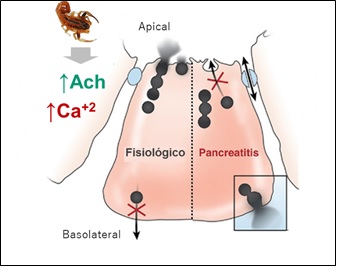
Figura 5 Mecanismo propuesto para explicar la pancreatitis producida por el envenenamiento escorpiónico. Se aprecia el aumento de la descarga de Acetilcolina (Ach) y la activación Ca+2-dependiente del proceso secretorio acinar, lo que deriva en el bloqueo de la descarga apical y la redirección de la exocitosis al dominio basolateral de la célula acinar (modificado a partir de33.
En segundo lugar, se produce una redirección de la exocitosis hacia el dominio de la membrana basolateral del acino, hecho que termina derivando en la secreción por parte de las células acinares hacia el espacio intersticial, donde ocurre también (al igual que dentro del dominio apical de las células acinares) la conversión de tripsinógeno en tripsina, la cual ocasiona la activación en cascada de las demás proenzimas pancreáticas, aumentando así la producción de amilasa pancreática (amilasemia), entre otras enzimas33. La amilasa pancreática es una α-1,4-glucosidasa que participa en la digestión de los polisacáridos, hidrolizando enlaces α-1-45.
4.3.2. Alteración del Páncreas endocrino
A nivel endocrino, se puede presentar hiperglucemia debido a diversos efectos, por la acción directa e indirecta de la descarga de catecolaminas producida a raíz de la activación del sistema simpático y su liberación a partir de las glándulas suprarrenales. El efecto cuantitativamente más importante se cree que ocurre a través de la inhibición de la secreción de insulina mediada por receptores α2-adrenérgicos presentes en las células β del páncreas. Este efecto sería el indirecto, ya que la insulina es una hormona cuya función es promover la incorporación de glucosa hacia las células. A su vez, esta hiperglucemia también podría ocurrir debido a la estimulación de la producción de amilasa a partir del páncreas exocrino, motivo por el cual se debe hacer un seguimiento de esta actividad enzimática, ya que deriva a su vez en una mayor obtención de glucosa que no puede ser utilizada por completo debido al déficit de insulina34. Se suma a estos fenómenos, el efecto directo de las catecolaminas liberadas, el cual implica la estimulación-adrenérgica que se produce en el hepatocito vía monofosfato de adenosina cíclico (AMPc), lo cual lleva a una activación de la proteína quinasa A, que fosforila a la enzima fosforilasa quinasa, la cual activa la enzima glucógeno fosforilasa, promoviendo así la degradación del glucógeno y contribuyendo de esta manera con la hiperglucemia35 (Figura 6).
Consultas a causa de efectos tóxicos del veneno de escorpión (t63.2), por grupos de edad, según regiones sanitarias de consulta
4.4. Manifestaciones a nivel del sistema inmunológico
El sistema inmunológico contiene las células y mediadores responsables de la defensa natural del organismo contra las infecciones y el daño tisular. La respuesta inmunitaria es mediada por diversas células y sustancias activas, entre ellos, los leucocitos y citoquinas pro- y anti-inflamatorias36. Estas células, al ser activadas por agentes patógenos, adquieren actividad fagocítica o liberan citoquinas o anticuerpos. Las citoquinas son moléculas de vital importancia para los procesos inflamatorios e inmunitarios37. Los efectos de estas moléculas pueden ser pro-inflamatorios, como en el caso de las IL-1, IL-6 (interleucinas 1 y 6), TNF-α, TNF-β (factor de necrosis tumoral alfa y beta), y IFN-γ (interferón gamma), o inmunosupresor como en el caso de IL-4, IL-10, IL-13 (interleucinas 4, 10 y 13)18.
4.4.1. Mecanismos de activación de células inmunes
4.4.1.1. Macrófagos
La incubación del veneno escorpiónico con macrófagos deriva en un aumento de la producción de IL-6 y TNF-α38 a consecuencia de la activación de dichas células y la subsecuente liberación de citoquinas proinflamatorias, evento que puede ser causado mediante dos mecanismos:
Estimulación de los macrófagos mediante la detección de patrones moleculares asociados al veneno (VAMPs) presentes en las toxinas escorpiónicas por parte de los receptores de tipo Toll (TLR) presentes en la membrana celular del macrófago39.
La activación de los macrófagos causada por los VAMPs implica un aumento en la fagocitosis de estas células. Es posible que el macrófago fagocite toxinas escorpionicas, las cuales alteran el funcionamiento de los canales de sodio presentes en el endosoma temprano, aumentando los niveles de sodio citosólico40. Este desequilibrio iónico en la célula es compensado por transportadores de sodio y calcio, lo que origina una sobrecarga de calcio intracelular. Este desequilibrio iónico pone en marcha procesos que terminan en la liberación de citoquinas proinflamatorias por parte del macrófago41.
4.4.1.2. Neutrófilos
Se ha descrito leucocitosis a expensas de los neutrófilos en múltiples casos de envenenamiento escorpiónico42. Al igual que en el caso de los macrófagos, existen varios posibles mecanismos que llevan a la activación de estas células:
Liberación de neuropéptidos (como la sustancia P), debido a los efectos del veneno en el sistema nervioso, que serían captados por células con receptores NK (como los macrófagos), los cuales liberarían el factor de activación plaquetario (PAF), que se uniría a receptores en la membrana de los neutrófilos, activándolos43.
El estrés oxidativo acompaña a múltiples manifestaciones del escorpionismo severo44. Tal estado de estrés oxidativo llevaría a peroxidación de los fosfolípidos de las membranas celulares, causando daño tisular. Los TLR de los neutrófilos podrían detectar patrones moleculares asociados al daño (DAMPs) o, directamente, a VAMPs del veneno escorpionico, activando a los neutrófilos45.
Estimulación de la proteína quinasa C (PKC) de forma directa o indirecta, mediante péptidos formadores de poros (que han sido descritos en el veneno de escorpiones de los géneros Parabuthus y Opistophthalamus) que llevan a un ingreso excesivo de calcio al espacio intracelular. La activación de la PKC es esencial, debido a que las cascadas involucradas en la formación de especies reactivas de oxígeno afectadas son dependientes de esta enzima46.
4.4.1.4.3Linfocitos
Se conoce poco acerca de los efectos del veneno a nivel de los linfocitos. Se ha propuesto que el efecto de las toxinas en los canales de potasio linfocíticos lleva a una inhibición de la proliferación de estas células, así como una reducción de la liberación de IL-247.
4.4.1.4. Sistema de complemento
Se han atribuido múltiples efectos relacionados con la inflamación a las proteínas C3a y C5a del sistema del complemento, como: aumento de la permeabilidad vascular y aumento de la migración de células quimiotácticas al sitio de la inflamación. El C5a también está asociado con un aumento de proteínas inflamatorias macrofágicas, atracción quimiotáctica de neutrófilos inducida por citoquinas y atracción de monocitos mediante la proteína quimiotáctica de monocitos 1 (MCP-1), TNF-α, IL-1 e IL-6. La incubación de venenos escorpiónicos con suero humano normal induce una migración neutrofílica al sitio de incubación, lo que implica que el veneno contiene componentes con la capacidad de activar los factores C3 y C5. Este planteamiento es apoyado por el hecho de que el efecto se suprime al calentar el suero a 56°C (temperatura a la cual se inactiva la función del sistema de complemento)48.
4.4.1.6. Pancreatitis y el sistema inmunológico.
Las toxinas del veneno escorpiónico tienen efectos a nivel del sistema nervioso autónomo, que derivan en una mayor liberación de neurotransmisores como la acetilcolina. Esta producción excesiva de acetilcolina lleva a la hipersecreción de enzimas pancreáticas, como ha sido descrito anteriormente49.
Esta hipersecreción enzimática junto al efecto constrictor del veneno en el esfínter de Oddi, representa un posible origen etiológico para la pancreatitis producida por el envenenamiento escorpiónico (pancreatitis obstructiva)50,51. Los mecanismos que explican la fisiopatología de la pancreatitis obstructiva son diversos y controversiales, pero la mayoría de los planteamientos coincide en que los factores determinantes de este fenómeno son el bloqueo del conducto biliar sumado a una sobreestimulación pancreática. Esto lleva a un aumento de la presión en el conducto pancreático, causando un reflujo de tripsina y llevando así a la activación intrapancreática del tripsinogeno52.
Otra teoría que explica el origen de la pancreatitis aguda se basa en metaloproteasas presentes en el veneno del escorpión, las cuales podrían ser responsables de la alteración de la secreción de las células de los acinos pancreáticos, haciendo que secreten enzimas en la porción basolateral de la célula en vez de la apical31. Existen otras teorías que podrían explicar esta pancreatitis. Entre ellas, un aumento en la presión duodenal desencadenada por efectos del veneno en el musculo liso intestinal. Esto puede llegar a causar una regurgitación de quimo rico en enterocinasa al interior del páncreas, activando sus enzimas53.
Posterior a la activación anómala de las enzimas pancreáticas, éstas causan destrucción y autodigestión del parénquima pancreático54. El daño tisular conlleva a la liberación de DAMPs, que se unen a los receptores de células inmunes, activándolas55. Esto causa una respuesta inflamatoria que incluye la liberación de mediadores inflamatorios como TNF-α, IL-1, IL-6, PAF, entre otros. En los casos más leves, la reacción puede mantenerse a un nivel local pero también pueden diseminarse a nivel sistémico en los casos más graves, fenómeno denominado síndrome de respuesta inflamatoria sistémica (SIRS)56.
Son de particular importancia los monocitos y neutrófilos, que posterior a su activación expresan moléculas de adhesión, liberan enzimas proteolíticas y radicales de oxígeno, sustancias capaces de causar daño tanto al parénquima de diversos órganos como a las células endoteliales. Esto lleva a desórdenes microvasculares en diversos órganos, teniendo gran importancia a nivel pulmonar, el edema no cardiogénico57.
Otro origen de mediadores inflamatorios en la pancreatitis aguda es el mismo parénquima pancreático. Estudios han demostrado producción y liberación de TNF-α y PAF en acinos pancreáticos durante la inducción de pancreatitis experimental en ratas. Ambos factores favorecen la pancreatitis en sus etapas iniciales. El TNF-α también cumple una función reguladora de la apoptosis de células acinares en la pancreatitis58.
El factor nuclear kappa B (NF-kB) cumple funciones esenciales, especialmente en la aparición de manifestaciones sistémicas de pancreatitis. Se ha encontrado un aumento del NF-kB en zonas de estrés oxidativo en etapas iniciales de pancreatitis59.
No se conoce el mecanismo exacto de activación del NF-kB, pero se propone que este fenómeno ocurre debido a señalizaciones patológicas de calcio, DAMPs, especies reactivas de oxígeno y citocinas liberadas por los acinos pancreáticos, particularmente TNF-α e IL-1B. Una vez activado, el NF-kB induce la producción y liberación de mediadores inflamatorios como TNF-α, IL-1, IL-2, IL-6, proteína macrofágica inflamatoria 1 (MIP-1), entre otros. La diseminación de estas sustancias lleva a un estado inflamatorio a nivel sistémico, contribuyendo al SIRS60.
4.5. Manifestaciones a nivel del sistema respiratorio y cardiovascular
Los diversos gradientes de concentración que se producen a través de la barrera alveolocapilar son de fundamental importancia para el intercambio de gases y se rige por la ley de Starling. Desequilibrios producidos en estas fuerzas pueden causar condiciones que son patológicas. Entre estas, el edema pulmonar, que se define como la presencia de líquido en el espacio intersticial y en los alveolos. Existen dos tipos de edema pulmonar: edema agudo de pulmón de causa cardiogénica, y edema de pulmón no cardiogénico, de importancia en el contexto del envenenamiento escorpiónico61.
4.5.1. Edema Pulmonar Cardiogénico
El edema pulmonar cardiogénico es producido por un aumento en la presión capilar pulmonar por encima de la presión oncótica62. Este aumento de presión posee un origen multifactorial que se encuentran en íntima relación con el efecto del veneno a nivel del sistema nervioso y cardiovascular. El aumento de catecolaminas liberadas por el efecto de las toxinas escorpiónicas posee un importante efecto sobre el funcionamiento cardiaco. Estas causan vasoconstricción sistémica, lo que eleva la resistencia vascular periférica y por lo tanto aumenta la poscarga ventricular izquierda. Debido a esto, se presenta una dificultad en el vaciamiento del ventrículo izquierdo, aumentando la presión a nivel de la aurícula izquierda y por consiguiente la presión en los capilares pulmonares, llevando a la salida de plasma hacia el espacio alveolar. De esta manera, la insuficiencia ventricular izquierda tiene la capacidad de originar un edema pulmonar63.
A esto se le suma el daño miocárdico que se presenta en las células cardiacas como consecuencia del envenenamiento. Existen tres teorías que explican la patogenia de este daño: La primera teoría se fundamenta en los elevados niveles de catecolaminas que se producen por el envenenamiento escorpiónico. Este origen guarda una gran similitud con la cardiomiopatía Takotsubo63,64. No se conoce exactamente el mecanismo por el cual las catecolaminas causan el daño a los miocitos, pero se teoriza que estas sustancias pueden producir una sobrecarga de calcio al miocito, ya sea mediante AMPc, que activa a la proteína kinasa A (PKA), fosforilando así los canales lentos de calcio L, o mediante radicales libres de oxígeno que alterarían el funcionamiento de los transportadores de sodio y calcio65.
Respaldan esta teoría el hecho de que se hayan reportado casos de edema a nivel apical del miocardio, característica distintiva de la cardiomiopatía por estrés64. Los estudios histológicos también guardan similitud con los resultados de sobredosis experimental de catecolaminas66. La segunda teoría implica un efecto directo de la toxina sobre la permeabilidad de sodio, calcio y potasio de las células cardiacas. Este fenómeno ocurriría debido a que se ha descrito un receptor para la toxina en los canales de sodio presentes en el sarcolema de miocitos en pollos. El efecto de la toxina sobre el canal consiste en la disminución de velocidad de apertura y cerrado de la misma, aumentando el nivel de sodio en el miocito, lo que podría ser compensado por una mayor actividad de la bomba de intercambio sodio-calcio, llevando a una sobrecarga de calcio67. Actualmente resulta difícil poder separar el posible efecto directo del veneno de los mecanismos mediados por catecolamina68.
La tercera teoría se basa en el daño miocárdico producido por hipoxia. Esta hipoxia podría estar causada por vasoconstricción de los vasos coronarios como consecuencia de los elevados niveles de catecolaminas o debido al aumento del nivel de citoquinas proinflamatorias. De igual forma, no está claro si el vasoespasmo coronario está realmente implicado en esta afección 69). Esta hipoxia también puede ser explicada por los efectos de la sobrecarga de catecolaminas en los cardiomiocitos, ya que éstas poseen efectos inotrópicos que aumentan el consumo de oxígeno a nivel cardiaco y es posible que también causen un espasmo microvascular sobre el tejido cardiaco65.

Figura 7 Mecanismos que podrían causar daños al cardiomiocito a partir del envenenamiento escorpiónico. Fuente: Elaboración propia.
4.5.2. Edema Pulmonar No Cardiogénico.
El edema pulmonar no cardiogénico es causado por un daño directo a la barrera alveolocapilar, lo que aumenta su permeabilidad y permite la salida del líquido desde la sangre a los alvéolos. De esta manera se produce una acumulación de líquido en los pulmones30. Existen diversos estudios anatomopatológicos que demuestran congestión de los alvéolos capilares, agrandamiento de los espacios intersticiales, infiltración neutrofílica, además de células alveolares tipo 1 y 2 en estado degenerativo70.
La función pancreática está íntimamente relacionada con la aparición del edema pulmonar en casos de envenenamiento escorpiónico. Esto es debido a que la toxina también está asociada a la aparición de pancreatitis. Este fenómeno implica una alta liberación tanto de enzimas digestivas, así como de citoquinas y sustancias proinflamatorias, que conllevan a un aumento en la permeabilidad de la barrera alveolocapilar mediante la liberación de proteasas, elastasas y radicales libres de oxígeno por parte de los neutrófilos. Se suma a todo esto el exceso de secreción fosfolipasa A2 que implica la pancreatitis, lo que lleva a la degradación de surfactante en los alveolos pulmonares, y así, a la atelectasia 71).
5. DIAGNÓSTICO DIFERENCIAL DEL ESCOPIONISMO
Generalmente la mayoría de los casos de envenenamiento escorpiónico no son letales. En algunos casos se presenta dolor local y solo sensación de ardor que puede ser semejante a los cuadros producidos por la picadura de un insecto himenóptero (abejas, avispas u hormigas). Sin embargo, una picadura de escorpión puede resultar en un envenenamiento sistémico que debe ser diferenciado de una reacción anafiláctica ocasionada por picadura de himenóptero3,4,72.
Para un buen diagnóstico, hay que basarse en el antecedente de la picadura (de manera excepcional puede faltar este dato en los casos de niños) asociado al cuadro clínico compatible6. Debe sospecharse una anafilaxia cuando aparece de manera aguda (en minutos o pocas horas) un síndrome rápidamente progresivo que afecta a la piel o las mucosas, o a ambas, y que se acompaña de compromiso respiratorio o circulatorio72.
Como la mayoría de las anafilaxias cursan con síntomas cutáneos (>80%), si el paciente presenta urticaria y angioedema el diagnóstico es claro, pero si los síntomas principales son dolor abdominal, vómitos o dificultad respiratoria, el diagnóstico puede ser complicado72. La prueba de laboratorio para apoyar el diagnóstico clínico de anafilaxia es la determinación de las concentraciones plasmáticas de histamina y de triptasa total72. En la actualidad, la medición de la triptasa sérica es la prueba más útil para el diagnóstico de anafilaxia72. En el caso del envenenamiento escorpiónico sistémico, las manifestaciones que se pueden presentar son: taquicardia o bradiarritmias, cetoacidosis diabética (hiperglucemia), edema agudo de pulmón, episodios de vómitos, salivación excesiva, diaforesis profusa, hipertensión arterial o hipotensión, agitación y convulsiones4,6,73.
No ha sido implementado aún un método que permita la detección de concentraciones séricas de veneno (generalmente en el orden de ng/mL) en tiempo real, lo cual constituiría una herramienta útil para el médico tratante. En los casos moderados o graves, algunos parámetros bioquímicos y hematológicos pueden ayudar al diagnóstico, pero son inespecíficos. La presencia de hiperglucemia es un hallazgo temprano útil cuando no hay antecedentes ni certeza sobre el episodio de envenenamiento, en vista de su relación con el nivel sérico de catecolaminas3,6. Puede ocurrir hipokalemia y leucocitosis neutrofílica, los cuales son hallazgos comunes en el escorpionismo sistémico y descenderán pocas horas después de la aplicación del antiveneno. También pueden hallarse acidosis metabólica con anión gap aumentado6. Se ha sugerido que tanto la aparición de hiperglucemia como de leucocitosis periférica son eventos asociados al mal pronóstico, así como la aparición de vómitos74,75.
El hiato aniónico (anión gap) tiene importantes implicaciones terapéuticas. Así, en las acidosis con anion gap aumentado, el objetivo es eliminar el ácido acumulado, la mayoría de las veces favoreciendo su metabolismo (por ejemplo, dando insulina en las cetoacidosis), lo que permitirá regenerar el bicarbonato que está tamponando el exceso de ácido76. En los casos graves, en el inicio del cuadro clínico, las enzimas creatina fosfoquinasa (CPK), lactato deshidrogenasa (LDH) y sus isoenzimas pueden estar normales o levemente aumentadas, presentando valores más elevados con la evolución del cuadro. Si hay daño miocárdico, puede estar aumentada la creatina-cinasa MB (CK-MB)6.
El único tratamiento específico para el envenenamiento escorpiónico es la aplicación del antiveneno. Estudios clínicos y experimentales demuestran que la rápida aplicación intravenosa de los antivenenos específicos, conduce a una completa y duradera neutralización de las toxinas, así como a su redistribución parcial desde los compartimentos periféricos al vascular5. Por este motivo establecer un rápido diagnóstico diferencial para identificar al envenenamiento sistémico juega un papel crucial para la pronta recuperación.
6. CONCLUSIÓN Y RECOMENDACIONES
Luego del análisis de los efectos de las toxinas escorpiónicas en los diversos sistemas fisiológicos, resulta evidente que el factor que inicia esta cascada de sucesos es la exacerbación funcional del sistema nervioso autónomo, ocasionado por la alteración del funcionamiento de los canales iónicos sensibles al voltaje. Esto conlleva a un aumento de los niveles de neurotransmisores circulantes.
La elevada concentración sérica de catecolaminas deriva en múltiples complicaciones a nivel de varios sistemas que interactúan entre sí. La complicación más resaltante y que mejor ejemplifica estas interacciones es el distrés respiratorio. Este acontecimiento posee un origen atribuido tanto a la insuficiencia cardiaca producida por las catecolaminas, así como a las sustancias liberadas a partir del tejido pancreático alterado, que activan las líneas de defensa del sistema inmunitario, debilitando la barrera alveolocapilar a consecuencia de las sustancias liberadas por los leucocitos.
A nivel del sistema digestivo se produce una afectación de diversos órganos, siendo el de mayor relevancia el páncreas. La inflamación pancreática deriva en hiperglucemia debido a la inhibición de la liberación de insulina y la sobreproducción de amilasa pancreática, todo esto sumado a la activación de la glucógeno fosforilasa por parte del hígado. La hiperglucemia es un componente vital del diagnóstico diferencial ya que distingue al envenenamiento escorpiónico de otras patologías producidas por exposición a artrópodos.
Es de suma importancia que el profesional del área de salud conozca las manifestaciones del envenenamiento escorpiónico para así poder discernir entre las manifestaciones producidas por escorpionismo y las que son producidas tras la picadura de un insecto himenóptero. Establecer un rápido diagnóstico juega un papel crucial para la recuperación ya que la pronta aplicación intravenosa del antiveneno, conduce a una completa y sostenida neutralización de las toxinas.
La importancia sanitaria del escorpionismo en el país aún no ha sido dilucidada, ya que existen pocos datos acerca de su incidencia y mortalidad. Esto se debe a que los accidentes escorpionicos no son de notificación obligatoria en el Paraguay, a diferencia de los accidentes ofídicos, declarados como tales a partir del año 2005 mediante una resolución ministerial en la se exigió que todo personal de salud notifique los casos de ofidismo que se presenten. Con dicha implementación, se ha logrado fortalecer la vigilancia epidemiológica de los accidentes ofídicos en Paraguay.
La importancia de la declaración del accidente por escopionismo como de notificación obligatoria radica en que, gracias a los datos epidemiológicos que se obtendrán, será posible iniciar un curso de acción orientado a la prevención de estos accidentes y su tratamiento con la producción de un antiveneno a nivel nacional que esté disponible en las regiones de importancia sanitaria del país.
En un estudio publicado en el año 2020 se obtuvieron evidencias que indican la existencia de diferencias significativas tanto en la composición del veneno como en su actividad biológica, de la especie T. trivittatus, abundante en la región oriental de Paraguay, con respecto a la especie endémica del norte de Argentina, Tityus carrilloi. Se indica, además, la existencia de potenciales diferencias en el reconocimiento por parte de los antivenenos terapéuticos disponibles en la región hacia el veneno de esta especie13. Lastimosamente en el Paraguay, la falta de un antiveneno específico contra las poblaciones de escorpiones que habitan el país obliga a recurrir a los antídotos disponibles en los países vecinos, como Argentina y Brasil, situación que también incluye a los antivenenos antiofídicos. Estos datos obtenidos sugieren la necesidad de que las autoridades sanitarias promuevan la producción de un antiveneno nacional, con la capacidad de neutralizar los efectos sistémicos producidos por las especies de escorpiones tóxicos que habitan el Paraguay.
La presencia futura o actual en el Paraguay de la especie Tityus serrulatus, la cual está presente en el estado de Paraná, Brasil, y que ha sido responsable de accidentes severos y fatales en ese país, también debe ser evaluada. Estos datos demuestran que Paraguay necesita realizar estudios orientados a estimar la influencia del cambio climático en el país sobre la dinámica de poblaciones de animales venenosos y trabajar en la georreferenciación de los casos de envenenamiento, como parte de un esfuerzo para evaluar y predecir la presente y futura magnitud de esta problemática.












 uBio
uBio