INTRODUCCIÓN
La mortalidad por traumatismo craneoencefálico grave (TCEG) en el paciente pediátrico, crece de forma directamente proporcional con la severidad de la injuria inicial. Se estima entre el 1 y 7 % de menores de 18 años afectados por dicha enfermedad en el mundo1. La incidencia de muerte por esta causa oscila entre 2,8 y 3,75 por cada 100 000 niños anualmente1.
El principal factor pronóstico de estos pacientes es la hipertensión intracraneana (HTIC), evento que se hace presente en el 65 % de los casos y que influye de forma directa sobre los resultados2. Después de un TCEG se desencadenan una serie de cambios moleculares y celulares que facilitan el desarrollo de edema cerebral, inflamación y deterioro de la autorregulación, lo que provoca incrementos de la presión intracraneal (PIC), y daño secundario. El incremento de la PIC de forma sostenida provoca disminución del flujo sanguíneo cerebral (FSC) y caída de la PPC3.
Las guías de manejo del TCEG en el paciente pediátrico patrocinada por La Fundación Americana para el Trauma Cerebral3, establecen el tratamiento de la HTIC cuando los valores de la PIC se encuentren por encima de 20 mmHg, así como el mantenimiento de la presión de perfusión cerebral (PPC) entre 40-50 mmHg4, con un nivel de evidencia clase III, sin distinción de valores de estos parámetros entre los diferentes grupos de edades.
El FSC normal en el niño oscila entre 40-108ml/100g/min y es regulado por la PPC, la autorregulación de la resistencia cerebro vascular y la tasa metabólica de oxígeno cerebral5. La PPC representa la diferencia entre la presión arterial media (PAM) y la PIC, sus rangos de valores normales se encuentran bien establecidos en el adulto no así en los pacientes pediátricos, por lo que la mayoría de los estudios sobre este tema en niños utilizan la información obtenida de estudios realizados en adultos, lo que no es beneficioso. Se conoce que los cerebros inmaduros toleran cifras bajas de PPC, sin embargo, existen estudios que plantean que las cifras menores de 40mmhg se asocian a resultados desfavorables y a una mortalidad elevada6,7.
Por lo anteriormente expuesto, mantener una PPC acorde a la PAM establecida para cada grupo de edad en estrecha relación con los valores de PIC considerados como normales en los diferentes grupos de edades, debe ser un objetivo de importancia en el manejo del TCEG en los niños. Para lograr tal estrategia es necesario establecer una PAM que se encuentre entre el quinto percentil y el percentil 90, al igual que la PIC, con valores por debajo de lo establecido como normal en los pacientes adultos, debido a las diferencias anatómicas y fisiológicas entre estos y los pacientes pediátricos. El objetivo de este trabajo es evaluar los valores de la PPC y su relación con los resultados en el paciente pediátrico con TCEG en el servicio de cuidados intensivos pediátricos en el Hospital Morón, Ciego de Ávila
METODOLOGÍA
Se realizó un estudio pre experimental de los pacientes menores de 18 años que ingresaron por un TCEG en el servicio de cuidados intensivos pediátricos (UCIP) del Hospital de Morón, Ciego de Ávila, Cuba, entre enero de 2003 y diciembre de 2017. El universo y la muestra estuvieron representados por 41 niños entre 1 mes y los 17 años, 11 meses y 29 días.
Criterios de inclusión: la escala de coma de Glasgow (ECG) entre 3 y 8 puntos, la realización de tomografía axial computarizada (TC) de cráneo simple al ingreso y el monitoreo continuo de la PIC por catéter intraventricular colocado en las primeras 24 horas de estadía hospitalaria. La información fue recogida en un cuaderno, que incluyó aspectos clínicos, analíticos, imagenológicos epidemiológicos, quirúrgicos y evolutivos de dichos pacientes, posteriormente los datos fueron vertidos en una base de datos confeccionada en el sistema estadístico SSPS versión 20.0 para Windows, utilizando la prueba de bondad de ajuste de chi cuadrado y el coeficiente de correlación Bivariada de Pearson.
Se definió TCEG a la lesión traumática craneal con ECG entre 3 y 8 puntos. Se subdividen los casos en 4 subgrupos: 8 puntos, entre 6-7 puntos, entre 4-5 puntos y 3 puntos. A todos los casos se les realizó TC de cráneo al ingreso, la cual se evaluó según clasificación de Marshall8 en lesión axonal difusa(LAD) I (normal), LAD II (cisternas presentes desviación línea media 0-5 mm), LAD III ( cisternas comprimidas y desviación línea medía 0-5mm), LAD IV ( desviación línea media >5 mm), lesión con efecto de masa evacuada (LEME) y lesión con efecto de masa no evacuada (LEMNE); y evolutivas (cada 72 horas en forma electiva) o de urgencia (degradación de la ECG o incrementos de PIC). Se calculan las luxaciones de la línea media y se dividen en: sin luxación, de 0-5 mm, 6-10 mm y mayor de 10 mm las mismas se correlacionan con las imágenes de TC.
Se realizó monitorización de la PIC, a través de un catéter intraventricular en el ventrículo lateral del lado más afectado por TC. Se consideran umbrales para el tratamiento de la HTIC en el lactante de 6mmHg, de 1 a 4 años de 10 mmHg y entre 5-17 años, 11 meses y 29 días, de 15 mmHg. Para los incrementos de la PIC por un período mayor a 15 minutos, se aplicaron las medidas de primer nivel establecidas en las guías de manejo escalonadas y aditivas7 para su control.
Presión arterial media se determina por la fórmula (2∙ presión diastólica + presión sistólica)/3. Los valores normales se encuentran entre el quinto percentil y el 90 percentil. La PPC se calcula utilizando la formula PPC=PAM-PIC. Tomando el 5to percentil como límite inferior de PAM se le restan los umbrales establecidos para cada grupo etáreo y en base a este cálculo se obtiene 47 mmHg en el lactante (1mes a 11meses y 29 días), 47 mmHg en el niño entre 1-4 años y 50 mmHg de 5-17 años, 11 meses y 29 días. Se dividen en menores de 47 mmHg y mayores de 47 mmHg en los menores de 4 años, y en menores de 50 mmHg y mayores de 50 mmHg en escolares y adolescentes. Se determina la PPC media en cada grupo afectado. Si la causa de la disminución de la PPC son incrementos de la PIC se aplica como mencionamos anteriormente el tratamiento escalonado y aditivo para su control7.
Se logra mantener una PPC adecuada en cada grupo de edad, la PAM optima en los niños se obtiene con aporte de fluidos del tipo de solución salina fisiológica (SSF) 20 ml/kg/dosis, en bolos hasta 3 dosis para mejorar la hemodinámica o solución salina hipertónica (CLNA·3 %) 6 ml/kg/dosis y apoyo con drogas vasoactivas del tipo de la norepinefrina de 0,05-1 μg/kg de peso/minuto.
Se evaluaron a los 6 meses del TCEG, a través de la escala de resultados de Glasgow, que los define en: grado I fallecido, grado II estado vegetativo persistente (EVP), grado III secuelas severas, grado IV secuelas moderadas, grado V secuelas ligeras o sin secuelas. A todos los pacientes y sus familiares incluidos en el estudio se les solicitó el llenado y la firma del modelo de consentimiento informado disponible en el servicio de cuidados intensivos pediátricos del hospital.
RESULTADOS
De los 41 casos atendidos en la UCIP por un TCE g, 35 (85,3 %) tenían entre 5 y 17 años, 4 (9,8 %) entre 1-4 años y 2 (4,9 %) menos de 1 año. La ECG al ingreso muestra un predominio del valor 8 puntos en 21 niños (51,2 %) p<0,001, seguido de 6-7 puntos en 8 (19,5 %), 4-5 puntos en 5 (12,2 %) y 3 puntos en 7 (17,1 %).
Como los valores establecidos de la PPC son iguales en los lactantes y los niños entre 1-4 años, del total de 6 casos, 2 presentaron una PPC menor de 47 mmHg (33,3 %) y 4 mayor de 47mmhg (66,7 %), con una media de 44,3 mmHg. De los 35 casos restantes entre 5-17 años, 23 (65,7 %) p<0,001, presentaban cifras de PPC por encima de 50 mmHg y 12 por debajo de 50 mmHg (34,3 %). Con una media para la PPC de 55mmhg en este grupo de edad (Gráfico 1).
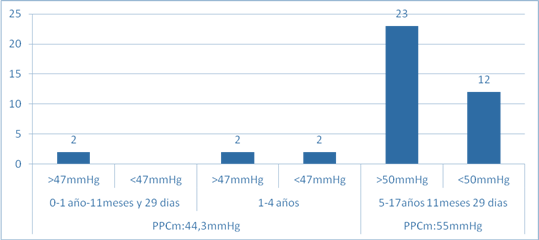
Gráfico 1: Distribución de pacientes pediátricos con traumatismo cráneo encefálico grave según valores de la presión de perfusión cerebral (N=41).
De los 2 casos en niños de hasta 4 años con cifras de PPC <47 mmHg, 1 fue provocado por HTIC con cifras de PIC de 30 mmHg (establecidas >10 mmHg por encontrarse entre 1-4 años) y otro por caída de la PAM provocada por lesiones asociadas con hematoma intraabdominal, por fisura-ruptura esplénica y shock hipovolémico refractario. En los pacientes mayores de 5 años, de los 12 que cursaron con cifras de PPC disminuida, 10 (83,33 %) tenían PIC elevadas, refractarias a tratamiento).
Respecto a la correlación entre los hallazgos tomográficos al ingreso y la PPC, obtuvimos que el patrón Marshall IV, fue más frecuente en los niños entre 5-17 años, 17 de 18 casos (94,44 %), de estos 10 (58,82 %) con cifras de PPC <50 mmHg (Tabla 1). La relación del patrón Marshall IV con el grado de efecto de masa intracraneal y luxación de las estructuras de línea media mostró que en los niños entre 5-17 años con cifras de PPC< 50 mmHg, predominaron las luxaciones de más de 10mm, 8 de 12 casos (66,67 %). De forma general las cifras normales de PPC para cada grupo de edad se relacionaron con patrones de Marshall inferiores al grado IV, mientras que aquellos casos con cifras de PPC inferiores a las normales se relacionaron con patrones de Marshall grado IV o superiores (Tabla 1 y Tabla 2).
Tabla 1: Distribución de pacientes pediátricos con traumatismo cráneo encefálico grave según valores de presión de perfusión cerebral y clasificación tomográfica de marshall (N=41).
| PPC | TAC | Total | ||||||
| Marshall I | Marshall II | Marshall III | Marshall IV | LEMNE | LEME | |||
| <47 mmHg | 0 | 1 | 0 | 1 | 0 | 0 | 2 | |
| >47 mmHg | 0 | 1 | 2 | 0 | 0 | 1 | 4 | |
| <50 mmHg | 0 | 0 | 1 | 10 | 1 | 0 | 12 | |
| >50 mmHg | 2 | 1 | 9 | 7 | 0 | 4 | 23 | |
| Total | 2 | 3 | 12 | 18 | 1 | 5 | 41 | |
Tabla 2: distribución de pacientes pediátricos con traumatismo cráneo encefálico grave según valores de presión de perfusión cerebral y clasificación tomográfica de marshall (n=41).
| PPC | Luxación de la línea media | Total | ||||
| Sin luxation | 0-5 mm | 6-10 mm | >10 mm | |||
| <47 mmHg | 0 | 1 | 0 | 1 | 2 | |
| >47 mmHg | 0 | 3 | 1 | 0 | 4 | |
| <50 mmHg | 0 | 1 | 3 | 8 | 12 | |
| >50 mmHg | 2 | 10 | 8 | 3 | 23 | |
| Total | 2 | 15 | 12 | 12 | 41 | |
El empleo de la craniectomía descompresiva (CD) precoz (de 0-3 h), como tratamiento de primera línea para la HTIC se practicó a 28 pacientes (68,3 %) p<0,019. De ellos 24 (68,57), en el grupo de 5-17 años, de estos en 14 casos (58,3 %) se logró obtener una PPC>50 mmHg y 10 casos (41,7 %) mostraron cifras de PPC<50 mmHg. Cuatro pacientes (66,7 %) menores de 5 años fueron sometidos a CD, tres de ellos (75 %) mantuvieron cifras elevadas de PPC para su edad (>47 mmHg) y uno (25 %) con PPC<47 mmHg.
A 13 pacientes menores de 18 años se les realizó la CD después de las primeras 3 h de evolución del trauma. Todos los casos se trataron según las Guías de manejo del TCEG en Pediatría. Al mostrar la asociación entre los valores de la PPC con los resultados podemos observar que los que presentaban cifras de PPC por debajo de los valores establecidos por los autores de este trabajo presentaban peores resultados. En el grupo entre 0-4 años dos casos tuvieron una PPC<47 mmHg, ambos fallecieron (100 %) y 4 con PPC normal, presentaron secuelas ligeras o no tuvieron secuelas (100 %).
En el grupo entre 5-17 años de 12 casos con PPC<50 mmHg, 9 fallecieron (75 %), 2 quedaron en EVP (16,7 %) y 1 mostró secuelas moderadas (8,3 %). De los que presentaron PPC normal para este grupo de edad, 20 (87 %) p<0,000 quedaron con secuelas ligeras o sin secuelas, 2 tuvieron secuelas moderadas (8,7 %) y 1 falleció (4,3 %). El coeficiente de correlación bivariada de Pearson (0,491) es significativo al nivel 0,01. La mortalidad global para todos los casos fue de 29,3 %.
DISCUSIÓN
Los umbrales normales y patológicos de PPC en el paciente pediátrico con TCEG no se encuentran bien establecidos9,10, se dispone de pocos estudios sobre el tema y la asociación entre el mantenimiento de valores adecuados de PPC para diferentes grupos de edades pediátricas con los resultados satisfactorios carece del sustento científico necesario, en el paciente menor de 18 años(4, 11).
La ECG es considerada una herramienta necesaria e indispensable en la evaluación inicial prehospitalaria y continuada en el TCEG, pues permite determinar la severidad del trauma, definir la guía de manejo específica y el pronóstico del paciente en todas las edades. Informes internacionales relacionan los valores bajos de dicha escala con una mayor mortalidad, tanto en la evaluación inicial como en la evolutiva, existiendo una correlación inversa entre los valores disminuidos con una mayor morbimortalidad11-13. En esta serie predominaron los pacientes con ECG de 8 puntos sobre los demás.
La determinación de valores o rangos de valores específicos de PPC en la edad pediátrica y su relación con los resultados ha sido contradictorio. Allen y colaboradores7, utilizaron en el niño de 0-5 años valores de PPC por encima de 44 mmHg y en edades entre 6-17 años mayores de 50 mmHg, mientras que en los resultados observaron que la supervivencia disminuyó en niños entre 0-5 años con PPC por debajo de 40 mmHg, entre 6-17 años con PPC por debajo de 50 mmHg, en ambos casos cuando la exposición a estas cifras fue por períodos prolongados. De igual forma Kapapa y colaboradores12, han particularizado las cifras de PPC para diferentes grupos de edades, quedando distribuidos en el lactante de 1mes: >40 mmHg, de 2 meses a 1 año: >45 mmHg, de 1-7 años: >50 mmHg, y en el escolar-adolescente mayor de 7 años: entre 55-60 mmHg.
Miller y colaboradores13, han manejado diferentes valores de PPC en el rango entre 40mmhg hasta 60 mmHg, sin diferenciar grupos de edad y sin existir diferencias significativas en relación a los resultados, lo que hace pensar en la posibilidad de existencia de amplios rangos de permisibilidad de PPC en la edad pediátrica.
Chaiwat y colaboradores14, en su serie de 36 casos refieren que mantener una PPC menor de 40 mmHg en las primeras 72 horas del TCEG no se asocia a pobres resultados, diferente de lo propuesto en el presente trabajo y a lo informado por Chambers y colaboradores15, quienes mostraron mejores resultados con PPC mayores de 40 mmHg, al igual que Downard y colaboradores16, quienes encontraron que todos los pacientes con PPC menor de 40 mmHg fallecieron.
Los valores óptimos de la PPC no están establecidos en el paciente pediátrico con TCEG, como se ha referido anteriormente. Esto se ha intentado explicar por las variaciones de la presión sanguínea normal, a las diferencias en la PAM para diferentes grupos de edades y consecuentemente a los cambios que la PPC experimenta a lo largo de la infancia y su relación con las variaciones en la autorregulación cerebral ocurridas durante el desarrollo normal en la infancia7.
Extrapolar los resultados obtenidos en estudios con pacientes adultos sobre umbrales de tratamiento relacionados con la PIC y la PPC, desconociendo las modificaciones producidas en la cavidad craneal y su contenido durante el desarrollo de los niños resulta inconsistente fisiológicamente además de haberse demostrado a través de algunos manuscritos que relacionan cifras de PPC < 40 mmHg con pobres resultados(7, 11).
Las principales causas de caída en la PPC se deben a diminución de la PAM o elevación de la PIC, la primera razón es generalmente provocada por choque hipovolémico, responsable entre el 50-75 % de las defunciones, como se observa en las fisuras o roturas de vísceras macizas17 o en los traumas complejos. Objetivamente el TCE no es causa directa de estado de choque o falla circulatoria, pero la mayoría de los pacientes provienen de accidentes del tránsito que involucran grandes volúmenes de energía, con múltiples lesiones asociadas que pueden generar pérdidas hemáticas en diferentes niveles.
La segunda, está dada por los episodios de HTIC que se presentan con una considerable frecuencia en el paciente con TCEG y que desencadenan la muerte en el 50 % de los que la sufren18,19. Cruz y colaboradores20, han informado resultados desfavorables con PIC no controlada (> 40 mmHg) en su serie. Liu y colaboradores21 mostraron que el 36,1 % de sus casos presentaban HTIC refractaria, en esta serie solo el 29,1 % lo presentó.
La clasificación de Marshall permite determinar alteraciones estructurales y predecir el pronóstico, observándose peores resultados en el Marshall IV y VI22 lo que coincide con nuestros resultados en los que predominaron el grado IV (p<0,001). La presencia del “swelling” en la TC de cráneo se ha relacionado con elevación de la PIC en el 75 % de los casos23. La compresión u obliteración de las cisternas basales se correlaciona con incrementos en la PIC informado por autores como Kouvarellis y otros24,25, estos autores encontraron en su estudio que la presencia de cisternas basales en la TC en el paciente pediátrico no implica normalización de la PIC, sino que, los valores de la misma se encuentran por debajo de 20 mmHg25.
Young y colaboradores26, encontraron como hallazgo tomográfico en su trabajo, la asociación entre presencia de sangre subaracnoidea, cisternas basales pequeñas y la existencia de masa extraaxial con cifras de PIC elevadas. Los autores del presente manuscrito asocian las cifras de PIC elevadas con PPC disminuidas y a la vez con borramiento de las cisternas basales (Marshall IV).
Zhao y colaboradores27, presentaron desviación de la línea media > 5 mm en 77,1 % de casos y compresión de las cisternas en 74,3 % sin comprobar su relación con cifras elevadas de PIC a través de la neuromonitorización invasiva. Según Laccarino y colaboradores28, las desviaciones de la línea media y las compresiones de las cisternas basales constituyeron factores predictivos de los resultados, pero no lo relacionaron con los valores de PPC. En la mayoría de los estudios consultados no se correlacionan los hallazgos tomográficos con el comportamiento de la PPC22-27.
La CD es una técnica quirúrgica que permite el control de la PIC, mejora la compliance cerebral, el flujo sanguíneo cerebral, la PPC y la oxigenación tisular cerebral29. La misma, se encuentra indicada para el control de la HTIC refractaria a tratamiento29,30, y puede tener influencia de forma directa en los resultados, en dependencia del tiempo de exposición del paciente a la HTIC y la adecuada selección de los casos a aplicar.
El número de estudios sobre el empleo de la CD en el niño, al compararlo con los adultos es muy escaso27,29,30, y se relacionan con mayor frecuencia a su efecto sobre la PIC que con el comportamiento de los valores de PPC31-34, aunque la relación inversamente proporcional entre estas dos variables implica que la modificación de una influye sobre el comportamiento de la otra.
El uso de la CD en la serie, favoreció una disminución en la exposición del tejido cerebral a eventos prolongados de HTIC, isquemia cerebral, hipoxemia y caída de la PPC, fenómenos todos relacionados con resultados desfavorables. Pérez y colaboradores31, muestran disminución de los valores de PIC en el 92,9 % de los casos después de aplicada la CD31. Pechmann y colaboradores32, reportan una mortalidad del 8 % con disminución de la PIC en toda la serie, aunque tres casos presentaron picos de elevación de la PIC posterior a la misma. Igualmente, Desgranges y colaboradores33, informaron una disminución de la PIC y estabilización de la PAM, inmediatamente después de realizado el procedimiento.
En este estudio el mantenimiento de una PPC óptima o por encima de los valores considerados normales para diferentes grupos de pacientes en edades pediátricas, tomando como referencia la PIC y la PAM normales en las diferentes edades, permitió mantener un flujo sanguíneo cerebral acorde a cada grupo de edad y de esta forma reducir la incidencia de daños secundarios en los casos, lo que indudablemente tuvo influencia sobre los resultados















