Introducción
La lesión cerebral traumática (LCT), es la de mayor potencial para el desarrollo de secuelas devastadoras, de todos los tipos de trauma en los niños, con un estimado conservador de aproximadamente tres millones de afectados cada año en el mundo1. Los accidentes de tráfico son la causa más frecuente de LCT en todas las edades2 y se estima que será la séptima causa de muerte para todos los grupos etáreos en el 20303.
El Traumatismo craneoencefálico (TCE) grave representa entre todas las modalidades de TCE en los niños, alrededor del 3-7 %, de acuerdo con algunos informes epidemiológicos4,5. La incidencia de muerte es de 2,8-3,75 / 100 000 / año en los países desarrollados, cifras que pudieran incrementarse en los países subdesarrollados o en desarrollo6,7.
La hipertensión intracraneal (HTI) está presente en más del 65 % de los pacientes que sufren de un TCE grave y se relaciona con más de la mitad de las muertes por esta causa8. El tiempo de exposición del tejido cerebral a cifras de presión intracraneal (PIC) por encima de los valores considerados normales se relaciona directamente con los resultados9, por lo que el conocimiento del comportamiento de esta variable se antoja indispensable para su adecuado control.
Los avances en la monitorización multimodal (MMM) de diferentes parámetros de la fisiología intracraneal y el tratamiento neurointensivo derivado de estos, han facilitado el entendimiento y la identificación de los blancos terapéuticos óptimos después de ocurrido el evento traumático en el paciente adulto, sin embargo estos beneficios han sido pobremente aplicados en la población pediátrica, tal es así, que las estrategias para los tratamientos médicos y quirúrgicos óptimos aún son ampliamente debatidos en la comunidad científica mundial10,11.
La mayoría de la literatura internacional sobre el tema coincide en la existencia limitada de datos sobre el tratamiento de los niños con TCE grave12, además de la tendencia bastante generalizada de transferir los resultados obtenidos en adultos, que es abrumadoramente superior que en los niños lo cual no es correcto. Un niño no puede ser considerado un adulto pequeño, por lo que resulta necesario identificar las diferencias anatómicas y fisiológicas intracraneales entre un niño y un adulto que permitan su tratamiento diferenciado ajustado a las características de cada grupo de edad, lo cual puede garantizar un tratamiento optimo en cada caso.
El objetivo de esta revisión es aportar información necesaria sobre los en los elementos anatómicos y fisiológicos del niño que influyen en los valores normales, umbrales de tratamiento de la PIC y de la presión de perfusión cerebral (PPC). Para lo cual se revisan las bases de datos nacionales e internacionales sobre el tema.
Desarrollo
En el año 2003, aparece publicada la primera edición de las Guías de tratamiento del Traumatismo Craneoencefálico en infantes, niños y adolescentes, patrocinada por La Fundación Americana para el Trauma Cerebral13. Una actualización de estas guías se realizó en el año 201214, y posteriormente en marzo del 2019, en la misma incluyó cambios en el nivel de evidencias y recomendaciones en las áreas de la neuromonitorización avanzada, la neuroimagenología, la terapia hiperosmolar, la analgesia, la sedación y el bloqueo neuromuscular, el drenaje de líquido cefalorraquídeo, la profilaxis de las crisis convulsivas, el control de la temperatura y la nutrición15.
Sin embargo, las consideraciones expuestas sobre los valores de PIC para iniciar el tratamiento de la HIC y los valores adecuados de la PPC, se corresponden con los resultados obtenidos en estudios de adultos, sin considerar las diferencias significativas en la fisiología intracraneal entre niños de diferentes edades y entre los niños y los adultos, lo que resulta en extremo controversial.
Las últimas recomendaciones pediátricas de La Fundación Americana para el Trauma Cerebral (BTF), establecen que debe considerarse la monitorización de la PIC en lactantes y niños con TCE grave y se recomienda tratar las elevaciones por encima de 20 mmHg, porque valores por encima de este nivel están asociados a un aumento de la mortalidad15-17, sin embargo, al considerar este parámetro estrechamente relacionado con la edad y al conocer los valores normales de PIC para diferentes grupos de edad, resulta controversial considerar un mismo valor como umbral de tratamiento para todas las edades.
Consideraciones Anatómicas del cráneo y el cerebro en los niños.
Anatómicamente en el cuerpo de un niño la cabeza es grande y pesada, sostenida por un cuello en el que los músculos no se encuentran debidamente desarrollados y las estructuras ligamentarias son débiles, todo lo cual hace a esta estructura muy vulnerable a los traumatismos18,19.
En el recién nacido y el lactante, la cabeza es desproporcionadamente grande con respecto al cuerpo y de forma gradual alcanza un radio cabeza: cuerpo, bastante similar al del adulto en unos pocos años. El crecimiento es particularmente rápido en los primeros años de vida. En el momento del nacimiento, el tamaño del cerebro es el 25 % al del adulto, mientras que el del cuerpo es solo el 5 %, la mitad del crecimiento post natal del cerebro ocurre en los dos primeros años de vida, el radio entre el tamaño de la cabeza: largo del cuello, con respecto al largo del cuerpo (alrededor del 25 %), es dos veces mayor que el de los adultos y constituye un fenómeno continuo de desarrollo y crecimiento desde la etapa gestacional.
El desproporcionado peso de la cabeza limita sus movimientos cuando el niño sufre una caída o cuando es golpeada por un objeto en movimiento, haciéndola más vulnerable a los traumatismos20-22.
La bóveda craneal, presenta algunas diferencias con la del adulto que pueden influir sobre los cambios fisiológicos que se experimentan después de producido un TCE grave. Nos referimos específicamente al comportamiento de las fontanelas y las suturas, las que experimentan cambios en diferentes momentos.
La fontanela posterior se encuentra cerrada generalmente a los dos meses de edad y la anterior se cierra entre los 12 y 18 meses. La presencia de suturas y fontanelas abiertas pueden ejercer una función “tampón” para la HIC, sobre todo si se produce un incremento gradual de los volúmenes intracraneales, pero este mecanismo es limitado, pues en los niños después de un TCE, los volúmenes se incrementan generalmente de forma rápida y la compleance se agota con facilidad12.
En los recién nacidos y los lactantes la bóveda craneal es fina, lo que unido a las suturas y fontanelas abiertas pueden facilitar, además, cambios morfológicos ante presiones o fuerzas externas sobre el cráneo23,24, lo que puede repercutir sobre las estructuras intracraneales y con mayor significación sobre el cerebro.
Consideraciones fisiológicas en la edad pediátrica.
En términos de fisiología y fisiopatología los niños no se comportan de forma similar a los adultos. Resulta un error muy frecuente que los profesionales encargados del tratamiento de niños que sufren de un TCE los consideren como un adulto pequeño y que, en consecuencia, se extrapolen los resultados obtenidos en estudios de adultos a la edad pediátrica.
En el mejor de los casos esta práctica es desacertada y en el peor puede llegar a ser peligrosa. Sucede que la disponibilidad de estudios sobre el tema en niños es mucho menor, por lo que también lo es la evidencia en qué sustentar las recomendaciones.
En la edad pediátrica es controversial establecer valores absolutos para diferentes edades con respecto a la definición de los umbrales para iniciar el tratamiento de la HIC, debido a que las peculiaridades fisiológicas que existen en el desarrollo de la bóveda craneal en los niños lo impide, por tanto, este acápite no queda bien definido en la actualidad por su dependencia y estrecha relación con los grupos de edades.
De igual manera sucede con los valores de la presión arterial sistémica (PAS), que varían con la edad. Existe una estrecha relación entre la PAS, la presión arterial media (PAM) y la PPC, las variaciones de la primera tienen influencia directa sobre los valores de PPC, por lo que estos, también pueden variar en cada grupo de edad, lo que haría muy controversial considerar un umbral de tratamiento absoluto en este aspecto para todos25.
Existen diferencias considerables entre los niños y los adultos en el ámbito del metabolismo y los índices cambian constantemente durante el reposo y en la actividad física, hasta lograr una estabilidad en la adultez.
Algunos detalles fisiológicos guardan importancia para las especialidades quirúrgicas. Los niños tienen un menor volumen sanguíneo circulante y una menor tolerancia a las pérdidas hemáticas, muestran además un mayor riesgo ante largos períodos de anestesia general, reaccionan de forma diferente a los medicamentos y tienen una reducción en la perfusión tisular, todos estos elementos deben ser considerados en el momento de someter a un niño a un procedimiento neuroquirúrgico en cualesquiera de sus variantes.
Variables intracraneales relacionadas con el TCE.
Presión intracraneal en el niño.
La PIC se define como la presión que existe dentro de la bóveda craneal. Se ha establecido que el funcionamiento cerebral es adecuado con valores de PIC entre 10 y 15 mmHg en adultos, de 3 a 7 mmHg en niños y de 1,5 a 6 mmHg en recién nacidos26, sin embargo, el umbral para iniciar el tratamiento en pacientes pediátricos con TCE grave al que se asocia una HIC, no se encuentra debidamente establecido.
Aunque puede ser evaluada de diferentes formas, la PIC generalmente es estimada a través de la presión que ejerce el LCR sobre las paredes del sistema ventricular, por lo que pudiera ser considerada como la mayor presión ejercida sobre una aguja colocada dentro del sistema ventricular, para evitar la pérdida del fluido27.
La estática y la dinámica del LCR están fundamentados en cuatro parámetros: 1. La velocidad de producción, 2. La compleance definida por la relación exponencial entre la presión de LCR y el volumen, 3. La resistencia a la absorción y 4. La presión en el seno venoso intradural27.
Tras el cierre de las suturas y las fontanelas, el cráneo se convierte en una estructura inextensible y, por tanto, mantiene un volumen constante independientemente de su contenido. En condiciones normales, este contenido se puede dividir en tres compartimentos: parénquima cerebral (80 %), líquido cefalorraquídeo (LCR) (10 %) y sangre (10 %).
Cuando aumenta el volumen de alguno de estos componentes, aumenta también la presión que ejerce dicho compartimento sobre los otros dos y se convierte en un mecanismo “tampón” para la PIC, lo que se conoce como teoría o doctrina de Monroe-Kellie.
En condiciones normales, estas variaciones se compensan de forma aguda a través del desplazamiento del LCR hacia la cisterna terminal. De forma más tardía, existe una disminución del flujo cerebral. Solo en situaciones crónicas, el parénquima es capaz de deformarse, a expensas de perder parte del agua extracelular e incluso neuronas y glía.
Sin embargo, cuando estos mecanismos tampón fallan, el aumento de la PIC puede suponer una disminución en el aporte sanguíneo y secundariamente una reducción de la PPC, con lo que aumenta la probabilidad de lesiones isquémicas, pues la variable depende tanto de la PAM como de la PIC26.
En esta relación se distinguen tres situaciones: en una primera fase, el aumento del volumen intracraneal (VI) no repercute en la PIC pues el desplazamiento del LCR y del volumen sanguíneo cerebral lo compensa. En la segunda fase, el sistema de regulación se encuentra en el límite y no consigue amortiguar el aumento de presión secundario al aumento de volumen. Por último, en la tercera fase, el sistema de autorregulación ha desaparecido y pequeños cambios de volumen suponen elevaciones muy llamativas de la PIC (27). (Figura 1) y (Figura 2).
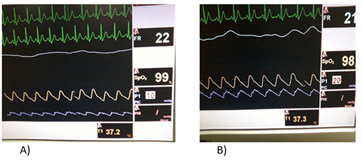
Análisis espectral del cambio de la morfología cuando la PIC asciende por encima de los 20 mmHg. A) PIC normal. B) PIC anormal.
Figura 2: Representación gráfica de la monitorización continua de la PIC en UCIP.
Consideramos valores normales de PIC en el recién nacido de 0-2mmhg, en el niño de 1mes a 11 meses y 29 días de 3-6 mmHg, con umbrales de tratamiento por encima de 6mmhg, en el niño mayor de un año de 3-15mmhg, dividiéndolo de 1-4 años por encima de 10 mmHg y de 5-17 años, 11 meses y 29 días por encima de 15 mmHg28.
Presión de perfusión cerebral
La PPC se define como el gradiente de presión a través del lecho vascular cerebral. La PPC resulta de restar la PIC a la presión arterial media (PAM)29. El proceso de autorregulación cerebral permite la variabilidad de la resistencia cerebrovascular con la consiguiente conservación del FSC ante cambios en la PPC, procesos que se encuentran alterados en el TCE g del niño, acarreando ante disminución de la PPC caída del FSC e isquemia.
Las opiniones sobre la PPC óptima y su relación con la autorregulación cerebral y el pronóstico han evolucionado a lo largo de los años. Según las últimas recomendaciones pediátricas de 2019 de la BTF, la PPC mínima en niños con TCE grave está entre 40-50 mmHg15. En adultos, el valor de PPC recomendada para la supervivencia y los resultados favorables es entre 60 y 70 mmHg30.
La edad pediátrica establece diferencias en relación a los pacientes mayores de 18 años, en cuanto a los valores de PAM, del FSC y por la tasa metabólica cerebral de oxigeno26. A pesar de lo cual no existen suficientes estudios que permitan conocer los valores adecuados en los diferentes grupos de edades pediátricas y su asociación con los resultados.
Los valores de PAM se obtienen por la fórmula 2 x presión diastólica + presión sistólica/3, oscilando entre el 5 y 90 percentil como rango de normalidad, de acuerdo a cada grupo de edad, por debajo del 5 percentil, se considera hipotensión arterial y por encima del 90 hipertensión arterial. Al presentar una PAM en el niño más baja que en el adulto y restarle las cifras de PIC que son menores igualmente que en el adulto (6,10 y 15 mmHg por edades), obtendremos como resultado valores de PPC menores que en el paciente mayor de 18 años.
En el lactante, según las curvas de percentiles para la TA oscila de 53,3-82,6 mmHg con una media de 67,9 mmHg. De 1-4 años de 56,6-83,3 mmHg con una media de 69,9 mmHg. De 5-17 años, 11 meses y 29 días de 65-106,6 mmHg media de 85,5 mmHg31. Utilizamos el valor inferior de la TA (5to percentil) y se le resta el umbral de tratamiento de la PIC en cada grupo etáreo (6, 10, 15 mmHg) obteniéndose las siguientes PPC: lactantes 53-6=47 mmHg, de 1-4 años 57-10=47 mmHg, 65-15=50 mmHg28.
Presión de perfusión cerebral optima (PPC Opt.) y el índice de reactividad cerebrovascular (PRX).
El PRx se calcula mediante el coeficiente de correlación de Pearson entre la PIC y la PAM. El PRx puede considerarse un estimador de autorregulación cerebral. Un PRx negativo indica una autorregulación intacta, mientras que un PRx positivo indica autorregulación deteriorada. Mediante la aplicación de un método automatizado de ajuste de curvas se puede determinar la PPC al valor mínimo de PRx y calcular el PPC opt.
En el TCE pediátrico, los pacientes con un menor PRx tienen una mayor probabilidad de supervivencia. Si bien no se han diseñado grandes estudios para determinar la PPC opt. en niños, se ha propuesto una PPC crítica para poblaciones estratificadas de edad en niños. Específicamente, en los grupos de edad 2-6, 7-10 y 11-16 años de edad, los buenos resultados se asociaron con valores de PPC de 43, 54 y 58 mmHg, respectivamente17.
Utilizando los valores de deferentes PPC se ha observado que cuando los valores se desvían del óptimo hay una relación entre los resultados y la diferencia de presión. En particular, los que pasan más tiempo con PPC menor que PPC opt. muestra un peor resultado9.
También se ha objetivado una relación significativa entre el pronóstico y la desviación de la PPC opt. Estos hallazgos destacan la importancia de guiar el tratamiento del TCE usando índices de autorregulación9. En la práctica clínica se puede interpretar que debe evitarse las diferencias entre el PPC real y PPC opt, mientras que el objetivo deben ser valores superiores que 10mmHg. Estas observaciones preliminares apoyan la necesidad de investigación sobre la viabilidad de la terapia orientada a la PPC opt.
Conclusión
El establecimiento de valores para el tratamiento de la PIC y el mantenimiento de la PPC en el paciente pediátrico es indispensable, permitiendo influir de forma directa sobre los resultados. Conocer las características anatómicas y fisiológicas de estas etapas de la vida es importante para el personal encargado de tratar a los niños, así como establecer las diferencias en relación al adulto.