INTRODUCCIÓN
La infección por el virus SARS-CoV-2 se inició en diciembre del 2019; a partir de un brote de neumonía de una nueva cepa de coronavirus en Wuhan, China, el virus fue aislado y llamado SARS-COV-2, la enfermedad fue llamada COVID-191-2. Dicha infección se extendió rápidamente a todo el mundo y la enfermedad fue declarada como pandemia en marzo del 20203.
La COVID-19 se ha asociado sobre todo con manifestaciones respiratorias, el síndrome respiratorio agudo severo (SARS). La mayoría de las personas infectadas son asintomáticas, pero una proporción de los pacientes con COVID-19, presenta una enfermedad grave con afectación de múltiples órganos1-2.
Los autoanticuerpos característicos de las enfermedades autoinmunes pueden detectarse en pacientes con COVID-19. Se considera que el SARS-CoV-2 pue- de alterar la auto-tolerancia y desencadenar respuestas autoinmunes a través de la reactividad cruzada con las células huésped4-5. Del mismo modo, se produce una cascada inflamatoria persistente similar al fenómeno autoinflamatorio de los sindromes autoinflamatorios6-7.
Desde los inicios de la pandemia, se han reportado diversas manifestaciones autoinmunes / autoinflamatorias en pacientes con COVID-19, como lesiones de vasculitis cutánea, vasculitis sistémicas asociadas a anticuerpos ANCA, manifestaciones autoinmunes hematológicas (púrpura trombocitopénica inmune, anemia hemolítica autoinmune, púrpura trombocitopénica trombótica), manifestaciones neurológicas (Síndrome de Guillain- Barré, mielitis trasversa, y otros), enfermedad de Kawasaki, Síndrome Inflamatorio multisistémico, entre otros4-7.
El objetivo del presente estudio es reportar las diferentes manifestaciones autoinmunes y autoinflamatorias asociadas a la infección por el virus SARS-COV 2, en una serie de casos de pacientes adultos, durante la pandemia de COVID-19 en Paraguay.
MATERIAL Y MÉTODO
Se realizó una serie de casos de pacientes adultos con COVID-19 agudo o antecedente del mismo, y manifestaciones autoinmunes y autoinflamatorias, internados en el Hospital Nacional de Paraguay, durante el periodo comprendido entre septiembre 2020 y agosto 2021. El diagnóstico de la infección por el virus SARS- COV-2, fue hecho con la prueba de reacción en cadena de la polimerasa por transcriptasa reversa (RT-PCR por su sigla en inglés) en muestras obtenidas por hisopado nasofaríngeo, y se asumió como antecedente de infección reciente a la positividad de la serología IgM para el virus SARS-COV-2 (inmunocromatografia).
Asuntos Éticos
Se respetaron todas las cuestiones éticas mencionadas en la Declaración de Helsinki que involucra a seres humanos. La identidad de los pacientes fue codificada para garantizar la confidencialidad de los datos.
RESULTADOS
Nuestros 10 pacientes (5 hombres, 5 mujeres; con un rango de edad de 19-73 años) presentaron diferentes patologías autoinmunes en el contexto de la infección aguda por Sars-Cov2 o posterior a la misma, en un pro- medio de 20 días después de iniciados los síntomas de COVID-19 (rango: 8-30 días). El 40% de los pacientes tenían patologías de base, entre las que podemos citar a la hipertensión arterial, obesidad, insuficiencia renal, diabetes, tabaquismo, y el uso de drogas ilícitas como cocaína. Es de destacar que ningún paciente tenía antecedentes de enfermedad reumática (Tabla 1).
Tabla 1 Características clínicas de pacientes con patologías autoinmunes y COVID-19. n=10
| Caso | Edad en años | Sexo | Procedencia | Patologías de base | Síntomas respiratorios/ GI | Diagnóstico | Tiempo entre inicio de síntomas del COVID-19 y el diagnóstico de la Patología Autoinmune | PCR para Sars-Cov 2 | IgM para Sars-Cov 2 | IgG para Sars-Cov 2 | Nexo positivo en el hoga en los últimos 2 meses |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 73 | Fem | Areguá | Hipertensión Diabetes tipo 2. ERC con dialisis peritonal. Obesidad Grado II | SI/NO | Vasculitis leucocitoclástica con microtrombos | 17 días | Positivo | NR | NR | Si |
| 2 | 23 | Masc | Ñemby | Ninguna | SI/NO | Granulomatosis con Poliangitis | 30 días | NR | Neg | Neg | Si |
| 3 | 59 | Fem | San Lorenzo | Hipertensión | SI/NO | Vasculitis leucocitodástica con microtrombos | 30 días | NR | Pos | Pos | Si |
| 4 | 19 | Masc | Pedro Juan Caballero | Uso de cocaína | SI/NO | LES | 8 días | Positivo | NR | NR | Si (presidiario |
| 5 | 27 | Fem | Itá | Ninguna | SI/NO | PPT | 14 días | Positivo | NR | NR | Si |
| 6 | 37 | Masc | Concepción | Ninguna | SI/NO | PTI | 14 días | Positivo | NR | NR | No |
| 7 | 28 | Fem | Limipio | Ninguna. Embarazo de 24 semanas | NO/SI | Sx de Guillain Barré | 30 días | Positivo | Pos | Pos | Si |
| 8 | 38 | Fem | Asunción | Obesidad mórbida. Fumadora | SI/NO | Sx de Guillain Barré | 22 días | Positivo | Pos | Pos | No |
| 9 | 56 | Masc | Itá | Ninguna | SI/NO | Sx de Guillain Barré | 22 días | Positivo | Pos | Pos | Si |
| 10 | 61 | Masc | Guarambaré | Ninguna | NO/NO | Sx de Guillain Barré | 15 días | Positivo | Neg | Neg | Si |
LES: Lupus Eritematoso Sistémico. PTT: Púrpura Trombocitopénica Trombótica. PTI: Púrpura Trombocitopénica Inmune. NR: No realizado. PRNS: Poli-radiculoneuropatía simétrica, GI: Gastrointestinal.
La complicación autoinmune más frecuente corresponde al Sx de Guillain-Barré (40%), seguida por vasculitis (Figura 1, A,B y C ). La PCR del SARS-CoV-2 en hisopado nasofaríngeo y orofaríngeo fue positiva en el 80% de los casos, con presencia de Anticuerpos para Sars-Cov-2 en 4 casos. Se encontraron datos de citopenias (anemia severa y plaquetopenia) en aquellos pacientes con Lupus eritematoso sistémico (LES), Púrpura Trombocitopénica Inmune (PTI) y Púrpura Trombocitopénica Trombótica (PTT) (Figura 2). En cuanto a la presencia de anticuerpos, solo fueron positivos: ANA en el paciente con LES y ANCA-c en el paciente con Granulomatosis con Poliangeitis.
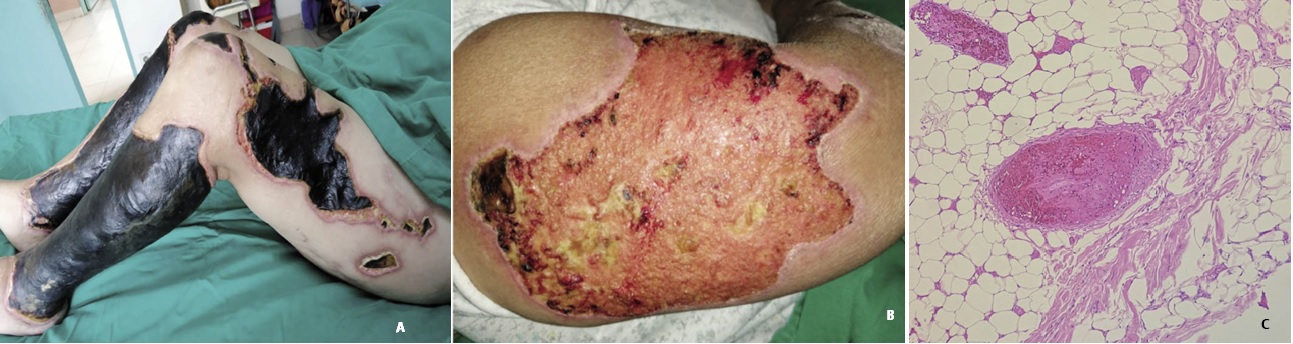
Figura 1: Paciente con vasculitis leucocitoclástica con microtrombos. Extensas lesiones necróticas y ulceradas en miembros inferiores (A) y superiores (B). C- Biopsia de lesión en piel (paciente con vasculitis): Vaso de la hipodermis, pared de la arteria con necrosis fibrinoide, extravasación de eritrocitos, leucocitoclastia, y luz ocupada por tromobosis.
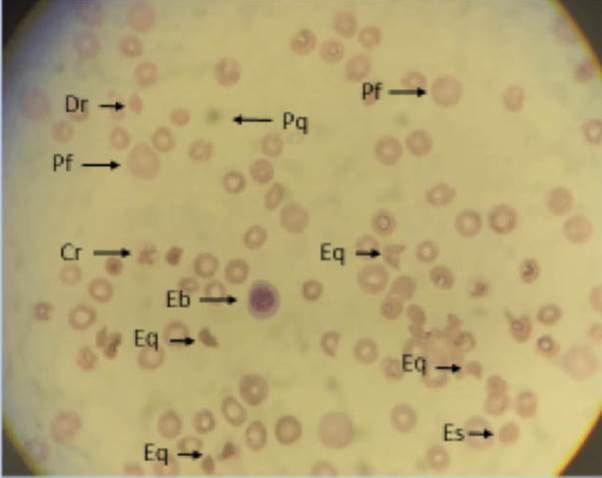
Figura 2: Frotis de sangre periférica en la paciente con PTT: Presencia de eritroblastos en sangre periférica, plaquetas disminuidas. Serie roja: esferocitos, esquistocitos +++, crenocitos, dacriocitos, policromatofilia. Dr: dacriocitos. Pf: policromatofilia. Cr: crenocitos. Eb: eritroblastos. Eq: esquistocitos. Es: esferocitos. Pq: plaquetas.
Todos los casos con sospecha de Sx de Guillain- Barré tuvieron electromiografía compatible con la misma (Tabla 2).
Tabla 2 Estudios auxiliares de diagnóstico en pacientes con patologías autoinmunes y COVID-19. n=10.
| Caso | Diagnóstico | Hb/Hto | Plaquetas | ANA | ANCA-c/ ANCA-p | Biopsia | Electromiografía |
|---|---|---|---|---|---|---|---|
| 1 | Vasculitis leucocitoclástica con microtrombos | 7,1/ 23% | 264.000 | Neg | Neg/Neg | Piel: Vasculitis leucocitoclástica con microtrombos | NR |
| 2 | Granulomatosiscon Poliangitis | 11,4/ 35% | 516.000 | Neg | Pos/Neg | NR | NR |
| 3 | Vasculitis leucocitoclásticacon microtrombos | 8,6/ 27% | 379.000 | Neg | Neg/Neg | Piel: Vasculitis leucocitoclástica con microtrombs | NR |
| 4 | LES | 4,0/ 15% | 97.000 | ANA + 1:160 moteado: C3 C4 Coombs + | Neg/Neg | NR | NR |
| 5 | PPT | 7,6/ 22% | 34.000 | Neg. Coombs neg | Neg/Neg | NR | NR |
| 6 | PTI | 12,5/ 34% | <10.000 | Neg | Neg/Neg | NR | NR |
| 7 | Sx de Guillain Barré | 10/ 30% | 639.000 | Neg | Neg/Neg | NR | PRNS |
| 8 | Sx de Guillain Barré | 12,5/ 37% | 294.000 | Neg | Neg/Neg | NR | PRNS |
| 9 | Sx de Guillain Barré | 16,6/ 47% | 335.000 | Neg | Neg/Neg | NR | PRNS |
| 10 | Sx de Guillain Barré | 11,8/ 34% | 190.000 | Neg | Neg/Neg | NR | PRNS |
LES: Lupus Eritematoso Sistémico. PTT: Púrpura Trombocitopénica Trombótica. PTI: Púrpura Trombocitopénica Inmune. NR: No realizado. PRNS: Poli-radiculoneuropatía simétrica.
En todos ellos observamos importantes alteraciones sistémicas, con resolución progresiva de las complicaciones, tras el tratamiento inmunosupresor con corticoides sistémicos, inmunoglobulina intravenosa (IGIV), o incluso ciclofosfamida y micofenolato mofetil según el caso. Dos pacientes fallecieron a pesar del tratamiento instaurado (Tabla 3).
Tabla 3 Tratamiento y desenlace de pacientes con patologías autoinmunes y Covid-19. n=10.
| Caso | Diagnóstico | Tratemiento | Desenlace |
|---|---|---|---|
| 1 | Vasculitis leucocitoclástica con microtrombos | ATB. Corticoides. HBPM. | Óbito |
| 2 | Granulomatosis con Poliangitis | Corticoides. CFM. MFM. HBPM. | Mejoría Clínica |
| 3 | Vasculitis leucocitoclástica con microtrombos | ATB. Corticoides. HBPM. | Mejoría Clínica |
| 4 | LES | Corticoides. IGIV. | Mejoría Clínica |
| 5 | PPT | Corticoides. Plasmaféresis. | Óbito |
| 6 | PTI | Corticoides. IGIV. | Mejoría Clínica |
| 7 | Sx de Guillain Barré | IGIV. HBPM. | Mejoría Clínica |
| 8 | Sx de Guillain Barré | Corticoides. IGIV. HBPM. | Mejoría Clínica |
| 9 | Sx de Guillain Barré | IGIV. HBPM. | Mejoría Clínica |
| 10 | Sx de Guillain Barré | IGIV. HBPM. | Mejoría Clínica |
ATB: antibióticos. HBPM: Heparina de bajo peso molecular. CFM: Ciclofosfamida. MFM: Micofenolato mofetil. LES: Lupus Eritematoso Sistémico. PTT: Púrpura Trombocitopénica Trombótica. PTI: Púrpura Trombocitopénica Inmune. IGIV: Inmunoglobulina Intravenosa.
DISCUSIÓN
Se describen diversas manifestaciones autoinmunes o autoinflamatorias en pacientes con COVID-19, al igual que en esta serie de casos.
Se han descrito lesiones cutáneas diversas y heterogéneas en pacientes con COVID-19, que pueden manifestarse antes, durante y después de la enfermedad8. En nuestra serie, dos pacientes presentaron una vasculitis cutánea, trombosante y leucocitoclástica. Se pudo demostrar la oclusión de los vasos sanguíneos pequeños por microtrombos, que se ha descrito en pacientes con COVID-198. Ambas pacientes respondieron bien al tratamiento con corticoides sistémicos, aunque la paciente 1 presentó posteriormente una sepsis intrahospitalaria con falla multiorgánica y muerte. La relación temporal entre la infección por el virus SARS- COV-2 y la aparición de las lesiones de vasculitis hacen probable la relación causal del virus SARS-COV-2 y la vasculitis, como fue reportado en la literatura por otros investigadores9-13.
Se cree que las lesiones son producidas por el efecto inflamatorio del virus que induce una endotelitis, alteraciones vasculares junto con la formación de microtrombos8,10-11. Se considera que los antígenos del SARS-CoV-2 pueden dar lugar a la producción de anti- cuerpos, formación de complejos inmunes circulantes que se depositan en el endotelio vascular de la piel, lo que da origen a una vasculitis leucocitoclástica11,13. La hipótesis para explicar estas lesiones consiste en que la activación del complemento y la cascada de la coagulación como resultado del depósito de complejos inmunes en los vasos sanguíneos da lugar a una endotelitis8,10-12. Otro mecanismo sugerido sería la liberación exagerada de interleucina 6 (IL-6)11.
Un paciente de nuestra serie sin antecedentes de vasculitis ANCA conocida, presentó una vasculitis pulmonar asociada a ANCA-c, un mes después de haber desarrollado un cuadro de COVID -19 leve que no requirió internación. El paciente fue tratado con bolos EV de metilprednisolona y ciclofosfamida EV con mejoría clínica. Uppal et al14, reportaron 2 pacientes con glomerulonefritis asociada a ANCA con fracaso renal agudo asociada al COVID-19. Ambos pacientes eran hombres no obesos, sin antecedentes de enfermedad renal o vasculitis ANCA conocida. Se consideró que los hallazgos pulmonares en los 2 pacientes estaban asociados con la enfermedad COVID-19. Moeinzadeh et al.15, también informaron sobre glomerulonefritis asociada a ANCA en un paciente con COVID-19. Powell et al.16, reportaron una vasculitis pulmonar asociada a ANCA con hemorragia alveolar en un niño con COVID-19 asintomático. En nuestro estudio, el paciente 2, después de un mes de haberse recuperado de COVID-19, presentó una vasculitis limitada al pulmón en forma de hemorragia alveolar, con respuesta favorable a inmunosupresores.
La anemia hemolítica autoinmune (AHAI) es un hallazgo raro, pero presente en algunos pacientes con COVID-19, durante la infección aguda o posterior a la misma17-21. En nuestra serie, un paciente presentó anemia hemolítica autoinmune en el contexto de debut de LES, al octavo día de padecimiento de COVID-19. El paciente fue tratado con corticoides con una buena respuesta, con regresión de la sintomatología. Encontramos descritos casos de debut de LES en relación COVID-19, algunos con anticuerpos antifosfolipídicos positivos22-24, sumándose al grupo de virus que pueden gatillar el inicio del LES.
La PTI fue reportada por Zulfiqar et al.25, en abril de 2020 en una paciente de 65 años con antecedentes de hipotiroidismo autoinmune con COVID-19, con buena respuesta con inmunoglobulina intravenosa, luego otros investigadores publicaron casos con PTI asociada al COVID-1925-28. Nosotros también reportamos un caso de PTI en esta serie. El paciente no recibió heparina, fue tratado con pulsos de metilprednisolona e IGIV, con posterior ascenso de las plaquetas. La serología para hepatitis B, C, HIV fueron negativas.
La PTT, patología poco frecuente, se ha descrito en la literatura asociada a otras infecciones virales como el dengue, hepatitis, herpes, entre otros29. Fue reportada en la literatura en mayo 2020 por Albiol N et al.30, en una mujer con antecedentes de cáncer de mama en remisión completa, que desarrolló PTT en el curso de la evolución del COVID-19, con buena respuesta al tratamiento con plasmaféresis y corticoides. Nuestra paciente con PTT, presentó una mala evolución con posterior óbito, probablemente secundario a sangrado en sistema el nervioso central. La PTT fue reportada en pacientes con COVID-19 por varios investigadores31-33.
Las manifestaciones neurológicas en pacientes con COVID-19 son variadas34-35. En nuestra pequeña serie, el 40% de los pacientes presentó SGB, el cual ha sido descrito en la literatura asociado al COVID-19 desde los inicios de la pandemia36-40. Todos los pacientes fueron tratados con IGIV; tres de los pacientes mostraron una buena recuperación de la fuerza muscular después del tratamiento y en una paciente la recuperación fue parcial. En todos los pacientes existió una relación temporal entre el COVID-19 y la aparición del SGB, con las características del SGB post-infeccioso clásico, donde también se plantean los mismos mecanismos patogénicos inmunomediados, dependientes de proteínas del Sars-Cov 2 y citocinas proinflamatorias del huésped37,40.
Nuestro trabajo presenta limitaciones como el pequeño número de casos, la falta de estudios inmunológicos más específicos como recuento de citocinas y células inflamatorias, la ausencia de estudio específico del Sars-Cov 2 en diferentes muestras como LCR y biopsias. No obstante, la fuerza de este reporte radica en la publicación de diferentes patologías autoinmunes y autoinflamatorias relacionadas a la infección aguda o posterior a la misma, del Sars-Cov 2, demostrando una vez más su potencial activación de la cascada inflamatoria persistente. Por tanto, debemos estar atentos a dichas complicaciones en pacientes con COVID-19.















