INTRODUCCIÓN
La Artritis Reumatoide (AR) es una afección autoinmune inflamatoria crónica frecuente, que se caracteriza por la inflamación persistente de las articulaciones sinoviales, que con el tiempo y sobre todo sin el tratamiento intensivo se producen las erosiones, con la destrucción del cartílago articular y la pérdida completa de la integridad articular. Así mismo puede afectar otros órganos y sistemas, con menor frecuencia.
Afecta alrededor del 0,8 por ciento de la población adulta a nivel mundial1. Su incidencia en los Estados Unidos se estima en 54 por 100,000 mujeres1. Las mujeres en edad fértil pueden ser afectadas por esta enfermedad durante la gestación, las estimaciones de población sugieren que más de 2000 mujeres con (AR) quedan embarazadas en los EE.UU. por año2. Durante el periodo de gestación los pacientes con AR podrían eventualmente desarrollar complicaciones, se podría observar una mayor actividad de la enfermedad para algunas gestantes así como parto prematuros, bajo peso del niño al nacer e incluso abortos3.
Para identificar las causas de mayor riesgo que conlleven a complicaciones en aquellas mujeres con AR y valorar una orientación terapéutica más adecuada y más segura. Esta revisión se enfocará en temas relacionados con la fertilidad, el embarazo, prescripción de medicamentos seguros en todas las etapas de la gestación y la lactancia en mujeres con AR.
Planificación familiar en la Artritis Reumatoide
Algunas mujeres con AR pueden experimentar disminución de la fertilidad. Durante el embarazo se puede observar una disminución de la actividad de la enfermedad, entre el 48 % al 86 %3,4. Las mujeres embarazadas con AR pueden presentar con mayor frecuencia un parto prematuro, ya sea por la misma actividad de la enfermedad, o por mecanismo de acción de algunos fármacos utilizados en dichas pacientes2. Así mismo se puede observar un aumento en el riesgo de lactantes pequeños para la edad gestacional, así como un menor peso al nacer3. Por lo que es fundamental tanto para el reumatólogo como para las mujeres en planes de gestación planificar de manera responsable para así poder disminuir al mínimo los riesgos que implica el embarazo en este grupo de pacientes y enfocarse en la terapéutica menos nociva para el futuro niño a ser concebido, a fin de que los mismos no tengan inconvenientes al momento de nacer o complicaciones relacionadas a la lactancia4.
Fertilidad en mujeres con Artritis Reumatoide
En las pasadas décadas, se ha visto que las mujeres con AR tienen menor número de hijos y mayor tasa de nuliparidad comparadas con aquellas mujeres sin la enfermedad5,6. Esto podría deberse a ciertos factores clínicos como la discapacidad física producida por la AR, que podría limitar la actividad sexual en estas pacientes, la subfertilidad causada por la alta actividad de la enfermedad o la implementación de ciertos medicamentos durante el tratamiento además de tasas más altas de aborto espontáneos7-9.
La subfertilidad y la nuliparidad contribuyen al hecho de un menor número de niños nacidos entre un subconjunto de mujeres con AR. Alrededor de un cuarto de las mujeres que padecen AR inscritas en el Banco Nacional de Datos de Enfermedades Reumáticas (NDB, por sus siglas en inglés) de los E.E.U.U. reportaron infertilidad10. Entre las causas dicha infertilidad se encontró un 19% de disfunción ovulatoria, 10% endometriosis y hasta un 15% sin causa aparente10.
Un estudio de cohorte prospectivo ha reportado que el 42% de las mujeres con AR que procuraban concebir experimentaron un retraso en el tiempo de la concepción de al menos 12 meses8. En comparación con lo referido por el Centro para el Control de Enfermedades de EE.UU. y Prevención (CDC) que estima que el 12,1% de todas las mujeres entre los 15 a 44 años de edad tienen una fertilidad disminuida11. En la cohorte PARA, se encontró hasta un 28% de disfunción ovárica, mientras que hasta en un 48% no se encontró una causa que explique la disminución de la fertilidad8.
Así mismo los fármacos utilizados para el tratamiento de la AR podrían elevar el riesgo de subfertilidad entre dichas pacientes; en el ensayo PARA, el retraso en la concepción parecía estar asociado con el uso previo a la concepción de los AINEs o la prednisona a dosis superiores a 7,5 mg diarios, incluso después del ajuste para la actividad de la enfermedad8.
Por todo ellos es imperativo planificar la concepción en todas las mujeres en edad fértil portadoras de AR para disminuir las tasas de morbimortalidad prenatal y los índices de brotes en las mismas.
Embarazo en la AR: Actividad de la enfermedad durante el embarazo
Diversos estudios han referido una mejoría clínica, es decir una disminución de la actividad de la enfermedad de entre un 48 a 86% en las pacientes con AR durante el embarazo3,12,13. Así mismo De Man et al. Tienen una mayor probabilidad de presentar una mejoría en la actividad de la enfermedad, en comparación a aquellas con AR seropositiva14. En otro estudio realizado en el Reino Unido, se reportó, que aquellas mujeres que presentaban una mejoría de la actividad de la enfermedad en el tercer trimestre, sólo el 16% alcanzaba la remisión completa15. Es importante destacar que un grupo de mujeres con AR gestantes pueden experimentar un brote de su enfermedad, tanto durante el embarazo como en el postparto. Algunos brotes asociados al embarazo pueden ser vinculados a la interrupción del tratamiento médico durante el embarazo16. En la cohorte de PARA, aproximadamente el 40% de las mujeres presentaron brotes moderados o graves alrededor de las 12 y 26 semanas del postparto12.
Las madres gestantes portadoras de AR tienen un mayor riesgo de eclampsia, parto por cesárea y parto prematuro17. Un estudio sueco en mujeres embarazadas con artritis idiopática juvenil (AIJ) presentó un mayor riesgo de complicaciones maternas e infantiles en comparación con los controles de la población18.
Las causas inmunológicas de las fluctuaciones en la actividad de la enfermedad durante el embarazo y el período del postparto siguen siendo especulativas.
Según la supresión del sistema inmunitario materno, que se produce para inducir tolerancia contra el feto, se ha hipotetizado que una mayor diferencia genética entre el HLA materno y fetal clase II en la DRB1, DQA y los alelos DQB podrían inducir una supresión más fuerte del sistema inmunitario materno mejorando la actividad de la enfermedad en la AR, pero estos datos no han sido del todo reconfirmado en estudios subsecuentes19,20.
La tolerancia inmune durante el embarazo facilita la viabilidad del feto a pesar de la incompatibilidad del antígeno leucocitario humano (HLA) entre la madre y el feto. Un cambio de una respuesta inmune de la célula T helper tipo 1 (Th1) a un patrón de respuesta inmune de la célula T helper tipo 2 (Th2) puede mediar la disminución en la actividad de la enfermedad experimentada or algunas mujeres durante el embarazo21.
Otra posibilidad podría ser el papel de las células T reguladoras, o Tregs, que parecen mantener la autotolerancia inmunológica y también se ha encontrado que facilitan la tolerancia materna de un feto en desarrollo22.
Un estudio ha encontrado niveles elevados de Tregs en mujeres gestantes con AR los cuales se asociaron el inversamente con la actividad de la enfermedad en el tercer trimestre y en el postparto23.
El nivel reducido de estrógenos, que tiene lugar durante el embarazo, parece desempeñar un papel en la mejora de la enfermedad. Algunos estudios apoyan seguriun rol bien recibido en la evaluación de la actividad de la enfermedad, debido a su factibilidad, accesibilidad, rentabilidad y además permite la obtención de imágenes de múltiples articulaciones concomitantemente.
La característica ecográfica de una artritis inflamatoria es la sinovitis, que se detecta fácilmente en la ecografía como un engrosamiento sinovial que puede ser hipervascular (Power Doppler positivo) en su etapa aguda y subaguda, mientras que un pannus fibroso más crónico puede presentarse sin hipervascularidad.
Los derrames articulares también pueden representar una parte de la respuesta inflamatoria a nivel de la articulación y se visualiza bien en la ecografía. Si bien tanto el líquido y el engrosamiento sinovial son ambos hipoecoicos (el líquido sinovial también puede ser anecoico), el derrame se puede desplazar y comprimir, mientras que la hipertrofia sinovial no. El líquido sinovial es hipovascular (Power Doppler negativo), mientras que la hipertrofia sinovial, junto con la señal Doppler color, constituyen el sello de imagen para la sinovitis31; esta característica particular exhibida por algunas articulaciones durante la exploración ecografía le confiere a este método un rol fundamental al momento de tomar una conducta terapéutica en aquellas mujeres gestantes que padecen de AR27 sobre todo cabe destacar la importancia de la presencia del power doppler31. La tenosinovitis también puede representar cambios activos de la artritis inflamatoria que se manifiesta como engrosamiento de la vaina tenosinovial, con o sin derrame significativo, y con o sin aumento de la vascularización32.
Cuando no se puede usar la IRM con gadolinio intravenoso, la ecografía es tan efectiva en el diagnóstico y monitoreo de la actividad de la enfermedad en la artritis reumatoide27.
Seguridad de los medicamentos en la AR durante la preconcepción, Embarazo y la Lactancia
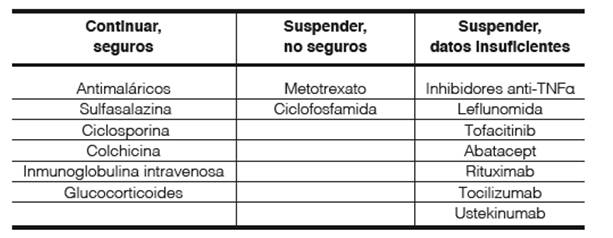
La seguridad de los medicamentos antirreumáticos durante el curso de la gestación genera una preocupación importante tanto para los pacientes como para los médicos. La Liga Europea contra el Reumatismo (EULAR) (Tabla 1) y la Sociedad Británica de Reumatología (BSR) han desarrollado algunas pautas útiles para orientar a los reumatólogos y a su vez brindarles más confianza a estos y a sus pacientes al momento de prescribir la medicación compatible con la gestación en curso2,33,34.
El tratamiento de pacientes con AR durante el embarazo puede ser posible con una seguridad razonable para el niño. Los datos disponibles de la literatura y los registros muestran que las mujeres embarazadas y en período de lactancia pueden tomar una gran cantidad de medicamentos convencionales: los glucocorticoides, la hidroxicloroquina, la azatioprina y la ciclosporina la evidencia de un mecanismo alterado de la síntesis de las hormonas sexuales periféricas en tejido sinovial de pacientes con AR: síntesis intracrina de los metabolitos activos del estrógeno a nivel de macrófagos y fibroblastos producen un aumento de la producción de citoquinas inflamatorias y la consiguiente inflamación e hiperplasia sinovial7,24.
Valor de la Ecografía en la artritis reumatoide activa durante el embarazo
Poder determinar la actividad de la enfermedad durante el embarazo resulta difícil, los componentes del índice de actividad de la enfermedad como el DAS28 podrían estar alterados por la condición misma del embarazo, como la velocidad de sedimentación globular (VSG) que se encuentra influenciada por el embarazo mismo debido al aumento del fibrinógeno circulante, la expansión del plasma y la disminución de la concentración de hemoglobina. El embarazo también podría influir en la escala visual analógica de la salud global (VAS) que se incorpora en la escala del DAS2825,26.
Encarar el tratamiento de la AR en el embarazo resulta complejo atendiendo a la necesidad de una interacción correcta entre el monitoreo de la actividad de la enfermedad y la mitigación de los síntomas con terapias no tóxicas pero eficaces. El embarazo no siempre es protector y en tal caso un brote de la enfermedad podría tener lugar con un aumento en la actividad de la misma. En tal caso se justifica la detección y el control estricto de los cambios inflamatorios para prevenir la destrucción articular que puede resultar en un mal pronóstico a largo plazo con cambios deformantes.
La ecografía musculo esquelética en pacientes con AR en gestación, proporciona una opción de imágenes de menor costo y menos riesgosa, capaz de detectar sinovitis, tenosinovitis y erosiones periarticular27.
La IRM (Imagen Por Resonancia Magnética) con gadolinio intravenoso para la evaluación de la artritis reumatoide es de utilidad limitada en pacientes embarazadas.
Ray et al. informan una asociación con un mayor riesgo de un amplio conjunto de afecciones cutáneas reumatológicas, inflamatorias o infiltrativas en el feto, y de muerte fetal o neonatal después de la IRM con gadolinio28.
En algunos estudios se han destacado tasas comparables de detección de inflamación sinovial entre la ecografía y la IRM29,30. Dados los efectos indeseados, secundarios tras la exposición a la IRM con gadolinio intravenoso, la ecografía musculoesquelética destaca seguriun rol bien recibido en la evaluación de la actividad de la enfermedad, debido a su factibilidad, accesibilidad, rentabilidad y además permite la obtención de imágenes de múltiples articulaciones concomitantemente.
La característica ecográfica de una artritis inflamatoria es la sinovitis, que se detecta fácilmente en la ecografía como un engrosamiento sinovial que puede ser hipervascular (Power Doppler positivo) en su etapa aguda y subaguda, mientras que un pannus fibroso más crónico puede presentarse sin hipervascularidad.
Los derrames articulares también pueden representar una parte de la respuesta inflamatoria a nivel de la articulación y se visualiza bien en la ecografía. Si bien tanto el líquido y el engrosamiento sinovial son ambos hipoecoicos (el líquido sinovial también puede ser anecoico), el derrame se puede desplazar y comprimir, mientras que la hipertrofia sinovial no. El líquido sinovial es hipovascular (Power Doppler negativo), mientras que la hipertrofia sinovial, junto con la señal Doppler color, constituyen el sello de imagen para la sinovitis31; esta característica particular exhibida por algunas articulaciones durante la exploración ecografía le confiere a este método un rol fundamental al momento de tomar una conducta terapéutica en aquellas mujeres gestantes que padecen de AR27 sobre todo cabe destacar la importancia de la presencia del power doppler31. La tenosinovitis también puede representar cambios activos de la artritis inflamatoria que se manifiesta como engrosamiento de la vaina tenosinovial, con o sin derrame significativo, y con o sin aumento de la vascularización32.
Cuando no se puede usar la IRM con gadolinio intravenoso, la ecografía es tan efectiva en el diagnóstico y monitoreo de la actividad de la enfermedad en la artritis reumatoide27.
Seguridad de los medicamentos en la AR durante la preconcepción, Embarazo y la Lactancia
La seguridad de los medicamentos antirreumáticos durante el curso de la gestación genera una preocupación importante tanto para los pacientes como para los médicos. La Liga Europea contra el Reumatismo (EULAR) (Tabla 1) y la Sociedad Británica de Reumatología (BSR) han desarrollado algunas pautas útiles para orientar a los reumatólogos y a su vez brindarles más confianza a estos y a sus pacientes al momento de prescribir la medicación compatible con la gestación en curso2,33,34.
El tratamiento de pacientes con AR durante el embarazo puede ser posible con una seguridad razonable para el niño. Los datos disponibles de la literatura y los registros muestran que las mujeres embarazadas y en período de lactancia pueden tomar una gran cantidad de medicamentos convencionales: los glucocorticoides, la hidroxicloroquina, la azatioprina y la ciclosporina, se consideran universalmente seguros y compatibles con la lactancia materna35.
Las opiniones controversiales entre los Reumatólogos y los obstetras pueden disminuir la confianza de los pacientes con AR que están gestando o tienen planes para ello generando ansiedad en los mismos, razón por lo que el Colegio Americano de Reumatología ha desarrollado pautas para la prescripción de medicamentos durante el embarazo y la lactancia2,36.
Algunas mujeres pueden sentir que para ser "buenas madres", deben renunciar al tratamiento de su AR durante el embarazo. Es de suma importancia que las mujeres, especialmente las que tienen AR activa en el momento de la concepción, deben ser informadas de que la interrupción de los medicamentos seguros durante el embarazo no es necesario y que la suspensión de estos fármacos podría afectar no solo a su funcionamiento físico sino también a la salud de sus hijos2.
El sitio web de OTIS “Mother To Baby” es un recurso en línea de confianza, a través del cual los pacientes pueden aprender y obtener más información sobre la compatibilidad de sus medicamentos con el embarazo y la lactancia37. El Colegio Americano de Reumatología en su sitio web también brinda información útil para el paciente sobre el embarazo, los medicamentos y las enfermedades reumáticas38.
AINEs en el embarazo, DMARD no biológicos y Esteroides
La seguridad de usar ciertos medicamentos en el periodo de gestación puede variar, los antiinflamatorios no esteroideos (AINE), la sulfasalazina y la hidroxicloroquina, cruzan la barrera placentaria, pero no están asociados con mal formaciones del feto al momento del nacimiento. No obstante, los AINE se deben utilizar con precaución ya que pueden retrasar el embarazo entre las mujeres que están tratando de concebir posiblemente inhibiendo la ovulación39. Aunque los datos no han sido del todo concluyentes40; estos fármacos también han sido relacionados con un mayor riesgo de abortos espontáneos en estudios poblacionales41. No se dispone estudios suficientes para evaluar la seguriun de los inhibidores de la Cox-2 durante embarazo, razón por la cual los AINE clásicos pueden ser preferidos para su uso en mujeres en periodo de gestación que cursen con AR42,43.
Los AINEs no son teratogénico en las primeras semanas del embarazo, pero después de la semana 20 pueden afectar la función renal y causar constricción del conducto arteriovenoso44, por lo que deben ser evitados posteriormente. Su concentración en la leche materna es muy baja y se consideran compatibles con la lactancia35.
La Hidroxicloroquina (HCQ) está etiquetada como categoría C, y si la misma es necesaria para controlar la actividad de la enfermedad, se puede administrar de manera segura durante todo el embarazo45. La hidroxicloroquina se considera compatible con el embarazo cuando se toma diariamente en dosis de 400 mg o menos, no está asociada con un mayor riesgo de nacimiento prematuro2. El 22% de la mujeres embarazadas con AR y con exposición a la HCQ, no presentaron diferencias en las anomalías congénitas entre las personas expuestas a HCQ y los controles sanos46.
Un metaanálisis utilizó cuatro estudios observacionales de mujeres con enfermedad del tejido conectivo con exposición a la HCQ en comparación a los controles no expuestos a HCQ, no encontraron un riesgo significativo de aborto espontáneo, muerte fetal, prematuridad o defectos congénitos en los nacidos vivos47 entre ambos grupos.
La sulfasalazina es también considerada un fármaco seguro durante el periodo de gestación, con mucho de los datos de seguridad extrapolados de mujeres con enfermedad inflamatoria intestinal42,48. Como la sulfasalazina es un inhibidor del dihidrofolato reductasa, suplementos de ácido fólico deben ser considerados en aquellas mujeres que usan sulfasalazina y que están en planes de embarazo. La sulfasalazina puede causar diarrea con sangre en aquellos bebés cuyas madres se exponen a la droga (3 g por día)49, la sulfasalazina debería de evitarse en aquellos lactantes prematuros o con algún padecimiento (hiperbilirrubinemia y deficiencia de glucosa-6-fosfato deshidrogenasa)35.
La prednisona u otros esteroides no fluorados en dosis bajas tienen menos probabilidades de atravesar la placenta que los esteroides fluorados3,50.
En un estudio de mujeres con AR se encontró que el uso de esteroides se asoció con el parto prematuro8.
Son necesarias más investigaciones sobre la seguridad de la prednisona entre las mujeres con AR, aunque los esteroides en dosis bajas administrados por vía oral, intramuscular o intraarticular, en general son considerados seguros y compatibles con el embarazo33,34.
Pequeñas concentraciones de AINEs, hidroxicloroquina y prednisona se puede encontrar en la leche materna, estas no se han asociado con efectos adversos en lactantes49,51. En general resulta tranquilizador que existe menos transferencia de medicamentos durante la lactancia que durante el embarazo49.
La leflunomida es teratogénica, la mayor parte de la teratogenicidad asociada a la droga ha sido observada en estudios animales y no en humanos52,53, se encuentra clasificada en la categoría X de riesgo fetal y se debe evitar en mujeres con deseos de gestación debido a su larga vida media45. Como el fármaco se puede secuestrar en la circulación biliar, un lavado con colestiramina puede reducir los niveles del fármaco antes del embarazo53.
En un grupo de pacientes con exposición de 8,6 semanas a la leflunomida post concepción el 95,3% fue sometido a lavado con colestiramida45. En este grupo de mujeres se observó un 87.5% de nacidos vivos, mientras que el 7.8% tuvo abortos espontáneos y el 1.6% abortos electivos. Cuando se ajustó para otros factores, no hubo diferencia en el peso del niño al nacer o la edad gestacional en función de la exposición a la leflunomida.
Hasta la fecha no existe evidencia de malformaciones congénitas con leflunomida después de la exposición durante el primer trimestre cuando se sigue con el lavado con colestiramina3,45. Entre las anomalías congénitas mayores que pudieran ocurrir se encuentran la aplasia cutis congénita y el síndrome de Pierre-Robin, disrafismo espinal oculto, conducto arterioso persistente, condrodisplasia punctata y bloqueo cardíaco congénito; las anomalías congénitas menores encontradas son nariz corta y puente nasal plano con filtro largo45.
Se describen algunos defectos en los lactantes con exposición a la leflunomida entre los que se pueden citar disrafismo espinal oculto, obstrucción de la unión pélvica ureteral unilateral con subsiguiente enfermedad renal multiquística y microcefalia53.
Los datos disponibles respecto a la leflunomida son limitados, no obstante la incorporación de la leflunomida para el tratamiento de la AR durante el embarazo y la lactancia no está recomendado3,45.
Metotrexato (MTX) es conocido por ser teratogénico e inducir abortos involuntarios; razón por la que debe interrumpirse 3 meses antes de un embarazo planificadad do35,54 y debe evitarse en mujeres que estén amamantando, ya que se ha detectado una pequeña cantidad en la leche materna. La contraindicación absoluta al metotrexato (MTX) (categoría X) durante el embarazo es secundaria al riesgo de aborto espontáneo y embriopatía producida por esta droga, las anomalías inducida por esta droga afectan el corazón, el sistema nervioso central y el esqueleto45. Si una mujer está recibiendo MTX, debe estar usando concomitante anticoncepción45.
Weber Schoendorfer et al. evaluaron los resultados de mujeres en gestación que tomaron MTX (30 mg / semana) antes y después de la concepción, comparados con mujeres con y sin enfermedad autoinmune (sin MTX); la incidencia acumulada de abortos espontáneos entre las mujeres expuestas a MTX después de la concepción fue mayor en un 42,5%, los defectos congénitos, fueron más comunes en mujeres con exposición a MTX después de la concepción en comparación con aquellas mujeres sin exposición al fármaco55.
La calificación de la azatioprina (AZA) en el embarazo es de categoría D, pero se ha utilizado en otras enfermedades como la Enfermedad Inflamatoria Intestinal (EII)45. La AZA no genera un mayor riesgo de prematuridad o bajo peso de nacimiento, sin embargo podría estar asociada a malformaciones congénitas según un metanálisis que comparo mujeres embarazadas con EII, tratadas con tiopurinas con aquellas mujeres sin tratamiento o con exposición a otros fármacos56, aunque la mayoría de los estudios sugieren que es compatible con el embarazo y la lactancia4.
Terapias dirigidas específicas en la AR en mujeres durante el embarazo y la lactancia
Las terapias dirigidas específicas incluyen DMARDs (Disease Modifying Antirheumatic Drugs) biológicos (bDMARD) y DMARD sintéticos dirigidos (tsDMARD).
Actualmente en la literatura se agrupan según su target.
Los inhibidores del factor de necrosis tumoral alfa (anti-TNF) Adalimumab (ADA), Certolizumab (CZP), Etanercept (ETN), golimumab (GOL) e infliximab (IFX); los agentes biológicos no inhibidores del TNF, como Abatacept (ABA; anti linfocito T citotóxico), Anakinra (ANK; anti bloqueador del receptor de interleucina ‐1), Rituximab (RTX; anti-CD20), y Tocilizumab (TCZ; bloqueador anti-interleuquina-6 [IL-6R]); existen inhibidores de IL-6R más nuevos (p. Ej., sarilumab), así como agentes dirigidos a otras vías mediadas por citocinas57,58.
Las Janus quinasas (JAK) representan otra diana terapéutica en la AR: el inhibidor oral de JAK tofacitinib (TOF) fue el primer tsDMARD aprobado para
la AR58 pero existen otros inhibidores de la JAK (p. Ej., Baricitinib)59.
Se piensa que los DMARDs biológicos ejercen efectos no deseados en los bebés de mujeres con AR durante el periodo de gestación o en periodo de lactancia.
Un informe inicial que revisó más de 120,000 eventos adversos informados a la Administración de Medicamentos y Alimentos de EE. UU. identificó 61
anomalías congénitas en 41 niños nacidos de madres que recibieron anti-TNF, entre estos niños la mayoría fueron diagnosticados con defectos cardíacos60.Gran parte de los datos sobre el uso seguro de terapias dirigidas durante el embarazo y la lactancia se obtuvieron de estudios observacionales e informes de casos61.
Según análisis de los datos recopilados de mujeres con enfermedades autoinmunes antes y durante el embarazo en Columbia Británica, Canadá, de 2002 a 2012, una alta proporción de pacientes descontinuó el uso de DMARDs biológico. Cuando se analizaron individualmente diferentes trimestres, el 31% (34/110) y el 38% (30/79) de mujeres suspendieron su tratamiento con bDMARDs dentro de su primer trimestre y segundo trimestre de embarazo, respectivamente; sin embargo, el 98% de los que recibieron tratamiento en el segundo trimestre (50/51) continuó el tratamiento en el tercer trimestre62.
El grupo de trabajo multidisciplinario EULAR realizó una revisión sistemática de la literatura de la que derivaron directrices para uso durante el embarazo y la lactancia de bDMARDs en pacientes con AR33. Durante el 1er trimestre del embarazo la terapia dirigida con anti-TNF de manera continua está recomendada.
La evidencia de esto vino de estudios de cohorte, estudios de casos y controles, estudios de registro e informes de casos que no mostraron aumento en las tasas de abortos espontáneos o malformaciones congénitas frente a un grupo de control o datos de fondo33,61. Los anti-TNF son generalmente demasiado grandes para cruzar la placenta por difusión simple, y el transporte activo a través de la placenta no comienza hasta aproximadamente las 16-18 semanas de gestación20.
Es importante considerar cuidadosamente tanto la estructura como el momento de exposición a los bDMARD durante el embarazo4.
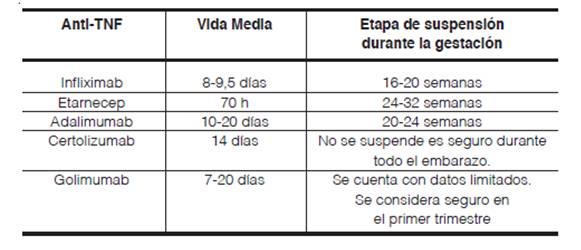
La organogénesis generalmente se completa con una gestación de 12 semanas; como el feto en desarrollo no está expuesto a los anti-TNF durante la organogénesis, es poco probable que desarrolle defectos de nacimiento relacionados con la medicación63. La Tabla 2 muestra la vida media de los anti-TNF, además expone las recomendaciones en semanas de cuando suspender los anti-TNF durante el embarazo, para asegurar que no haya inhibidor de TNF en la circulación materna al momento del nacimiento ya que también secuestaría presente en la circulación neonatal, exponiendo al bebé a infecciones4,33,34.
Tanto el infliximab como el adalimumab según el análisis realizado por Luu et al. Fueron los principales anti-TNF utilizados en un grupo de mujeres gestantes con una exposición al fármaco de 23,4 ± 13,1 semanas.
La mitad de los pacientes recibieron el tratamiento en el tercer trimestre, después de realizar un análisis multivariado ajustado por varios factores de confusión asociados este grupo de investigadores concluyeron que las complicaciones e infecciones maternas aumentaron en mujeres gestantes tratada con infliximab y adalimumab, pero el niño no mostró un riesgo mayor asociado con el tratamiento materno con anti-TNF.
El análisis recomendó la continuación del tratamiento con anti-TNF a través de todos los trimestres durante el embarazo si es necesario64.Tanto el infliximab como el adalimumab son anticuerpos monoclonales IgG1 que
se transportan activamente a través de la placenta, esto ocurre principalmente en el tercer trimestre pero mucho menos en el primer trimestre durante el período de organogénesis65.
Lichtenstein et al. concluyeron que los bebés con exposición a infliximab durante el embarazo en madres con enfermedad de Crohn no mostraron un mayor riesgo de efectos adversos, aunque el infliximab podría resultar en una tasa de nacidos vivos más baja, una condición que los autores sugirieron que podría estar relacionada con la grave naturaleza de la enfermedad de Crohn y mayor exposición a agentes inmunosupresores en este grupo de pacientes66.
En cuanto a Etanercept y Golimumab los datos obtenidos sobre los mismos fueron de estudios de cohorte o series de casos sin grupo control. El grupo de trabajo EULAR declaró que Etanercept y el Certolizumab Pegol pueden ser utilizados durante el embarazo ya que los mismos tienen una baja transferencia a través de la barrera placentaria (95% de acuerdo; grado de evidencia bajo)33. Las concentraciones de certolizumab pegol en la sangre del cordón umbilical es menor a 2 μg / ml, y el nivel medio de certolizumab pegol en la sangre del cordón umbilical es del 3,9% del nivel en la sangre de las mujeres gestantes20. Matro et al. No observaron tasas elevadas de infección ni retraso en el desarrollo de los bebés nacidos de madres tratadas con bDMARDs67.
Los datos para los DMARDs no inhibidores del TNF como el RTX, ANK, TCZ y ABA; son insuficientes, los mismo se deben reemplazar antes de la concepción por otros medicamentos y solo deben considerarse cuando todos los demás agentes compatibles con el embarazo no logran controlar la actividad de la enfermedad en la AR33.
El Rituximab se clasifica como categoría C para el embarazo, y se recomienda esperar 12 meses después de la exposición al Rituximab antes de intentar la concepción45.
El Rituximab es detectable en la sangre de los recién nacidos y en la sangre del cordón umbilical68.
En un informe de caso, las células B no fueron detectables en la sangre del cordón umbilical después de la exposición al Rituximab de una madre con linfoma de células B difuso69.
La mayor cohorte de exposiciones a Rituximab durante el embarazo para enfermedades variadas que utilizan una base de datos de seguridad de medicamentos incluyó 153 embarazos con resultados conocidos68; de esta cohorte el 59% de los niños nacieron vivos. El aborto espontáneo ocurrió en el 21%, mientras que el 18% fue electivo. De los nacidos vivos, 24% fueron prematuros con una muerte a las 6 semanas de etiología poco clara. Once bebés presentaron anormalidades hematológicas, que incluyen leucopenia, trombocitopenia y anemia, y otros cuatro pacientes sufrieron una infección neonatal, además hubo dos informes de anomalías congénitas, entre ellas un pie zambo y una malformación cardíaca.
No hay información suficiente con respecto al uso de tocilizumab y el embarazo. Se clasifica como un factor de riesgo C45. Se ha informado un total de 33 embarazos con exposición a tocilizumab con once partos a término. En siete, se produjo un aborto espontáneo con cinco de los que también recibieron MTX. Otros 13 tuvieron un aborto electivo, mientras que el resultado en dos fue desconocido70. En cuanto al Tofacitinib (TOF) solo había sido estudiado en una serie de casos, y debe evitarse en el embarazo hasta que haya más datos disponibles. Tofacitinib se clasifica como grupo de riesgo C45.
Una revisión sistémica de la literatura realizada por Gerosa et al. concluyó que varios no anti-TNF, como rituximab, tocilizumab, belimumab, ustekinumab, secuestaría presente en la circulación neonatal, exponiendo al bebé a infecciones4,33,34.
Tanto el infliximab como el adalimumab según el análisis realizado por Luu et al. Fueron los principales anti-TNF utilizados en un grupo de mujeres gestantes con una exposición al fármaco de 23,4 ± 13,1 semanas.
La mitad de los pacientes recibieron el tratamiento en el tercer trimestre, después de realizar un análisis multivariado ajustado por varios factores de confusión asociados este grupo de investigadores concluyeron que las complicaciones e infecciones maternas aumentaron en mujeres gestantes tratada con infliximab y adalimumab, pero el niño no mostró un riesgo mayor asociado con el tratamiento materno con anti-TNF.
El análisis recomendó la continuación del tratamiento con anti-TNF a través de todos los trimestres durante el embarazo si es necesario64.Tanto el infliximab como el adalimumab son anticuerpos monoclonales IgG1 que se transportan activamente a través de la placenta, esto ocurre principalmente en el tercer trimestre pero mucho menos en el primer trimestre durante el período de organogénesis65.
Lichtenstein et al. concluyeron que los bebés con exposición a infliximab durante el embarazo en madres con enfermedad de Crohn no mostraron un mayor riesgo de efectos adversos, aunque el infliximab podría resultar en una tasa de nacidos vivos más baja, una condición que los autores sugirieron que podría estar relacionada con la grave naturaleza de la enfermedad de Crohn y mayor exposición a agentes inmunosupresores en este grupo de pacientes66.
En cuanto a Etanercept y Golimumab los datos obtenidos sobre los mismos fueron de estudios de cohorte o series de casos sin grupo control. El grupo de trabajo EULAR declaró que Etanercept y el Certolizumab Pegol pueden ser utilizados durante el embarazo ya que los mismos tienen una baja transferencia a través de la barrera placentaria (95% de acuerdo; grado de evidencia bajo)33. Las concentraciones de certolizumab pegol en la sangre del cordón umbilical es menor a 2 μg / ml, y el nivel medio de certolizumab pegol en la sangre del cordón umbilical es del 3,9% del nivel en la sangre de las mujeres gestantes20. Matro et al. no observaron tasas elevadas de infección ni retraso en el desarrollo de los bebés nacidos de madres tratadas con bDMARDs67.
Los datos para los DMARDs no inhibidores del TNF como el RTX, ANK, TCZ y ABA; son insuficientes, los mismo se deben reemplazar antes de la concepción por otros medicamentos y solo deben considerarse cuando todos los demás agentes compatibles con el embarazo no logran controlar la actividad de la enfermedad en la AR33.
El Rituximab se clasifica como categoría C para el embarazo, y se recomienda esperar 12 meses después de la exposición al Rituximab antes de intentar la concepción45.
El Rituximab es detectable en la sangre de los recién nacidos y en la sangre del cordón umbilical68.
En un informe de caso, las células B no fueron detectables en la sangre del cordón umbilical después de la exposición al Rituximab de una madre con linfoma de células B difuso69.
La mayor cohorte de exposiciones a Rituximab durante el embarazo para enfermedades variadas que utilizan una base de datos de seguridad de medicamentos incluyó 153 embarazos con resultados conocidos68; de esta cohorte el 59% de los niños nacieron vivos. El aborto espontáneo ocurrió en el 21%, mientras que el 18% fue electivo. De los nacidos vivos, 24% fueron prematuros con una muerte a las 6 semanas de etiología poco clara. Once bebés presentaron anormalidades hematológicas, que incluyen leucopenia, trombocitopenia y anemia, y otros cuatro pacientes sufrieron una infección neonatal, además hubo dos informes de anomalías congénitas, entre ellas un pie zambo y una malformación cardíaca.
No hay información suficiente con respecto al uso de tocilizumab y el embarazo. Se clasifica como un factor de riesgo C45. Se ha informado un total de 33 embarazos con exposición a tocilizumab con once partos a término. En siete, se produjo un aborto espontáneo con cinco de los que también recibieron MTX. Otros 13 tuvieron un aborto electivo, mientras que el resultado en dos fue desconocido70. En cuanto al Tofacitinib (TOF) solo había sido estudiado en una serie de casos, y debe evitarse en el embarazo hasta que haya más datos disponibles. Tofacitinib se clasifica como grupo de riesgo C45.
Una revisión sistémica de la literatura realizada por Gerosa et al. concluyó que varios no anti-TNF, como rituximab, tocilizumab, belimumab, ustekinumab, secuestaría kinumab y abatacept, no se asociaron con un mayor riesgo de anomalías fetales en mujeres embarazadas con enfermedades reumáticas que fueron tratadas con estos bDMARDs71.
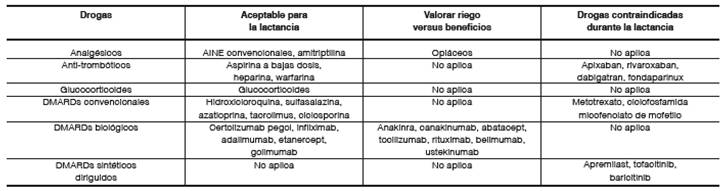
Para el tratamiento de mujeres con AR en periodo de lactancia la Tabla 3 muestra las estrategias más aceptadas. La evidencia se limita a los informes de casos para el uso de la terapia dirigida durante la lactancia, y las recomendaciones de EULAR se basaron únicamente en la opinión de expertos61. Existe una transferencia mínima de anti-TNF con la lactancia, no se ha encontrado que los neonatos que están amamantando tengan un mayor riesgo de infecciones, las madres de estos lactantes pueden usar anti-TNF33,72.
No obstante las vacunas con virus vivos deben evitarse entre los bebés expuestos a los anti-TNF al final del segundo o tercer trimestre (por ejemplo, el rotavirus en los EE. UU.), por otro lado se puede usar un programa de vacunación normal73.
Los inhibidores de TNF deben continuarse durante la lactancia; IFX, ADA, ETN y CZP presentan baja transferencia a través de la leche materna. En las muestras de leche materna, las concentraciones máximas de infliximab (19 de 29), adalimumab (2 de 21), certolizumab pegol (3 de 13) fueron 0.74 μg / mL, 0.71 μg / mL, 0.29 μg / mL respectivamente. El nivel de golimumab fue indetectable en la muestra de leche materna de la única mujer examinada67.
Los no inhibidores de TNF como RTX, ANK, ABA y TCZ no tenían datos, pero, en teoría, pueden considerarse en función de sus propiedades farmacológicas cuando no hay otros agentes disponibles. TOF no tenía datos y debería ser evitado61.
En las muestras de leche materna, las concentraciones máximas de ustekinumab fue de 1.57 μg / mL algo más elevada comparada con infliximab, adalimumab, certolizumab pegol que fueron de 0.74 μg / mL, 0.71 μg / mL, 0.29 respectivamente67.
Por lo tanto, según varios estudios, la exposición a los bDMARD es segura para las madres y los bebés.
Shimada et al. concluyeron que los pacientes con AR deben continuar bDMARD en el momento del embarazo ya que estos medicamentos tienen la ventaja de acortar el tiempo de embarazo, aumentando el peso al nacer de los recién nacidos y la disminución de la dosis de corticoesteroides durante el embarazo. El uso de bDMARD antes del embarazo no afecta las tasas de aborto, parto prematuro o ruptura prematura de las membranas74.
No obstante, entre los bDMARD, el anti-TNF puede presentar una mayor evidencia de seguridad debido a su uso más prolongado en comparación con los no anti-TNF. Para apoyar esta aseveración, un estudio reciente analizó a 6.218 mujeres con 8.607 embarazos a quienes se les diagnosticó enfermedades autoinmunes variables, incluidas 109 mujeres con 120 embarazos que estaban recibiendo tratamiento con bDMARD 3 meses antes o durante el embarazo. El citado estudio no pudo asociar un mayor riesgo de parto prematuro o bajo peso al nacer entre las madres con exposición a los bDMARD75.
Respuesta al inicio del tratamiento con TNF o GC durante el embarazo
Durante el periodo de gestación las pacientes que experimentan brote o aumento en la actividad de la enfermedad necesitan intensificar la medicación. Tras el tratamiento con anti-TNF los valores de PCR disminuyen significativamente, así como las puntuaciones de DAS28-CRP. De igual modo después de empezar la corticoterapia en pacientes embarazadas con AR, la mediana de los valores de PCR disminuye a niveles normales al igual que DAS28-CRP llegando a remisión de la actividad76.
Asociación entre las tasas de brotes durante el embarazo en pacientes con AR, actividad de la enfermedad e interrupción del Anti-TNF en el embarazo
En el curso del embarazo, se observa un brote de actividad de la enfermedad en el 29% de pacientes con AR, la mayoría de los brotes surgen en el primer trimestre76. La interrupción del anti-TNF en las primeras semanas del embarazo se correlacionó con mayor riesgo de brotes (P = 0,001); así también los brotes durante el curso del embarazo se asociaron con elevada actividad de la enfermedad y PCR elevado.
Después de la interrupción de anti-TNF, el riesgo relativo de un el brote durante el embarazo en pacientes con AR fue de 3.33 (IC 95% 1.8 - 6.1). Los pacientes con AR que suspendieron anti-TNF mostraron enfermedad activa en el primer trimestre y niveles máximos dePCR76.
En la mayoría de los pacientes con AR sin tratamiento con anti-TNF, la actividad de la enfermedad se mantuvo estable durante el embarazo, con puntuaciones de DAS28-PCR que oscilaron entre 2,6 y 3,1 y bajos niveles de PCR76.
CONCLUSIÓN
Algunas mujeres con AR pueden experimentar disminución de la fertilidad; relacionada a la actividad de la enfermedad, discapacidad física, así como al uso de ciertos fármacos.
Las mujeres que estén en planes de gestación lo deben planificar con su reumatólogo para disminuir las tasas de morbimortalidad prenatal y los índices de brotes de la enfermedad. Existe una disminución de la actividad de la enfermedad de entre un 48 a 86% en las pacientes con AR durante el embarazo.
El DAS28 en gestantes con AR podría estar alterado por la condición misma de embarazo siendo difícil dilucidar por este método la actividad real de la enfermedad.
La ecografía musculoesquelética en pacientes con AR en gestación, proporciona una opción de imágenes de menor costo y menos riesgosa, capaz de detectar sinovitis, tenosinovitis y erosiones periarticular; este método desempeña un rol fundamental al momento de tomar una conducta terapéutica.
Las mujeres, especialmente las que tienen AR activa en el momento de la concepción, deben ser informadas de que la interrupción de los medicamentos seguros durante el embarazo, no es necesario y que la suspensión de estos podría afectar a su funcionamiento físico, así como a la salud de sus hijos.
Los antiinflamatorios no esteroideos (AINE), cruzan la barrera placentaria, pero no están asociados con mal formaciones del feto al momento del nacimiento, no obstante, los AINE se deben utilizar con precaución ya que pueden retrasar el embarazo entre las mujeres que están tratando de concebir, posiblemente inhibiendo la ovulación.
Los glucocorticoides, la hidroxicloroquina, la azatioprina y la sulfasalazina se consideran universalmente seguros y compatibles con el embarazo y la lactancia materna. La hidroxicloroquina se considera compatible con el embarazo cuando se toma diariamente en dosis de 400 mg o menos. La prednisona u otros esteroides no fluorados en dosis bajas tienen menos probabilidades de atravesar la placenta que los esteroides fluorados, el uso de esteroides en gestantes con AR se asocia con parto prematuro.
La Leflunomida es teratogénica se debe evitar en la mujer con deseos de embarazo, un lavado con colestiramina puede reducir los niveles del fármaco antes del embarazo.
Metotrexato es teratogénico por lo que debe interrumpirse 3 meses antes de un embarazo planificado; si una mujer está recibiendo MTX, debe estar usando concomitante anticoncepción además el metotrexato debe evitarse en mujeres que estén amamantando.
Durante el periodo de gestación las pacientes que experimentan brote o aumento en la actividad de la enfermedad necesitan intensificar la medicación.
La terapia con anti-TNF durante el 1er trimestre del embarazo está recomendada, El Etanercept y el Certolizumab Pergol pueden ser utilizados durante el embarazo ya que los mismos tienen una baja transferencia a través de la barrera placentaria.
Los bDMARDs no inhibidores del TNF como el RTX, ANK, TCZ y ABA; deben reemplazarse antes de la concepción por otros medicamentos y solo deben considerarse cuando todos los demás agentes compatibles con el embarazo no logran controlar la actividad de la enfermedad en la AR.
Existe una transferencia mínima de anti-TNF con la lactancia, deben continuarse durante la lactancia ya que no se ha encontrado que los neonatos que están amamantando tengan un mayor riesgo de infecciones; no obstante las vacunas con virus vivos deben evitarse entre los bebés expuestos a los anti-TNF al final del segundo o tercer trimestre.