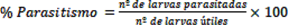INTRODUCCIÓN
Las plagas del Orden Lepidoptera en cultivos hortícolas causan daños directos en el producto comercial o daños indirectos al reducir el área fotosintética por la defoliación de las mismas, de tal manera que pueden reducir hasta 99% del rendimiento de la producción (Maish, 2019; Sarwar, 2014; Bhat et al., 2011; Alam, 1986).
Con el intento de reducir el uso de insecticidas por su impacto negativo en el ambiente, la resistencia a varios ingredientes activos de insecticidas de este grupo de plagas y la demanda de los consumidores por productos más ecológicos, se está apuntado más al control biológico, siendo las plagas lepidópteros los más estudiados en el área (Stiling & Cornelissen, 2005). Los enemigos naturales reducen significativamente la población de las plagas al causar alta mortalidad y baja fecundidad de las mismas, de los cuales, se destacan los parasitoides hymenópteros (Stiling & Cornelissen, 2005; Debach, 1977).
Los primeros pasos para implementar el control biológico es la identificación de las plagas y de los enemigos naturales y la determinación de la capacidad de parasitismo/depredación (Salas-Araiza & Salazar-Solís 2003). Por tanto, se halló de suma importancia identificar los parasitoides en un huerto de San Lorenzo, Paraguay para conocer la composición de este nicho de esta zona, y a su vez estimar el porcentaje de parasitismo de cada especie de parasitoide.
MATERIALES Y MÉTODOS
Se recolectaron todas las larvas del Orden Lepidoptera encontradas dentro de los cultivos de brócoli, repollo, tomate y zapallito de tronco de manejo convencional entre los meses de abril y octubre en intervalos de 14 días en el Centro Fruti-hortícola de la Facultad de Ciencias Agrarias (FCA) de la Universidad Nacional de Asunción (UNA), San Lorenzo, Paraguay, ubicado entre las coordenadas 25°20’ latitud sur y 57º31’ longitud oeste. La recolección de larvas fue de forma manual en frascos de plástico y posteriormente fueron trasladadas al Laboratorio de la División de Entomología del Área de Protección Vegetal FCA-UNA. Las mismas fueron criadas en condiciones controladas de 25±5ºC de temperatura, 70±10% de humedad relativa y 12 horas de fotofase, y alimentadas diariamente con hojas frescas del cultivo procedente. Los parasitoides emergidos de las larvas fueron identificados en el Museo Nacional de Historia Natural del Paraguay. Finalmente se calculó el porcentaje de parasitismo (Bahena-Juárez & Velázquez-García, 2012).
El número de larvas útiles era la diferencia entre el total de larvas colectadas del hospedero de cada especie de parasitoide y las muertas del mismo grupo por manejo, enfermedad, o escape, mientras que las larvas parasitadas por la especie de parasitoide en cuestión eran cuantificadas solamente a partir de las larvas útiles
RESULTADOS
Parasitoides identificados
Se encontraron larvas de Diaphania hyalinata (Crambidae) en cultivo de zapallito de tronco, larvas de Plutella xylostella (Plutellidae) en cultivos de repollo y brócoli, larvas de Tuta absoluta (Gelechiidae) en cultivo de tomate, larvas de las Sub Familia Plusiinae (Noctuidae) y del complejo Spodoptera (Noctuidae) en cultivos de tomate y repollo. Emergieron parasitoides en todos los grupos de plaga excepto en las larvas de la Sub Familia Plusiinae en el cultivo de repollo (Tabla 1).
Se identificaron diez géneros de parasitoides, los cuales fueron Apanteles sp. (Hymenoptera: Braconidae), Carcelia sp. (Diptera: Tachinidae), Charops sp. (Hymenoptera: Ichneumonidae), Chelonus sp. (Hymenoptera: Braconidae), Copidosoma sp. (Hymenoptera: Encyrtidae), Euplectrus sp. (Hymenoptera: Eulophidae), dos especies del género Glyptapanteles (Hymenoptera: Braconidae), Oomyzus sokolowskii (Hymenoptera: Eulophidae), Parapanteles sp. (Hymenoptera: Braconidae) y Pseudapanteles sp. (Hymenoptera: Braconidae).
Tabla 1. Plagas del Orden Lepidoptera y parasitoides hallados en cultivos de brócoli, repollo, tomate y zapallito de tronco. San Lorenzo, Paraguay. 2021.
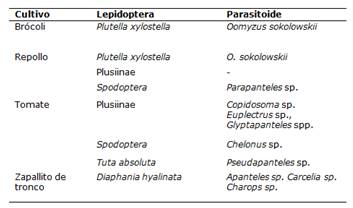
Se ha observado el parasitismo de Apanteles sp. sobre larvas de Diaphania hyalinata (Lepidoptera: Crambidae) del cultivo de zapallito de tronco.
En este trabajo Chelonus sp. fue encontrado en larvas del complejo Spodoptera del cultivo de tomate. Por su parte Copidosoma sp. parasitó larvas de la Sub Familia Plusiinae del cultivo de tomate.
Euplectrus sp. emergió a partir de las larvas de la Sub Familia Plusiinae del cultivo de tomate. Se ha encontrado dos especies de Glyptapanteles, las cuales, parasitaron a larvas de la Sub Familia Plusiinae del cultivo de tomate. Oomyzus sokolowskii parasitó larvas de Plutella xylostella en los cultivos de repollo y brócoli.
Parapanteles sp. parasitó larva de Spodoptera sp. del cultivo de repollo. Por otro lado, se ha observado el parasitismo de Pseudapanteles sp. en Tuta absoluta.
Porcentaje de parasitismo
La mayoría de las especies de parasitoides no alcanzaron el 10,00% de parasitismo (Tabla 2). Las especies que superaron el 10,00% fueron Copidosoma sp. (57,29%), Pseudapanteles sp. (48,48%) y Chelonus sp. (29,41%), dentro de las cuales, los dos primeros presentaron alrededor del 50% de parasitismo.
Tabla 2. Larvas útiles del hospedero, larvas parasitadas y porcentaje de parasitismo por especie de parasitoide. FCA-UNA. San Lorenzo, Paraguay. 2021
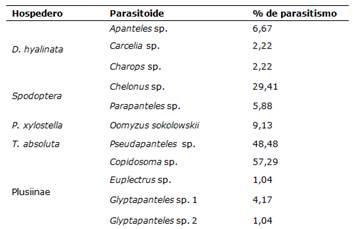
Copidosoma sp. fue el principal parasitoide que atacaba a larvas de la Sub Familia Plusiinae en el cultivo de tomate cuyo porcentaje de parasitismo era de 57,29%.
A su vez, no se puede dejar de lado a la competencia inter-especifica entre los parasitoides de las larvas de la Sub Familia Plusiinae en el cultivo de tomate ya que la misma es uno de los factores que más afecta a la estructura del nicho de los parasitoides (Ehler, 1992).
En cuanto al porcentaje de parasitismo de Pseudapanteles sp., el mismo presentó un valor de 48,48%, mayor que en otros trabajos similares.
DISCUSIÓN
Existen reportes de Apanteles impiger y Apanteles spp. como parasitoides de larvas de Diaphania hyalinata en cultivos de pipián, pepino y calabaza (Rodezno-Rodríguez & Rodríguez-Flores, 2007; Gonring et al., 2003; Medina-Gaud et al., 1989; Pena et al., 1987).
No se ha encontrado ningún registro de parasitismo de Carcelia sp. y Charops sp. en larvas de D. hyalinata, por lo que estos ejemplares constituyen el primer reporte de parasitismo en este hospedero en Paraguay. Sin embargo, hay registros de parasitismo de Carcelia spp. en otras especies de la familia Crambidae (CABI, 2021; Waterhouse, 1998; Chien et al., 1984) y de Charops spp. en otras especies de la familia Crambidae (Ganapathy, 2010; Shepard & Barrion, 1998; Chien et al., 1984; Odebiyi, 1982).
En diferentes partes del mundo se ha observado el parasitismo de Chelonus spp. en larvas de Spodoptera exigua y S. litura en cultivos hortícolas (Alvarado-Rodríguez, 1987; Rai, 1974).
En Paraguay ya hay registros de parasitismo de Copidosoma spp. en larvas de la Sub Familia Plusiinae (Ortiz-Irala, 2017; Peña-Gómez, 2017). En otros países también se ha observado el parasitismo de Copidosoma floridanum sobre especies de esta sub familia en el cultivo de tomate (Murillo-Pacheco et al., 2018; Murillo et al., 2012; Gallardo-Covas, 2005; Bosque et al., 1996).
Se ha registrado el parasitismo de Euplectrus spp. en Trichoplusia ni (Noctuidae: Plusiinae) y Rachiplusia nu (Noctuidae: Plusiinae) (Murillo-Pacheco et al., 2018; Murillo et al., 2012). En otros trabajos también hallaron parasitismo de este género en esta sub familia (Gallardo-Covas, 2005; Whitfield et al., 2002).
Muchos autores destacaron una atribución prometedora de Oomyzus para el manejo integrado de la polilla de la col en los cultivos crucíferas, especialmente en las zonas tropicales de tierras bajas (Sow et al., 2013; Talekar & Hu, 1996).
Hay registros de parasitismo de Parapanteles scotti y P. gerontogeae en larvas de Spodoptera cosmioides, S. eridania y S. exempta (Freitas et al., 2019; Donaldson, 1991). Salas-Gervassio et al. (2019) citaron a Pseudapanteles dignus como la única especie del género Pseudapanteles entre los parasitoides de Tuta absoluta de la región neotropical. En Argentina, la misma especie es considerada como un agente potencial en control biológico aplicado de T. absoluta (Luna et al., 2015; Luna et al., 2012).
Alam (1986) quien reportó que Copidosoma spp. parasitaban 8% - 100% de Pseudoplusia includens en cultivos de tomate de Barbados cuyo promedio era 80%; y de Jones et al. (1982) quienes hallaron que C. truncatellum parasitó 33% - 58% de las larvas de Trichoplusia ni. El alto/moderado porcentaje de parasitismo de este parasitoide podría ser por la alta tasa de reproducción del parasitoide y la alta especificidad de hospedero ya que Copidosoma floridanum es un parasitoide poliembrionico especifico a larvas de la Sub Familia Plusiinae que puede emerger hasta 2000 individuos a partir de un huevo (Grbic et al., 1996; Noyes, 1988).
También cabe destacar que el porcentaje de parasitismo de las otras especies parasitoides emergidas de las larvas de la Sub Familia Plusiinae (Euplectrus sp. y Glyptapanteles spp.) en el cultivo de tomate fue menor al 5%. Esto concuerda con Hawkins (1994) y Altieri et al. (1993) quienes afirmaron que una o unas pocas especies dentro de un complejo de parasitoides regulan la población de los hospederos plagas en la mayoría de los casos.
En varios estudios ya se ha observado mayor sobrevivencia de Copidosoma floridanum en casos de multiparasitismo con otras especies de parasitoides en larvas de la Sub Familia Plusiinae (Yamamoto et al., 2007; Uka et al., 2006; Utsunomiya & Iwabuchi, 2003; Strand et al., 1990). Esto se debe por las larvas soldados producidas junto con las larvas reproductivas de C. floridanum y por una sustancia proteica liberada en la hemolinfa del hospedero que paraliza a la otra especie de larvas de parasitoide (Uka et al., 2006).
En los cultivos de tomate convencionales bajo invernadero Garrido et al. (2017) hallaron 23,8% y 20,5% de parasitismo en los dos muestreos, mientras que Sánchez et al. (2009) presentaron 17,06% y 27,53% de parasitismo de Pseudoapanteles. Esta diferencia se pudo dar lugar porque las larvas de este trabajo fueron recolectadas en parcelas ya cosechadas y en parcelas de un mes, en las cuales, se realizaron poca aplicación de insecticidas y manejo de malezas, los cuales proveen menor mortalidad, mayor refugio y alimentación a los parasitoides, y por tanto atribuyen al aumento de la población de parasitoides como en los trabajos de Nieves et al. (2015) y Polack (2008) en donde el porcentaje de parasitismo llegó a superar el 60%.
Además, Pseudapanteles sp. presenta atributos que lo hace un agente potencial en el control biológico por su alta capacidad de búsqueda, alta especificidad de hospedero, buena sincronización con el hospedero y buena adaptabilidad a las condiciones climáticas. Pseudapanteles dignus es un parasitoide nativo de Sudamérica cuyos hospederos se reducen a especies de la familia Gelechiidae asociadas a plantas de la Familia Solanaceae (Salas-Gervassio et al., 2019). Además, este parasitoide presenta una sincronización estacional con Tuta absoluta sin presentar preferencia sobre algún instar larval, más el porcentaje de parasitismo es independiente a la densidad del hospedero (Luna et al., 2012).
Durante la realización del trabajo la principal limitación ha sido contar con ejemplares para la comparación de especímenes y en ausencia de los mismos, este trabajo constituye un gran aporte para el conocimiento de la fauna benéfica.
CONCLUSIÓN
En las condiciones en las que fue realizada el experimento, se puede concluir que: Se identificaron los parasitoides Apanteles sp. (Hymenoptera: Braconidae), Carcelia sp. (Diptera: Tachinidae), Charops sp. (Hymenoptera: Ichneumonidae), Chelonus sp. (Hymenoptera: Braconidae), Copidosoma sp. (Hymenoptera: Encyrtidae), Euplectrus sp. (Hymenoptera: Eulophidae), Glyptapanteles spp. (Hymenoptera: Braconidae), Oomyzus sokolowskii (Hymenoptera: Eulophidae), Parapanteles sp. (Hymenoptera: Braconidae), y Pseudapanteles sp. (Hymenoptera: Braconidae) asociados a los cultivos estudiados.