INTRODUCCIÓN
El cáncer y las cardiopatías representan las principales causas de morbimortalidad. Los cánceres más frecuentes responsables de dichas curvas son el de mama, pulmón, gastrointestinal, próstata 1. Aunque comúnmente se piensa que son dos entidades de enfermedad separadas, la enfermedad cardiovascular (ECV) y el cáncer poseen varias similitudes y posibles interacciones que sugieren una biología compartida de la cual hay evidencia emergente. Si bien la inflamación crónica es una característica indispensable de la patogénesis y la progresión tanto de la ECV como del cáncer, se pueden encontrar mecanismos adicionales en su intersección. Los avances terapéuticos, a pesar de mejorar la longevidad, han aumentado la cardiotoxicidad relacionada con el tratamiento 2.
La inflamación es un tema unificador e inespecífico entre una variedad de enfermedades, incluidas la ECV y el cáncer 3,4. Las afecciones comunes como la obesidad, la Diabetes (DM), la hipertensión (HTA) y la hipertrigliceridemia inducen inflamación 5-8, y esto puede explicar, en parte, por qué las ECV y el cáncer comparten varios factores de riesgo. Otras fuentes de inflamación son generalizadas, incluidas las infecciones microbianas y víricas, la exposición a alérgenos, la radiación, los productos químicos tóxicos, el consumo de alcohol, el tabaco y otras enfermedades crónicas y autoinmunes.
La HTA es un factor de riesgo de ECV bien establecido. Los estudios clínicos y experimentales demuestran una relación causal entre la HTA y la remodelación cardíaca vascular y estructural. Induce estrés oxidativo en la pared arterial e incrementa las presiones sanguíneas para reducir el estrés. Esto puede conducir posteriormente a la insuficiencia cardíaca diastólica como la sistólica. (9,10
Los estudios observacionales que evalúan la HTA y el riesgo de cáncer han arrojado resultados mixtos. El estudio más grande hasta la fecha evaluó a más de medio millón de personas del Síndrome Metabólico y Proyecto de Cáncer durante una mediana de 12 años y descubrió que los hombres tenían un riesgo de cáncer además de un incremento de las muertes por cáncer relacionadas a valores de presión arterial de 10 mmHg. La HTA se asoció con varios tipos específicos de cáncer 11. En el trabajo de Younis y colaboradores mostró que la presión arterial sistólica y diastólica era mayor en pacientes con cáncer en comparación con el control 12.
Numerosos estudios relacionan la DM con el riesgo de cáncer y su progresión. En 2010, un informe de consenso de la Asociación Estadounidense de Diabetes concluyó que hay evidencia convincente que asocia DM con cáncer colorrectal, de mama, endometrial, hepático, pancreático y de vejiga 13. Una más reciente revisión general sistemática de metaanálisis de estudios observacionales (2015) que evalúa la asociación de DM tipo 2 con incidencias de cáncer concluyó que existe evidencia sólida de una asociación de DM tipo 2 con: cáncer de mama, colangiocarcinoma, intrahepático, colorrectal y cáncer de endometrio14.
El 20% de las neoplasias malignas podrían estar relacionadas con el peso, el aumento de peso y la obesidad 15. Basado en numerosos estudios y datos de meta análisis, el Instituto Americano para el Cáncer Research and World Cancer Research Fund (AICR/WCRF) cree que es convincente la evidencia que une la obesidad al adenocarcinoma esofágico, pancreático, hepático, colorrectal, cáncer de mama en mujer post menopáusica, endometrio y riñón 16,17. Además, el AICR/WCRF informa evidencia probable de otros cánceres. El riesgo de cáncer con obesidad parece aumentar con el aumento del IMC, donde el riesgo de neoplasia se incrementó significativamente en 12% con un IMC de 27,5-29,9 y hasta 70% en aquellos con un IMC de 40-49,9 18.
El consumo de tabaco, especialmente el tabaquismo, también es un factor de riesgo prevenible y muy ponderado para múltiples tipos de cáncer 19,20. La Sociedad Americana del Cáncer estima que fumar es responsable del 30% de todas las enfermedades relacionadas con el cáncer y muertes en los Estados Unidos. El principal mecanismo carcinógeno es la lesión repetitiva de epitelio de células escamosas, superior a las capacidades regenerativas normales,así como ambién otros mecanismos ya descriptos21.
La relación entre cáncer de mama y factores de riesgo cardiovascular (FRCV) esta recientemente descrita, sobre todo a la obesidad y sobrepeso como factor de riesgo para antraciclinas y trastuzumab. La combinación de obesidad y sobrepeso se asoció significativamente con un mayor riesgo de desarrollo de cardiotoxicidad en pacientes en régimen quimioterápico contra el cáncer de mama 22. Actualmente, hay tres modelos de predicción de riesgo cardiovascular recomendados en las guías de práctica clínica: score de Framingham, SCORE (evaluación sistemática de riesgos coercitivos) y el modelo de Organización Mundial de la Salud/Sociedad Internacional de HTA(OMS/ISH)23. El score de Framingham usa información sobre edad, sexo, presión arterial sistólica, tabaquismo y perfil lipídico 24.
En el trabajo de Hershman DL et al, 87% de los pacientes con cáncer de mama tenían uno o más FRCV. Se identificó a la DM, la HTA, el hipercolesterolemia y la enfermedad arterial coronaria 25,26. Si bien tenemos mucha bibliografía internacional, es fundamental determinar los FRCV antes de iniciar el tratamiento antitumoral en nuestra población de mujeres con cáncer de mama ya que debemos saber aquellos predominantes y si coinciden con los propuestos como riesgo previo al tratamiento de la patología oncológica. En la actualidad se disponen de escalas que valoran de forma conjunta el FRCV y de cardiotoxicidad 27. Sin embargo, estas escalas no son utilizadas de forma rutinaria por los oncólogos clínicos. El objetivo de esta investigación fue determinar y correlacionar los FRCV en pacientes con cáncer de mama.
METODOLOGÍA
Diseño: estudio observacional, longitudinal, prospectivo, multicéntrico
Población de estudio: pacientes con el diagnóstico anatomopatológico de cáncer de mama y bajo tratamiento oncológico en el Instituto Nacional del Cáncer (INCAN) y el Hospital Nacional de Itauguá (HNI), Paraguay.
Muestra de estudio: El cálculo de la muestra se realizó con spss 20.0 se tomo en base a el promedio de pacientes año con el diagnostico de cáncer de mama siendo tal promedio de 304 pacientes en las instituciones, el intervalo de confianza de 95%, porcentaje de error del 5 % cuyo tamaño de muestra hallado fue de n:170.
Tipo de muestreo: no probabilístico de casos consecutivos.
Reclutamiento: se incluyó a las pacientes con cáncer de mama bajo tratamiento que acudían a consultorio y aceptaban formar parte del estudio hasta completar el tamaño de muestra. Durante la valoración de consulta externa se determinaron los datos antropométricos, signos vitales, presión arterial a nivel de antebrazo y tobillo, perímetro abdominal. Se completó una planilla con datos sobre los hábitos tóxicos, sedentarismo, enfermedades cardio metabólicas previas. Fueron excluidos los pacientes varones con cáncer de mama, o aquellas pacientes que no realizaron ningún tratamiento hormonal, quimioterápico o anti Her 2. También las embarazadas, las pacientes con imposibilidades de colaborar con el estudio o aquellas que se negaron a firmar consentimiento informado
Se tomaron muestras de sangre, previa autorización de la paciente, para determinar niveles de glicemia y perfil lípido con protocolo de 8 horas de ayuno previa a la toma de muestra. Posteriormente se realizó cálculo de score de Framingham.
Variables: edad, sexo, peso, talla, IMC, circunferencia de cintura, colesterol total, HDL, LDL, VLDL, triglicéridos, glicemia, riesgo cardiovascular con el score de Framingham.
Instrumentos de medición: el peso se midió en una báscula de adulto con tallímetro de pedestal. Con cinta métrica no extensible ni deformable con divisiones de 1 milímetro se midió la circunferencia de la cintura. La presión arterial se midió en reposo y con el individuo sentado en dos oportunidades con esfigmomanómetro manual.
Análisis de datos: las variables se registraron en fichas técnicas, conservadas en carpeta y luego transcriptas a planilla electrónica Microsoft Excel©. Los datos fueron sometidos a estadística descriptiva con SPSS® 20.0 para hallar las frecuencias y medidas de tendencia central y dispersión. Se utilizó la prueba Chi2 para comparar variables cualitativas y la prueba ANOVA para analizar variables continuas de distribución normal. Se calculó la correlación por el método de Spearman. Se consideró significativa toda p <0,05.
Cuestiones éticas. Se solicitó los permisos a las autoridades del INCAN y HNI. Se garantizó la confidencialidad de los datos incluidos en el estudio. Se respetó la autonomía de las pacientes en la decisión de participar y las que aceptaron firmaron el formulario de consentimiento informado. Se respetó el principio de no maleficencia, no implicó ningún procedimiento invasivo que ponga en riesgo la integridad de las participantes del estudio. Las participantes recibieron información de su estado nutricional, estilo de vida, riesgo cardiovascular y cardiometabólico, además del seguimiento y tratamiento de los casos nuevos de diabetes, hipertensión y dislipidemias a través de los consultorios disponibles en ambos centros hospitalarios. Los autores declaran no tener conflictos de interés comercial.
RESULTADOS
El total de nuestra muestra fue de 170 pacientes. La media de edad fue 50±13 años. Las variables antropométricas, laboratoriales y los FRCV se presentan en las tablas 1 y 2.
Tabla 1 Descripción de medidas antropométricas de las pacientes con cáncer de mama (n 170)
| Medidas antropométricas | Mediana | IQ 25 | IQ 75 |
|---|---|---|---|
| Peso (kg) | 72 | 64 | 81,25 |
| Estatura (m) | 156 | 152 | 162 |
| Índice masa corporal (kg/m2) | 29 | 25 | 33 |
| PAS en brazo (mm Hg) | 120 | 110 | 130,5 |
| PAD en brazo (mm Hg) | 80 | 70 | 90 |
| PAD en pierna izquierda (mm Hg) | 81 | 80 | 90 |
| PAS en pierna izquierda (mm Hg) | 130 | 120 | 140 |
PAS: presión arterial sistólica; PAD: presión arterial diastólica
Tabla 2 Factores de riesgo cardiovascular de las pacientes con cáncer de mama (n 170)
| Factores | Mediana | IQ 25 | IQ 75 | |
|---|---|---|---|---|
| Colesterol total (mg/dL) | 191 | 159,75 | 230 | |
| Colesterol HDL (mg/dL) | 49 | 43 | 57 | |
| Colesterol LDL (mg/dL) | 131,5 | 102,75 | 155 | |
| Score de riesgo cardiovascular | 5 | 1 | 13 | |
| Frecuencia | Porcentaje 51,8 14,7 70 38,2 3,5 | |||
| Hipertensión arterial | 82 | |||
| Diabetes mellitus tipo 2 | 25 | |||
| Sobrepeso | 119 | |||
| Sedentarismo | 65 | |||
| Tabaquismo | 6 | |||
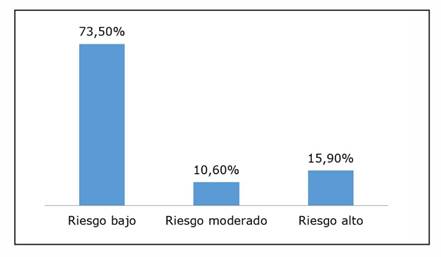
Aplicando el score de Framingham, predominó el riesgo cardiovascular bajo (Gráfico 1).
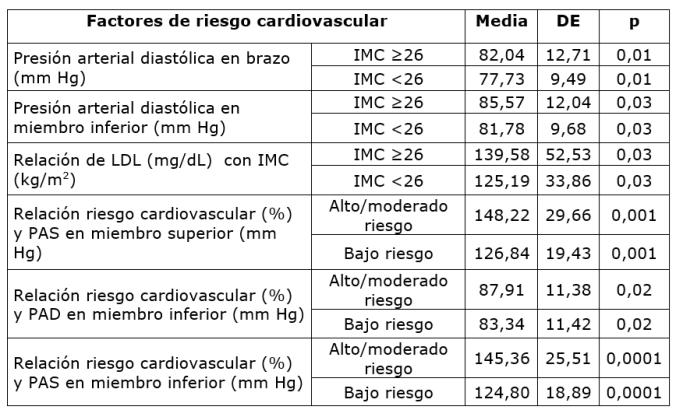
Al relacionar IMC con variables hemodinámicas las presiones arteriales diastólicas (PAD) tienen significancia estadística con incremento de valores en pacientes con sobrepeso y obesidad, existe relación entre Score de Framingham con incremento de PAD de miembros inferiores en pacientes de alto/moderado riesgo (Tabla 3).
DISCUSIÓN
La ECV es una preocupación creciente entre los sobrevivientes de cáncer de mama. Los avances en la detección y terapéutica temprana han provocado que más del 90% de las mujeres sobrevivan 5 años con una reducción de la mortalidad relacionada de 2% por año en la última década 28,29. No obstante, una mayor supervivencia ha hecho que aumente la ECV en estas mujeres 30. Para las sobrevivientes de cáncer de mama, las muertes por ECV representan el 35% de las muertes no relacionadas con el cáncer en personas de 50 años o más, y la mortalidad cardiovascular es la mayor causa de muerte no relacionada con el cáncer 30.
Se han publicado pocos informes sobre la magnitud de la ECV en las poblaciones de sobrevivientes de cáncer de mama. Los datos demuestran que no se realizaron controles y seguimiento antes, durante y posterior al tratamiento oncológico teniendo en cuenta que tiene un impacto directo en la mortalidad y la SG. Es por ello que necesitamos caracterizar mejor la población local para poder hacer algo que sea propio de cada región y país para identificar estos factores.
En el trabajo realizado por Gernaat et al. del Hospital Médico Universitario de Utrecht- Holanda, demostró que las mujeres con cáncer de mama tienen un mayor riesgo de mortalidad por ECV que las mujeres sin cáncer. En general, las mujeres con cáncer de mama tuvieron más riesgo de mortalidad por ECV según la puntación de riesgo de Framingham 23. En nuestra muestra el promedio tenía de forma basal un score de riesgo de Framingham de 5, es decir, un riesgo moderado a alto, coincidiendo con hallazgos internacionales. Según Park et al de la Universidad de Pensilvania en las mujeres posmenopáusicas mayores, el riesgo de mortalidad atribuible a la ECV es mayor en las sobrevivientes de cáncer de mama.30.
La DM estuvo presente en nuestra muestra en 14,70% desde el momento del diagnóstico inicial. Está determinado que la DM es un factor de riesgo significativo de ECV. La resistencia a la insulina, como se ve en la DM tipo 2, promueve la liberación de estrógeno y testosterona en las mujeres, y estos esteroides sexuales pueden ser causales en la relación entre DM y cáncer de mama 4 y ha sido identificada como un factor de riesgo independiente que predispone al desarrollo de cáncer de mama 31. Un metaanálisis bien diseñado mostró que las mujeres con DM tenían 23% más de riesgo de cáncer de mama posterior que aquellas sin DM y la asociación puede variar según la etnia 32.33.
El sobrepeso estaba expresado en gran parte de nuestra muestra (70%) coincidiendo con el trabajo de Reyes D et al en cuya población el 76,89% presentaron un exceso de peso según su IMC. El 81,25% tenía grasa no saludable obesidad (muy alto) 34,2.
El estado del perfil lipídico en pacientes con cáncer de mama en el momento del diagnóstico inicial y durante la quimioterapia sigue siendo controvertido. Encontramos que en nuestra muestra la media de LDL fue 131,5 mg/dL. El reporte de Li X et al en Korea evaluó de forma retrospectiva el estado de los lípidos de pacientes con cáncer de mama antes y después de la quimioterapia adyuvante, la situación de dislipidemia puede empeorar después de la quimioterapia se debe monitorizar sus valores en el momento del diagnóstico inicial y durante la quimioterapia y tratamiento hormonal (35) (36.
Nuestra muestra presentó una relación de sobrepeso y LDL con resultados anormales. Con IMC ≤26 la media fue 125 mg/dL y el LDL de pacientes con IMC ≥26 en pacientes sin sobrepeso tuvo un valor de riesgo moderado a alto. Este hallazgo es comparable con un trabajo realizado por Mishra S. quien demuestra una fuerte asociación entre aumento de IMC y riesgo de cáncer de mama explicando que hay una asociación entre triglicéridos y el IMC y riesgo de cáncer de mama 37) (38. Está demostrado que la hiperlipidemia, particularmente niveles elevados de lipoproteína de baja densidad (LDL), es un factor de riesgo que está asociada con el desarrollo de cáncer de mama 39,40. Nuestra muestra se encontró valores de riesgo moderado a alto.
La mediana del IMC de nuestra muestra fue 29 kg/m2, valor que coincide con la literatura en la cual se registra que el sobrepeso y obesidad es frecuente en pacientes con cáncer de mama (42. Por eso, se debe replantear al inicio de la quimioterapia una valoración nutricional para disminuir el RCV y poder impactar en la sobrevida 43.
La HTA es la ECV más común y aproximadamente el 28,5% de la población es hipertensa 44. La coexistencia de HTA y cáncer entre los pacientes es común y las tasas de incidencia aumentan con la edad45. Al analizar el sobrepeso/obesidad y peso adecuado con la presión arterial se encontró diferencia estadísticamente significativa en la presión arterial diastólica en brazo y la presión arterial diastólica miembro inferior. Se detecta regularmente en pacientes con cáncer, con frecuencia de 40% 46,47,48, coincidiendo con la presión arterial de nuestra muestra donde fue de 170-80 mm Hg en 51,80%. Además, sigue siendo un importante factor de riesgo reversible para la ECV 49. Su aparición ha sido reportada como un evento adverso para numerosas terapias contra el cáncer acercándose al 10% y 36% 50. En el trabajo realizado en Chile por Pereira A et al, fue significativamente mayor en los casos (37,1%) 51. Sin embargo, el trabajo por Peeters PH et al en Holanda demuestra que no existe asociación directa de HTA para aumentar la incidencia del cáncer de mama per se 52) (23. Está demostrado que la gravedad y la incidencia de HTA es considerablemente más alta durante la exposición a la quimioterapia 30,53.
La HTA diastólica aislada es un subtipo de HTA más comúnmente observado en el grupo de menor edad. Según el trabajo realizado en la India por Midha T et al informa que a prevalencia de HTA diastólica aislada fue 4,5%, 6,2% en hombres y del 3,1% en mujeres. Los factores más importantes asociados son el estilo de vida sedentario y el aumento del IMC 54. Cuando realizamos el análisis estadístico de correlación de variables entre score de riesgo de Framingham y valores de presión arterial observamos que existe correlación entre la presión arterial diastólica tomada en el brazo (r 0,244 p 0,001) y la presión arterial diastólica tomada en el miembro inferior (r 0,27 p 0,0001). Debemos de mencionar que el score de Framingham no considera el valor de la presión arterial diastólica como FRCV. En el metaanálisis realizado por Han H et al en el análisis de subgrupos, referidos por el autor ya mencionado, resalta una asociación positiva entre la HTA diastólica y la incidencia de cáncer de mama 55. La evidencia disponible ha mostrado que determinados patrones de dieta pueden contribuir a la prevención de la ECV. La dieta mediterránea según el estudio de PREDIMED dio beneficio como recomendación sobre la dieta hipocalórica mediterránea para la prevención de ECV 56.
Este estudio nos arroja importantes datos sobre los factores de riesgo de ECV en nuestra población de pacientes con cáncer de mama. Sin embargo las limitaciones de esta investigación fueron el periodo corto de seguimiento, la escala de medición utilizada para valorar el riesgo cardiovascular (Framingham) siendo que se recomienda actualmente la escala SCORE y cabe destacar que tampoco se tuvieron en cuenta parámetros de inflamación sistémica como PCR y VSG por ser marcadores inespecíficos elevados en el cáncer. Para este estudio no se contó con un grupo control debido a que la asociación de factores de riesgo ECV ya está establecida en la literatura y el fin del trabajo era describir su presencia nuestra población estudiada.
CONCLUSIONES
Los FRCV presentes en esta muestra fueron bastante frecuentes, considerando que la mitad de las pacientes eran hipertensas, con sobrepeso en 70%, con una mediana de IMC de 29 k/m2. Además, padecían de diabetes en un tercio de la muestra, con dislipidemia con una media de colesterol total de 191 mg/dL. Casi dos tercios era sedentaria. El score de Framingham predominante fue con riesgo elevado y moderado en 26,5%.
Existe correlación estadística entre valores elevados de presión arterial diastólica con obesidad/sobrepeso, así como con riesgo cardiovascular moderado a alto.