La insuficiencia cardiaca (IC) es un síndrome clínico complejo que resulta de cualquier deterioro estructural o funcional del llenado ventricular o gasto cardiaco1-9. No hay una sola prueba o examen para el diagnóstico de la IC porque es en gran medida un diagnóstico clínico basado en una cuidadosa anamnesis y examen físico, siendo la identificación de una causa cardiaca subyacente fundamental para el diagnóstico de la IC 10-18. Los avances en los tratamientos y su implementación han mejorado la supervivencia y han reducido la tasa de hospitalización en pacientes con IC-FEr12-16. Las tasas europeas de mortalidad por todas las causas a los 12 meses de los pacientes hospitalizados o estables/ambulatorios con IC son del 17 y el 7% respectivamente. Por otro lado, las tasas de hospitalización a los 12 meses fueron del 44 y el 32% respectivamente 16. Mientras que la tasa de mortalidad de 1 año por todas las causas fue del 6,4% para la insuficiencia cardiaca crónica 17. En pacientes con IC (hospitalizados o ambulatorios), la mayoría de las muertes se deben a causas cardiovasculares, fundamentalmente muerte súbita y empeoramiento de la IC.
La IC comprende un amplio espectro de pacientes, desde aquellos con fracción de eyección del ventrículo izquierdo (FEVI) conservada (IC-FEc) hasta a aquellos pacientes con FEVI reducida (IC-FEr). Aquellos pacientes con FEVI en la banda del 40-49% representan una zona gris, que actualmente se define como IC con FEVI en rango medio (IC-FEm)7-11. La diferenciación de los pacientes con IC según la FEVI es importante, dada su relación con diferentes etiologías subyacentes, características demográficas, comorbilidades y respuesta al manejo terapéutico 1.
Los objetivos del tratamiento para los pacientes con IC son mejorar el estado clínico, la capacidad funcional y la calidad de vida, prevenir las hospitalizaciones y reducir la mortalidad. Si bien se ha logrado mucho y se ha progresado significativamente en el manejo terapéutico de la IC, existen varios aspectos en los que todavía hay campo para la investigación tanto clínica como experimental. Por lo tanto, es nuestra intención realizar un análisis de los mecanismos fisiopatológicos, de ciertos conceptos epidemiológicos, y de los objetivos diagnósticos y terapéuticos en el manejo clínico de la insuficiencia cardiaca congestiva crónica.
Conceptos epidemiológicos en la insuficiencia cardiaca congestiva
La prevalencia de la IC se sitúa aproximadamente en el 1-2% de la población adulta en países desarrollados, y aumenta a más del 10% entre personas de 70 o más años de edad. El riesgo de IC a los 55 años es del 33% para los varones y el 28% para las mujeres 1. El riesgo de desarrollar IC durante toda la vida es del 20% para los estadounidenses de 40 o más años de edad 15.
Los datos de tendencias temporales basados en pacientes hospitalizados indican que la incidencia de la IC puede estar disminuyendo, debido más a la IC-FEr que a la IC-FEc. La IC-FEr parece tener un perfil epidemiológico y etiológico distinto que la IC-FEc. Comparados con la IC-FEr, los pacientes con IC-FEc son de más edad, más frecuentemente mujeres y más frecuentemente con antecedentes de hipertensión y fibrilación auricular, mientras que una historia de infarto de miocardio es menos frecuente. La remodelación auricular conduce al desarrollo de la fibrilación auricular, la cual contribuye prominentemente a la fisiopatología de la IC-FEc -Figura 1. Las características de los pacientes con IC-FEm se encuentran entre la IC-FEr y la IC-FEc, pero son necesarios más estudios para una mejor caracterización de este grupo de población.
Muchos pacientes con IC y miocardiopatía isquémica tienen antecedentes de infarto de miocardio o revascularización coronaria. Sin embargo, una coronariografía normal no excluye la presencia de tejido miocárdico cicatricial o afección de la microcirculación coronaria, como evidencia alternativa de la cardiopatía isquémica. En los últimos 30 años, los avances en los tratamientos y su implementación han mejorado la supervivencia y han reducido la tasa de hospitalización en pacientes con IC-FEr. Los datos europeos más recientes (estudio piloto ESC-HF y el resultado de seguimiento a un año ESC-HF-LT), demuestran que las tasas de mortalidad por todas las causas a los 12 meses de los pacientes hospitalizados o estables/ambulatorios con IC son del 17 y el 7% respectivamente, y las tasas de hospitalización a los 12 meses fueron del 44 y el 32% 16. Mientras que la tasa de mortalidad de 1 año por todas las causas fue del 23,6% para la insuficiencia cardiaca aguda y del 6,4% para la insuficiencia cardiaca crónica 17. En pacientes con IC (hospitalizados o ambulatorios), la mayoría de las muertes se deben a causas cardiovasculares, fundamentalmente muerte súbita y empeoramiento de la IC. La mortalidad por todas las causas suele ser mayor en la IC-FEr que en la IC-FEc. Las hospitalizaciones se deben frecuentemente a causas no cardiovasculares, especialmente en pacientes con HF-FEc 16. En otra población estudio de cohorte con datos de mortalidad a 5 años, la supervivencia en diferentes etapas del seguimiento osciló entre el 97% y el 20% 18.
Clasificación clínica de la insuficiencia cardiaca
La insuficiencia cardiaca es un síndrome clínico complejo que resulta de cualquier deterioro estructural o funcional del llenado ventricular o gasto cardiaco. Las manifestaciones cardinales de la insuficiencia cardiaca son disnea y fatiga, que pueden limitar la tolerancia al ejercicio, y retención de líquidos, lo que pueden conducir a la congestión pulmonar y/o esplácnica y/o edema periférico 1,2. No hay una sola prueba o examen para el diagnóstico de la IC porque es en gran medida un diagnóstico clínico basado en una cuidadosa historia y examen físico 2.
La identificación de una causa cardiaca subyacente es fundamental para el diagnóstico de la IC. Normalmente, la miocardiopatía es la causa de la disfunción ventricular sistólica o diastólica. No obstante, las anomalías de válvulas, pericardio, endocardio, ritmo cardiaco y conducción también pueden causar IC, en algunas ocasiones se puede deber a la combinación de más de una de ellas.
La Sociedad Europea de Cardiología (ESC) utiliza la siguiente clasificación según el tiempo de evolución de la enfermedad: pacientes que han tenido IC por algún tiempo, se dice normalmente que padecen IC crónica. Un paciente en tratamiento con síntomas y signos que no han cambiado durante 1 mes se describe como un paciente estable. La IC de nueva aparición (de novo) puede presentarse de forma aguda, por ejemplo, como consecuencia de un infarto agudo de miocardio (IAM), o subaguda, por ejemplo, en pacientes con miocardiopatía dilatada, que frecuentemente tienen síntomas durante semanas o meses antes de que se confirme el diagnóstico. Aunque los síntomas y signos de IC desaparezcan, la disfunción cardiaca subyacente puede permanecer y los pacientes seguirían en riesgo de descompensación recurrente.
La IC comprende un amplio espectro de pacientes, desde aquellos con FEVI normal (considerada típicamente como ≥ 50%) o IC con FE conservada (IC-FEc) hasta aquellos con FEVI reducida (típicamente considerada como < 40%) o IC-FEr. Los pacientes con FEVI en la banda del 40-49% representan una zona gris, que actualmente se define como IC con FEVI en rango medio (IC-FEm). La diferenciación de los pacientes con IC según la FEVI es importante, dada su relación con diferentes etiologías subyacentes, características demográficas, comorbilidades y respuesta a los diferentes tratamientos 1.
La terminología utilizada para describir la gravedad de los síntomas de los pacientes y la intolerancia al ejercicio se basa en la estratificación funcional de la NYHA como se puede apreciar en la Tabla 1.
Tabla 1 Clasificación sintomática de la insuficiencia cardíaca según la New York Heart Association, basada en la gravedad de los síntomas y la actividad física.

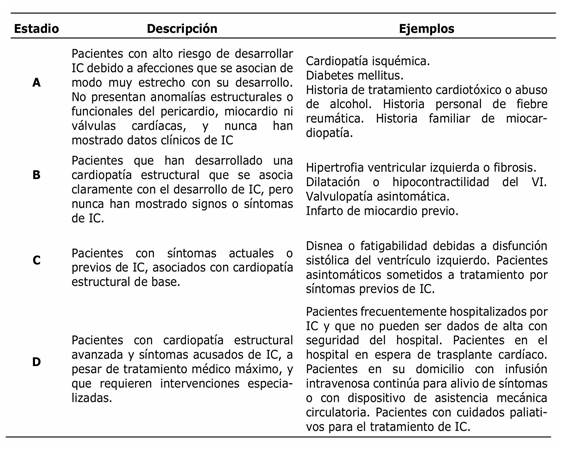
El Colegio Americano de Cardiología y la Asociación Americana del Corazón (ACCF/AHA) describe las fases de desarrollo de la IC según los cambios estructurales y los síntomas en cuatro estadios (Tabla 2) (2.
Tabla 2 Estadios evolutivos de la insuficiencia cardíaca, según las Guías del American College of Cardiology/American Heart Association.
Tratamiento farmacológico de la ICC con fracción de eyección reducida (IC-FEr)
Los objetivos del tratamiento para los pacientes con IC son mejorar el estado clínico, la capacidad funcional y la calidad de vida, prevenir las hospitalizaciones y reducir la mortalidad 19-27. El tratamiento recomendado para todos los pacientes sintomáticos con insuficiencia cardiaca y fracción de eyección reducida está dado por los siguientes fármacos 28-36.
Inhibidores de la enzima de conversión de la angiotensina: se ha demostrado que los IECA reducen la morbimortalidad de los pacientes con IC-FEr y están recomendados para pacientes sintomáticos siempre que no haya contraindicaciones o intolerancia. La dosis de IECA debe aumentarse hasta alcanzar la dosis máxima tolerada al objeto de conseguir una adecuada inhibición del sistema renina-angiotensina-aldosterona (SRAA). Los IECA también están recomendados para pacientes con disfunción sistólica del VI asintomática, para reducir el riesgo de IC, hospitalizaciones por IC y muerte.
Beta Bloqueantes: los beta-bloqueadores reducen la morbimortalidad de los pacientes con IC-FEr asintomáticos pese al tratamiento con IECA y, en la mayoría de los casos, un diurético, pero no se han probado en pacientes congestionados o descompensados. Hay consenso en cuanto a que los beta-bloqueadores y los IECA son complementarios y se pueden instaurar al mismo tiempo cuando se confirma el diagnóstico de IC-FEr. El tratamiento con bloqueadores beta debe instaurarse en pacientes clínicamente estables a dosis bajas; después se aumenta gradualmente hasta alcanzar la dosis máxima tolerada. Debe considerarse el tratamiento con bloqueadores beta para pacientes con IC-FEr y FA, especialmente si la frecuencia cardiaca es alta. Los beta-bloqueadores están recomendados para pacientes con historia de infarto de miocardio y disfunción sistólica del VI asintomática, para reducir el riesgo de muerte.
Antagonistas de los receptores de mineralcorticoides/aldosterona: se recomienda espironolactona o eplerenona para todo paciente con IC-FEr sintomático (a pesar del tratamiento con un IECA y un bloqueador beta) y FEVI ≤ 35%, para reducir la mortalidad y las hospitalizaciones por IC 31. Deben tomarse precauciones al emplear los antagonistas de receptores mineralcorticoides (ARM) en pacientes con la función renal afectada o con potasio sérico > 5,0 mmol/l. Deben realizarse controles regulares de la concentración de potasio sérico y de la función renal acordes con el estado clínico del paciente.
Diuréticos: los diuréticos están recomendados para reducir los signos y síntomas de congestión de los pacientes con IC-FEr. Un meta-análisis Crochrane muestra que los diuréticos de asa y las tiacidas parece que reducen el riesgo de los pacientes con IC crónica de muerte y empeoramiento de la IC respecto a placebo, y cuando se comparan con un grupo activo de control, parece que mejoran la capacidad de ejercicio 27.
El objetivo del tratamiento diurético es alcanzar y mantener la euvolemia con la dosis más baja posible.
Inhibidor del receptor de angiotensina y neprilisina: se ha desarrollado una nueva clase de fármacos que actúan en el SRAA y el sistema de las endopeptidasas neutras (inhibidor del receptor de la angiotensina y neprilisina) (28,29. El primero de esta clase es el LCZ696, una molécula que combina fracciones de valsartán y sacubitrilo (inhibidor de neprilisina) en un solo compuesto. Con la inhibición de la neprilisina, se enlentece la degradación de NP, bradicinina y otros péptidos. El péptido natriurético de tipo A altamente circulante (ANP) y el BNP ejercen efectos fisiológicos a través de su fijación a los receptores del NP y el aumento de la generación de cGMP, aumentando de esta forma la diuresis, la natriuresis, la relajación miocárdica y el anti-remodelado 29. Los ANP y BNP inhiben además la secreción de renina y aldosterona. El bloqueo selectivo de los receptores de AT1 reduce la vasoconstricción, la retención de sodio y agua y la hipertrofia miocárdica 28. Un estudio reciente investigó los efectos a largo plazo del sacubitrilo- valsartán comparado con un IECA (enlapril) en la morbimortalidad de los pacientes ambulatorios con IC-FEr sintomática y FEVI ≤ 35%. En esta población, el sacubitrilo-valsartán (97 y 103 mg/12 h) fue superior al IECA (enalapril, 10 mg/12 h) para la reducción de las hospitalizaciones por empeoramiento de la IC, la mortalidad cardiovascular y la mortalidad total 29.
Inhibidor del canal If: la ivabradina enlentece la frecuencia cardiaca inhibiendo el canal If en el nódulo sinusal, por lo que solo se debe emplear en pacientes en ritmo sinusal 30. La ivabradina redujo la variable combinada de mortalidad y hospitalización por IC en pacientes con IC-FEr sintomática y FEVI ≤ 35%, en ritmo sinusal y con frecuencia cardiaca ≥ 70 lpm hospitalizados por IC en los 12 meses previos y tratados con dosis de bloqueadores beta basadas en la evidencia (o dosis máxima tolerada), un IECA (o ARA-II) y un ARM.
Antagonistas del receptor tipo 1 de la angiotensina II: los ARA-II solo se recomiendan como tratamiento alternativo para pacientes que no toleran los IECA. Se ha demostrado que el candesartán reduce la mortalidad cardiovascular. Se observó un efecto positivo del valsartán en las hospitalizaciones por IC (pero no en las hospitalizaciones por todas las causas) de los pacientes con IC-FEr que recibían tratamiento de base con IECA. La combinación de IECA y ARA-II debe restringirse a pacientes con IC-FEr sintomática que reciben tratamiento con un bloqueador beta y no toleran un ARM, y debe emplearse bajo estricta supervisión de la presión arterial.
Combinación de hidralazina y dinitrato de isosorbida: no existen pruebas claras que apoyen el uso de un tratamiento combinado a dosis fijas para todos los pacientes con IC-FEr. La evidencia sobre la utilidad clínica de esta combinación es escasa. En un estudio realizado con pacientes que se declaraban de raza negra (definida como ser descendiente de africanos) mostró que la adición de la combinación de hidralazina y dinitrato de isosorbida al tratamiento convencional (IECA, bloqueador beta y ARM) reduce la mortalidad y las hospitalizaciones por IC de los pacientes con IC-FEr y NYHA III-IV. Los resultados de este estudio son difíciles de trasladar a pacientes de otro origen racial o étnico. Se puede considerar la combinación de hidralazina y dinitrato de isosorbida para pacientes con IC-FEr sintomáticos que no pueden tolerar los IECA y los ARA-II (o los tienen contraindicados) para reducir la mortalidad.
Otros tratamientos con beneficios más inciertos: para pacientes sintomáticos con insuficiencia cardiaca y fracción de eyección reducida, se describen tratamientos que han mostrado beneficios en mejoría de los síntomas, reducción de las hospitalizaciones por IC o ambos, y se los considera útiles como tratamiento adicional en pacientes con IC-FEr.
Digoxina y otros glucósidos digitálicos: se puede considerar la administración de digoxina para pacientes en ritmo sinusal con IC-FEr sintomática para reducir el riesgo de hospitalización (tanto por todas las causas como por IC), aunque su efecto adicional al del tratamiento con bloqueadores beta no se ha probado hasta la fecha. En pacientes con IC sintomática y FA, la digoxina puede ser útil para reducir la frecuencia ventricular rápida, pero solo se recomienda para el tratamiento de pacientes con IC-FEr y FA con frecuencia ventricular rápida cuando no se puede aplicar otras opciones terapéuticas 32.
Ácidos grasos poliinsaturados n-3: los ácidos grasos poliinsaturados (PUFA) n-3 han mostrado solo un pequeño efecto terapéutico. Únicamente con las preparaciones de PUFA n-3 con ácido eicosapentanoico (EPA) y ácido docosahexanoico (DHA) como ésteres etílicos de, al menos, el 85% (850 mg/g) se ha demostrado un efecto en la variable acumulada de muerte cardiovascular y hospitalización. Las preparaciones de PUFA n-3 que contienen 850-882 mg de EPA y DHA como ésteres etílicos en proporción 1:1,2 se pueden considerar como tratamiento coadyuvante para los pacientes con IC-FEr sintomática que reciben tratamiento óptimo con un IECA (o ARA-II), un bloqueador beta y un ARM 37-39.
Tratamientos no recomendados (beneficio no probado) para pacientes sintomáticos con insuficiencia cardiaca y fracción de eyección reducida:
Inhibidores de la 3-hidroxi-3-metilglutaril coenzima A reductasa (estatinas): aunque las estatinas reducen la morbimortalidad de los pacientes con enfermedad ateroesclerótica (EAC), no son efectivas para mejorar el pronóstico de los pacientes con IC-FEr. Sin embargo, para los pacientes que ya reciben tratamiento con estatinas para la EAC o la hiperlipemia subyacentes, se debe considerar la continuación de este tratamiento 40-43.
Anticoagulantes orales y tratamiento antiagregante: excepto en pacientes con FA (tanto con IC-FEr como con IC-FEc), no existen pruebas de que el tratamiento con un anticoagulante oral reduzca la morbimortalidad respecto a placebo o AAS.
Inhibidores de la renina: el aliskirén (un inhibidor directo de la renina) no logró mejorar los resultados en pacientes hospitalizados por IC a los 6 y 12 meses, y actualmente no se recomienda como tratamiento alternativo a los IECA o ARA-II 44.
Tratamientos no recomendados (considerados perjudiciales) para pacientes sintomáticos con insuficiencia cardiaca y fracción de eyección reducida:
Bloqueadores de los canales del calcio: los bloqueadores de los canales del calcio no dihidropiridínicos (BCC) no están indicados para el tratamiento de pacientes con IC-FEr. El diltiazem y el verapamilo se han demostrado peligrosos para los pacientes con IC-FEr. Existen varios BCC dihidropiridínicos; algunos de ellos aumentan el tono simpático y pueden tener un perfil de seguridad negativo en la IC-FEr. Solo existen pruebas de la seguridad del amlodipino y el felodipino en pacientes con IC-FEr, pero solo deben emplearse en estos pacientes si existe una indicación convincente 45.
Tratamiento de la ICC con fracción de eyección conservada (IC-FEc)
Los pacientes pertenecientes a este grupo poseen disfunción diastólica, son generalmente mayores y muy sintomáticos y frecuentemente tienen mala calidad de vida, por tanto un objetivo importante del tratamiento es aliviar los síntomas y mejorar la calidad de vida 45-48. En la Figura 2 podemos observar los criterios de clasificación de la disfunción diastólica por ecocardiografía Doppler.
Efecto del tratamiento en los síntomas de la ICC con fracción de eyección conservada: los diuréticos normalmente mejoran la congestión cuando la hay y, por lo tanto, los síntomas y signos de la IC. No hay pruebas de que los beta-bloqueadores y los ARM mejoren los síntomas de estos pacientes. Sobre los pacientes tratados con ARA-II (solo con el candesartán se demostró una mejoría en la clase de la NYHA) e IECA, la evidencia de una mejoría de los síntomas es inconsistente 46,47.
Efecto del tratamiento en la hospitalización en la ICC con fracción de eyección conservada: para pacientes en ritmo sinusal, hay algunos datos de que el nebivolol, carvedilol, la digoxina, la espironolactona y el candesartán pueden reducir las hospitalizaciones por IC 49-51. Para los pacientes en FA, no parece que los bloqueadores beta sean efectivos y no se ha estudiado la digoxina. La evidencia sobre el uso de ARA-II o IECA no es concluyente.
Efecto del tratamiento en la mortalidad en la ICC con fracción de eyección conservada: los estudios sobre IECA, ARA-II, bloqueadores beta y ARM no han demostrado una reducción de la mortalidad de los pacientes con IC-FEc o IC-FEm. Sin embargo, en pacientes mayores con IC-FEr, IC-FEc o IC-FEm, el nebivolol redujo la variable combinada de muerte u hospitalización por causas cardiovasculares, sin una interacción significativa entre el efecto del tratamiento y la FEVI basal 51.
Otras consideraciones: los pacientes en FA deben recibir tratamiento anticoagulante para reducir el riesgo de complicaciones tromboembólicas. El tratamiento antiagregante es ineficaz para este propósito. Para los pacientes con IC-FEm/IC-FEc y FA, la tasa óptima de la frecuencia ventricular no está claramente establecida y un control agresivo de la frecuencia puede ser perjudicial.
Hay pruebas circunstanciales de que el tratamiento de la hipertensión, generalmente sistólica, es importante en la IC-FEm/IC-FEc. Parece que los diuréticos, IECA, ARA-II y ARM son fármacos adecuados para dicho propósito, pero los bloqueadores beta podrían ser menos efectivos para la reducción de la PAS.
El tratamiento hipolipemiante oral de primera línea para los pacientes con IC-FEc e IC-FEm debe ser la metformina. Un estudio sobre la empagliflozina mostró una reducción de la PA y el peso corporal, probablemente debido a glucosuria y diuresis osmótica. Su empleo se asoció a una reducción de las hospitalizaciones por IC y de la mortalidad cardiovascular. Sin embargo, el tratamiento agresivo de la disglucemia puede ser perjudicial 52,53.
La isquemia miocárdica puede contribuir a los síntomas y la morbimortalidad, por lo que se debe tener en cuenta durante la evaluación de los pacientes 54,55. Sin embargo, no se ha demostrado que la revascularización mejore los síntomas o la evolución de los pacientes. Los pacientes con angina deben seguir la misma estrategia de tratamiento que los pacientes con IC-FEr.
Es muy importante la diferenciación de los pacientes con IC según la FEVI dada su relación con diferentes etiologías subyacentes, características demográficas, comorbilidades y respuesta al manejo terapéutico. Los objetivos del tratamiento para los pacientes con IC son mejorar el estado clínico, la capacidad funcional y la calidad de vida, prevenir las hospitalizaciones y reducir la mortalidad. Los estudios experimentales y clínicos deben enfocarse a seguir aportando datos sobre la fisiopatología, la influencia de la edad, los criterios diagnósticos, la caracterización de subgrupos especiales, y la identificación de nuevos agentes farmacológicos para mejorar la estrategia terapéutica preventiva y curativa en pacientes con insuficiencia cardiaca congestiva crónica.














