INTRODUCCIÓN
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria crónica de causa desconocida que puede afectar a prácticamente todos los órganos. Las anormalidades inmunológicas, en particular la producción de un número de anticuerpos antinucleares, son características prominentes de la enfermedad. Las mujeres se ven afectadas con mayor frecuencia que los hombres1. Es una enfermedad autoinmune crónica, de etiología desconocida, caracterizada por diversas alteraciones inmunológicas, cuyas manifestaciones clínicas incluyen una gama amplia y diversa en prácticamente todos los órganos y sistemas2. La prevalencia de LES es más alta en mujeres, tanto en población blanca como en la negra, con una relación de 3:1 en la etapa antes de la pubertad y posmenopáusica, y de 9:1 a 12:1 durante la edad reproductiva2.
La problemática que acarrea la aparición de fiebre en un paciente con LES es compleja y requiere de un enfoque multidisciplinario. Los dos principales diagnósticos a sospechar ante esta situación son la presencia de una infección o que la fiebre sea secundaria a actividad del LES, aunque en un número importante de pacientes ambas condiciones se superponen y coexisten. Resulta trascendental establecer un correcto diagnóstico en este contexto ya que las conductas terapéuticas a adoptar son claramente diferentes. Así, por ejemplo, realizar innecesariamente tratamientos antibióticos en ausencia de infección acarrea riesgo de resistencia bacteriana; asimismo utilizar grandes dosis de corticoides e inmunosupresores sin haber descartado previamente la presencia de un proceso infeccioso puede poner en riesgo la vida del paciente 3. La fiebre constituye un motivo de consulta frecuente en el paciente lúpico, siendo la causa individual más frecuente, seguida por otras como artralgias, dolor abdominal, síntomas respiratorios, dolor torácico, etc4.
Las infecciones son consideradas causa importante de morbilidad y mortalidad en pacientes con LES, reportándose dentro de las primeras dos causas de muerte más comunes en estos pacientes5. Las infecciones en LES son responsables del 40-50% de la morbilidad y mortalidad6. Concurren a determinar este aumento intrínseco del riesgo de infección la carga genética del paciente, los trastornos derivados de la propia enfermedad y las drogas utilizadas en su tratamiento6.
El LES es una causa reconocida de inmunodeficiencia secundaria. Entre las alteraciones de la inmunidad detectadas podemos mencionar: linfopenia de linfocitos T (especialmente CD4+), descenso en la producción de citoquinas (IL2 y IFN-gamma), sensibilidad cutánea retardada marcadamente disminuida, hiper, hipo o disgammagobulinemia, disminución en el número de células "natural killer" (NK), disminución en la capacidad de fagocitosis, presentación de antígenos, producción de citoquinas y depuración de complejos inmunes de los macrófagos y por último, también se ha observado un descenso en el número y función de los neutrófilos. En el LES es posible detectar alteraciones tanto de la inmunidad específica como inespecífica, de la inmunidad celular, humoral como así también de la función fagocítica. Además de la enfermedad en sí misma, estos pacientes presentan otros factores de inmunodepresión, como por ejemplo, tratamientos con corticoides o con inmunosupresores, complicaciones de la enfermedad como la insuficiencia renal crónica, la hemodiálisis, las internaciones repetidas, las lesiones cutáneas o mucosas, etcétera (7,8.
El estudio GLADEL (Grupo Latinoamericano de Estudio del Lupus) incluyó a 1.214 pacientes con LES analizando el inicio y las características generales de los pacientes con LES, con un seguimiento prospectivo a 20 años. La supervivencia de esta cohorte a cuatro años fue de 95%, y la primera causa de muerte fue la infección asociada con la reactivación de la enfermedad (44%) 6. De manera similar, un estudio realizado en Barcelona por Cervera et al, donde se evaluaron las principales causas de morbilidad y mortalidad en una población de 1.000 pacientes con LES en un periodo de 10 años, se reportó que las infecciones en estos pacientes ocuparon el segundo lugar dentro de las principales causas de muerte, con un 25%4.
No existe una fórmula ideal para el tratamiento de esta enfermedad. Se han creado numerosos regímenes, como el de Dubois, modificado por Hahn y otros más, según las manifestaciones y el grado de daño del paciente 9. Sin embargo, durante muchos años, se ha estudiado y se han planteado diversos sistemas para definir el tipo de tratamiento a prescribir durante el curso de los brotes lúpicos. Esto dio origen a varios instrumentos para calcular, o al menos definir, el grado de afección de LES en un momento dado y cómo aplicarse en relación con la terapia a instaurar 10. A esto se denominó "índice de actividad", que define el grado de afección lúpica en cualquier momento dado y que puede oscilar desde la remisión o actividad mínima o nula, hasta la actividad grave que comprometa la vida del paciente 11,12,13.
En 1988 un grupo de investigadores británicos publicó el British Lupus Isles Assessment Group Index (BILAG), cuestionario de 86 acápites con base en los síntomas de ocho sistemas. El Systemic Lupus Erythematosus Disease Activity Measure (SLEDAI) es un índice global que fue desarrollado por un grupo de expertos de Toronto en 1986 y descrito con detalle por Bombardier et al. en 1992, que a diferencia de los demás, permitía una rápida revisión de los signos y síntomas manifestados, al menos, 10 días antes 14. Existen varios otros índices validados para la evaluación de pacientes con LES, no se ha encontrado suficiente evidencia para determinar cuál es el más apropiado. Los índices BILAG y SLEDAI, con moderada fiabilidad y poca sensibilidad al cambio, son los 2 índices con una validación más completa y los más empleados 15,16.
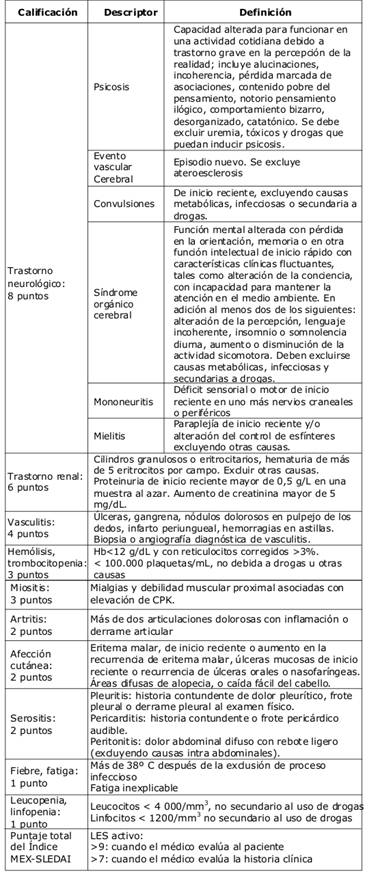
En México, Guzmán y colaboradores desarrollaron el índice MEX-SLEDAI que es una validación/modificación del índice SLEDAI y se ha demostrado la accesibilidad, reproducibilidad, validez y sensibilidad al cambio del mismo (Tabla 1) 17. Su objetivo fundamental fue dirigirlo a países cuyas condiciones económicas impidan el acceso a reactivos para los test inmunológicos, por lo que en su estructura no se incluyen variables del laboratorio inmunológico. Este índice goza de gran aceptación en nuestro continente por realizar valoraciones basadas esencialmente en elementos clínicos 16. Es una serie de diferentes puntos e incluye la revisión de diversos sistemas (nervioso central y periférico, cardiovascular, nefrológico, esquelético, entre otros) en el examen físico del paciente. El médico debe indicar los hallazgos positivos en cada aspecto y otorgar una puntuación establecida; ésta se sumará y, según los resultados o la prevalencia dentro de un acápite de uno o más síntomas, se clasificará al paciente con actividad o no.
La distinción entre una infección aguda y exacerbación del LES es un desafío para el médico internista pues es muy importante excluir meticulosamente las infecciones ya que la terapia inmunosupresora utilizada para tratar las exacerbaciones puede generar resultados catastróficos en los pacientes infectados.
Los objetivos fueron determinar las causas de fiebre en pacientes con LES del Hospital Nacional, describir sus características demográficas y clínicas y determinar la frecuencia de actividad lúpica según la escala MEX-SLEDAI.
MATERIAL Y MÉTODOS
Diseño: descriptivo, observacional, prospectivo, de corte transversal.
Población de estudio:
Varones y mujeres, mayores de edad, portadores con LES que acuden por fiebre al Hospital Nacional (Itauguá, Paraguay) entre abril y noviembre de 2016.
Criterios de inclusión:
Pacientes con diagnóstico de LES que cumplan al menos con 4 criterios de la clasificación SLICC 201218, independientemente del tratamiento farmacológico que reciban para el control de la enfermedad.
Pacientes que hayan presentado fiebre en los últimos 15 días o en el momento de la consulta.
Pacientes que han firmado el consentimiento informado.
Criterios de exclusión:
Pacientes con diagnóstico de LES de menos de 1 año de evolución.
Pacientes que no presenten fiebre durante el período del estudio.
Muestreo: no probabilístico, de casos consecutivos.
Variables:
Demográficas: edad, sexo, procedencia
Clínicas: temperatura axilar, tiempo de diagnóstico de la enfermedad, tratamiento actual.
Índice de actividad MEX-SLEDAI: neurológica, vascular, músculo esquelético, renal, hematológico, piel y serosas.
Laboratorio: hemograma, urea, creatinina, VSG, proteinuria, orina simple, cultivos
Causa de fiebre: reactivación, infección, concomitancia de ambas, medicamentosa.
Reclutamiento: se acudió al libro de registro de ingresos para detectar a los pacientes con LES y fiebre internados en el Dpto. de Medicina Interna y el Dpto. de Urgencias. Los pacientes que acudieron espontáneamente al Hospital de Día también fueron incluidos, previo consentimiento informado.
Gestación de datos: las variables fueron registradas en una ficha técnica, transcriptas a planilla electrónica y descriptas con el programa estadístico Epi Info 7(r). Las cualitativas se expresaron en frecuencias y porcentajes; las cuantitativas, en medias y DE.
Cálculo de tamaño de muestra: dada la baja frecuencia del fenómeno en estudio, se decidió incluir a todos los sujetos por conveniencia.
Aspectos éticos:
Se respetaron los Principios de la Bioética:
• Autonomía: los pacientes decidieron de forma autónoma participar o no en este estudio, no se sacó provecho de los pacientes vulnerables.
• Beneficencia: los resultados fueron entregados a los pacientes y a los médicos tratantes para que se pueda iniciar las terapias correspondientes. Los estudios laboratoriales no tuvieron costo para los pacientes.
• No maleficencia: ninguno de los procedimientos fue cruento o invasivo.
• Justicia: no se discriminó a los pacientes por género, creencia religiosa o política.
Esta investigación fue aprobada por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Itapuá, Paraguay.
RESULTADOS
Se contactaron 45 pacientes con diagnóstico de LES que acudieron por fiebre, de los cuales 8 fueron excluidos por no cumplir criterios de inclusión. Fueron enrolados 37 pacientes con edad media 30±11 años (rango 16-59 años). Hubo predomino del sexo femenino (89%). La procedencia fue mayoritariamente de ciudades circunvecinas al Hospital Nacional de Itauguá.
En cuanto el tratamiento, todos recibían hidroxicloroquina 400 mg/día pero 27 pacientes estaban tratados con corticoides, con dosis media de 15±9 mg/día. Como comorbilidades asociadas, hubo solo tres pacientes diabéticos y ninguno era portador de la inmunodeficiencia adquirida.
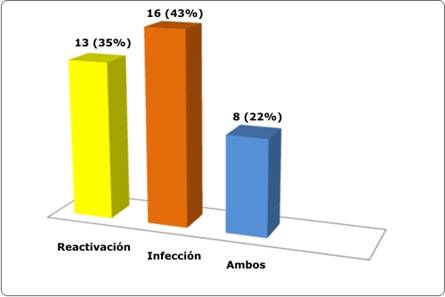
Los sujetos tenían fiebre objetivada en más de una ocasión y el tiempo medio de duración de la misma fue 8±5 días (rango 2-21 días). Todos fueron internados y sometidos a examen clínico llegando a la causa de la fiebre en la totalidad de los casos siendo la causa principal la infección. No se halló ningún caso de fiebre medicamentosa (Gráfico 1). Los focos infecciosos principales fueron la neumonía y piel o partes blandas (Tabla 2).
Los gérmenes aislados en hemocultivo fueron solo dos: Escherichia coli y Staphylococcus aureus meticilino resistente y en urocultivo Escherichia coli en su mayoría.
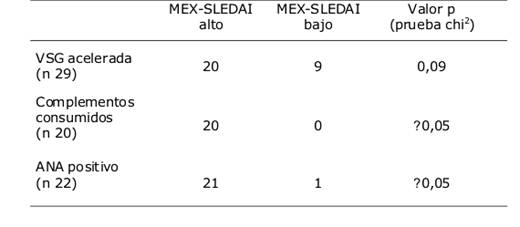
La media de puntajes de la escala MEX-SLEDAI fue de 8±5 puntos (rango 1-19 puntos). Poniendo como nivel de corte 7 puntos dentro de la escala de MEX-SLEDAI, se agruparon a los pacientes con actividad y sin ella. Se detectó una relación estadísticamente significativa entre el puntaje MEX-SLEDAI y la reactivación (p˂0,05 test exacto Fischer) (Tabla 3).
La presencia de ANA positivo ≥1:160 y complemento consumido se relacionaron estadísticamente con la reactivación lúpica medida por MEX-SLEDAI, no así la VSG acelerada (Tabla 4).
DISCUSIÓN
El predominio de LES en el sexo femenino (89%) constituye un resultado semejante a lo reportado en todos los estudios1.
La infección es una causa frecuente de morbimortalidad en los pacientes con LES. La incidencia comunicada en la literatura médica internacional oscila entre un 25-75%18,19. Esta amplia variabilidad puede deberse a la diferente metodología empleada en la recogida de datos porque, mientras que algunas series solo contabilizan las infecciones graves con demostración microbiológica o histopatológica, otras incluyen hasta las banales no confirmadas. En nuestra serie, 43% de los pacientes presentó una etiología infecciosa, comparable a otros reportes: 50% por Bouza E et al en el año 200120, 36% por Bosch X et al en el año 200621 y 29% por Ruiz-Irastorza G et al en el año 200922.
En cuanto a las infecciones más frecuentes en pacientes con LES, el estudio de De Luis A et al 23 realizado en 96 casos de infecciones en LES, las infecciones urinarias son la causa más frecuente (31%), siendo la Escherichia coli el germen aislado más comúnmente (56%); le sigue el 25% que correspondieron a infecciones respiratorias (neumonías bacterianas, tuberculosis e infecciones oportunistas); el tercer foco de infección lo constituyó la piel, siendo el Staphylococcus aureus el germen más frecuente en esta localización y en un 16% de los casos se detectaron bacteriemias a Staphylococcus spp, Salmonella y Pseudomona aeruginosa, sobre todo en pacientes con LES activo. González R et al.19 observó que la infección urinaria fue la infección más frecuente (27,2%), seguida por la cutánea (24,6%) y de la respiratoria (21%). Estos reportes son similares a nuestra serie donde se observó una igualdad entre la infección de piel y partes blandas y la respiratoria (33,3% cada uno), seguida de la infección de vías urinarias (23,8%). El germen más comúnmente aislado en las infecciones urinarias fue la E. coli (80%). Se registraron 2 casos con bacteriemias, ambos con infección de piel y partes blandas, asilándose en sus hemocultivos E. coli y Staphylococcus aereus meticilino resistente. No se aislaron gérmenes oportunistas ni se registró ningún óbito.
Un desafío actual es la asociación entre dengue y LES activo, ya que ambos presentan cuadro clínico y laboratorial muy semejantes, pudiendo coexistir ambas patologías (24,25.
Para medir la actividad de la enfermedad en pacientes con LES necesitamos una medida compuesta cuantitativa que tenga una aceptable validación. Dada la afectación multisistémica en el LES y su extensa variabilidad, contar con una escala compuesta con todas las variables supone un reto. En el momento actual, existen múltiples herramientas con mayor o menor grado de validación, aunque ninguna ha sido aceptada como la única medida recomendada a nivel internacional17. La elección de la medida más apropiada en cada caso dependerá fundamentalmente del contexto en el que se vaya a utilizar y la pregunta que se quiera responder en términos de evaluación de la enfermedad.
Los índices BILAG y SLEDAI, con moderada fiabilidad y poca sensibilidad al cambio, son los 2 índices con una validación más completa y los más empleados 15. Para este trabajo se utilizó una variante de la escala SLEDAI la cual es el MEX-SLEDAI17, índice validado por reumatólogos mexicanos. Su principal diferencia es la no utilización de pruebas serológicas como anticuerpos específicos y complementos, reduciendo así costos para países en vías de desarrollo. Presenta una especificidad del 93% comparada con otros índices 26. La decisión de utilizar también el MEX-SLEDAI en este trabajo tuvo como objetivo poder recomendar su uso cuando no exista disponibilidad de reactivos para la realización de exámenes de inmunología. Entre nuestros pacientes, poniendo como nivel de corte 7 puntos de la escala, el 59,46% presentaba enfermedad activa. Estos presentaban complementos disminuidos y ANA positivo en 90,9% y 95,45%, respectivamente. El 36,36% de estos pacientes con enfermedad activa presentaban concomitantemente un cuadro infeccioso. Al analizar la relación entre pacientes con puntaje alto de MEX-SLEDAI y VSG acelerada no se halló una relación estadísticamente significativa como lo fue con complemento consumido y ANA positivo5,26.
Concluyendo, se determinó que la causa más frecuente de fiebre en pacientes con LES son los cuadros infecciosos (43%), siendo los focos más frecuentes el respiratorio y piel o partes blandas. En cuanto a la actividad del LES, se encontró con enfermedad activa el 56,76% de los casos, obteniéndose en todos ellos un índice MEX-SLEDAI de 7 puntos o más.