INTRODUCCIÓN
Las pautas terapéuticas dirigidas a la restitución del tejido óseo perdido, se enfocan en el empleo de biomateriales que minimicen el tiempo de espera de esta regeneración. En este particular el quitosano es considerado como un biomaterial osteoinductor1,2, por lo cual se asumiría que acelera el proceso de regeneración ósea, mediante la implantación de andamiajes creados a partir de él.
El quitosano es un biomaterial biocompatible, no tóxico, analgésico y antibacterial con propiedades antivirales y antitumorales, tiene efecto hemostático, cicatrizante de heridas, biodegradable, actúa como un bioadhesivo3, ya que al presentar una estructura porosa favorece la integración , vascularización del tejido y su superficie química apropiada para la adhesión, diferenciación y proliferación celular, permitiendo una unión bioquímica del material a las paredes celulares evitando que sea expulsado fácilmente del defecto óseo, y sirve de vehículo para colocar algunos fármacos si se quiere potenciar su efecto4,5; además de ser un biomaterial de fácil obtención y de bajo costo. Todas estas propiedades y ventajas le aportan beneficios apreciables sobre los demás tratamientos, en consecuencia se presenta como la alternativa de tratamiento más completa para ser utilizado en la ROG.
Por otra parte, la regeneración ósea guiada (ROG) como terapia dirigida a recuperar defectos óseos, es un reto terapéutico debido a riesgos derivados de la biomecánica del hueso, así como de los biomateriales comúnmente usados, que no garantizan un adecuado resultado estético y funcional, debido principalmente al colapso de las membranas empleadas para tal fin. Existe una extensa cantidad de autores6-11 afirman que aún en defectos cerrados o defecto con paredes óseas conservadas (en el cual solo falta una pared) existen grandes posibilidades de invasión de tejido vecino al defecto óseo, interfiriendo con el proceso de regeneración; por lo que debe considerarse la colocación de un biomaterial, o especialmente una membrana como técnica casi obligatoria a la práctica de toda exodoncia compleja. Pero las membranas comúnmente usadas en la ROG son no reabsorbibles y las que presentan mayores inconvenientes pues deben ser retiradas tiempo después de la cirugía y es frecuente que se expongan e infecten12; tampoco aportan ningún beneficio biológico adicional, sin mencionar el alto costo que implica su uso.
En torno a lo anterior se afirma que el potencial de regeneración ósea mediante membranas puede ser incrementado al asociar un material de relleno del defecto (sobre todo en defectos que carecen de varias paredes), ya que evita el colapso de la membrana, aumenta la concentración de factores osteogénicos, y define el contorno anatómico del hueso neoformado13. Es por ello que en esta investigación se propuso el diseño y empleo de un andamio de quitosano en forma de liposoma cubriendo su implantación con una membrana bioadhesiva a base del mismo componente.
Los liposomas de quitosano podrían ser una opción para superar estos inconvenientes, gracias a que su materia prima posee propiedades cicatrizante de heridas, analgésicas, antibacteriales, coagulantes, regenerador de tejido óseo, además de ser un biopolímero abundante en la naturaleza y por lo tanto económico, características que la mayoría de los demás tratamientos no poseen3,5.Además el quitosano es altamente biocompatible y bioactivo porque libera productos biológicos asociados a él (glucosamina, proteoglucanos, entre otros) mejorando la promoción de la curación a un ritmo más rápido14, propiedades que no poseen los biomateriales de uso convencional en la ROG.
Adicionalmente, en la literatura no se han encontrado estudios histológicos en modelo animal experimental donde se empleen liposomas de quitosano cubiertos con membrana de la misma composición como tratamiento para la regeneración ósea guiada, ni evidencia histomormométrica del comportamiento del tejido óseo ante estas formulaciones, encontrando así un vacío en el conocimiento en esta área. Es por ello que el presente trabajo somete a prueba los lisposomas y membrana de quitosano como un sistema de andamiaje en dos formas físicas que podría ofrecer una nueva solución terapéutica para solventar defectos óseos.
Dentro de éste contexto, con esta investigación se pretendió como objetivo general Determinar histológicamente la eficiencia del quitosano para la regeneración ósea guida en defectos óseos creados en tibias de ratas del linaje Wistar.
MATERIALES Y MÉTODOS
El presente estudio se clasifica como de tipo confirmatorio, siguiendo la taxonomía de Hurtado15. Correlativamente esta investigación se ajusta al diseño experimental descrito en la clasificación de Arias16. El biomaterial actúa como un estímulo o variable independiente, ocasionando la regeneración del tejido óseo (variable dependiente) ante la implantación del mismo Específicamente se trata de un ensayo preclínico in vivo realizado en animales de laboratorio.
La muestra estuvo constituida por 25 ratas de laboratorio machos, del linaje Winstar (Rattus norveguicus albinus), de 4-5 meses de edad, con un peso comprendido entre 300 g-350 g, provistas por el Bioterio de la Universidad de los Andes-Mérida (BIOULA). El grupo experimental estuvo formado por 25 tibias derechas y el control 25 tibias izquierdas. La selección de la muestra estuvo determinada por los criterios éticos establecidos por el bioterio en cuanto al empleo del menor número posible de animales y usando un muestreo por conveniencia ajustado a los criterios anteriormente descritos, por ende la muestra se clasifica como no probabilística16.
La identificación de los animales que conformaron los grupos a evaluar en cada una de las semanas se realizó por marcaje de la cola en aros de diferentes colores para cada grupo, y durante el período experimental, se mantuvieron en jaulas individuales y luego en tres grupos: al grupo de animales a los que se les realizó la primera evaluación (semana 3), el grupo de la segunda evaluación (semana 6) y el de la tercera evaluación (semana 9).
Se determinaron diferentes indicadores para cada una de sus dimensiones empleando parámetros histológicos evaluados a través de los siguientes indicadores, según los criterios de la Escala de Heiplie17:
Grado de madurez ósea
0. Ausente.
1. Presencia de células indiferenciadas.
2. Proliferación y diferenciación de las células indiferenciadas a células formadoras de hueso.
3. Presencia de islotes aislados de hueso inmaduro.
4. Espículas óseas uniendo los islotes de hueso inmaduro conformando un patrón heterogéneo.
5. Hueso maduro compacto.
Presencia y calidad de médula ósea
0. Ausente.
1. Hematopoyéticamente activa, presencia mayoritaria de eritrocitos.
2. Disminución del número de eritrocitos y aumenta el de adipocitos.
3. Médula ósea amarilla.
Continuidad del defecto-hueso normal (unión ósea)
0. Ausencia de formación ósea en el reborde del defecto.
1. Escasa formación ósea.
2. Moderada formación ósea; 2/3 del defecto sin relleno óseo.
3. Elevada formación ósea; 1/3 del defecto sin relleno óseo.
4. Relleno casi total del defecto (mayor de 2/3 del defecto).
5. Continuidad del defecto con el hueso normal del 100%.
Formación ósea periférica
0. Ausente.
1. Escasa.
2. Moderada.
3. Elevada.
La recolección de los datos se llevó cabo mediante la técnica de la observación indirecta16, valorándose de manera sistemática los cambios histológicos presentes en los preparados histológicos. Asimismo se trató de una observación estructurada, puesto que se utilizaron instrumentos detallados y categóricos15) que permitieron registrar estructuradamente la presencia o ausencia de los diferentes indicadores e igualmente el grado en que se manifestaron algunos de estos.
La presente investigación, se rigió por las consideraciones del código de Bioética y Bioseguridad actual, establecidas por el Ministerio del Poder Popular para Ciencia, Tecnología e Industrias Intermedias - Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT-2008). Adicionalmente, este proyecto de investigación, fue discutido y aprobado por la Comisión de Bioética del Bioterio de la Universidad de Los Andes (BIOULA), identificado con el protocolo: CEBIOULA/003.
Procedimiento
Para la preparación de los liposomas, se siguió el procedimiento estandarizado por los mismos autores de la presente publicación, Suárez y cols18 en el centro de investigaciones odontológicas de la Facultad de Odontología ULA.
Los animales fueron intervenidos en grupos de 8 por semana y 9 en la última semana de intervención, de manera sucesiva hasta intervenir a los 25 animales previstos, llevándose a cabo dicha experiencia en un total de 3 semanas de procedimientos quirúrgicos.
Fase Prequirúrgica:
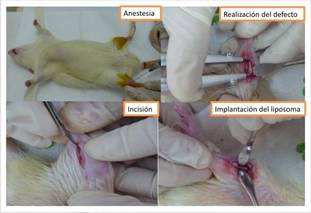
Luego de la organización de las mesas de trabajo con todos los insumos, instrumental y equipos necesarios, se asignaron de forma aleatoria los animales a cada grupo de evaluación 3, 6 y 9 semanas. Se comenzó por el pesaje del animal para el cálculo de las dosis anestésica, analgésica y antibiótica. Luego se administró el anestésico Tiopental (Pentotal(r)) en dosis de 0,5 mL/kg vía intraperitoneal y una vez sedado se preparó el campo operatorio lavando con solución Betanide(r) y depilando ambas patas del animal. La frecuencia de la administración de tiopental para la anestesia quirúrgica dependió del tiempo de la intervención en relación al efecto ultracorto de la droga. Sin embrago se procuró realizar la intervención en ambas patas en menor tiempo posible bajo una única dosis anestésica.
Fase Quirúrgica:
Se inmovilizó cada pata trasera comenzando la experiencia por la pata derecha de la wistar o lado experimental. Se aplicó anestesia local intramuscular en el área en dosis de 0,25 ml de Lidocaína (Rapicaine(r)) al 2% con adrenalina al 1:100.000. Se diseñó el colgajo longitudinal y con una hoja de bisturí N° 15 se realizó una incisión de 2 cm longitudinalmente sobre la cara anterior de cada pata, luego se separó la piel y el espacio intramuscular hasta visualizar el músculo cortándolo hasta liberar el hueso. Se cortó el periostio cuidadosamente y se separó de la tibia. Con un micromotor, una fresa cilíndrica 701, se realizó el fresado o desgaste del hueso a baja velocidad en posición totalmente vertical, en refrigeración constante con solución fisiológica y secado con gasa estéril, hasta obtener un defecto óseo lineal de 1cm de longitud y de ancho 0,5 cm, con profundidad de la mitad de la punta activa de la fresa hasta llegar a médula. Se lavó con solución fisiológica y secó con gasa estéril.
Luego se implantó sobre la pata derecha de uno a dos liposomas de Quitosano, una vez inserto se cubrió con membrana de quitosano para estabilizar el relleno. Se reposicionaron los tejidos cuidando de no movilizar la membrana. El músculo se suturó con técnica continua usando sutura reabsorbible Vicryl(r) 4-0 y en la piel con sutura no reabsorbible seda negra 3-0 que se retiraba a los 8 días posteriores a la cirugía.
Se repitió el mismo procedimiento en la pata izquierda, salvo que no se implantó nada. Inmediatamente terminada la cirugía se le administró analgésico (meloxicam, 1,0 mg/kg de peso 1 vez al día por 3 días, vía subcutánea) y antibiótico (lincomicina 0,015 mL suministrado en dosis única, vía intraperitoneal) por vía intramuscular en dosis únicas. Los animales se ubicaron en jaulas individuales, observándolos hasta recuperar conciencia y se trasladaron a un cubículo acondicionado y sólo para este grupo de animales, fueron vigilados y alimentados por el personal técnico del BIOULA.
Fase Post-quirúrgica:
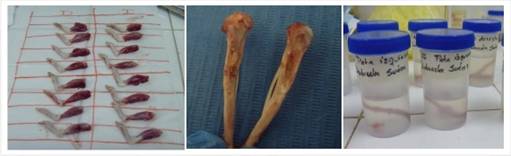
A la tercera, sexta y novena semana se sacrificaron los animales mediante la utilización de sobredosis anestésica intraperitoneal con tiopental. La obtención de las muestras para la valoración histológica se realizó mediante disección y cada una de las muestras fue identificada e inmersa en formalina al 10%. Se cortaron los bloques del área de la tibia intervenida usando micromotor y fresa de carburo en rueda para cortar los bloques, obteniéndose un total de 70 muestras durante todo el experimento.
Posteriormente se realizó el estudio histológico en el cual las muestras fueron descalcificadas individualmente durante 1 semana en Osteomoll(r) (acido clorhídrico más formaldehído), luego se marcó el área del defecto con hematoxilina, se colocaron en casetes identificados y fueron introducidas en la batería de alcoholes y tinción con hematoxilina marcando el área del defecto.
Las muestras se introdujeron en casetas plásticas correctamente identificadas, procurando que la cara marcada quedase en contacto con la parte posterior de la caseta. El tejido fue procesado mediante la técnica de deshidratación, aclaramiento e infiltración. La deshidratación con alcoholes de gradación creciente, mediante inmersión de las muestras en alcohol isopropílico al 99% cinco veces por una hora en cada inmersión. Luego se pasaron por xilol alcohol por 1 hora.
Seguidamente aclaramiento con xilol por 1 hora, que desplaza el alcohol para permitir la miscibilidad con la parafina fundida, buscando que al extraerse de la solución gotee todo el remanente de xilol antes de pasar al parafinado. Se llevaron a la estufa las muestras embebidas en parafina a 56ºC por 2 horas. Al culminar este parafinado se incluyeron en bloques de parafina (Paraplast(r)) conformándolos con moldes barras de Leuka. Cada bloque de parafina se seccionó con el micrótomo obteniéndose de 3 a 6 cortes de 0,5 micras. Los cortes resultantes se montaron en portaobjetos y se introdujeron en la estufa 2 horas para desparafinarlas (Figura 4).
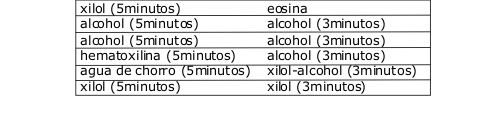
Se realizó la coloración y montaje de los preparados histológicos. La batería de coloración aplicada se explica en el diagrama a continuación:
Se usó como medio de montaje el Martex(r) y se colocaron los cubreobjetos sobre todos los preparados histológicos (Figura 5).
Se inspeccionaron las láminas de los preparados obtenidos. Este procedimiento se llevó a cabo usando un microscopio óptico de doble cabeza para permitir la observación del autor y el experto simultáneamente. Un primer vistazo para la familiarización y calibración de los observadores y una segunda ronda de observaciones para el llenado inicial del instrumento. Se digitalizaron las imágenes para el llenado definitivo del instrumento.
Metodología estadística
Para el análisis cuantitativo los datos susceptibles al mismo fueron procesados en el programa informático estadístico SPSS versión 15.0 para Windows(r). Cada parámetro fue analizado según estadísticos descriptivos básicos, utilizando distribución de frecuencias para las variables categóricas.
RESULTADOS
Comportamiento histológico observado en el grupo experimental. Semana 3:
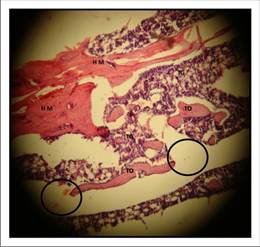
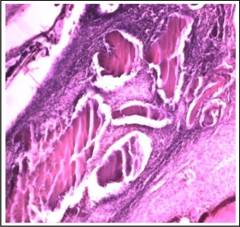
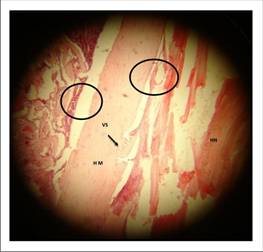
En cuanto a la madurez ósea, en el preparado de la figura 6 se ubica una zona grande central a manera de banda color rosa pálido, correspondiente a hueso maduro compacto (HM) con patrón homogéneo alternando con focos de mineralización osteoide. Se observan algunos osteocitos de reducido tamaño incluidos en dicha matriz y el espacio correspondiente a vasos sanguíneos (VS). Es una zona prototípica del grado 5, mayor nivel de madurez ósea propuesta en la escala de Heiplie.
Parte de los espacios vacíos aluden al grado de unión ósea, o como se encontraba la continuidad del defecto con el hueso normal (HN). En este sentido, predominó el nivel 4 o formación ósea casi total, es decir, Relleno mayor de 2/3 del defecto para la semana 3.
La formación ósea periférica para este mismo momento de evaluación, en el grupo experimental fue elevada. Está íntimamente relacionado a la unión ósea. En el preparado estas zonas están representadas con el círculo negro, observándose también como toda la capa celular que delimita los espacios blancos o el espacio correspondiente al remanente de defecto óseo, evidenciando una unión casi total.
Fuente propia
Figura 6 Corte histológico (HE) de tibia experimental de Wistar que representa algunos indicadores sugerentes de regeneración ósea. Aumento de 10x.
La relación entre la cantidad de adipocitos y el resto de células del infiltrado inflamatorio permitió establecer el nivel de madurez de la médula ósea. Se consideró madura cuando predominaron las células adipocíticas en relación a la serie eritroide, por ejemplo una relación 30/70 indica presencia de un 30 % de infiltrado y 70% de adipocitos en el tejido de granulación.
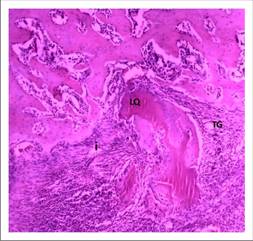
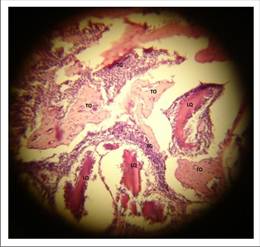
En la Figura 7 del preparado histológico se observan indicadores tempranos de regeneración ósea, prototípicos del nivel 1 de la escala de Heiplie. Se trata de una médula ósea hematopoyéticamente activa, o con presencia mayoritaria de eritrocitos (80% plasmocitos/20% adipocitos), es decir, la calidad de la médula era ideal para el momento de la evaluación tan incipiente.
Se observan múltiples focos de tejido de granulación (TG), algunas de estas zonas se encuentran rodeando a un artefacto rosado oscuro refringente y acelular compatible con restos de liposoma de quitosano (LQ). Contiguamente a estos focos de tejido de granulación e infiltrado inflamatorio se ubican algunas trabéculas óseas inmaduras (TO).
Esta gran cantidad de células de infiltrado inflamatorio indica una hiperactividad de la médula ósea en presencia de quitosano pero sin signos de reacción a cuerpo extraño, puesto que no se observan células gigantes multinucleadas, por lo que se presume de quimiotaxis de elementos celulares que al cabo de estas tres semanas post implantación se están diferenciando en osteoblastos, responsables de la fabricación de matriz osteoide.
Fuente propia.
Figura 7 Corte histológico (HE) de tibia experimental de Wistar donde se observan indicadores sugerentes de regeneración ósea. Aumento de 10x.
Comportamiento histológico observado en el grupo control. Semana: 3
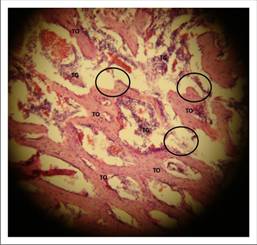
En el grupo control a las 3 semanas, se observó un conglomerado de tejido osteoide en forma de islas, correspondiendo a múltiples trabéculas óseas inmaduras (TO). En consecuencia se le adjudicó a la mayoría de los preparados controles el grado 5 de madurez ósea, aunque pareciera que se trata de un grado 4 de madurez, pues las trabéculas semejan espículas óseas uniendo los islotes de hueso inmaduro conformando un patrón heterogéneo. Sin embargo, el preparado de la Figura 8 también es hueso maduro pero su distribución no es homogénea y robusta como en el ejemplo del grupo experimental. Este patrón de las trabéculas típico en el grupo control podría atribuirse a que no existe un andamio que guiase la formación de tejido osteoide como ocurrió en el grupo experimental.
Fuente propia
Figura 8 Corte histológico (HE) de tibia control de Wistar donde se observan indicadores sugerentes de regeneración ósea. Aumento de 10x.
En torno a la calidad de la médula ósea la figura representa el común de lo visto en el grupo control, en el cual la médula ósea se consideró activa con importante presencia de tejido de granulación (TG) en la mayoría de los casos pero en una cantidad un poco menor en relación a la elevadísima celularidad denotada en el grupo experimental. Esta menor expresión de plasmocitos es normal para el grupo control, obedece a que ante un cuerpo extraño en las primeras semanas estas células proliferan y prevalecen mientras se requiera que se diferencien en células promotoras de hueso como los osteoblastos para la deposición de matriz organiza y posterior mineralización ósea.
En cuanto a la unión y a la formación ósea periférica las áreas encerradas en el círculo negro señalan la discontinuidad entre el hueso. Se observa así porque en el grupo control las trabéculas óseas no son continuas entre sí, ni con los bordes del defecto óseo, la formación ósea se observó escasa y discontinua.
Comportamiento histológico observado en el grupo control. Semana 6:
En la Figura 9 se representa el grado 5 de madurez ósea de acuerdo a la escala de Heiplie en dos grandes zonas en las que se observa hueso maduro (HM) con algunos vasos sanguíneos y osteocitos incluidos. Pero en otras zonas se observan trabéculas óseas inmaduras (TO) correspondientes al grado 3 de madurez ósea.
La médula ósea en este preparado de ejemplo es activa pero con mayor cantidad de adipocitos (20% plasmocitos/80% adipocitos) que lo observado en la semana 3. Esto es indicativo de que a medida que avanzó el tiempo la médula fue sustituyendo alguno de sus componentes celulares por células adiposas y es representativo de una médula ósea madura. De igual manera este corte histológico realizado a la semana 6, evidencia falta de continuidad entre hueso nativo y el neoformado y, por tanto, escasa formación ósea periférica señalándose en los espacios vacíos con el círculo negro.
Comportamiento histológico observado en el grupo experimental. Semana 6.
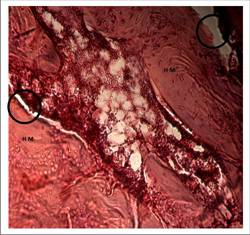
En el grupo experimental la médula ósea tuvo una importante actividad en la semana 6, incrementándose la porción de infiltrado inflamatorio (I) alrededor de los restos de liposoma de quitosano. Este fondo color violeta entremezcla al tejido de granulación (Figura 10).
Estas células rodearon al liposoma de quitosano en el grupo experimental puesto que en principio deben reconocerlo, cercarlo mientras se acoplan si a él si el biomaterial es biocompatible; para biodegradarlo posteriormente, de modo que no quede incluido como un cuerpo extraño generando un granuloma de cuerpo extraño. Por ende, en las siguientes evaluaciones se debería observar actividad celular alrededor del liposoma hasta tanto sigan apareciendo trazas del biomaterial.
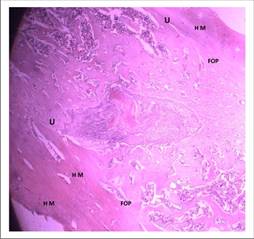
En la Figura 11, se puede apreciar que la imagen característica de la madurez ósea grado 5 o hueso maduro (HM) compacto, que predominó en todos los casos experimentales, se representa en este corte histológico como la banda color rosa homogénea en la zona inferior de la fotografía y en otra banda superior derecha.
Así mismo la formación ósea periférica que se denota en el corte de la figura 36 como FOP es elevada, presentándose este hallazgo sólo en el 50% de los casos experimentales. Esta formación ósea desde los márgenes del defecto propició en la mayoría un nivel moderado de unión, pero en un 25% de los casos ocurrió una casi continuidad como la observada en los márgenes del defecto de la presente imagen (U).
Comportamiento histológico observado en el grupo control. Semana 9:
En el grupo control ya para la semana 9 se observan zonas más grandes y heterogéneas de hueso compacto maduro (HM) bordeando la porción medular. En cuanto a la médula ósea sigue siendo activa pero con 50% de presencia de adipocitos (50/50). Los círculos negros indican las brechas que existen entre el hueso maduro y las trabéculas óseas neoformadas, siendo evidente la escasa unión en todos los cortes histológicos del grupo al cabo de las 9 semanas. De la misma forma la formación periférica es escasa por lo que condiciona que no exista continuidad con el hueso circundante (Figura 12).
Comportamiento histológico observado en el grupo experimental. Semana 9.
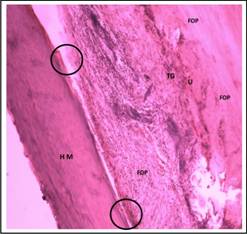
Se observó reparación del defecto óseo con presencia de hueso maduro (HM) homogéneo. En cuanto a la continuidad, se aprecia que a pesar de la madurez del tejido aún se observan microbrechas entre el tejido neoformado y el hueso que rodeaba el defecto óseo, defecto que no se observa en el corte puesto que ya la matriz osteoide reemplazó el espacio y en muchos casos por hueso maduro; es decir, existe formación ósea periférica elevada (Figura 13).
La actividad de la médula continúa pero ya abraca menos zonas comparada con las primeras semanas lo que podría sugerir que el tejido se encuentra en fase quiescente. Sin embargo en algunas cortes persiste el liposoma y la reacción del infiltrado inflamatorio alrededor (Figura 14).
Evaluación histológica cuantitativa.
Madurez ósea
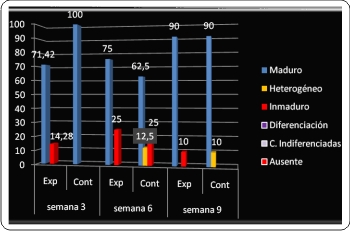
El primer criterio histológico evaluado fue la madurez ósea. Lo deseable es que las áreas del defecto logren recuperarse hasta alcanzar la madurez ósea completa o formación de hueso maduro. Este nivel de madurez fue superior en el grupo control, detectada en el 100% de los preparados histológicos de las muestras para la primera evaluación. Pero en la segunda evaluación, cambia la relación y predomina este parámetro en el grupo experimental, diagnosticándose en el 75% de las muestras observadas. En la tercera evaluación la frecuencia de la madurez ósea se iguala con 90% para cada grupo (Gráfico 1).
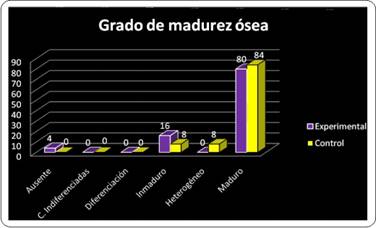
Por otra parte, cuando se analiza el comportamiento de este mismo parámetro en ambos grupos de forma global, se observó que la madurez ósea se alcanzó a lo largo del estudio en el 84% de los casos del grupo control y en el 80% de los preparados en el grupo experimental (Gráfico 2).
Se desconoce la explicación al comportamiento de los datos en este parámetro, pero se presume que el descenso de los casos con madurez ósea entre la primera y la segunda evaluación puede deberse al mecanismo de remodelación ósea que sigue a la fase de mineralización o neoformación ósea. Pero independientemente del grupo (control o experimental), para la tercera evaluación se iguala la frecuencia en la madurez ósea, lo que puede indicar que para ese modelo animal, para el cual no está establecido el tiempo de regeneración ósea espontánea, este proceso presuntivamente se completa después de 9 semanas de ocurrida la injuria o lesión ósea.
Calidad de la médula ósea
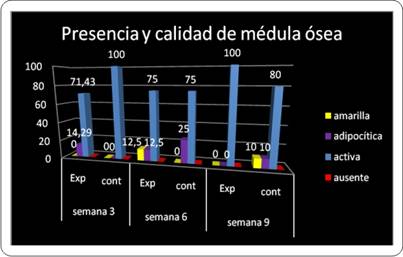
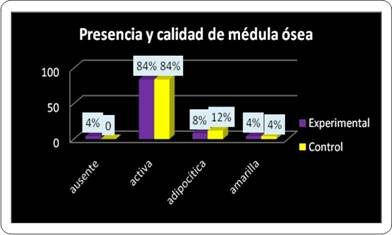
Otro criterio de suma importancia para constatar la eficacia de la neoformación ósea fue la calidad de la médula ósea. Repecto a lo anterior, en la primera evaluación (semana 3) en el grupo experimental se observó presencia de médula ósea activa en el 71,43% de los preparados, 75% en la segunda evaluación (semana 6) y 100% de actividad de la médula ósea al cabo de 9 semanas (tercera evaluación). Mientras que en el grupo control la presencia de médula ósea activa decreció entre la semana 3 y la semana 6, del 100% al 75% respectivamente. En la evaluación de la semana 9 para el grupo control la actividad de la médula se detectó en el 80% de los preparados histológicos del grupo control (Gráfico 3).
Al analizar el anterior parámetro de forma acumulativa, a lo largo del estudio, se encontró que existe paridad entre el grupo control y experimental (84% para cada uno) en lo referido a la presencia de médula ósea activa. Esto puede estar indicando que, los cambios en esta frecuencia solo son perceptibles si se analizan en cada momento evaluativo y no como sumatoria de todos los casos a lo largo del estudio(Gráfico 4).
Continuidad del defecto con el hueso circundante
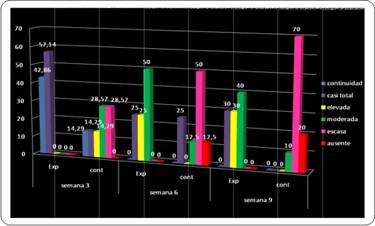
En torno a este parámetro, se observó un comportamiento atípico pues en la primera evaluación a la semana 3 solo se detectó continuidad en el grupo experimental en el 42,86%, seguida de una casi total continuidad en el resto de los preparados experimentales. Comparando con el grupo control, se observó que predominó en esta evaluación moderada continuidad en el 28,57% y el mismo porcentaje para escasa continuidad.
En la segunda evaluación (semana 6) sigió predominando la continuidad en el grupo experimental con 50% de casos de continuidad moderada y un 25% de continuidad casi total. Para la tercera evaluación (semana 9) se halló continuidad moderada en un 40% en el grupo experimental, y en un 10% para el grupo control (Gráfico 5).
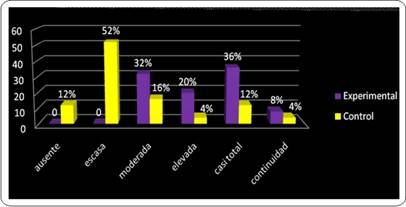
Sin embargo, si se analizan en conjunto todos los casos, se sigue observando un comportamiento más favorable para el grupo experimental, en el cual los promedios de los niveles de continuidad moderada, elevada, y casi total, fueron mayores que en el grupo control. La continuidad total se observó en pequeños sectores de ambos grupos, visto en el 8% en el grupo experimental y apenas en un 4% del grupo control (Gráfico 6).
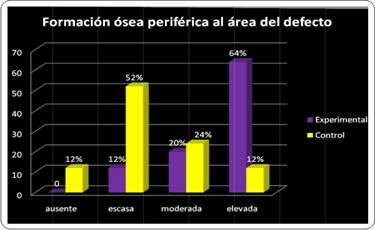
Formación ósea periférica
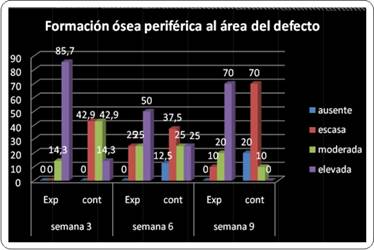
El nivel de formación ósea se evaluó para cada grupo, observándose elevada formación ósea periférica en el grupo experimental con predominio sobre el grupo control en todas las evaluaciones. Puntualmente en la primera evaluación (semana 3) la formación ósea fue elevada en el 85,7% de los preparados experimentales en contraste con el 14,3% para el grupo control. No obstante, este nivel decayó en el grupo experimental para la segunda evaluación (semana 6) ubicándose en el 50% de los preparados experimentales, y aumentó en el grupo control (25%). En la tercera evaluación (semana 9) se observó elevada formación ósea periférica en el 70% de los casos en el grupo experimental, y en relación a esto en el grupo control se observó el mismo porcentaje (70%) pero para la categoría escasa (Gráfico 7).
En consecuencia cuando se observa de forma global el comportamiento del parámetro para cada grupo, se halla un predominio en el grupo experimental (64%) que en el grupo control (12%) en el mismo momento evaluativo (Gráfico 8).
DISCUSIÓN
Madurez ósea
La cantidad y extensión de la aposición ósea fue confirmada histológicamente, diferenciándose que tipo de tejido se formó en dicha zonas: mineralización osteoide y tejido óseo maduro. Aunque numéricamente en el análisis histológico no se aprecian diferencias entre grupos control y experimental, en el análisis cualitativo de los preparados pudo diferenciarse que en los caso donde se implantó el liposoma, el tejido observado era tejido óseo maduro, en tanto que, en la mayoría de los casos controles en el preparado histológico se observaban focos de tejido osteoide o de mineralización. No obstante, para el cómputo de los datos en la escala de Heiplie se consideraban ambas formas de tejido como madurez ósea, pero en la realidad los focos de mineralización son solo centros iniciales de mineralización; mientras que trozos de tejido óseo maduro en toda su extensión como ocurrió en el grupo experimental, es el ideal.
La madurez ósea en presencia de los liposomas de quitosano expresa la utilidad del quitosano como andamio para la regeneración de defectos; tal y como ya lo habían confirmado Chang y cols. en el 200719, quienes injertaron scaffolds de quitosano en defectos osteoarticulares en ratones y doce semanas después observaron que los defectos fueron reparados con cartílago hialino, a partir de colágeno tipo II y proteoglicanos confirmados por pruebas de inmunohistoquímica.
El colágeno tipo II es el componente fundamental de la red inicial que se forma en el espacio del defecto, red que posteriormente se mineralizará para sufrir cambios de remodelado de su arquitectura y culminar en hueso maduro. Tanto en el estudio de Chang y cols19) como en la presente investigación se constató la presencia de cartílago hialino, colágeno en los preparados del grupo tratado con quitosano, pero a diferencia de aquel estudio, en ésta investigación se logró observar amplias zonas de hueso maduro.
No obstante, estos hallazgos difieren de los observados por Campo y col. en 20111, ya que estos autores no encontraron diferencias significativas entre el grupo de ratas tratadas con membrana de quitosano y el grupo al que se le implantó membranas de quitosano con hidroxiapatita; a pesar de ello los autores afirman que el uso de las membranas a base de quitosano con y sin hidroxiapatita permite el incremento de las características de ambos biomateriales, lo que trae consigo un mejor rendimiento en el proceso de la ROG.
Las diferencias entre ambos estudios tal vez se deban a la forma física del quitosano, pudiéndose presumir que para reparar defectos óseos de tamaño crítico, es más recomendable implantar liposomas que logren llenar el área del defecto y no solo una membrana que actué principalmente aislando el tejido conjuntivo del defecto.
Este razonamiento cobra sentido cuando se asume que además de obtener mayor cantidad del biomaterial en contacto con el tejido, por su forma de hidrogel, éste libera con mayor rapidez su principio activo, razón por la que en el estudio de Chang y col. en 200719, la tinción de abundantes proteoglicanos fue observada, pues una de las razones por las que el quitosano es biocompatible, bioadhesivo, bioactivo y estimulante la regeneración de los tejidos, se debe a la similitud de su estructura química con los proteoglicanos, estructuras imprescindibles que promueven muchas de las funciones de reparación de los órganos.
Calidad de la médula ósea
Otro criterio de suma importancia para constatar la eficacia de la neoformación ósea es la calidad de la médula ósea. Aunque no lo parezca, lo deseable en este caso es la presencia de médula activa, pues indica hematopoyesis y garantiza una tasa constante de actividad celular regenerativa. La presencia de médula ósea amarilla o bien una médula adipocítica no es ideal, y solo debería estar presente cuando existe un desequilibrio patológico de los adipocitos en la sustancia medular.
Cabe recalcar que una elevada actividad de la médula ósea como la que fue observada con mayor frecuencia en el grupo experimental, indica la bioestimulación que el quitosano provoca en las células indiferenciadas provenientes del periostio, endostio y de la médula misma, bioactivando su transformación en fibroblastos y osteoblastos, tal como lo afirmaron Rao y cols. en el 200920 y Niu y cols. en el 201121.
Continuidad del defecto con el hueso circundante
La continuidad que radiográficamente habíamos observado en elevada frecuencia en una investigación anterior a ésta22, histológicamente se constató en una parte muy pequeña de la muestra. Posiblemente esto responde al proceso tan agresivo de desmineralización utilizando ácido nítrico, que pudo barrer con zonas de aposición mineral que no alcanzó la madurez ósea y que justamente puede ubicarse en los márgenes del defecto. Sin embargo, si se observa detalladamente el comportamiento de ambos grupos en cada período de evaluación, se aprecia que en el grupo experimental predominó el nivel moderado y por tanto siempre se acercó más al nivel de continuidad que el control, representando otro indicio claro de la estimulación proporcionada por el liposoma de quitosano.
Sobre este aspecto específico no se encontraron antecedentes con los que lograse comparar el hallazgo. Sin embargo, esta continuidad histológicamente fue percibida y asociada a la presencia en algunos casos de fragmentos del quitosano, alrededor y por encima del cual se observó siempre una elevada concentración de células osteoblásticas activas. Esta elevadísima adhesión celular explica la biocompatibilidad del biomaterial, pues las células se adhieren y proliferan sobre estas porciones de quitosano.
Formación ósea periférica
La formación ósea periférica tiene fuerte vinculación con la continuidad, dado que la formación ósea periférica al área del defecto permite el cierre del defecto. Cuando la neoformación se inicia a partir de la capa celular que tapiza la periferia del hueso o periostio, el cierre será desde ese exterior u osificación intramembranosa. Aunque también puede ocurrir a partir de un molde de tejido cartilaginoso, cartílago hialino que será reemplazado por tejido óseo; proceso conocido como osificación endocondral, en el cual el cierre sucede desde el interior al exterior; o bien de forma concéntrica u osificación pericondral (desde el exterior del cartílago).
Pero en el caso de esta investigación, cuando se implanta un biomaterial dentro de un lecho óseo, esta neoformación pudiera darse desde dos direcciones, en primer lugar desde la capa celular periférica hacia el centro (intramembranosa); y casi simultáneamente desde el biomaterial, que actúa como matriz, un molde que guía el proceso hasta el hueso maduro, tal como sucede en la osificación endocondral.
Con respecto a cuál es el tipo de proceso de osificación que ocurre ante la implantación de Quitosano, existe controversia. Por un lado Jiang y col. 201022, observaron escasa presencia de cartílago en osificación en las muestras tratadas con microesferas de quitosano, concluyendo que el proceso de osificación que se induce el biomaterial es intramembranoso, y por otra parte, Chang y cols19) confirman la presencia de cartílago hialino formado en sitios de implantación de quitosano, fallando a favor de la osificación endocondral. Entonces estos antecedentes, abren el abanico de posibilidades y de acuerdo a lo observado en los preparados de la presente investigación, se cree que el proceso de crecimiento óseo puede ocurrir en ambas direcciones del andamio, por ende pudiese verse potenciado, lo que explica que en el grupo experimental se manifestase un mayor nivel de continuidad y de formación ósea en la periferia.
Así también, la aceleración del proceso de regeneración ósea que ya se presumía radiográficamente fue constatada histológicamente en esta investigación. Estos hallazgos son consistentes con la investigación de Miranda y cols. en 201123, quien utilizó un andamio de gel poroso de quitosano, para el desarrollo y la diferenciación osteogénica de células madre mesenquimales de la médula ósea, insertando el gel en alvéolos dentarios de ratas.
En esta investigación se obtuvo como resultado que este material promueve la adhesión, difusión, viabilidad y diferenciación osteogénica de dichas células. Esta estimulación tiene lugar por el carácter policatiónico del quitosano, que le propicia unión electrostática con los glucosaminoglicanos (moléculas aniónicas) y también enlazar con factores de crecimiento (moléculas señalizadoras), produciendo la estimulación de diversas células, en gran medida estimula los fibroblastos, promotores de angiogénesis, y a mayor nutrición vascular, más rápida ocurre la reparación. Además dicho estímulo fibroblástico acelera la formación de médula ósea, deposición de matriz colágena, que luego será mineralizada (matriz osteoide) y remodelada hasta conformar hueso maduro.
Esta reflexión coincide con lo manifestado por Kung y cols. en 201124) acerca del efecto osteoinductivo del quitosano en la periferia de implantes de titanio en ratas, pues atribuyen el efecto a que el biomaterial promueve la diferenciación celular en osteoblastos, favorece el aumento de trabéculas óseas e incrementa la formación de médula ósea. Finalmente, esta forma física de liposoma usada en la presente investigación podría determinar una biodegradación lenta con liberación sostenida de los productos químicos asociados al quitosano, razón por la cual podría ser utilizado con gran éxito en la fabricación de andamios bioactivos para guiar la regeneración ósea.
En resumen, el obtener mayor regeneración ósea en el grupo experimental y el comportamiento del tejido ante el andamio liposomal de quitosano son resultados que pueden explicarse por la rapidez con que se diferencian mayor número de células en la estirpe osteoblástica y su crecimiento más acelerado en presencia de quitosano, rico en glucosaminoglicano, extrapolable a la inducción que producen los glucosaminoglicanos nativos que se encuentra intracelularmente en mastocitos del tejido conectivo y otras células hematopoyéticas, participando en la respuesta inmune e inflamatoria. También el quitosano pudo haber tenido actuación a nivel de la matriz extracelular como sucede con los proteoglicanos (PG) propios del cuerpo, los cuales participan principalmente en procesos de difusión de moléculas hidrosolubles, migración, proliferación y adhesión celular. Estos PG participan en interacciones célula-matriz extracelular, adhesión célula-célula y señalización celular.
La bioestimulación celular asociada al quitosano y su grupo funcional es un evento que ya había sido indicado por Suphasiriroj y cols. en 200825) y Akman y cols. en el año 201026 cuando lograron medir este efecto en cultivos celulares. En torno a la explicación de esta respuesta, autores como Venkatesan y Kim en 201027, afirman que el quitosano por sí mismo no es osteoconductivo pero al interactuar con la hidroxiapatita (presente en el medio óseo formando parte de la fase inorgánica del hueso y que es sintetizada para la reparación del defecto) mejora tal propiedad y por lo tanto el biomaterial es capaz de comportarse similar al hueso natural.
Toda la evidencia proporcionada por las microfotografías ópticas de los preparados histológicos permite afianzar la tendencia observada en el análisis descriptivo de los datos, que las tibias tratadas con quitosano mostraron mayor ROG al finalizar el estudio que las tibias no tratadas. Esto concuerda con lo expresado por Danilchenko y col. en 201128, quienes concluyen que los andamios de quitosano demostraron buenas propiedades osteoinductivas y que dichos andamios pueden usarse como sustitutos de tejido óseo. Sin embargo, es necesario diferir un poco de la opinión de estos autores pues el biomaterial no es un sustituto, más si constituye una matriz para rellenar provisionalmente el defecto y aminorar la tensión mecánica que el defecto óseo ocasiona en el área circundante al él, porque en condiciones de disolución de continuidad, el hueso es frágil y tardará en formar un tejido fibroelástico provisional para promover su reparación y con ello reponer su funcionalidad.
Histológicamente se corroboró que en el grupo experimental se observaron las mejores respuestas del tejido y una mayor frecuencia de parámetros celulares sugerentes de ROG, razones por las cuales se reafirma la eficiencia del liposoma indicado para este fin, ya que estimula la diferenciación celular y la madurez ósea en menor tiempo que en condiciones naturales. El uso del liposomas de Quitosano en defectos óseos en tibias de ratas Wistar como andamios para la ROG promueve la neoformación ósea en menor tiempo que el tiempo que tarda en regenerar un defecto en condiciones fisiológicas naturales, por lo tanto es eficiente para la ROG.
Afortunadamente, en esta investigación al igual que en estudios similares se pudo constatar mediante la histomorfometría de muestras de tejido óseo la utilidad que posee la quitina y sus derivados como el quitosano en medicina regenerativa, biomateriales que se han venido proponiendo como andamios de implantación biológica para la regeneración de huesos y otros tejidos29, así como también se ha promovido su empleo para crear andamiajes o estructuras tridimensionales para sustentar el crecimiento de tejidos in vitro30. Todas estas evidencias abren una panacea de posibilidades para el clínico y el científico abocado a la regeneración de los tejidos.