Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Virtual de la Sociedad Paraguaya de Medicina Interna
versão On-line ISSN 2312-3893
Rev. virtual Soc. Parag. Med. Int. vol.3 no.1 Asunción mar. 2016
https://doi.org/10.18004/rvspmi/2312-3893/2016.03(01)22-032
ARTÍCULO ORIGINAL
Respuesta a la vacuna contra la hepatitis B en pacientes en hemodiálisis crónica
Response to hepatitis B vaccine in patients with chronic hemodialysis
Autores: Nelson López1, Raúl Real2
Resumen
Introducción: la hepatitis B (HB) sigue siendo un importante problema de Salud Pública debido a las consecuencias que acarrea en los pacientes infectados. Entre los grupos de alto riesgo de adquirir este virus se encuentran los pacientes con enfermedad renal crónica (ERC) en tratamiento hemodialítico, por lo que la vacunación constituye un importante método de prevención y protección contra el virus de la hepatitis B (VHB).
Objetivos: determinar el nivel de antiHBsAg y hallar la prevalencia de respuesta inadecuada a la vacuna contra la HB. Detectar los factores de riesgo asociados a la falta de respuesta inmunológica a la vacuna contra HB.
Metodología: estudio observacional, descriptivo, prospectivo, de corte transverso, con componente analítico. Se incluyeron pacientes adultos con ERC en tratamiento hemodialítico trisemanal del Hospital Nacional de Itauguá durante el 2015. A todos se les determinó antiHBsAg.
Resultados: se incluyeron 89 sujetos, de los cuales 47% tuvieron una respuesta inadecuada a la vacuna contra el VHB, con un leve predominio del sexo masculino.
Conclusiones: la frecuencia de respuesta inadecuada a la vacuna es 47%. La edad, el hábito tabáquico, las comorbilidades y el estado de nutrición por IMC resultaron como factores de riesgo no significativos en la respuesta inadecuada a la vacuna contra el VHB, mientras que los años de hemodiálsis y la uremia se relacionaron de manera significativa a esta mala respuesta.
Palabras claves: enfermedad renal crónica, antiHBsAg, vacuna hepatitis B, hemodiálisis
Abstract
Introduction: Hepatitis B (HB) is still an important problem of Public Health due to the consequences in the infected patients. Among the groups with high risk of acquiring this virus, there are the patients with chronic renal disease (CRD) receiving hemodialysis treatment. Vaccination is an important prevention and protection method against the hepatitis B virus (HBV).
Objectives:To determine the level of anti-HBsAg, find the prevalence of inadequate response to the HB vaccine and detect the risk factors associated with the lack of immunological response to HB vaccine.
Methodology: This was a cross-sectional prospective descriptive observational study with analytical component. Adult patients with CRD receiving hemodialysis treatment three times a week in the National Hospital of Itauguá during 2015 were included. Anti-HBsAg was determined in all of them.
Results: Eighty nine patients were included and 47% of them had inadequate response to HB vaccine with a slight predominance of men.
Conclusions: The frequency of inadequate response to the vaccine was 47%. Age, smoking habits, co-morbidities and nutritional state by BMI were non-significant risk factors in the inadequate response to HB vaccine while years of hemodialysis and uremia were significantly related to this bad response.
Keywords: chronic renal disease, anti-HBsAg, hepatitis B vaccine, hemodialysis
Antecedentes
La hepatitis B (HB) afecta a más de dos billones de personas en todo el mundo, muchos de ellos con secuelas como la hepatitis crónica (20%) o mueren por cirrosis o carcinoma hepatocelular (0,03 a 0,06%)1. El Paraguay es un país de riesgo intermedio de HB crónica: 2-7%2. A pesar del uso de vacunas contra el virus HB y las medidas preventivas, esta infección sigue siendo un importante problema de salud global, incluyendo a los pacientes en hemodiálisis3.
Los pacientes con insuficiencia renal crónica (ERC) se encuentran con mayor riesgo de adquirir el virus HB de equipos de diálisis compartida, por aumento de la exposición a los productos de sangre y la inmunodeficiencia asociada con ERC4,5.
En los años sesenta y setenta, la HB constituyó un grave problema en las unidades de HD. En las últimas décadas, la incidencia de la infección por el virus de la HB en este grupo de pacientes ha disminuido notablemente debido a los mejores métodos de estudio, a los controles más estrictos de los bancos de sangre, a los menores requerimientos transfusionales desde la disponibilidad de la eritropoyetina, a la optimización de la hemodiálisis de los pacientes infectados por el virus de la HB y al uso extensivo de la vacunación6. No obstante, los repetidos brotes de infección por el VHB en pacientes no vacunados subrayan el continuo riesgo de infección en esta población2.
La vacuna contra la HB es segura y efectiva contra más del 90% de los serotipos y genotipos del virus de la HB7. Está indicada en adultos pertenecientes a grupos de riesgo: personal de salud, gestantes, hemodializados8, pacientes con hepatopatías crónicas9, hemofílicos, diabéticos, personas con promiscuidad sexual y adictos a drogas intravenosas10.
Se recomiendan 3 dosis separadas por 1 mes entre la 1° y 2° dosis y 6 meses entre la 2° y 3° dosis11,12. La aplicación recomendada en adultos es vía intramuscular, en el deltoides, pues la aplicación en el glúteo no genera niveles adecuados de anticuerpos13. Las reacciones adversas a esta vacuna son mínimas y autolimitadas. Tampoco se ha demostrado asociación de la vacuna con la esclerosis múltiple y afecciones reumatológicas7.
La vacunación es importante tanto para la prevención de adquirir el VHB en pacientes susceptibles y para la reducción de la fuente de pacientes infectados con el HBV11,12. La infección por el VHB sigue siendo una preocupación en poblaciones de diálisis, debido a que los programas de vacunación han tenido menos éxito en estas poblaciones que en la población general8. Las causas de la mala seroconversión en pacientes con ERC suele incluir malnutrición, uremia e inmunosupresión debida a insuficiencia renal 5,6,14.
La manera de detectar la respuesta a la vacuna es con la detección del anticuerpo contra el antígeno de superficie del virus HB (antiHBsAg)15. Los sujetos vacunados se clasifican según su respuesta inmunogénica en diversos grupos16-18:
<2,1 UI/mL: no respondedor
2,1-9,9 UI/mL: hiporrespondedor
10-100 UI/mL: poco respondedor
>100 UI/mL: buen respondedor
Es imposible predecir el estado de inmunoprotección sin tener un dosaje de antiHBs17. La causa de la falta de respuesta a la vacuna no está bien aclarada pero se ha demostrado que está ligado a genes del Complejo Mayor de Histocompatibilidad, sobre todo HLA-DR7, DR3, DQ2y DP1119. Este gen impediría a los linfocitos T helper 1 reaccionar a la vacuna contra HB produciendo adecuados niveles de interleukina-2, interferón gamma e interleukina-1020. Este defecto no se asocia a infecciones típicas de los inmunodeprimidos y responden muy bien a otras vacunas como el toxoide tetánico y la vacuna contra el herpes virus21. Estos genes son propios de los celiacos y explicarían la posibilidad que los mismos sean poco respondedores22.
La respuesta inmunológica a la vacuna de la HB se correlaciona con el grado de insuficiencia renal, con una mayor respuesta en pacientes con insuficiencia renal crónica en etapa de prediálisis, por lo que es más aconsejable una vacunación precoz en esta fase de la enfermedad renal4,11. Por el contrario, en los pacientes en hemodiálisis, la respuesta a la vacuna de la HB es muy variable y menor que en la población general, con una respuesta incluso por debajo del 50% con la administración de tres dosis de vacuna y algo superior con la administración de cuatro dosis23-26. Además, la persistencia de la respuesta inmunológica también es más baja, con una rápida disminución de los títulos de anticuerpos protectores en muchos de estos pacientes6.
La estrategia ante un sujeto no respondedor es determinar la presencia del antígeno de superficie del virus HB (HBsAg) y el anticuerpo contra el core del virus HB (antiHBc IgM)15,18. Si uno o ambos marcadores salen positivos, se asume la presencia de una HB crónica, ya no se requiere revacunar y debería remitirse al Gastroenterólogo para evaluar su situación clínica15. De confirmarse una hepatitis crónica, existen antivirales efectivos que reducen el riesgo de cirrosis y hepatocarcinoma7,15,18. Pero si ambos salen negativos se descarta una infección por virus HB y ese sujeto es susceptible de adquirirla, por lo que debe revacunarse y tomar medidas de prevención apropiadas hasta tanto aparezcan los anticuerpos específicos7. Muchos de los estudios publicados sobre la vacuna de la HB en los pacientes en hemodiálisis se ha centrado sobre los resultados de la seroconversión de esta población, pero la información sobre la evolución de la inmunidad en los pacientes respondedores o en los que son revacunados es más limitada6. Se ha visto que los sujetos que responden con niveles elevados de antiHBsAg tras la primera serie de vacuna contra HB, persistirán con esos valores altos por mucho tiempo27.
Pero los niveles de antiHBsAg declinan con el tiempo: más del 60% de las personas que inicialmente tuvieron una buena respuesta antigénica presentarán declinación antigénica en los sgtes. 15 años28. No existen investigaciones que demuestren claramente la frecuencia con que deban hacerse las dosis de refuerzo29.
No obstante, la respuesta inmune puede reactivarse ante una infección accidental por virus HB o con una dosis de refuerzo. Una medición de antiHBsAg posterior a una dosis de refuerzo determinará el estado verdadero de respuesta inmunológica: si es superior a 10 UI/mL detecta la indemnidad de la memoria inmunológica pero un valor menor requiere un esquema de vacunación completo. Si una nueva medición de antiHBsAg sigue baja, se confirma la presencia de un verdadero no respondedor. Estas son personas altamente susceptibles de adquirir HB y deberían hacerse chequeos frecuentes para detectarla y tratarla30.
La alta prevalencia de pacientes con ERC que acuden al Hospital Nacional para recibir tratamiento sustitutivo renal hace necesario identificar a estos individuos para valorar la respuesta inicial a la vacuna de la HB, los factores que influyen en dicha respuesta y la relación existente entre la respuesta inicial y el progresivo descenso de los anticuerpos, ya que se ha visto en la literatura que un gran porcentaje de estos pacientes no responden al esquema habitual de vacunación y se encuentran desprotegidos31,32.
Objetivos
- Determinar el nivel de antiHBsAg y hallar la prevalencia de respuesta inadecuada a la vacuna contra la HB en pacientes con ERC en tratamiento hemodialítico trisemanal del Servicio de Hemodiálisis del Departamento de Nefrología del Hospital Nacional de Itauguá.
- Detectar los factores de riesgo asociados a la falta de respuesta inmunológica a la vacuna contra HB en pacientes con ERC: edad, sexo, IMC, tiempo trascurrido entre la última dosis de vacuna HB, tabaquismo, valores de perfil renal, años de HD.
Material y métodos
Se aplicó un diseño observacional, descriptivo, prospectivo, de corte transverso, con componentes analíticos. La población de estudio estuvo constituida por pacientes con insuficiencia renal crónica en tratamiento hemodialítico trisemanal, de sexo masculino y femenino, mayores de edad, que acuden al Servicio de Hemodiálisis del Departamento de Nefrología del Hospital Nacional a partir durante el 2015. Se incluyeronsujetos con ERC en tratamiento hemodialítico trisemanal que firmaron el consentimiento informado. Se excluyeron a aquellos que nunca recibieron el esquema completo de la vacuna contra HB, a los conocidos portadores de estados de inmunosupresión (congénita o adquirida) o en quimioterapia y a los que tienen antecedente de haber padecido HB.
Se utilizó un muestreo no probabilístico, de casos consecutivos. Las variables medidas fueron las demográficas, los factores de riesgo (fecha de última dosis de vacuna contra HB, IMC, tabaquismo, diabetes mellitus, grado de insuficiencia renal crónica, años en tratamiento hemodialítico, estado de nutrición) y el nivel de antiHBsAg. Este nivel se utilizó para clasificar los tipos de respuesta: <2,1 UI/mL: no respondedor; 2,1-9,9 UI/mL: hiporrespondedor; 10-100 UI/mL: poco respondedor; >100 UI/mL: buen respondedor.
Para el reclutamiento se solicitó permiso al Director General y al Comité de Investigación del Hospital Nacional. Posteriormente se contactó con los interesados en someterse al estudio, se les explicó los objetivos de la investigación y se les leyó el consentimiento informado. Los que aceptaron participar fueron encuestados para determinar los factores de riesgo y medir el IMC. Posteriormente se realizó la detección de antiHBsAg en el Servicio de Inmunología del Dpto. de Laboratorio del Hospital Nacional, con el reactivo marca SIEMENS y procesado en el autoanalizador IMMULITE 2000. El método utilizado fue el inmunoensayo quimioluminiscente de dos pasos en fase sólida. La sensibilidad es <3,0 mUI/mL.
Todas las variables se registraron en planilla electrónica. Para determinar el riesgo se calculó el OR (IC 95%) utilizando la prueba chi2 del programa estadístico Epi Info 7®. Para analizar las variables cuantitativas se utilizó la prueba ANOVA o Kruskall Wallis. Se consideró significativa toda p<0,01.
El cálculo de tamaño de muestra se realizó con el programa estadístico Epi Dat 2.1®. Se esperó una prevalencia de no respondedores a la vacuna contra la HB de 40%6,8,18,19. Con un universo de 100 pacientes, precisión 5%, intervalo de confianza 95%, el tamaño mínimo calculado fue de 79 pacientes.
Los aspectos éticos fueron tenidos en cuenta ya que se mantuvo el anonimato de los sujetos del estudio. Todos los sujetos reclutados leyeron y firmaron la hoja de consentimiento informado. Se respetaron los Principios de la Bioética: todos los sujetos contactados tuvieron oportunidad de participar de la investigación, no se hizo discriminación por sexo, raza o creencia religiosa. Los resultados del análisis de antiHBsAg fueron entregados personalmente a los participantes. Si resultaban no respondedores a vacuna HB, se les aconsejó recibir un esquema completo y medición ulterior de antiHBsAg. Los análisis y vacunas son gratuitos en el Hospital Nacional. Los sujetos contactados podían negarse a participar del estudio sin que ello repercuta en su consulta al Hospital ni se altere el relacionamiento con los investigadores y otros médicos. Esta investigación fue aprobada por el Comité de ética de la Facultad de Medicina de la Universidad Nacional de Itapúa. No se declaran conflictos de interés comercial.
Resultados
Accedieron al estudio 94 pacientes con ERC. Predominó el sexo masculino con 63 casos (67%). El 98% de la muestra correspondió a la raza blanca, mientras que el 2% a la raza negra. La edad media en el sexo femenino fue 47,6 ±14,4 años y del sexo masculino 46,8 ±15 años. El hábito tabáquico se observó en 13 sujetos (14,89%).
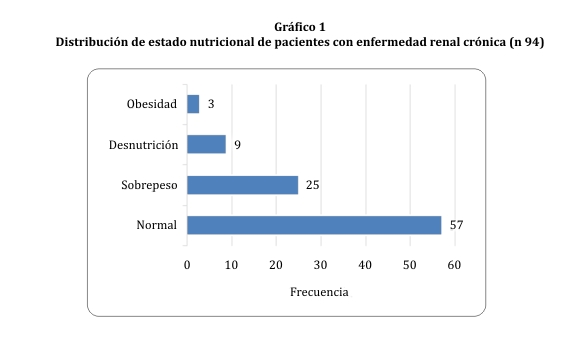
Según el IMC, en la población de estudio predominaron los pacientes con normopeso, seguido del grupo de sobrepeso, con un bajo predominio de los pesos extremos (gráfico 1).
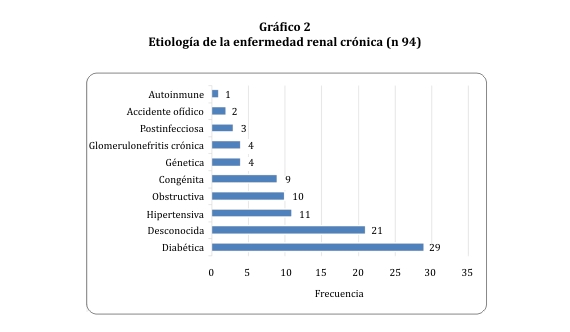
La etiología predominante de ERC fue la diabética (30,85%), seguida de la desconocida (22,34%) (gráfico 2).
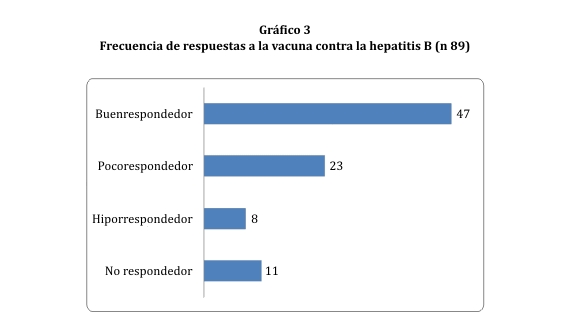
De las 94 muestras tomadas, se recibieron 89 resultados de antiHBsAg, con valores dispares. Se utilizaron las sgtes. definiciones: <2,1 UI/mL: no respondedor; 2,1-9,9 UI/mL: hiporrespondedor; 10-100 UI/mL: poco respondedor; >100 UI/mL: buen respondedor. Así se halló una prevalencia de buen respondedor en 52,8% (gráfico 3).
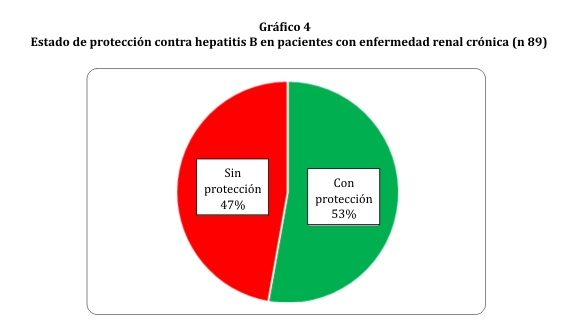
Se reagruparon los no respondedores, hiporrespondedores y poco respondedores usando como punto de corte un valor de antiHBsAg <100 UI/mL, obteniéndose así 42 sujetos sin protección adecuada (47%) y 47 (53%) buenos respondedores a la vacuna contra HB (gráfico 4).
Se observó un leve predominio de no respondedores a la vacuna contra el VHB en el sexo masculino: RR 1,2 (IC 95% 0,8 - 1,8) (p 0,2 prueba chi2). La edad media en los respondedores fue 45,7±15,3 años y en los no respondedores fue 49,5±13,9 años (p 0,2 prueba ANOVA). La media del IMC en pacientes con protección fue 24,8 ±3,7 kg/m2 y en aquellos sin protección fue 24,9 ±4,3 kg/m2 (p 0,9 prueba ANOVA).
El tabaquismo no resultó ser factor de riesgo significativo para una respuesta no favorable a la vacunación contra la HB: RR: 1,2 (IC 95% 0,8 - 1,9) (p 0,3 prueba chi2). Relacionando la diabetes mellitus con el estado de protección se obtuvo un RR 1,02 (IC 95% 0,6 - 1,5) (p 0,9 prueba chi2). Para la hipertensión arterial se calculó RR 1,1 (IC 95% 0,7 - 1,9) (p 0,7 prueba chi2).
La uremia media en los pacientes sin protección fue 138,3±27 mg/dL, mientras que en los pacientes con protección fue 153,2 ±28,7 mg/dL (p 0,01 prueba ANOVA).
Con respecto a los años de hemodiálisis, entre los pacientes respondedores la media fue 6,6±4,7 años, mientras que los no respondedores fue 4,8±3,6 años (p 0,05 prueba ANOVA).
No se obtuvieron datos fiables de la cantidad de dosis recibidas de vacuna contra la HB ni el tiempo transcurrido entre la última dosis de la vacuna y la toma de muestra para el dosaje de antiHBsAg.
Discusión
Un estudio previo sobre la etiología de la ERC en el Paraguay refiere 70% a causas desconocidas y 15% a la nefropatía diabética, datos que contrastan con los hallazgos de este estudio33.
Aún hoy día existen controversias acerca de la efectividad de la vacuna contra la HB en pacientes en tratamiento hemodialítico, pero debido a que estos pacientes se encuentran en situación de riesgo de contraer esta infección viral, su uso se ha generalizado en esta población de pacientes34.
En esta investigación, el 53% de los pacientes vacunados desarrolla respuesta adecuada, cifra que coincide con resultados de otros estudios6,18,19,24. No obstante, se debería esperar cifras mayores de respuesta adecuada. La respuesta inadecuada está relacionada con un déficit de la inmunidad, que es característica de la ERC avanzada35,36. En sujetos no respondedores, un nuevo esquema de vacunación logra alcanzar valores adecuados de antiHBsAg en 19%6.
Hay correlación entre el grado de insuficiencia renal y las alteraciones inmunitarias observadas en los casos de uremia26. También se han identificado otros factores que afectan esta respuesta de forma negativa, como la edad, la diabetes mellitus, la desnutrición y la duración de la diálisis, entre otros6. En esta investigación, la falta de respuesta a la vacuna estuvo relacionada con el aumento de la edad, pero de manera no significativa. Además se observó un leve predominio de no respondedores en el sexo masculino, que contrasta con estudios realizados en Sudamérica18. Tal vez esta diferencia se deba a otros factores no evaluados en esta muestra como el nivel de ferritina18.
Los años de hemodiálisis se relacionaron de manera significativa con el estado de protección, de modo a que los pacientes respondedores tenían una media mayor que los no respondedores. Si bien es natural que con el paso de los años exista una declinación en los niveles de anticuerpos24, el fenómeno inverso observado en este estudio podría explicarse por la mayor tasa de revacunaciones que se realiza en el Hospital Nacional.
El hallazgo de que los pacientes respondedores presentaban una promedio mayor de uremia no parece razonable, pero es bien sabido que la misma depende de muchos factores, por ejemplo de los estados catabólicos y nutricionales. Este tema queda pendiente para investigaciones posteriores.
No hubo diferencias significativas entre las medias de IMC de pacientes respondedores y no respondedores, a pesar de que se ha visto en otros estudios que los pacientes desnutridos tienen una menor respuesta10. Esto puede deberse a que esta muestra tuvo baja frecuencia de este grupo de pacientes. Por el contrario, otros factores, como la presencia de diabetes mellitus e hipertensión arterial, no influyeron en la respuesta de esta muestra, así como está descrito en la literatura18.
Entre las limitaciones de este estudio se debe tener en cuenta que no fue posible evaluar la transferencia pasiva de anticuerpos a través de transfusiones sanguíneas previas, que estos sujetos reciben de manera frecuente por la anemia secundaria a su patología. Además, no se ha podido medir directamente la tasa de adhesión completa al calendario de vacunación, ya que este procedimiento no se realiza en el Servicio de Hemodiálisis, sino en el vacunatorio del Departamento de Pediatría, de donde se han recogido algunos datos pero que resultaron insuficientes para determinar la relación existente entre el esquema recibido y la respuesta inmunológica a la vacuna.
En base a estos hallazgos, se recomienda:- Se debería iniciar la vacunación a pacientes con ERC en la etapa predialítica, ya que se observa una mejor respuesta en este periodo evolutivo23,37,38.
- Utilizar dosis doble de vacuna en pacientes con ERC, ya que se ha visto una mejor respuesta con ese esquema 39,40.
- Se debería buscar otros métodos para intentar mejorar la respuesta a la vacuna contra la HB, como por ejemplo usando otras vías de administración o diferentes coadyuvantes19,39.
- La limitación del registro deficiente del esquema de vacunación puede ser minimizada si se ingresan inmediatamente los datos de la tarjeta de vacunación en un registro electrónico en el Servicio de Hemodiálisis para un mejor seguimiento del paciente.
- No hay consenso acerca del tiempo que se debe esperar para el control serológico del anticuerpo para valorar la respuesta antigénica, pero es recomendable realizar controles semestrales o anuales, debido al alto riesgo de adquirir HB que conlleva el tratamiento hemodialítico.
Concluyendo, en esta muestra predominó el sexo masculino (67%), de raza blanca (98%) y con predominio de la nefropatía de origen diabético (30,89%). La frecuencia de respuesta inadecuada a la vacuna contra la HB fue 47%. No se detectaron factores de riesgo estadísticamente significativos para la falta de respuesta a la vacuna contra la HB.
Referencias bibliográficas
1. Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat. 2004 Mar;11(2):97-107. [ Links ]
2. Mast EE, Weinbaum CM, Fiore AE, Alter MJ, Bell BP, Finelli L, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep. 2006 Dec 8;55(RR-16):1-33. [ Links ]
3. Zampino R, Boemio A, Sagnelli C, Alessio L, Adinolfi LE, Sagnelli E, Coppola N. Hepatitis B virus burden in developing countries. World J Gastroenterol. 2015 Nov 14;21(42):11941-53. [ Links ]
4. European Best Practice Guidelines Expert Group on Hemodialysis, European Renal Association. Section VI. Haemodialysis-associated infection. Nephrol Dial Transplant. 2002;17 Suppl 7:72-87. [ Links ]
5. Fehr T, Ambühl PM. Chronic hepatitis virus infections in patients on renal replacement therapy. Nephrol Dial Transplant. 2004 May;19(5):1049-53. [ Links ]
6. Pin M, Compte MT, Angelet P, Gállego C, Gutiérrez C, Martinez Vea A. Long-term evaluation of immune response to hepatitis B vaccine in 136 patients undergoing hemodialysis. Nefrologia. 2009;29(5):415-20. [ Links ]
7. Pottie K, Greenaway C, Feightner J, Welch V, Swinkels H, Rashid M, et al. Evidence-based clinical guidelines for immigrants and refugees. CMAJ. 2011 Sep 6;183(12):E824-925. [ Links ]
8. Schroth RJ, Hitchon CA, Uhanova J, Noreddin A, Taback SP, Moffatt ME, Zacharias JM. Hepatitis B vaccination for patients with chronic renal failure. Cochrane Database Syst Rev. 2004;(3):CD003775. [ Links ]
9. Thudi K, Yadav D, Sweeney K, Behari J. Physicians infrequently adhere to hepatitis vaccination guidelines for chronic liver disease. PLoS One. 2013 Jul 26;8(7):e71124. [ Links ]
10. Annunziata K, Rak A, Del Buono H, DiBonaventura M, Krishnarajah G. Vaccination rates among the general adult population and high-risk groups in the United States. PLoS One. 2012;7(11):e50553. [ Links ]
11. Launay O, Floret D. Hepatitis B vaccination: a review. Med Sci (Paris). 2015 May;31(5):551-8 [ Links ]
12. Pham H, Geraci SA, Burton MJ; CDC Advisory Committee on Immunization Practices. Adult immunizations: update on recommendations. Am J Med. 2011 Aug;124(8):698-701. [ Links ]
13. Chen W, Gluud C. Vaccines for preventing hepatitis B in health-care workers. Cochrane Database Syst Rev. 2005 Oct 19;(4):CD000100. [ Links ]
14. Einollahi B. Immune response to hepatitis B vaccine in patients with chronic kidney disease. Hepat Mon. 2011 Oct;11(10):781-2. [ Links ]
15. Davison SA, Strasser SI. Ordering and interpreting hepatitis B serology. BMJ. 2014 Apr 17;348:g2522. [ Links ]
16. García C. Patricia, De La Cerda S. Gabriela, Calvo A. Mario, Godoy G. Rosa, Covarrubias F. Carmen, Potin S. Marcela et al. Inmunogenicidad de una vacuna recombinante anti hepatitis B en personal de salud. Rev. chil. infectol. (Internet). 2002 ( citado 2016 Ene 09) ; 19( 3 ): 133-139. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182002000300001&lng=es. [ Links ]
17. Pérez-López JA, García-Elorriaga G, Del Rey-Pineda G, Manjarrez-Téllez B. Antibodies against hepatitis B after vaccination in health workers. Salud Publica Mex. 2011 May-Jun;53(3):205-6. [ Links ]
18. Pereira ZT, Mendoza-Sassi RA. Factors associated with the immune response to hepatitis B vaccine in Brazilian hemodialysis patients. Rev Med Chil. 2012 Jul;140(7):882-8. [ Links ]
19. Roukens AH, Visser LG. Hepatitis B vaccination strategy in vaccine low and non-responders: a matter of quantity of quality? Hum Vaccin. 2011 Jun;7(6):654-7. [ Links ]
20. Yen YH, Chen CH, Wang JH, Lee CM, Changchien CS, Lu SN. Study of hepatitis B (HB) vaccine non-responsiveness among health care workers from an endemic area (Taiwan). Liver Int. 2005 Dec;25(6):1162-8. [ Links ]
21. Lin CS, Xie SB, Liu J, Zhao ZX, Chong YT, Gao ZL. Effect of revaccination using different schemes among adults with low or undetectable anti-HBs titers after hepatitis B virus vaccination. Clin Vaccine Immunol. 2010 Oct;17(10):1548-51. [ Links ]
22. Odinsen O, Owusu-Ofori S, Dompreh A, Sarkodie F, Opare-Sem O, Parker D, Allain JP. Antibody detection and kinetics of antibody production during early stages of immunization with hepatitis B virus vaccine. Clin Vaccine Immunol 2007 Dec;14(12): 1623-8. [ Links ]
23. Torres Sánchez MJ,Peña Ortega M,Ramírez Gómez M,Pérez Marfil A,Morales A,Balaguer Alberti G,Osuna Ortega A.La vacuna frente al virus de la hepatitis B ¿cuál es la mejor pauta en los pacientes en hemodiálisis? Dial Traspl. 2015;36(2):57-57. [ Links ]
24. Peces R. Inmunización frente a la hepatitis B y persistencia de memoria inmunológica. Nefrología 2002;22(6):503-506 [ Links ]
25. Dinits-Pensy M, Forrest GN, Cross AS, Hise MK. The use of vaccines in adult patients with renal disease. Am J Kidney Dis 2005;46(6):997-1011 [ Links ]
26. Zhang L, Liu J, Lu J, Yan B, Song L, Li L, Cui F, Zhang G, Wang F, Liang X, Xu A. Antibody response to revaccination among adult non-responders to primary Hepatitis B vaccination in China. Hum Vaccin Immunother. 2015 Nov 2;11(11):2716-22. [ Links ]
27. Lopes MH, Sartori AM, Souza TV, Mascheretti M, Chaves Tdo S. Hepatitis B revaccination for healthcare workers who are anti-HBs-negative after receiving a primary vaccination series. Rev Soc Bras Med Trop. 2012 Oct;45(5):639-42. [ Links ]
28. McMahon BJ, Dentinger CM, Bruden D, Zanis C, Peters H, Hurlburt D,et al. Antibody levels and protection after hepatitis B vaccine: results of a 22-year follow-up study and response to a booster dose. J Infect Dis. 2009 Nov 1;200(9):1390-6. [ Links ]
29. Spradling PR, Xing J, Williams R, Masunu-Faleafaga Y, Dulski T, Mahamud A, et al. Immunity to hepatitis B virus (HBV) infection two decades after implementation of universal infant HBV vaccination: association of detectable residual antibodies and response to a single HBV challenge dose. Clin Vaccine Immunol. 2013 Apr;20(4):559-61. [ Links ]
30. Wang L, Wang K, Zou ZQ. Crosstalk between innate and adaptive immunity in hepatitis B virus infection. World J Hepatol. 2015 Dec 28;7(30):2980-91. [ Links ]
31. Mathew RO, Mason DL, Song R, Tryniszewski T, Kennedy JS. Role of T-regulatory cells in the response to hepatitis B vaccine in hemodialysis patients. Hemodial Int. 2015 Jun 23. [ Links ]
32. Hashemi B, Mahdavi-Mazdeh M, Abbasi M, Hosseini-Moghaddam SM, Zinat NH, Ahmadi F. Efficacy of HBV vaccination in various stages of chronic kidney disease: is earlier better? Hepat Mon. 2011 Oct;11(10):816-20. [ Links ]
33. Santa Cruz F, Cabrera W, Barreto S, Mayor MM, Báez D. Kidney disease in Paraguay. Kidney Int Suppl. 2005 Aug;(97):S120-5. [ Links ]
34. Finelli L, Millar JT, Tokars JI, Alter MJ, Arduino MJ. Nacional Surveillance of dialysis-associated diseases in the United Status, 2002. Semin Dial. 2005 Jan-Feb;18(1):52-61. [ Links ]
35. Fabrizi F, Bunnapradis S, Martin P. HBV infection in patients with end-stage renal disease. Semin Liver Dis 2004;24 Suppl 1:63-70. [ Links ]
36. Tang S, Lai KN. Chronic viral hepatitis in hemodialysis patients. Hemodial Int. 2005 Apr;9(2):169-79. [ Links ]
37. Tong NK, Beran J, Kee SA, Miguel JL, Sánchez C, Bayas JM, et al. Immunogenicity and safety of an adjuvanted hepatitis B vaccine in pre-hemodialysis and hemodialysis patients. Kidney Int. 2005 Nov;68(5):2298-303. [ Links ]
38. Janus N, Vacher LV, Karie S, Ledneva E, Deray G. Vaccination and chronic kidney disease. Nephrol Dial Transplant. 2008 Mar;23(3):800-7. [ Links ]
39. Walayat S, Ahmed Z, Daniel Martin, Puli S, Cashman M, Dhillon S. Recent advances in vaccination of non-responders to standard dose hepatitis B virus vaccine. World J Hepatol 2015; 7(24): 2503-2509. [ Links ]
40. Bonazzi PR, Bacchella T, Freitas AC, Osaki KT, Lopes MH, Freire MP, Machado MC, Abdala E. Double-dose hepatitis B vaccination in cirrhotic patients on a liver transplant waiting list. Braz J Infect Dis. 2008 Aug;12(4):306-9. [ Links ]
Artículo recibido: 2 enero 2016 Artículo aceptado: 3 febrero 2016
Autor correspondiente:
Dr. Nelson López
Dirección: Hospital Nacional (Itauguá, Paraguay)
Teléfono: (+595) 974 169808
Correo electrónico: ng_lopez_g@hotmail.com
1Facultad de Medicina. Universidad Nacional de Itapúa (Encarnación, Paraguay)
2Departamento de Medicina Interna. Hospital Nacional (Itauguá, Paraguay)