Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Virtual de la Sociedad Paraguaya de Medicina Interna
versão On-line ISSN 2312-3893
Rev. virtual Soc. Parag. Med. Int. vol.1 no.2 Asunción set. 2014
https://doi.org/10.18004/rvspmi/2312-3893/2014.01(02)42-053
ARTÍCULO ORIGINAL
Insuficiencia respiratoria aguda en el Síndrome de Guillain Barré
Acute respiratory insufficiency in the Guillain-Barré Syndrome
Autores: Dr. Víctor Hugo Cabanellas López1, Dr. Víctor Hernán Martínez1, Dr. Roberto Andrés Yubero1, Dra. Laura Céspedes2
Resumen
Introducción: el síndrome de Guillain Barré (SGB) frecuentemente afecta a los músculos respiratorios por lo que el ingreso de pacientes afectos de esta patología debe ser a una sala de Terapia Intensiva para monitoreo y asistencia respiratoria mecánica.
Objetivo: determinar las características clínicas y complicaciones de los pacientes con SGB ingresados a terapia intensiva.
Material y métodos: diseño observacional descriptivo retrospectivo que incluyó a varones y mujeres, mayores de edad, portadores de SGB, ingresados al Departamento de Medicina Interna del Hospital Nacional entre abril 2000 y agosto 2013. Se describen la necesidad de asistencia respiratoria mecánica (ARM), las complicaciones asociadas y el desenlace.
Resultados: se incluyeron 35 pacientes, con predominio del sexo masculino (65%). Los eventos desencadentes del SGB más frecuentes fueron las infecciones respiratorias (31%) y las vacunaciones (25%). La insuficiencia respiratoria aguda se presentó en 42%. La neumonía asociada a respirador fue la complicación prevalente y la mortalidad global fue 8,5%.
Palabras claves: síndrome de Guillain Barré, asistencia respiratoria mecánica, insuficiencia respiratoria aguda
Abstract
Introduction: Guillain-Barré syndrome (GBS) frequently affects respiratory muscles and thus, patients with this pathology have to be admitted into Intensive Care Unit for monitoring and mechanical respiratory support.
Objective: To determine the clinical characteristics and complications of GBS patients admitted into intensive care.
Material and methods: Retrospective descriptive observational design that included adult men and women, carriers of GBS, and admitted into the Department of Internal Medicine of the National Hospital between April, 2000 and August, 2013. The need of mechanical respiratory support (MPS), associated complications and outcome are described.
Results: Thirty five patients were included, with majority of men (65%). The most frequent triggering events of GBS were respiratory infections (31%) and vaccinations (25%). Acute respiratory insufficiency was seen in 42% of the cases. Ventilator associated pneumonia was the prevailing complication and global mortality was 8.5%.
Keywords: Guillain-Barré, mechanical respiratory support, acute respiratory insufficiency
Introducción
El síndrome de Guillain Barré (SGB) es el epónimo para un grupo heterogéneo de neuropatías periféricas mediada inmunológicamente.1,2 Se describen varios subtipos: el 90-95% de los casos corresponde a una polirradiculopatía desmielinizante, presentación más frecuente en Europa y Estados Unidos, caracterizándose por un cambio desmielinizante secundario a infiltración de las células T, macrófagos y daño axonal secundario. La forma axonal, en cambio, es más frecuente en Asia y América y se caracteriza por la presencia de anticuerpos dirigidos al axón.3,4 El síndrome de Miller Fisher, consistente en oftalmoplejía, ataxia y arreflexia, fue reportado en 1956 como una variante del SGB, debido a que el líquido cefalorraquídeo de los pacientes afectados exhibían disociación albúmino citológica.5
Los estudios epidemiológicos han sugerido la existencia de variaciones estacionales y geográficas en la incidencia del síndrome sin poder establecer patrones consistentes en todas las poblaciones. La mayoría de estos estudios provienen de los Estados Unidos y Europa, lo que evidencia la falta de información sobre otras regiones del mundo.6
La incidencia bruta reportada en América del Norte y Europa varió desde 0,81 hasta 1,89 (mediana 1,11) casos por cada 100.000 personas/año.7 Esta tasa aumenta exponencialmente con la edad, y es reseñable que la incidencia se ve incrementada con la edad, a razón de un 20% por cada década transcurrida.7 La proporción de hombres y mujeres con el síndrome es de 1,78 (IC95% 1,36-2,33). Dos tercios de los casos son precedidos por síntomas de infección del tracto respiratorio superior o diarrea.8
Un estudio realizado en México halló que 56% tuvo antecedente infeccioso en las 4 semanas previas y que las variedades axonales presentaron estancia hospitalaria más prolongada (21,7 vs 10,9 días, p 0,008) y una tendencia a mayor necesidad de ventilación mecánica (33% vs 0%, p 0,12).9 Existe una gran diversidad en los reportes de eventos precedentes al SGB. En más del 60% de los pacientes el inicio del cuadro clínico está precedido, en un período de 1-4 semanas, por un evento respiratorio o digestivo, generalmente de naturaleza infecciosa vírica o bacteriana.10 Se sugiere que tanto las infecciones bacterianas (Campylobacter jejuni y Mycoplasma pneumoniae, entre otros) como víricas (citomegalovirus, virus de Epstein-Barr, etc) pueden desencadenar el síndrome.10 Se ha notificado la ocurrencia del SGB posterior a eventos no infecciosos, tales como vacunación, instrumentación quirúrgica, posparto.10
El virus del dengue, como agente causal desencadenante de SGB, adquiere también importancia en el Paraguay. Rojas y colaboradores del Hospital Nacional (Itauguá, Paraguay), han reportado dos pacientes con parálisis aguda fláccida y arrefléctica iniciada en la siguiente semana de dengue confirmado por serología. Ambos tuvieron notable recuperación tras el tratamiento con inmunoglobulina humana.11
Se estima que el riesgo de desarrollar SGB después de recibir la vacuna de la influenza estacional, se encuentra incrementado por un factor de 1,7 dentro de las primeras seis semanas posteriores a la vacunación. Esto se puede traducir en un caso adicional de SGB por cada millón de vacunas.13 El riesgo fue mayor cuando se utilizó la vacuna de origen porcino, en el periodo de vacunación norteamericano de 1976-1977, donde el riesgo se incrementó por un factor entre 4 y 8, es decir, alrededor de 8 ,8 casos de SGB por millón de vacunas, con un riesgo relativo estimado entre 4,9 y 11,7 casos por un millón de adultos vacunados.13 Tipos específicos del antígeno leucocitario humano (HLA) se han encontrado en pacientes con subtipos axonales y desmielinizantes de SGB, sugiriendo una predisposición genética que contribuiría a la inmunopatogénesis.14 Sin embargo, la incidencia familiar de este síndrome es rara, pues no se observó predilección de género ni edad.14
El SGB es en realidad un grupo de cuadros clínicos más que una entidad aislada, lo cual se refleja también en la fisiopatología. Los microorganismos y las estructuras neuronales afectadas comparten determinantes antigénicos, lo que facilita la ocurrencia del mimetismo molecular. Campylobacter jejuni expresa lipooligosacáridos en su pared bacteriana, similares a los gangliósidos que se encuentran en las fibras del los nervios periféricos, ocasionando una reacción cruzada.15,16
Los anticuerpos dirigidos contra los gangliósidos (anti-GM1, anti-GM1-b y anti-GalNac-GD1a) situados en el nodo de Ranvier, bloquean los canales de sodio dependientes de voltaje y suprimen la propagación de los potenciales de acción en el SGB.17,18
La polirradiculopatía inflamatoria aguda desmielinizante es la forma clínica clásica y supone alrededor del 85-90% de los pacientes con SGB en Norteamérica y Europa.19-23
La polirradiculopatía inflamatoria aguda axonal motora y sensitiva es un trastorno más grave que causa degeneración axonal motora y sensitiva con mínima o nula desmielinización, la recuperación es más lenta.21
En un estudio publicado por Cuadro y col en el 2011, constataron que un compromiso predominantemente axonal se asoció con la presencia de insuficiencia respiratoria (p 0,02) concomitantemente no hubo una asociación entre el patrón axonal y presencia de trastornos deglutorios.20
El síndrome de Miller-Fisher (SMF) se caracteriza por la presencia de la tríada oftalmoplejía, ataxia y arreflexia. Está desencadenado por ciertas cepas de C. jejuni, que inducen la formación de anticuerpo antigangliósido GQ1b, o por H. influenzae.21 Estos anticuerpos reconocen epítopos que se expresan específicamente en las regiones nodales de los nervios oculomotores, en los ganglios dorsales y en neuronas cerebelosas, estructuras responsables de la sintomatología del SMF.21
Existe un concepto erróneo de que el SGB tiene un buen pronóstico pues 20% de los pacientes quedan secuelas severas y aproximadamente 5% del total de los casos fallecen, pese a la inmunoterapia.24 En la mayoría de los pacientes es necesaria la hospitalización y un 30% requiere ventilación asistida en algún momento de la enfermedad.25,26
Los criterios diagnósticos fueron aceptados fueron adaptados por Asbury y Cornblath:30
1. Rasgos requeridos para el diagnóstico:
a. debilidad progresiva de brazos y piernas
b. arreflexia osteotendinosa
2. Rasgos que apoyan firmemente el diagnóstico:
a. progresión de los síntomas de dísa a 4 semanas
b. simetría relativa; la absoluta es rara pero si un miembro está afectado, el otro lo estarpía en menor o mayor grado
c. síntomas o signos sensitivos leves
d. afectación de los nervios craneales: facial bilateral, oculomotores, etc
e. comienzo de la recuperación entre la semana 2 y 4
f. disfunción autonómica
g. ausencia de fiebre al inicio de la enfermedad
h. elevación de la concentración de proteínas en el líquido cefaloraquídeo (LCR) con menos de 10 células/mm3
i. hallazgos típicos en los estudios neurofisiologicos
3. Rasgos dudosos que excluyen el diagnóstico:
a. presencia de un nivel sensitivo nítido
b. marcada o persistente asimetría de los síntomas o signos
c. disfunción esfinteriana persistente y grave
d. más de 50 células/mm3 en LCR
4. Rasgos que excluyen el diagnóstico:
a. diagnóstico de botulismo, miastenia gravis, polimiositis, neuropatía tóxica.
b. transtorno en el metabolismo de las porfirinas
c. difteria reciente
d. sindrome sensitivo puro sin debilidad
e. la progresión de la enfermedad durante más de dos meses sería una polirradiculopatia crónica inflamatoria desmielinizante.
Estos criterios han sido ampliamente criticados por ser sólo aplicables a la forma típica de síndrome pero pueden orientar en cierta medida al diagnóstico.27 La disociación albúmina-citológica, pilar importante para la confirmación diagnóstica del SGB, se expresa casi invariablemente sólo en la segunda semana en la enfermedad clásica y en la tercera en el SMF.28
El estudio neurofisiológico tiene mayor rendimiento a partir de la segunda semana, principalmente al detectar abolición del reflejo H, que corrobora el compromiso radicular y el enlentecimiento de la velocidad de conducción nerviosa que se observa en la AIDP y el SMF.28 Sin embargo, otros hallazgos neurofisiológicos importantes, como el bloqueo de conducción y el aumento de la latencia distal o abolición de la onda F pueden aparecer en la primera semana de evolución de la enfermedad,facilitando así el diagnóstico más precoz del SGB.28
Los estudios electrodiagnósticos son herramientas útiles en el diagnóstico y en la diferenciación entre la variedad desmielinizante del SGB que responde al tratamiento y que posee un mejor pronóstico.30,31 Los criterios de electrodiagnóstico del Dutch Guillain Barre study group criteria consideran que debe presentar solo una de las siguientes anormalidades en al menos dos nervios:
1. aumento en la latencia motora distal > 150% o mayor al límite de lo normal
2. disminución en la velocidad de conducción < 70% o menor al límite normal
3. aumento de la latencia de la onda F > 150 por encima del límite de lo normal
4. disminución compuesta de la amplitud del potencial de acción muscular superior al límite de lo normal.32,33
Todo paciente con sospecha de SGB debe ser ingresado en un hospital con Servicio de Neurología y Unidad de Terapia Intensiva (UTI) aunque el déficit sea mínimo, especialmente si la evolución del evento es de pocos días, ya que los síntomas suele alcanzar el mayor grado de intensidad dentro de las 2 primeras semanas tras el inicio del cuadro, dado que la neuropatía puede progresar rápidamente y la gravedad que puede alcanzar nunca se puede prever.34 Son criterios de ingreso en UTI el riesgo o situación de insuficiencia respiratoria con capacidad vital inferior a 15 ml/kg o inestabilidad autonómica.34 Dentro de los predictores clínico-fisiológicos de falla respiratoria se encuentran la debilidad motora en extremidades inferiores y superiores como síntoma inicial, la debilidad bulbar, la progresión temprana de la enfermedad, la disautonomía, la debilidad del nervio facial bilateral, así como la disminución de la capacidad vital respiratoria.35 Los predictores electrofisiológicos son: latencia prolongada, disminución de la amplitud del nervio frénico y amplitud reducida del potencial de acción compuesto muscular diafragmático. Además, los pacientes con SGB con características electrofisiológicas del tipo desmielinizante están en un riesgo mayor de presentar falla respiratoria y, por lo tanto, necesitar ventilación mecánica. La presencia de anticuerpos IgG anti-GQ1b son factores predictivos importantes de debilidad del músculo respiratorio en el SGB, así como el incremento de las enzimas hepáticas. Posponer la ventilación mecánica puede traer consecuencias fatales para los pacientes.36
Como tratamiento, la plasmaféresis y las inmunoglobulinas intravenosas son útiles y mejoran los resultados del tratamiento conservador.36 Entre ambas terapias no hay diferencias significativas, sin embargo, su empleo combinado en un mismo paciente no proporciona mayores ventajas. La elección de uno u otro se decidirá por la experiencia o facilidad de disposición de la plasmaféresis.36 En general es recomendable empezar con inmunoglobulinas y dejar la plasmaféresis como una alternativa ante un fracaso o recaida.36 La dosis recomendada de inmunoglobulina es 0,4 g/kg por 5 días consecutivos IV. La plasmaféresis se realiza con albúmina 200 a 250 ml/kg/día con cuatro o cinco recambios. En cuanto al uso de esteroides, la pulsoterapia de metilprednisolona (500 mg/día durante cinco días) no muestra mejoría respecto al placebo. Tampoco dan buen resultado los corticosteroides orales.36 Se produce recaída, empeoramiento 12 semanas tras la mejoría inicial, en 10 % de los pacientes, que pueden tratarse con nuevos recambios plasmáticos o nuevas dosis de inmunoglobulinas.37
Las complicaciones observadas en UTI son la hipoventilación, tromboembolismo pulmonar, arritmias cardíacas, inestabilidad cardíaca, hipertensión e insuficiencia cardíacas, infecciones pulmonares, recidivas.38 La mortalidad es 5-10% con cuidados intensivos, mayor del 25% sin cuidados intensivos. El 50% de los pacientes se recuperan totalmente entre seis y ocho semanas, el 25% se recupera totalmente a los 12 meses, el 20 % entre uno y dos años y sólo el 4-5 % tiene secuelas neurológicas tales como paresia de la donsiflexión del pie, parálisis faciales, parestesias y disestesias, recidiva en menos del 1%.38 Los pacientes con prolongada ventilación mecánica durante su estancia en la UTI presentan varias complicaciones que incluyen aspiraciones bronquiales, atelectasia, tromboembolia, contracturas, escaras de decúbito.39 La mortalidad en la UTI está generalmente relacionada a la complicaciones. Es relativamente baja pero la mortalidad se vuelve alta en pacientes ventilados siendo una de las causas más comunes la neumonía asociada al ventilador. A pesar del tratamiento medico, el SGB sigue siendo una condición severa: 3 -10% de los pacientes mueren y 20% todavía no puede caminar después de los 6 meses.39
Objetivo
Determinar las características clínicas y complicaciones de los pacientes con SGB ingresados al Dpto. de Medicina Interna.
Materiales y métodos
Diseño: observacional, descriptivo, retrospectivo, de corte transversal.
Población de estudio: Varones y mujeres mayores de edad con diagnóstico de SGB, ingresados al Departamento de Medicina Interna (Itauguá, Paraguay) entre abril del 2000 y agosto 2013.
Criterios de inclusión: diagnóstico de SGB confirmado por criterios clínicos, laboratoriales y/o electromiográficos
Criterios de exclusión: portadores de otras patologías que se manifiestan por debilidad neuromuscular
Muestreo: no probabílistico de casos consecutivos.
Variables: edad, sexo, días de internación, requerimiento de ventilacion mecánica, estado al alta, antecedente de infecciones o inmunizaciones previas, antecedente de cirugías previas, comorbilidades y hábitos tóxicos como tabaquismo y enolismo, complicaciones.
Reclutamiento: se revisaron las historias clínicas de todos los pacientes que ingresaron al Departamento de Medicina Interna cuyo diagnóstico de egreso fue SGB en el periodo de estudio.
Gestión de datos: se diseñó una hoja de recolección de datos para extraer la información obtenida de las historias clínicas, estudios laboratoriales y neurofisiológicos, que luego fueron trascriptos en una planilla electrónica. Las variables fueron descriptas usando el programa estadístico Epi Info 2000©.
Aspectos éticos. Se respetaron las normas éticas de la Declaración de Helsinki de 1975 en la versión revisada de 1983. Se preservó en el anonimato la identidad de los pacientes estudiados. Los diagnósticos fueron validados por médicos especialistas en Medicina Interna y Medicina Crítica.
Resultados
Se incluyeron 35 pacientes con diagnóstico confirmado de SGB. Hubo un predominio del sexo masculino: 22 casos ( 65,7%). La edad osciló entre 20 y 74 años, siendo la mediana 50 años.
Se llegó al diagnóstico teniendo en cuenta los sgtes. criterios:
1. clínica: todos los pacientes presentaron cuadro clínico compatible con SGB
2. punción lumbar a 32 pacientes: se constató disociación albúmino - citológica en 29 casos (83%) y LCR normal en 3 pacientes (17%)
3. electromiografía: fue realizada a 10 pacientes y todos concluyeron positivos para SGB.
Combinando los métodos auxiliares de diagnóstico, se obtuvieron los siguientes datos:
- Un caso con LCR normal pero con EMG positiva.
- Siete casos con LCR con disociación albúmino citológica + EMG positiva
- Dos casos con EMG positiva a quienes no se les realizó punción lumbar.
En un solo paciente se llegó al diagnóstico por el cuadro clínico.
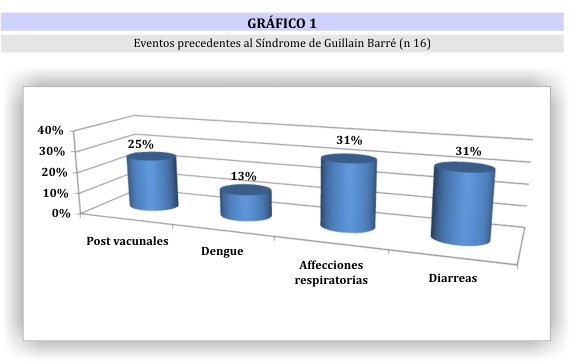
Se halló un evento precedente en 16 pacientes (45,71%), siendo los más frecuentes las diarreas y la infecciones respiratorias altas (31% cada uno) (gráfico 1). Las vacunas implicadas fueron: 1 antitetánica , 1 antirubeola y 2 antirrábicas.
Del total de estos 16 pacientes, 2 tuvieron más de 1 factor de riesgo implicado: un paciente con diarreas y dengue y otro con afección respiratoria y diarreas. Los dos casos de dengue fueron confirmados por serología IgM positiva.
La presentación clínica fue:
Los reflejos osteotendinosos fueron todos negativos, excepto en 1 paciente en quien el SGB se confirmó por electromiografía.
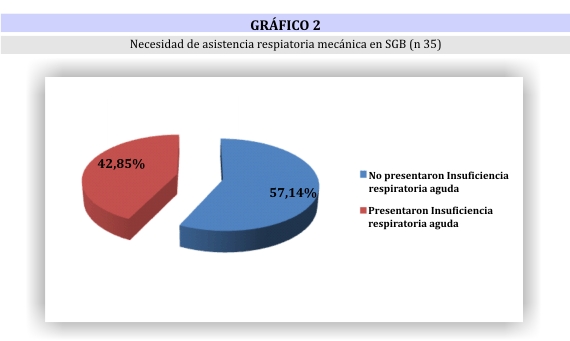
La insuficiencia respiratoria aguda se presentó en 15 pacientes (42,8%) (gráfico 2), de los cuales:
De los 12 pacientes internados en UTI del Hospital Nacional, 3 se sometieron a traqueostomía por ventilación prolongada. Las complicaciones observadas en UTI fueron: neumonía asociada a ventilador (11 casos), neumotórax (2 casos) y atelectasia (1 caso). Fallecieron 3 pacientes, que corresponden a 8,5% del total de pacientes incluidos en este estudio y a 25% de los sometidos a asistencia ventilatoria mecánica.
El relación al tratamiento recibido, 14 pacientes recibieron inmunoglobulinas y 1 de ellos recibió tratamiento combinado con corticoides.
Discusión
En estudio fallecieron 3 pacientes (8,5%), con lo que se registra mayor proporción en comparación a otras referencias.15 No obstante, al considerar la mortalidad en pacientes ingresados a UTI y sometidos a asistencia respiratoria mecánica, esa frecuencia aumentó a 25%, similar a la hallada en grandes series.3 En este estudio predominaron las infecciones nosocomiales, propias de la asistencia ventilatoria mecánica, muy común en estas situaciones.6
En cuanto a la incidencia, hemos objetivado predominio en la población adulta. Está descrito que la incidencia aumenta 20% por cada 10 años de edad de la población estudiada. La predominancia en el sexo masculino coincide con la literatura.7
Entre los eventos precedentes nuestros hallazgos concuerdan con la literatura en que la mayoría está ligada a un evento infeccioso previo, virico o bacteriano.10 Como dichos eventos previos se presentaron con antelación al ingreso, el aislamiento del organismo causal no se obtuvo en los registros hospitalarios con los que contamos al momento de realizar el presente trabajo. Sin embargo sí tenemos registros de 2 pacientes que desarrollaron el SGB posterior a un cuadro de dengue, claramente demostrado por Rojas y colaboradores.11 Existen muchos reportes que mencionan sobre casos post vacunación de la influenza13 aunque en nuestro estudio no hemos registrado casos post vacunación anti-influenza. Los casos registrados como eventos post vacunales señalan a la vacuna antitetánica (1 caso), antirubeola (1 caso) y antirrábica (2 casos), casualmente todos eran varones.
En ninguno de los casos fue posible la identificación de los anticuerpos causales, por limitaciones laboratoriales en nuestro medio.
Diversos autores describen el requerimiento ocasional de ARM en 30% de los pacientes.25,26 En este estudio la insuficiencia respiratoria se observó en 42,85% del total de los pacientes y de éstos 80% requirieron ARM.
Las complicaciones surgidas durante su estancia en UTI, tales como neumonías se presentaron en 11 pacientes de los 14 ingresados a ese servicio, lo que aumentó la morbi mortalidad de los pacientes.
La disociación albúmino citológica fue positiva en 82,85%, similar a los reportes de otros estudios.28 A los pacientes que tuvieron estudio de LCR, los estudios electromiográficos resultaron diagnósticos. Es de destacar que todos los pacientes de este estudio presentaban cuadro clínico de SGB.
Se realizó tratamiento con inmunoglobulinas en 14 pacientes (40% de los casos) pues el acceso a esta medicación no es constante en el hospital. La plasmaféresis no se realiza en nuestro centro.
Se recomienda un diagnóstico clínico certero y el apoyo laboratorial de la punción lumbar en tiempo oportuno pues agiliza el inicio del tratamiento adecuado y con ello se evita la progresión de la enfermedad, optimizando la recuperación del paciente, disminuyendo la estancia hospitalaria y todas las probables complicaciones que podrían surgir a partir de ella.
En conclusión, los eventos desencadentes del SGB más frecuentes fueron las infecciones respiratorias (31%) y las vacunaciones (25%). La insuficiencia respiratoria aguda se presentó en 42%. La neumonía asociada a respirador fue la complicación prevalente y la mortalidad global fue 8,5%.
Referencias bibliográficas
1. Yuki N, Hartung HP. Guillain-Barré syndrome. N Engl J Med. 2012 Jun 14; 366(24):2294-304. [ Links ]
2. Ram S. India' s contribution on "Guillain-Barre syndrome": mapping of 40 years research. Neurol India. 2013 Jul-Aug; 61(4):375-82. [ Links ]
3. Hughes RA, Swan AV, Raphaël JC, Annane D, van Koningsveld R, van Doorn PA. Immunotherapy for Guillain-Barré syndrome: a systematic review. Brain. 2007 Sep; 130(Pt 9):2245-57. [ Links ]
4. Lehmann HC, Hartung HP, Kieseier BC, Hughes RA. Guillain-Barré syndrome after exposure to influenza virus. Lancet Infect Dis. 2010 Sep; 10(9):643-51. [ Links ]
5. Arányi Z, Kovács T, Sipos I, Bereczki D. Miller Fisher syndrome: brief overview and update with a focus on electrophysiological findings. Eur J Neurol. 2012 Jan; 19(1):15-20 [ Links ]
6. Domínguez-Moreno R, Tolosa-Tort P, Patiño-Tamez A, Quintero-Bauman A, Collado-Frías DK, Miranda-Rodríguez MG, et al. Mortality associated with a diagnosis of Guillain-Barré syndrome in adults of Mexican health institutions. Rev Neurol. 2014 Jan 1; 58(1):4-10 [ Links ]
7. Sejvar JJ, Baughman AL, Wise M, Morgan OW. Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis. Neuroepidemiology. 2011;36(2):123-33. [ Links ]
8. Poropatich KO, Walker CL, Black RE. Quantifying the association between Campylobacter infection and Guillain-Barré syndrome: a systematic review. J Health Popul Nutr. 2010 Dec; 28(6): 545-52. [ Links ]
9. Carrillo Perez DL, Garcia-Ramos G, Ruano-Calderon LA, Sosa-Hernandez JL, Mendez-Castillo JJ. Síndrome de Guillain Barré en un hospital de referencia en México. Rev Mex Neuroci. 2012 Ene-Feb; 13(1): 15-21. [ Links ]
10. Lestayo-O' Farrill Z, Hernández-Cáceres JL. Analysis of the behaviour of Guillain-Barre syndrome. Agreements and discrepancies. Rev Neurol. 2008; 46(4): 230-7. [ Links ]
11. Rojas G, Real R, Aveiro A, Correa D, Ruiz L, Fridman V, Galeano D. Guillain Barre Syndrome associated with dengue. Report of two cases. Rev. Nac. (Itaugua). 2013; 5(2): 41-3. [ Links ]
12. Sivadon-Tardy V, Orlikowski D, Porcher R, Ronco E, Caudie C, Roussi J, et al. Detection of Campylobacter jejuni by culture and real-time PCR in a French cohort of patients with Guillain-Barre syndrome. J Clin Microbiol. 2010 Jun; 48(6): 2278-81. [ Links ]
13. González Duarte A, Ponce de Leon Rosales S. Asociación del síndrome de Guillain Barré y la vacuna de influenza A (H1N1). Rev Fac Med UNAM. 2010 Mar-Abr; 53(2): 83-6. [ Links ]
14. Naik KR, Saroja AO, Patil BP. Familial Guillain-Barré syndrome: First Indian report. Ann Indian Acad Neurol. 2012 Jan; 15(1): 44-7. [ Links ]
15. Walling AD, Dickson G. Guillain-Barré syndrome. Am Fam Physician. 2013 Feb 1; 87(3): 191-7. [ Links ]
16. Yuki N, Susuki K, Koga M, Nishimoto Y, Odaka M, Hirata K, et al. Carbohydrate mimicry between human ganglioside GM1 and Campylobacter jejuni lipooligosaccharide causes Guillain-Barre syndrome. Proc Natl Acad Sci U S A. 2004 Aug 3; 101(31): 11404-9. [ Links ]
17. Vucic S, Kiernan MC, Cornblath DR. Guillain-Barré syndrome: an update. J Clin Neurosci. 2009 Jun; 16(6): 733-41. [ Links ]
18. Odaka M, Yuki N, Tatsumoto M, Tateno M, Hirata K. Ataxic Guillain-Barré syndrome associated with anti-GM1b and anti-GalNAc-GD1a antibodies. J Neurol. 2004 Jan; 251(1): 24-9. [ Links ]
19. Hughes RA, Cornblath DR. Guillain-Barré syndrome. Lancet. 2005 Nov 5; 366(9497): 1653-66. [ Links ]
20. Cuadro R, Silvariño R, Vacarezza M, Buzó R, Méndez E. Síndrome de Guillaín-Barré en el adulto: manifestaciones clínicas, analíticas y epidemiológicas de diez pacientes asistidos consecutivamente en un único centro. Rev Med Urug. 2011; 27(3): 155-60. [ Links ]
21. García-Ramos GS, Cacho Díaz B. Síndrome de Guillain-Barré (SGB). Diagnóstico diferencial. Rev Mex Neuroci. 2005; 6(5): 448-54. [ Links ]
22. Hamidon BB. An acute pharyngeal-cervical-brachial (PCB) variant of Guillain-Barre syndrome presenting with isolated bulbar palsy. Med J Malaysia. 2006 Jun; 61(2): 245-7 [ Links ]
23. Casares Albernas F, Herrera Lorenzo O, Infante Ferrer J, Varela Hernández A. Síndrome de Guillain-Barré. Actualización acerca del diagnóstico y tratamiento. Arch Méd Camaguey. /Internet/. 2007 /citado 20 junio 2014/; 11(3). Disponible en: http://www.amc.sld.cu/amc/2007/V11n3-2007/2030.htm [ Links ]
24. van den Berg B, Bunschoten C, van Doorn PA, Jacobs BC. Mortality in Guillain-Barre syndrome. Neurology. 2013 Apr 30; 80(18): 1650-4. [ Links ]
25. Bourke SC. Respiratory involvement in neuromuscular disease. Clin Med. 2014 Feb; 14(1): 72-5 [ Links ]
26. González-Suárez I, Sanz-Gallego I, Rodríguez de Rivera FJ, Arpa J. Guillain-Barre Syndrome: Natural history and prognostic factors: a retrospective review of 106 cases. BMC Neurol. 2013 Jul 22; 13(1): 95 [ Links ]
27. Mogale KD, Antony JH, Ryan MM. The pharyngeal-cervical-brachial form of Guillain-Barré syndrome in childhood. Pediatr Neurol. 2005 Oct; 33(4): 285-8. [ Links ]
28. Cerisola-Cardoso A, Capote-Moreira G, Scavone-Mauro C. Guillain-Barré syndrome in paediatrics. Different forms of presentation and difficulties involved in reaching an early diagnosis. Rev Neurol. 2007; 44(12): 725-32. [ Links ]
29. Prieto Zancudo C, Galván Luzuriaga M, Alva García P. Neuropatía motora axonal aguda (síndrome de Guillain-Barré). SEMERGEN. 2007; 33(9): 488-91. [ Links ]
30. Newswanger DL, Warren CR. Guillain-Barré syndrome. Am Fam Physician. 2004 May 15; 69(10): 2405-10. [ Links ]
31. Pithadia AB, Kakadia N. Guillain-Barré syndrome (GBS). Pharmacol Rep. 2010 Mar-Apr; 62(2): 220-32. [ Links ]
32. Albertí MA, Alentorn A, Martínez-Yelamos S, Martínez-Matos JA, Povedano M, Montero J, Casasnovas C. Very early electrodiagnostic findings in Guillain-Barré syndrome. J Peripher Nerv Syst. 2011 Jun; 16(2): 136-42. [ Links ]
33. Netto AB, Taly AB, Kulkarni GB, Uma Maheshwara Rao GS, Rao S. Prognosis of patients with Guillain-Barré syndrome requiring mechanical ventilation. Neurol India. 2011 Sep-Oct; 59(5): 707-11. [ Links ]
34. Ali MI, Fernández-Pérez ER, Pendem S, Brown DR, Wijdicks EF, Gajic O. Mechanical ventilation in patients with Guillain-Barré syndrome. Respir Care. 2006 Dec; 51(12): 1403-7. [ Links ]
35. Hernández-Torruco J, Canul-Reich J, Fausto-Soli J, Méndez-Castillo JJ. Predictores de falla respiratoria y de la necesidad de ventilación mecánica en el síndrome de Guillain-Barré: una revisión de la literatura. Rev Mex Neuroci. 2013; 14(5): 272-80. [ Links ]
36. Dada MA, Kaplan AA. Plasmapheresis treatment in Guillain-Barré syndrome: potential benefit over IVIg in patients with axonal involvement. Ther Apher Dial. 2004 Oct; 8(5): 409-12. [ Links ]
37. Latov N. Practice parameter: immunotherapy for Guillain-Barré syndrome: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2004 May 11; 62(9): 1653-4 [ Links ]
38. van den Berg B, Walgaard C, Drenthen J, Fokke C, Jacobs BC, van Doorn PA. Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol. 2014 Jul 15. [ Links ]
39. Galeotti F, Massari M, D' Alessandro R, Beghi E, Chiò A, Logroscino G, et al. Risk of Guillain-Barré syndrome after 2010-2011 influenza vaccination. Eur J Epidemiol. 2013 May; 28(5):433-44. [ Links ]
Artículo recibido: 28 junio 2014 Artículo aprobado: 19 agosto 2014
Autor correspondiente:
Dr. Víctor Hugo Cabanellas
Dirección: Paseo de Fátima y Andalucía 362 (Mariano Roque Alonso, Paraguay)
Teléfono: (595) 982 640704
Correo electrónico: hugocabanellas@gmail.com
1Especialista en Medicina Interna. Servicio de Terapia Intensiva, Dpto. de Medicina Interna. Hospital Nacional (Itauguá, Paraguay)
2Residente de Terapia Intensiva de Adultos. Servicio de Terapia Intensiva, Dpto. de Medicina Interna. Hospital Nacional (Itauguá, Paraguay)