INTRODUCCIÓN
La evolución de la resistencia a los antimicrobianos ha puesto en riesgo el valor de las drogas de amplio espectro disponibles para el tratamiento de las enfermedades infecciosas1. La aparición de cepas productoras de carbapenemasas, que, por lo general van acompañadas de otros mecanismos de resistencia, ha dado origen a bacterias resistentes a múltiples antibióticos2, a esta situación se suma la pobre producción farmacéutica de nuevos antimicrobianos, haciendo cada vez más difícil lograr el éxito terapéutico contra las infecciones bacterianas.
En nuestro país, las primeras cepas portadoras de carbapenemasa del tipo KPC fueron confirmadas en Enterobacterales (ETB) en el año 20092, y desde ese entonces se han registrado brotes en distintos centros asistenciales de todo el país. Las carbapenemasas del tipo metalobetalactamasa genotipo NDM, fueron detectadas y confirmadas en Asunción y Central en Acinetobacter pitti en el año 20123, siendo Paraguay el primer país en confirmar la presencia de este mecanismo de resistencia en Acinetobacter sp. en la región4, y actualmente es una de las carbapenemasas más frecuentes en ETB.
Toda esta problemática de carácter mundial ha promovido la consideración de la utilización de drogas en desuso, como las polimixinas, para el tratamiento terapéutico, antimicrobianos que por muchos años han sido relegados por su toxicidad5,6.
Actualmente, sólo dos polimixinas, polimixina E (colistina) y polimixina B, están disponibles comercialmente. La colistina ha resurgido como tratamiento de última línea a mediados de la década de los 90 para el tratamiento de infecciones severas ocasionadas por bacilos gramnegativos resistentes a múltiples antimicrobianos7,8.
Desafortunadamente, el aumento de la utilización de este antimicrobiano trajo aparejado el incremento de su resistencia a nivel mundial.
Los mecanismos de resistencia a esta droga son de varios tipos: intrínsecos, que son propios de los microorganismos; y adquiridos, que pueden ser cromosómicos y plasmídicos9.
Hasta el año 2015, los mecanismos de resistencia cromosómicos a la colistina eran los únicos conocidos, siendo el más común la modificación del lipopolisacárido (LPS) de la membrana plasmática9. También se ha encontrado heterorresistencia en algunas cepas como consecuencia de mutaciones cromosómicas y que describe la presencia de 2 poblaciones con diferentes perfiles de sensibilidad a la colistina10-12.
Desde la publicación del hallazgo del mecanismo plasmídico de resistencia a polimixinas en Escherichia coli (eco), a finales del 201513, cuyo gen codificante es el mcr-1 (Mobile Colistin Resistance), se llevaron a cabo estudios retrospectivos en animales, alimentos, humanos y medioambiente, los mismos evidenciaron que este mecanismo se halla ampliamente diseminado en varios países del mundo, en muestras de diversos orígenes y en diferentes especies de ETB14,15.
Estudios detallados del gen realizados por varios grupos de investigadores, han demostrado la gran cantidad de variantes (22 variantes genéticas funcionales de mcr-1)16,17 y alelos nuevos de mcr-1 (de mcr-2 a mcr-9) circulantes 18-20.
En Paraguay, el hallazgo y confirmación de mcr-1 fue en agosto de 2016, en cepas de Klebsiella pneumoniae (kpn) aisladas de muestras urinarias de pacientes ambulatorios21; luego fue detectada en otros miembros de ETB aislados tanto de pacientes hospitalizados como de la comunidad. Se observó además en estos aislamientos la presencia de resistencia acompañante a otros antimicrobianos, incluyendo a carbapenémicos por la producción de carbapenemasas22.
El gran desafío para los laboratorios de microbiología clínica, sin dudas, representa el análisis de los aislamientos bacterianos a fin de obtener el perfil de susceptibilidad a la colistina, lo cual guarda relación con las características estructurales de droga que dificultan la tarea a la hora de la realización de las pruebas de sensibilidad23.
A lo largo de los años, las guías internacionales, como el Clinical and Laboratory Standards Institute (CLSI) y European Commitee on Antimicrobial Susceptibility testing (EUCAST), han realizado revisiones y modificaciones en relación a las polimixinas, como cambios en los criterios de interpretación, en las composiciones de las drogas y componentes utilizados para la realización de las pruebas de sensibilidad; y en el año 2016 ambas instituciones han conformado un grupo de trabajo conjunto y han publicado recomendaciones para la determinación de la Concentración Inhibitoria Mínima (CIM) de colistina para un grupo de microorganismos; siendo la microdilución en caldo la metodología de referencia recomendada para ETB, Pseudomonas aeruginosa y Acinetobacter spp., y recomendando la no utilización de metodologías de difusión en agar24.
En cuanto a los criterios de interpretación, el CLSI, luego de retirar los puntos de corte para colistina de sus tablas de interpretación para ETB en 1986, los volvió a incorporar este año 202025 categorizando las CIM (I≤2, R≥4), a diferencia del EUCAST que las mantiene (S≤2, R≥4) (26.
En nuestro país como en toda la región, los laboratorios de microbiología clínica se encuentran limitados para la determinación de la CIM por el método de referencia propuesto, tanto en insumos como por la complejidad del trabajo requerido para ello.
El Laboratorio de Referencia Regional (LRR); del Instituto Nacional de Enfermedades Infecciosas (INEI-ANLIS) Dr. Carlos Malbrán de Argentina; ha estandarizado para los laboratorios clínicos y de referencia de los países de la región, alternativas para llevar a cabo las pruebas de susceptibilidad a colistina; categorizando las distintas metodologías en 3 grupos27:
Metodologías de referencia (MR): que incluyen la microdilución en caldo, macrodilución en caldo, dilución en agar y reacción en cadena de la polimerasa para mcr-1;
Metodologías aceptadas (MA): que incluyen al sensititre, Walkaway (MicroScan), predifusión con tabletas de colistina, COL-agar-spot, COLTEST, CIM por elución de discos de colistina de 10 ug, Colistin Drop-test, y
Metodologías cuestionadas (MC) que son las Rapid Polymyxin NP test, Vitek 2, Phoenix; difusión de discos y tiras de gradientes.
Además, recomienda la utilización de los puntos de corte de EUCAST para la interpretación de los valores de CIM.
En Paraguay, es cada vez mayor la necesidad de contar con esta droga para el tratamiento de las enfermedades infecciosas, por lo que resulta imperiosa la evaluación de las metodologías utilizadas en los laboratorios clínicos, con las cepas aisladas en nuestro país.
MATERIALES Y MÉTODOS
Estudio multicéntrico coordinado por el Laboratorio Central de Salud Pública (LCSP), llevado a cabo en la Sección Antimicrobianos con cepas de ETB remitidas por los laboratorios que conforman la Red Nacional de Vigilancia de Resistencia a los Antimicrobianos Paraguay.
Fueron estudiadas 86 cepas de ETB remitidas por 16 diferentes centros, para confirmación de resistencia a colistina, en el periodo comprendido entre 2016 a 2019. Las mismas, luego de ser identificadas por pruebas bioquímicas convencionales, fueron sometidas de manera simultánea a las pruebas de susceptibilidad a colistina por 6 metodologías diferentes:
Difusión de discos: Se evaluó el halo de inhibición en mm por el método de Kirby Bauer (KB), con discos de colistina de 10 ug de la marca BioRad25;
Difusión de tiras de gradiente, método epsilométrico (EPS): Se evaluó la CIM utilizando tiras de gradiente de colistina de la marca Liofilchem25;
Macrodilución en caldo (MAC): Se evaluó la CIM, siguiendo las recomendaciones del CLSI (Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved standard, 10th ed. CLSI document M07-A010. CLSI, Wayne, PA.), utilizado colistina sulfato de la marca Alfa Aesar, con volumen final de 1 mL, y con rango de concentración de 0,25 a 8 ug/mL;
Elución de discos de colistina de 10 ug (ELU): Se evaluó la CIM siguiendo recomendaciones del CLSI y el LRR, utilizando por cepa, 4 tubos de 10 mL de caldo con 0, 1, 2 y 4 discos de colistina de 10 ug respectivamente25,27;
Equipo automatizado Vitek®2 (VTK): Se evaluó la CIM, con la utilización de tarjetas AST-N303, según recomendaciones de la marca;
Análisis molecular de portación del gen mcr-1 (PCR): Se evaluó la presencia del gen mcr-1, según protocolo del LRR (disponible en la página web: http://antimicrobianos.com.ar/2016/01/deteccion-deresistencia-transferible-a-colistin-gen-mcr-1/)
La metodología de referencia utilizada fue la MAC, recomendada por el LRR (27), y la interpretación de los resultados fue realizada utilizando los puntos de corte de EUCAST (Sensible≤2 ug/mL, Resistente≥4 ug/mL) (26.
Además, fueron calculadas las siguientes tasas:
Error grave (EG): Resultados falsos resistentes (resistente por metodología de prueba y sensible por metodología de referencia).
Error muy grave (EMG): Resultados falsos sensibles (sensible por metodología de prueba y resistente por metodología de referencia).
Concordancia categórica(CC): Concordancia en la interpretación de las CIM de las metodologías evaluadas y el método de referencia.
El valor de ≤3% para las tasas de EG y EMG es el máximo permitido por CLSI para pruebas de sensibilidad (FDA permite tasa de EMG de ≤1,5% como máximo); y para CC ≥ 90% (28.
Control de calidad: Las cepas controles utilizadas fueron Escherichia coli ATCC® 25922™ (CIM a colistina: 0,25-2 ug/mL), Pseudomonas aeruginosa ATCC® 27853™ (CIM a colistina: 0,5-4 ug/mL) (25), y OPS 229-Programa Latinoamericano de Control de Calidad (control positivo de mcr-1 y MAC) (CIM a colistina: 4-8 ug/mL).
Aspectos éticos: La revisión y aprobación del protocolo de investigación (Referencia: Protocolo CEI-LCSP N° 185/13062020) fue realizada por parte del Comité de Ética en Investigación del Laboratorio Central de Salud Pública (Certificación Internacional FWA N° FWA00020088), y el dictamen favorable fue otorgado en fecha 16 de julio de 2020 (Dictamen 139/2020).
RESULTADOS
De las 86 cepas de ETB estudiadas en la Sección Antimicrobianos del Departamento Bacteriología y Micología del LCSP, 82 (95 %) fueron de origen hospitalario, siendo el 76% de las mismas portadoras de carbapenemasa. Los resultados de tipificación fueron los siguientes: 75 (87,21 %) correspondieron a Klebsiella pneumoniae (kpn), 6 (6.97 %) a Escherichia coli (eco), 2 (2.33 %) a Klebsiella aerogenes (eae), 2 (2.33 %) a Enterobacter cloacae (ecl) y 1 (1.16 %) de ellas a Salmonella Schwarzengrund (sal). Figura 1.
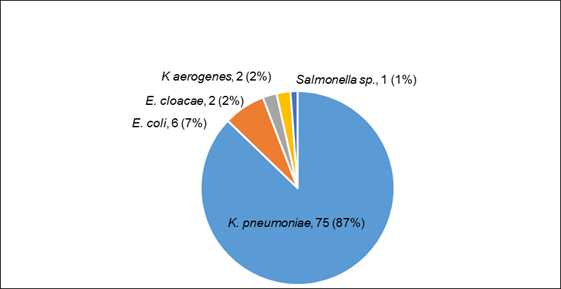
Figura 1: Evaluación de pruebas de sensibilidad a colistina en Enterobacterales aisladas en Paraguay (2016 - 2019). n 86.
El 13% de las mismas fueron sensibles a la colistina y 87% resistentes utilizando la metodología de referencia (MAC); 9 cepas (10,5 %) portaban el gen de resistencia plasmídica a colistina (mcr-1). Figura 2.

Figura 2: Portación del gen mcr-1 en cepas de Enterobacterales aisladas en Paraguay. (2016 - 2019). n 86.
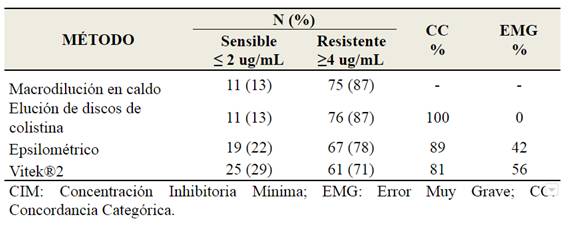
Comparación de ELU con MAC: Los resultados obtenidos por ELU fueron concordantes con los de MAC en el 100% en lo referente a las interpretaciones de las CIM (sensibles/resistentes); sin embargo, fueron observadas diferencias en 1 dilución en 6 cepas.
Comparación de EPS con MAC: Se encontró 100 % de concordancia entre los resultados por EPS y MAC en cepas resistentes a la colistina. En cepas sensibles, se encontraron discrepancias en el 42 % (error muy grave).
Comparación de VTK con MAC: El 100% de los resultados resistentes por este método fueron concordantes con el método MAC; sin embargo, se encontraron diferencias del 56% en cepas sensibles a la colistina. Con una cepa de E. cloacae con heterorresistencia a la colistina se obtuvo una CIM ≤0,5 ug/mL con el VTK. La Tabla 1 compara los resultados de las pruebas de sensibilidad a colistina, con valores de CIM; así como la tasa de EMG de cada método comparado con el de referencia MAC.
Tabla 1: Resultados de las pruebas de susceptibilidad a colistina en cepas de Enterobacterales por 4 metodologías que arrojan CIM (ug/mL). n 86
Comparación de KB con MAC: Las cepas con halo de inhibición menor a 12 mm (≤ 11 mm), fueron en el 100% resistentes con la metodología de referencia; sin embargo, con halos de 12 mm y más, se obtuvieron diferentes resultados, tanto sensibles (37%) como resistentes (63%). En la Tabla 2 se muestran los resultados de los halos de inhibición (mm) de las cepas estudiadas.
Tabla 2: Comparación de los resultados de evaluación de la sensibilidad a colistina en cepas de Enterobacterales, por los métodos Kirby Bauer y macrodilución en caldo. n 86

Comparación de portación de mcr-1 con MAC: El gen mcr-1 fue detectado en 9 cepas (10,5%), con halos de inhibición comprendidos entre 10 y 13 mm; una de las 9 cepas resultó sensible a colistina por MAC. Las especies con portación de dicho gen fueron: kpn (n: 2), eco (n: 5), sal (n: 1) y ecl (n: 1). Ocho de estas cepas con portación de mcr-1 contaban con genes de resistencia acompañante a otros antimicrobianos: Betalactamasa de espectro extendido genotipo CTX-M, resistencia a quinolonas mediada por plásmidos genotipo qnrB y carbapenemasa del grupo 2f genotipo KPC.
DISCUSIÓN
Estudios similares comparativos entre diferentes metodologías de evaluación de la sensibilidad a colistina, y los resultados obtenidos fueron muy variados; sin embargo, la mayoría de ellos coinciden en que los datos proporcionados por pruebas que no sean de referencia pueden conducir a una terapia inadecuada con colistina, y el consecuente fracaso terapéutico29-34.
A pesar de los años que lleva en el mercado esta droga, de amplio uso tanto en salud veterinaria como humana; no se ha logrado definir el método óptimo para determinar su sensibilidad en los laboratorios de rutina; además, las guías y los criterios de interpretación de las pruebas de susceptibilidad han sufrido varias modificaciones a lo largo del tiempo, como cambios sucesivos en los puntos de corte e interpretación, en las composiciones de los drogas y componentes utilizados, por citar algunos de ellos. Un trabajo interesante fue desarrollado en el año 2016 por el Polymyxin Breakpoints Working Group, y como resultado fueron publicadas las recomendaciones para la determinación de CIM a colistina; considerando la microdilución en caldo como la única metodología válida24.
Teniendo en cuenta que no todos los laboratorios de microbiología clínica cuentan con las capacidades (insumos, personal calificado, complejidad) para llevar a cabo las pruebas de dilución; el LRR ha puesto a consideración varias alternativas27 para la predicción de la susceptibilidad a la colistina. Es muy importante que los laboratorios de referencia lleven a cabo estudios sobre las metodologías disponibles en el país, a fin de facilitar recomendaciones sobre el desempeño de estas pruebas.
Este trabajo lo llevamos a cabo, como Laboratorio de Referencia Nacional, con cepas de Enterobacterales aisladas y remitidas por los centros colaboradores; a fin de evaluar el desempeño de las metodologías más utilizadas a nivel nacional, establecer las tasas de error y evaluar las características de las cepas con portación de mecanismo plasmídico de resistencia a colistina (mcr-1) con cada una de las técnicas evaluadas.
El método con el mejor desempeño, según nuestros resultados, fue el de ELU; con el cual se ha obtenido un valor de CC del 100% en comparación con la metodología de referencia. Con ello, concluimos que el método de ELU es confiable para el reporte de la susceptibilidad de la colistina en bacilos gramnegativos pertenecientes a ETB. Además, tiene la ventaja de ser económica y sencilla de realizar; pudiendo los laboratorios de rutina optar por la realización del macro o micrométodo (adaptación del LRR) y ponerla a punto27, a fin de brindar resultados confiables para orientar el tratamiento de los pacientes.
En un estudio similar en bacilos gramnegativos, Patricia J. Simner y colaboradores29, obtuvieron con esta metodología (ELU) resultados de CC similares al nuestro, (100%) al utilizar como método de referencia la MAC; además obtuvieron concordancia del 98% con microdilución en caldo como método de referencia.
En contrapartida, según nuestro estudio, el método que presentó peor desempeño fue el VTK, con el que se obtuvo una tasa de EMG de 56%; seguido del método EPS, con una tasa de EMG del 42 %. Con ambos métodos no se observaron EG.
Publicaciones recientes similares a este trabajo concuerdan con nuestros hallazgos. Chew, KL y colaboradores30, encontraron tasas elevadas de EMG para las metodologías de VTK y EPS; y Dafopoulou K. y colaboradores31, en el año 2015, en un estudio de evaluación comparativa de métodos de sensibilidad a colistina en Klebsiella pneumoniae y Acinetobacter baumannii, han comunicado tasa de EMG de 39,3% para el método EPS; sin embargo, obtuvieron resultados diferentes a los nuestros para VTK, no detectando EMG para esta metodología.
En un estudio también realizado en ETB en el año 2011, Maalej S.M. y colaboradores32, han reportado resultados de CC de apenas el 33% entre el método EPS y el que utilizaron de referencia (dilución en agar).
En el año 2008, Melda S y colaboradores33 en un estudio de comparación de métodos de sensibilidad a colistina en cepas Acinetobacter baumanni sensibles a esta droga encontraron CC con los métodos de KB y EPS en comparación con la metodología de referencia utilizada (microdilución en caldo); es decir, no encontraron EG. De manera similar, nuestros resultados con las técnicas de EPS y VTK no arrojaron EG, hallazgos que respaldan los resultados de resistencia a colistina, no así los resultados obtenidos como sensibles, motivo por el cual no recomendamos el uso de ambas metodologías en los laboratorios de microbiología clínica.
Para el método de difusión de discos (KB), no hemos podido calcular las tasas de error, ya que las guías disponibles no cuentan con puntos de corte en sus tablas de interpretación, e incluso esta metodología está desaconsejada; sin embargo, muchos laboratorios de rutina la siguen utilizando. Nuestros resultados confirman que la misma, a pesar de ser sencilla y práctica, no es confiable para el reporte de sensibilidad en ETB, aun con halos de inhibición de 14 mm (según nuestros hallazgos, resistentes en el 50%). Solo podríamos garantizar que las cepas con halos de inhibición ≤11 mm son resistentes. Estudios publicados por varios investigadores, como Gales y colaboradores (34 y Maalej J.M. y colaboradores32, también han concluido que el método KB no es confiable para la determinación de la sensibilidad de la colistina.
En cuanto a las cepas con portación del gen mcr-1 , nuestros hallazgos evidenciaron la circulación en el país, de cepas de ETB con CIM≤2 ug/mL.
Para finalizar; si bien existen diversas metodologías para la realización de pruebas de susceptibilidad a la colistina disponibles en el país y al alcance de los laboratorios de microbiología clínica, es importante que los profesionales bacteriólogos conozcan el desempeño de estas pruebas, considerando que algunas tienen muy bajo rendimiento, con tasas de EMG que superan lo recomendado por los organismos certificadores, y los resultados obtenidos de los mismos podrían conducir a una terapia antimicrobiana inadecuada, resultando finalmente en el fracaso terapéutico para el tratamiento de las enfermedades infecciosas, sobre todo aquellas en las que están involucradas gérmenes multirresistentes.















