INTRODUCCIÓN
El 5% de los pacientes con COVID-19 evoluciona a enfermedad crítica, definida como insuficiencia respiratoria, shock séptico y/o falla multiorgánica 1. La coinfección en pacientes hospitalizados es del orden del 3,5% y la infección secundaria puede darse en un 14,3% 2. Por otro lado, hemos encontrado un solo caso de co-infección de varicela y el nuevo coronavirus y 72 casos de vasculitis en pacientes con infección por SARS-CoV-2 alrededor del mundo 3,4. Presentamos el caso de un paciente adulto que sobrevivió a una enfermedad crítica por COVID-19 en la UCI y desarrolló excepcionales complicaciones durante su evolución.
PRESENTACIÓN DEL CASO
Mujer de 57 años, hipertensa en uso de telmisartán y nevibolol; refiere mialgias generalizadas, náuseas y fiebre con escalofríos por lo que acude al sanatorio donde realizó estudios: a) Hb de 10,2g% y leucocitos 6.600/mm3, 7% linfocitos y b) se constata hipoxemia arterial por lo cual se interna y recibe oxigenoterapia por cánula nasal. Radiografía de tórax: opacidades algodonosas bilaterales. Exudado nasofaríngeo: SARS-CoV-2 (RT-PCR) (+) por lo que se inicia dexametasona (8mg/d, i.v.) y enoxaparina (60 U/d, s.c.). En su 2º y 3º día de internación (DI) recibió plasma convaleciente. Se le administra meropenem (1g c/8hs, i.v.) y levofloxacina (750mg/d, i.v.), por internación reciente por NAC. A la mañana siguiente refiere disnea a grandes esfuerzos y se inicia remdesivir (200 mg de carga i.v., seguida de 100mg/d). El empeoramiento es progresivo. Inicia oxigenoterapia con cánula de alto flujo, (42L/min y 42% de FiO2) sin lograr objetivo. Se traslada a UCI. Signos vitales: P/A 130/80mmHg, FC: 60 x min, FR: 36 xmin y 91% de SatO2. Se constató taquipnea, tiraje y crepitantes bilaterales.
Diagnóstico inicial: a) Neumonía por SARS-CoV-2 (COVID-19 crítico), b) Neumonía nosocomial y c) Hipertensión arterial.
Se instaló CPAP 8cmH2O+FiO2 60%, logrando mejoría parcial. Al 4º DI: PAFI de 128, Hb 9,7g%, leucocitos 12.800/mm3 (94% neutrófilos y 5% linfocitos), GOT 69 U/L, GPT 90 U/L, PCR 24 mg/L, dímero- D 1,6 µg/mL, ferritina 3126 ng/mL, LDH 946 U7L, IL-6 1260 pg/mL y procalcitonina 0,1 ng/mL. Se consensua con la familia el uso de tocilizumab (600mg, carga y 400mg 12 hs después, i.v). La paciente se mantuvo lúcida y con tolerancia a CPAP y oxígeno durante los 4 días de UCI. Presenta progresivo y notorio aumento de IL-6 (6995pg/mL), LDH (1220U/L) y dímero-D (15µg/mL). Ecocardiografía: presión sistólica de arteria pulmonar normal. A 10ºDI la disnea empeora y se procede a intubación de secuencia rápida sin complicaciones con conexión a ARM (PAFI de 83 con PEEP 15cmH2O). Reclutamiento alveolar con buena respuesta, pero intolerante a posición prona (varias tentativas). Enoxaparina (60U/s.c. c/12 hs) y alta FiO2. A 14º DI inestabilidad hemodinámica, requiriendo noradrenalina. Leucocitos 36,000/mm3, procalcitonina 10,29ng/mL y ácido láctico 4,7mmol/L. Se modifica el esquema antibiótico. Al 16º DI hemocultivos (3/3): Acinetobacter baumannii, sensible a carbapenem y aminoglucósidos. TAC tórax: opacidades difusas con escasas áreas de parénquima normal, predominando consolidaciones hacia áreas dependientes y vidrio esmerilado en las demás áreas (Figura 1- a).
Diagnóstico 2: Síndrome de disfunción orgánica múltiple, Síndrome de dificultad respiratoria aguda (SDRA) por SARS-CoV-2 y Shock séptico de origen bacteriano en paciente con inmunosupresión.
El esquema meropenem (1g c/8hs, i.v) + tigeciclina (100mg c/12hs, i.v.) + vancomicina (1g c/12hs) + voriconazol (200mg c/12hs) + pentaglobina (IgG humana enriquecida con IgM e IgA, i.v.), arrojó resultados satisfactorios para el 22º DI (leucocitos 10.800/mm3 c/ 83% neutrófilos y 17% linfocitos, GOT 27U/L y GPT 59 U/L procalcitonina 0,23ng/mL, ácido láctico 1,7mmol/L, IL6 78,8pg/mL, dimero-D 0,8µg/mL, ferritina 624ng/mL, galactomanano negativo). La PAFI de 140 (FiO2 50%) auguraba requerimiento de ARM prolongada y se procedió a traqueostomía percutánea. La paciente con P/A estable, ya no requiere vasoactivos.
Al 24º DI, aparecen vesículas peri labiales y erupciones vesicantes en dorso que se extienden en días, como máculas o pápulas purpúricas polimorfas, algunas de ellas umbilicadas, por todo el tronco (Figura 2). Se solicitan estudios virológicos de lesiones labiales y biopsia cutánea para biología molecular. Inicia aciclovir (10mg/kg c/8 hs i.v.). PCR: Virus de Varicela-Zoster (VVZ) en piel y herpes simple peri bucal. Histopatología: vasculitis leucocitoclástica (Figura 2). Por hematoquecia + proteinuria +ANA (1/80) + Anti Ro (+) + disminución de niveles de C3 y C4 + se plantea vasculitis sistémica, (ANCA-c y ANCA-p, negativos). Se le administran bolos de metilprednisolona (i,v.) más infusión de inmunoglobulina, que producen mejoría de lesiones cutáneas y lenta recuperación de disfunción renal. PAFI se mantiene igual.
Diagnóstico 3: a) SDRA por SARS-CoV-2, b) Vasculitis, c) Varicela en inmunocomprometido y c) Herpes Simple.
Al 26º DI (22º día en UCI y 18º día de ARM) presenta secreción catarral y leucocitosis (20.200/mm3 c/ 88% neutrófilos). TAC tórax (Figura 1- b, d y e): leve neumopericardio (post-traqueostomía) y patrón parenquimatoso que plantea infección por Pneumocystis jirovecii. Ferritina 1072ng/mL, procalcitonina0,94 ng/mL, dimero-D 1,92µg/mL. Nuevo policultivo para bacterias, búsqueda de p. jiroveci y virus. Inicia cotrimoxazol (TMP 20mg/k/d y SMX 100mg/k/d). En días, creció Stenotrophomonas maltophilia en hemocultivo (3/3, sensible a sulfas), así como en secreción traqueal. En esta muestra, el paneo viral (PCR) informa citomegalovirus (CMV) con bajo umbral de ciclado (¿alta carga viral?) y VVZ.
Diagnóstico 4: a) SDRA por SARS-CoV-2, b) Sepsis por Stenotrophomonas maltophilia, c) Neumonía por CMV, VVZ y Stenotrophomonas maltophila; d) Neumopericardio secundario a traqueostomía.
Se optimizó fijación de cánula de traqueostomía con resolución de neumopericardio y se reemplazó aciclovir por dosis plena de ganciclovir (5mg/kg c/12hs). La paciente presentó mejoría clínica, laboratorial e imagenológica (Figura 1- c). PCR de control en aspirado traqueal (8 días después): VVZ y SARS-COV-2. Toleró el destete progresivo que duró varias semanas debido a la sarcopenia.
Después del alta la paciente fue sometida a un programa de rehabilitación intensa recuperando paulatinamente su masa muscular, apuntando a lograr su mejor desempeño físico e incorporación a su vida habitual
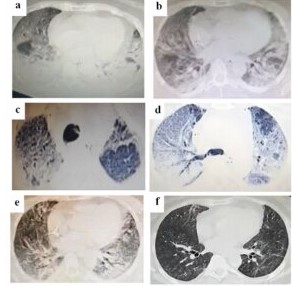
Figura 1: Tomografías de tórax (TAC) realizadas durante la evolución de la paciente a) 16º día de internación (DI), parénquima con severo compromiso de opacidades difusas predominando consolidaciones y broncograma aéreo hacia regiones dependientes y vidrio esmerilado en región de lóbulo medio derecho; b) 26º DI, leve mejoría en relación a la anterior, aunque persiste opacidades difusas en vidrio esmerilado comenzando a aparecer áreas mejor aireadas, neumopericardio; c) TAC de alta resolución de 26º DI que muestra dilataciones (seudobronquiectasias) y microquistes sobre fondo de vidrio esmerilado en ápice derecho, al igual que en región anterior de ápice izquierdo; d) TAC de alta resolución de 26º DI mostrando compromiso parcheado de espacio aéreo con patrón en pavimento loco (crazy paving) y microquistes y consolidación en región posterior, a izquierda los quistes son más evidentes, se observa también neumomediastino; e) 42º DI, mejoría sustancial de aireación parenquimatosa con opacidades residuales en porciones dependientes, resolución del neumopericardio; f) TAC a 45 días del alta donde se ve notoria mejoría de las lesiones, con algunos mínimos tractos de distorsión de la arquitectura.

Figura 2: Macroscopía y microscopía de las lesiones de piel a) Dorso de la paciente, placas polimorfas, eritemato-violáceas, purpúricas en diferentes estados evolutivos, mostrando erosiones y umbilicación en algunas; b) microfotografía de biopsia cutánea que muestra extravasación de eritrocitos, polvillo nuclear perivascular y degeneración fibrinoide de la pared; c) otra sección del corte donde se observan capilares congestivos y degeneración fibrinoide de sus paredes, compatibles con cambios residuales de vasculitis leucocitoclástica
DISCUSIÓN
La enfermedad crítica por COVID-19 se da en el contexto de adultos mayores con comorbilidades. Se han publicado series con 43,3% de individuos con menos de 60 años y con
36% sin enfermedades concomitantes (5,6. Esto sustenta la gran pregunta que pone en vilo a la humanidad: ¿Cuáles son los predictores reales de severidad de la virosis? Los estudios epidemiológicos iniciales nos dieron una zona de confort estructurada por el rol de la comorbilidad, de la inmunosenescencia o de la aleatoria tormenta de citoquinas. Un 13,5% de las formas severas de la enfermedad desarrolla autoanticuerpos anti-interferón (rol en la contención de replicación viral) 7, otro 3,5% padece de problemas congénitos en el grupo de interferón Tipo I 8 y existe un locus de susceptibilidad en un grupo de genes del cromosoma 3p21.31 9. ¿Cómo identificar a estos pacientes y anticipar el tsunami?
La infección secundaria es un importante capítulo no abarcado en la mayoría de las guías y, como variable determinante, no se considera en los modelos de predicción clínica. En el reporte presentado aquí se sucedieron episodios de sepsis por Acinetobacter baumannii, por Stenotrophomonas maltophilia y neumonía polimicrobiana (virus de varicela-zoster, citomegalovirus y Stenotrophomonas maltophilia). El uso de corticoides y tocilizumab cierra el caso como predisponentes, de manera simplista. Pero, ¿qué tal si el propio SARS-CoV-2, al igual que otros virus predisponen per se a la sobre infección? Esto es un fenómeno visto en otros virus. Durante la pandemia de la influenza A (H1N1) hasta el 34% de las muertes se debieron a infecciones bacterianas 10. En una cohorte de estudio COVID-19 casi el 50% de los pacientes que fallecieron desarrollaron neumonías secundarias por Klebsiella pneumoniae, Staphylococcus, Acinetobacter baumannii, y Escherichia coli (11). El daño parenquimatoso inducido por el SARS-CoV-2 en pacientes críticos disminuye el aclaramiento de las partículas virales y esto predispone a la infección bacteriana y a la cronicidad de portación viral 12. Esto se da también en pacientes inmunodeprimidos y en su conjunto explica el prolongado hallazgo del nuevo coronavirus en nuestro reporte 13. Pero resuenan varias preguntas relevantes: a) ¿Cuál es el rol de la interacción del SARS-CoV-2 con la particular respuesta inmunitaria de cada individuo?, b) ¿Cómo interviene el microbioma pulmonar ante el nuevo coronavirus y otros huéspedes bacterianos, virales o fúngicos? Más allá de estas preguntas, los desenlaces en el COVID-19 crítico se asocian con certeza con el tipo de resistencia antimicrobiana de los gérmenes que tengan las UCI. Esto obliga a extremar el tema de seguridad del paciente y a radicalizar políticas austeras y racionales en términos de uso de antibióticos. Por esta y muchas otras variables, una visión holística de la COVID-19 propone ir más allá del término de pandemia y utilizar el término de sindemia (confluencia y sinergia de epidemias) 14.
La infección por citomegalovirus, esquivada como epifenómeno, es un importante modulador de la función inmunológica y podría influir en los desenlaces de la COVID-19 15. El uso de tocilizumab puede asociarse con la infección por este agente 16,17. En el presente caso, la carga viral en la secreción traqueal fue muy alta, inferida a partir del umbral de ciclados (CT) de la PCR. El punto de inflexión en la evolución favorable de la paciente fue el ganciclovir.
Se describen lesiones exantemáticas “varicela-like” dentro del amplio espectro de afecciones cutáneas por el SARS-CoV-2. La búsqueda de VVZ es relevante para etiquetarlas como tal (18,19). En pacientes inmunocomprometidos las lesiones pueden tornarse hemorrágicas 20. Un solo relato de coinfección varicela y COVID-19 se reporta (3. En la paciente de este ensayo, se ha confirmado la presencia de VVZ por biología molecular en biopsia cutánea y en dos oportunidades en secreción traqueal, configurando el cuadro de varicela y neumonía varicelosa. El conjunto de la biopsia, los hallazgos por biología molecular y la buena respuesta al tratamiento confirman, entonces, uno de los primeros relatos académicos de sobreinfección por VVZ en la COVID-19.
La varicela puede también inducir una amplia gama de vasculopatías que van desde capilaritis leves hasta vasculitis granulomatosas, pues la neoangiogénesis de origen viral es factible en contextos inflamatorios o neoplásicos (21. Un estudio demostró que la afección vascular de grandes y pequeños vasos se vio en 50%, 37% en pequeños vasos y 13% en grandes vasos 22. La vasculitis leucocitoclástica, es una característica rara de las lesiones herpéticas de la piel y existen pocos reportes asociativos 23,24. No atribuimos las lesiones cutáneas a los otros microorganismos o fármacos que se dieron en la paciente, debido a que en la biopsia cutánea se confirmó presencia de VVZ. No se puede dejar de pensar en un fenómeno autoinmune superpuesto a todo. De otra manera: ¿cómo explicar ciertos marcadores encontrados en la paciente? En la COVID-19 se pueden detectar altos títulos de anti-SSA/Ro que podrían agravar la neumonía por SARS-CoV-2 o simplemente ser expresión de reacción cruzada con otros anticuerpos 25. La primera fundamentó la administración de los bolos de metilprednisolona, que contribuyó al buen desenlace.
La conducción de los pacientes internados en UCI es intrincada y no pocas veces requiere abordajes que evocan términos como “uso compasivo” o “fuera del prospecto” ante la alta tasa de mortalidad que genera el SARS-CoV-2 en este grupo por lo que el consentimiento del paciente o de los familiares es determinante para el manejo 26-28.
En este escrito presentamos el caso de una paciente que sobrevivió a dos episodios de sepsis y una neumonía polimicrobiana. Describimos, mediante este reporte, una de las primeras asociaciones entre varicela, vasculitis e infección por SARS-CoV-2.