INTRODUCCIÓN
Con la intención de atenuar el impacto de la COVID-19, se elaboraron recomendaciones sobre bioseguridad para ambientes de cuidados sanitarios y para la población en general, extrapoladas de modelos de otras enfermedades, de experiencias de epidemias anteriores y de artículos que emergieron durante la pandemia, urgidos por elucubrar los mecanismos de transmisión del nuevo coronavirus1-3. Todavía quedan áreas grises sobre el modo de contagio del SARS-CoV-2 y las variables que participan en su difusión poblacional. Este ensayo ha sido realizado con el fin de analizar los escritos relevantes sobre estos dos aspectos.
METODOLOGÍA
Tipo de revisión y estrategia de búsqueda
Revisión nominal, centrada en la búsqueda de artículos destacados en PubMed, LILACS, medRxiv y reportes institucionales (OMS, CDC, ECDC y MSP). Términos de búsqueda: COVID-19, SARS-CoV-2, transmisión, modos de transmisión, diseminación y sinónimos apropiados.
DESARROLLO Y DISCUSIÓN
Escasos trabajos en portugués y en español se han escrito sobre el tema y disponer de documentos en idioma vernáculo ayudará a difundir con mayor eficacia la información fiable en nuestras regiones.
Bioaerosoles
Wells y Riley demostraron en 1962 que el contacto con aire contaminado por Mycobacterium tuberculosis, generaba la enfermedad. Esta “hipótesis de aerosoles” clasificaba a las gotas respiratorias según su tamaño (>o<5µm diámetro), y desde entonces, esta dicotomía de gotas grandes y pequeñas se ha perpetuado como explicación de la transmisión de las infecciones respiratorias, y adoptadas por la OMS y los CDC (4,5.
Las gotas emitidas por procesos respiratorios sufren rápidamente un proceso de deshidratación, reduciéndose a núcleos de gotitas dependiendo de factores físico químicos, (contenido de mucina, proteína, agua) y ambientales (temperatura, humedad relativa, recambio de aire por hora, etc.). Los virus dentro de las partículas también sufren modulaciones biológicas debido a luz ultravioleta, desecación, temperatura, etc. De este modo la partícula finalmente inhalada realiza un trayecto durante el cual es sometida a múltiples fuerzas que modifican su estructura y su composición. (Figura 1) 6.
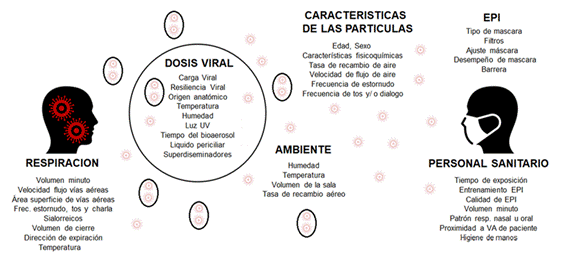
Figura 1: Determinantes de transmisión de partículas respiratorias durante la respiración espontánea. UV: ultravioleta; EPI: equipo de protección individual; VA: Vía aérea. Traducido y reproducido con permiso del Dr. N. Wilson.
La hipótesis de Wells-Riley, constituye una arbitrariedad histórica aplicada a un modelo específico de enfermedad y que actualmente no es utilizada en el campo de la ingeniería ambiental. Hoy sabemos que la emisión de partículas respiratorias de los humanos es heterogénea a causa de la variabilidad en la producción de saliva, en la anatomía de las vías aéreas y otros factores. La respiración normal produce partículas de hasta 2μm y mientras hablamos se pueden observar fracciones de 0,8-125μm y cuando elevamos la voz, aumentan de tamaño, velocidad y alcance 7,8. Además, la mecánica respiratoria individual determinará la intensidad de la voz y de los suspiros, (suspiramos 12 veces por hora); la tos y el estornudo generan gotitas de diferente tamaño (0,1- 900 μm, aunque 97% tienen <1μm) 9,10. La distancia de alcance depende de varios factores y uno de ellos es el tamaño. Una gota de 1000μm cae a un metro en 0,3s, una de 100μm en 3s y una de 1μm puede quedar “flotando” hasta 12h 11. La velocidad de expulsión también varía según la maniobra: respirar (1m/s), hablar (5m/s); toser (10m/s) y estornudar (20-50m/s) 12. Estas aserciones provienen de experimentos realizados en laboratorios y constituyen aproximaciones a escenarios clínicos reales dada la multiplicidad de variables que inciden en el comportamiento físico-químico de las partículas. La recomendación de los CDC para el distanciamiento social (2 metros) se basa en estudios realizados en 1930, época que no detectaba aerosoles <1 µm 13.
Actualmente se define al aerosol como una suspensión estable de partículas sólidas o líquidas (<100µm), que pueden permanecer en el aire por mucho tiempo, concentrarse más cerca de la fuente, pudiendo viajar 2-6 metros disminuyendo a la distancia y distribuirse en una sala. Se originan en el tracto respiratorio inferior y las personas pueden inhalarlas. Por otra parte, el concepto de microgotas comprende a partículas líquidas que miden más de 100 µm y se depositan rápidamente en el suelo o superficies. Se originarían en las vías aéreas superiores. 14. Al parecer el tamaño de las partículas respiratorias generadas es multimodal. La exposición a aerosoles excede por mucho a las microgotas, y esto debe ser balanceado cuando las personas hablan, suspiran, tosen, estornudan o se someten a los llamados procedimientos generadores de aerosoles. ¿Cuáles son las fuentes de las partículas que respiramos en los ambientes cerrados? ¿Respiramos más aerosoles que microgotas?
La OMS propone que el SARS-CoV-2 se transmite principalmente a través de microgotas respiratorias y por contacto (15. La transmisión por microgotas implica cuidados en entornos específicos con énfasis donde se realizan procedimientos que generan dispersión de gotas respiratorias en el aire procedimientos generadores de aerosoles (PGA).
En los laboratorios se estudia la dispersión que generan los PGA mediante técnicas que utilizan maniquíes, gases de propulsión, métodos ópticos para detección, gases trazadores y/o simuladores computacionales, intentando emular situaciones reales. Ver Figura 2 16,17.
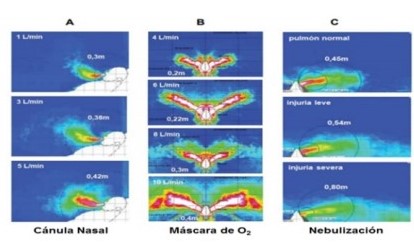
Figura 2: Dispersión de aire en simulador de paciente (maniquí) ante aplicación de diferentes niveles de flujo de oxígeno - por cánula nasal (A), - por máscara facial de bajo flujo (B) y - por nebulización (C).
Los números ubicados en los ángulos representan flujos o estado del sistema respiratorio y en cada cuadro se inscribe la distancia de la dispersión medida. Traducido, modificado y reproducido con permiso del Dr. DSC Hui.
Se menciona a los PGA como una especie de divisoria de aguas entre situaciones de alto o bajo riesgo 18. Varios procedimientos realizados rutinariamente en los sanatorios y hospitales son etiquetados como PGA y es posible que tengan un cierto peso en la transmisión nosocomial de las infecciones virales 19-21. Una revisión sistemática que tomó como desenlace el riesgo para transmisión, encontró asociación significativa con la intubación traqueal OR 6,6 (IC95% 4,1-10,6), la ventilación no invasiva OR 3,1 (IC95% 1,4-6,8), la traqueotomía OR 4,2 (IC95% 1,5-11,5) y la ventilación manual antes de la intubación OR 2,8 (IC95% 1,3-6,4). Otros procedimientos no tuvieron una asociación significativa 22. Ante esta dicotomía en los hallazgos, se propone una taxonomía de los PGA basada en el nivel de concordancia sobre “generadores de aerosoles” o “posibles generadores de aerosoles” citando en estos grupos a la autopsia, procedimientos post-mortem con dispositivos de alta velocidad, intubación y extubación, broncoscopia, inducción de esputo, ventilación manual, aspiración de vías aéreas, resucitación cardiopulmonar, traqueotomía y procedimientos en traqueotomías, ventilación no invasiva, oxigenoterapia con cánula de alto flujo, rupturas de protocolo en sistemas de ventilación cerrada, tratamientos con aerosoles o nebulizaciones, nasofaringoscopia o laringoscopia, ventilación de alta frecuencia, maniobra de tos, ventilación mecánica, fisioterapia respiratoria y aspirado nasofaríngeo 23. Realmente no se ha establecido si estos son los únicos procedimientos que se asocian a la generación de microgotas potencialmente infecciosas. Otros ensayos no han encontrado proporcionalidad entre PGA y la cantidad de RNA viral en las adyacencias de los pacientes infectados 24,25.
Lindsley y cols, han demostrado la viabilidad de los virus de influenza colectados en las muestras de exhalación simple y proponen una teoría paradigmática: como las exhalaciones comunes (22.000 exhalaciones por día) superan ampliamente en número a los episodios de tos, aquellas se constituyen en la principal fuente de material infeccioso por aerosol a lo largo del tiempo 26,27. Se han documentado este tipo de transmisión para otros agentes virales como en la varicela, sarampión y SARS28.
Lydia Bourouiba del Instituto Tecnológico de Massachusetts (MIT) propone un nuevo modelo para las emisiones respiratorias. Ella demostró que las exhalaciones, la tos y los estornudos no están representadas solamente por gotas de mucus y saliva expulsadas siguiendo una trayectoria balística, sino que consisten en una nube de gas turbulento que traslada aire ambiente y gotitas de diversos tamaños, atrapadas en una micro atmósfera de humedad y temperatura que protege a las partículas de la evaporación, mucho más que a las partículas aisladas. Bajo estas condiciones, la vida media de estas partículas puede extenderse considerablemente y por ende pueden trasladarse a una mayor distancia de la que esperamos. Esta nube puede viajar hasta 8 metros durante un estornudo. Cuando la carga de partículas pierde su momentum (masa por velocidad) y su coherencia (física), las gotitas dentro de la nube se evaporan, dejando residuos que pueden suspenderse por horas y su diseminación dependerá de los sistemas de ventilación o de control de clima del ambiente 29.
La “hipótesis de la nube de gas turbulento” de Bourouiba se nutre aún más de los siguientes hallazgos: a) evidencia de ARN viral en salas de pacientes con COVID-19, en superficies difíciles de alcanzar y en muestras de aire a más de 2 metros de los pacientes 30; b) Liu y cols descubrieron que el virus puede re suspenderse en el aire cuando los trabajadores de la salud retiran su equipo de protección personal, limpian los pisos y se mueven a través de áreas infectadas 31; c) presencia de SARS-CoV-2 en los sistemas de ventilación de las salas de pacientes 32. La hipótesis de la nube de gas turbulento explica cómo es posible que los virus viajen a largas distancias del paciente y también ayuda a entender porque el virus se propaga rápido. Estudios más recientes demostraron la viabilidad de las partículas virales obtenidas de muestras de aire en salas de pacientes con la enfermedad (33,34.
Estos hechos desafían los dogmáticos 1 o 2 metros de distanciamiento social mencionados en las guías y es más consistente con la hipótesis de la nube de gas turbulento como medio de transmisión por sobre el modelo clásico dicotómico de microgotas y aerosoles. Tal vez habría que mirar estos nuevos hallazgos como una especie de teoría del todo, como una propuesta armonizadora ya que no se puede descartar que los contagios en el rango “conversacional” sean debidos a aerosoles. Esto es: la transmisión por microgotas o aerosoles no se excluyen mutuamente 35. ¿Por qué no admitir que hablar, cantar o reír constituyen eventos generadores de aerosol?
Factores que modulan la transmisión
El virus. Los virus RNA pueden sufrir mutaciones que alteran la virulencia y/o la transmisibilidad. Un componente principal del coronavirus es la proteína S (Spike) que consta de un sector especial denominado RBD (Receptor Binding Domain) mediante el cual la proteína se acopla a los receptores de las células atacadas. Al parecer, mutaciones iniciales del RBD en el SARS-CoV del 2003 perturbaron la capacidad de penetración celular y esto pudo haber frenado su expansión 36. En contraste, el RBD de las cepas iniciales del SARS-CoV-2 ha demostrado una eficiente interacción con los receptores ACE2 humanos (37. Uno de los primeros estudios en Brasil demostró que el 85% de las cepas circulantes en Sao Paulo tenían una sustitución de nucleótido en la proteína S (G25088T) 38. Esto tiene relevancia para nuestro país ya que en aquel entonces nuestro sistema sanitario cobijaba en albergues a compatriotas que mayoritariamente provenían de dicho estado de Brasil. A 3 meses de iniciada la pandemia, una variante D614G en la proteína S ya se convertía en el genotipo mundial prevalente (cepa que generaba cargas virales más altas) 39. La variante G614-SARS-CoV-2, posee mayor estabilidad y afinidad por los receptores celulares que su antecesor D614 40.
Se comprobaron cientos de mutaciones y su impacto clínico se está evaluando seriamente. Dos de ellas acaparan la atención médica mundial: N501Y (¿mayor contagiosidad?) y E484K (¿escape de los anticuerpos?). Una variante, que tiene la mutación N501Y, es la B.1.1.7 (conocida también como VOC 202012/01 o 201/501Y/V1) ha sido identificada en varias regiones de Europa al parecer es responsable de un pico relevante en la transmisión en algunos países con una contagiosidad atribuida de 70% 41,42 que ya fue aislada en Argentina, Brasil, Perú, Chile y Ecuador. Otra variante, la B.1.351 (o 501Y.V2) que contiene las mutaciones N501Y y E484K, fue aislada en más de 20 países e induce mayor carga viral y mayor transmisibilidad en los pacientes. Una tercera variante, la B.1.1.28 (mutaciones N501Y, E484K y K417N) fue recientemente identificada en Brasil, Japón y otros países (43. La OMS propone cautelosamente que estas cepas podrían incrementar las hospitalizaciones y la muertes 44. Aún hay cierta anarquía en la nomenclatura de las mutaciones y sus variantes pero Rambaut y cols. proponen criterios para uniformizarla 45.
El hospedador. La proteasa transmembrana 2 de la serina (TMPRSS2) acondiciona al nuevo coronavirus antes de entrar a la célula escindiendo la proteína S (S1 y S2). S1 inicia la unión al receptor ACE2, mientras que S2 inicia la fusión de membrana viral y celular. Al parecer, existe un vínculo entre las hormonas sexuales masculinas y la regulación del receptor ACE2 y su correceptor TMPRSS2 (hipótesis androgénica) que podría explicar la mayor prevalencia y complicaciones en los hombres y la relativa inmunidad de los niños 46,47. El polimorfismo de los nucleótidos en ACE2 y en TMPRSS2 es escaso, aunque experimentos in silico predicen expresiones variables en genes que interactúan con la proteína S (ACE2, CLEC4G, CLEC4M, CD209), en genes que expresan receptores accesorios en epitelio olfatorio (REEP6), en genes que inhiben la replicación viral (SLC27A2, PKP2) y en genes de las proteasas que permiten la entrada viral (TMPTSS2, CTSB, CTSL) (48,49. ¿Por qué cuando hay un caso índice en la casa, no todos se infectan? ¿Se debe esto a genotipos diferenciados como moduladores?
Los receptores ACE2 no son abundantes en el aparato respiratorio y esto postula otros factores de anclaje (correceptores) u otros receptores alternativos. La Figura 3 ilustra estas ideas y el efecto de ciertas comorbilidades 50.
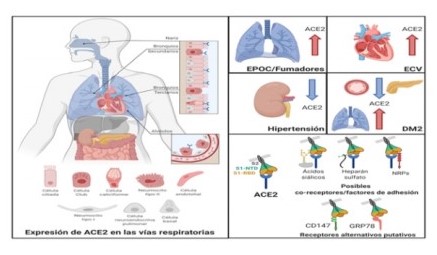
Figura 3: El receptor ACE2 (azul), se expresa muy poco en las vías respiratorias, en comparación con el intestino, riñón, corazón y páncreas. En el epitelio respiratorio, ACE2 se expresa en las células ciliadas, club (de Clara), en los neumocitos tipo 2 y en las células endoteliales de los capilares pulmonares. En algunas comorbilidades asociadas con la gravedad y el mal pronóstico de COVID-19, los niveles de ACE2 están aumentados (EPOC y enfermedades cardiovasculares=ECV). Los pacientes con hipertensión presentan niveles reducidos de ACE2 en el riñón. En los pacientes con diabetes tipo 2 (DM2), ACE2 está disminuida en el páncreas y el sistema vascular, pero aumenta en los pulmones. La evidencia actual respalda un posible rol de los co-receptores o factores de adhesión, como las neuropilinas (NRPs), el heparán sulfato y los ácidos siálicos. Receptores alternativos= CD147 y GRP78. S1-NTD: terminal amino de S1(proteína S escindida); S1-RBD: dominio de unión del receptor de S1; S2: segmento de proteína S escindida unida a SARS-CoV-2. Reproducido con permiso de Zamorano N. y Grandvaux N., quienes tradujeron el texto.
La superficie apical de las células sustentaculares del neuroepitelio olfatorio tiene receptores ACE2 en cantidad superior al epitelio nasal y traqueal. Como la superficie de la región olfatoria es mayor en adultos comparado a la de los niños, esto también explicaría la distribución etaria de la COVID-19 51. ¿Virus neurotrópico?
Las glándulas salivales podrían ser otro punto de entrada directo, ya que existe abundante expresión de ACE2 y TMPRSS2 en el tejido epitelial de estos órganos. La concentración del SARS-CoV-2 es mayor en saliva que en el hisopado faríngeo en estadios precoces 52.
La desproporcionada afectación de las minorías étnicas y raciales por el nuevo coronavirus, debe analizarse en el debido contexto. Es decir, la mayor tasa de infección en estos grupos, ¿implica una razón biológica o es un epifenómeno socioeconómico de ciertos países? 53,54.
En la figura 3 se citan enfermedades que pueden regular la expresión de ACE2 y la obesidad podría incluirse entre ellas (50,55. Aunque existen guías sobre cuáles son los factores de riesgo para infección severa, no abundan los escritos sobre condiciones que predisponen per se a la COVID-19 56. Según el TESSY (The European Surveillance System), entre 748.996 casos leves se constataron cardiopatías (6%), diabetes (3,3%), cáncer (2,3%), neumopatías (1,8%), hipertensión (0,7%) y otra (datos de 2da semana enero 2021) 57.
Los pacientes de grupo sanguíneo A (OR=1,33) y B (OR=1,06), y aquellos con factor Rh (+) (OR=1,22) tienen mayor susceptibilidad para adquirir COVID-19. Los del grupo O se asocian a menor riesgo de infección (OR=0,71) 58.
El tipo de protección utilizado modula la transmisión al hospedador y se relaciona con la ocupación o el ambiente en el cual se desempeñan las actividades. Los riesgos se clasifican en muy altos (trabajadores de salud que se expongan a PGA en ambientes con pacientes con sospecha o confirmación de COVID-19 o trabajadores de salud que recolectan o manipulen especímenes o trabajadores que realicen autopsias en morgues que tienen relación con la epidemia), altos (trabajadores de salud expuestos a salas de pacientes con sospecha o confirmación de COVID-19, sin que haya PGA o trabajadores de ambulancia o trabajadores mortuorios que se encargan de preparar los cuerpos de pacientes con sospecha de COVID-19), intermedios (aquellas profesiones u ocupaciones que requieren frecuente y/o cercano contacto con personas que pueden estar infectadas, pero en quienes se desconoce o no se sospecha COVID-19, por ej: trabajadores que están en contacto con viajeros, escuelas o trabajos donde haya densidad poblacional alta, etc.) o bajos (labores que no requieren contacto con sospechosos o conocidos portadores de SARS-CoV-2) 59.
La piedra angular del tema bioseguridad es que sus componentes (medidas ambientales, de administración y personales) tienen un orden de prelación, innegociable, dentro del cual el equipo de protección personal constituye el último eslabón. No obstante, mencionaremos que en el ambiente comunitario (riesgos intermedios o bajos), las mascarillas quirúrgicas tienen un efecto de control de la fuente (52-90%) disminuyendo la emisión y proveyendo algún tipo de protección al usuario disminuyendo la inhalación de partículas en un rango de 25-90%. Esto depende del tipo de máscara, el ajuste y el rigor en el uso 60. En términos de protección, los respiradores (N95 c/ 95% de filtro o FFP2 c/ 92% de filtro) son más eficaces que las mascarillas quirúrgicas (61,62. Otro elemento fundamental es el distanciamiento social pues se dieron casos de diseminación del nuevo coronavirus en multitudes que utilizaban mascarillas 63.
El ambiente. Los interiores (ambientes internos) se han asociado a eventos de infección incluyendo a los eventos de super diseminación. Las multitudes en ambientes cerrados, pobremente ventilados, como bares, cines y restaurantes pueden exponerse a una acumulación de partículas infecciosas, lo cual empeora en exposiciones prolongadas o durante las conversaciones 64. Los conglomerados de transmisión se caracterizan frecuentemente por casos índices de jóvenes adultos pre sintomáticos en contextos asociados de respiración intensa en proximidad cercana 65. La mayoría de las transmisiones ocurren mediante contacto cercano (15 min cara a cara y rango de 2 metros) y la diseminación es especialmente eficiente dentro del ambiente domiciliario y en encuentros con familiares y amigos. Las tasas de ataque secundario en los domicilios (proporción de individuos susceptibles que se infectan en contacto con caso primario) son del 18,8% (rango de 4-35%) y estas varían con la prevalencia en la comunidad, distribución etaria, densidad de cohabitantes y ventilación de los espacios 66,67. Existen documentos sobre medidas ambientales en edificios no hospitalarios 68-71. Se debe insistir de modo vehemente en la ventilación de los espacios (y en el correcto direccionamiento del flujo ventilatorio). Algunos estamentos recomiendan la tasa de 2,5 L/s/persona en iglesias y 6,7 L/s/persona en salas de clase 14,72.
Estudios laboratoriales demostraron que el SARS-CoV-2 flota en aerosoles mecánicamente generados hasta 3 horas, persistir en cobre hasta 4 horas, en cartón hasta 24 horas, 48 horas en acero inoxidable y hasta 72 horas en plástico. Otros encontraron que a las 3 horas ya no se detectaban en el papel ni en el pañuelo de papel, 2 días en la madera y en la ropa; hasta 4 días en el vidrio y en el papel billete, 4 días en capa interna y 7 días en capa externa de mascarilla quirúrgica 73,74. Resulta difícil extrapolar estos hallazgos al mundo real debido a que los inóculos virales que se emplearon sobrepasan los que pueden generar las maniobras respiratorias. Hay que considerar que encontrar ARN viral no garantiza viabilidad (75.
El nivel de recambio de aire de las salas de hospitales y consultorios en nuestro país se puede monitorizar mediante medición de niveles de CO2. Existen medidas simples y baratas que pueden ser utilizadas para optimizar la ventilación natural 76. Son conceptos fundamentales la ventilación cruzada y el uso de ventiladores de flujo horizontal (únicos o múltiples, dentro o fuera) para “manipular” el flujo de aire a través de las salas 77. La OMS ha elaborado un manual que contempla de manera detallada y delicada los aspectos de bioseguridad para un centro de manejo de infecciones respiratorias agudas severas (78. Se citan eventos de contagio en otro tipo de ambientes (no edilicios), que se pueden dar por ejemplo medios de transporte (buses y aviones) para los cuales también existen directrices 79,80.
Muchos otros factores ambientales pueden influir sobre la transmisibilidad, como el calor, la luz ultravioleta y la humedad, o el pH y hasta la polución ambiental (81,82.
Finalmente, se detectaron partículas virales en aguas de ríos y de desecho. Algunos trabajos proponen que estos hallazgos pueden reflejar con mucha aproximación el número de infectados en una región o en una ciudad (83.
Modos de contagio
Aunque son investigadas la propagación por contacto, por secreciones gastrointestinales, por vía hematógena, vertical, sexual y/o mediante otros fluidos (orina, lágrimas), el aparato respiratorio es la principal ruta de entrada del virus (Figura 4) 84.
Trasmisión por vía respiratoria. Un paradigma sobre la transmisión respiratoria del virus establece que hay dos vías de contagio: inhalación e inoculación. La inhalación de partículas que pueden quedar flotando en el aire por horas y hasta “viajar” a distancias variables puede ser un hecho a partir de volúmenes de aire expelidos por pacientes infectados, incluso apenas al hablar. Pero, entonces, ¿por qué no hay publicaciones que demuestren al SARS-CoV-2 “flotando” en el aire? Posiblemente se debe a los métodos utilizados en su búsqueda. ¿Cómo se recolectan las muestras de aire?
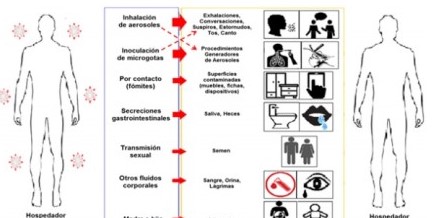
Figura 4: Modos de transmisión del SARS-CoV-2. Esquema de análisis de esta revisión. Reproducida, traducida y modificada con el permiso de la Dra. Rutu Karia y cols.
¿Cómo se filtran estas muestras para estudiar las partículas? ¿Cómo se buscan las partículas? Se reportaron altas concentraciones de RNA viral en hospitales, viables, buscándolas en regiones sub-micrométricas, utilizando PCR digital de gotas (dd-PCR) de sensibilidad mayor a la RT-PCR 31,85,86. La transmisión desde los asintomáticos, los eventos de super diseminación y sucesos en ambientes especiales como los mencionados en buses o aviones sugieren que la inhalación de aerosoles es una vía importante para la transmisión de la COVID-19. Creo que el tema de aerosoles versus microgotas se evapora en la hipótesis de la nube de gas turbulento de Bourouiba, ya que los aerosoles pueden causar contagios cercanos y lejanos.
La inoculación de microgotas en las vías respiratorias deviene de la exposición del hospedador a eventos del paciente (tos, estornudo, carraspeo, etc.) o procedimientos que inducen dispersión de gotitas en el aire (PGA). Para la OMS y la CDC la mayoría de los contagios se producen a través del contacto cercano, motivo por el cual el distanciamiento social debe ser de 1m (OMS) o 6 pies=1,82m (CDC) 87,88. Aunque ambas instituciones puntualizan que la transmisión por aerosoles no es la ruta primaria para la transmisión, dictaminan que ésta puede ocurrir bajo ciertas circunstancias 89,90. Otro de los argumentos que preconiza la importancia de las microgotas es que la atomización que sufren las secreciones respiratorias debe redituar partículas capaces de cargar una dosis “contagiosa” del SARS-CoV-2. Anand y Mayya, en un artículo desafiante, proponen llamar “virusoles” a las partículas contagiosas de modo a separarlas en los análisis “puramente físicos”. Además, proponen una clasificación de los inóculos según la severidad (asintomáticos, leves y moderados = cargas virales desde 102/mL hasta 2x105/mL; formas graves = carga viral > 2x105/mL). Las gotas que cargan inóculos relevantes para el contagio miden > 20µm (91.
Transmisión por contacto. En teoría, las microgotas al caer convierten las adyacencias en material contaminado. Se llama fómite a todo objeto inanimado que puede extender una enfermedad infecciosa mediante contacto. Durante gran parte de la pandemia se ha preconizado que este modo de contagio podría utilizar dos vías; una directa (pasar manos, besos, abrazos, examinar, palpar, o auscultar paciente, etc.) y otra indirecta (contacto de la mano con superficies u objetos contaminados como hojas, fichas de pacientes, placas radiográficas, esfigmomanómetros, etc.). Ocurrido el contacto con las manos, el siguiente paso exigía el transporte del inóculo hacia el rostro (hacia zonas periorificiales) (92.
Siempre y cuando se preserven los protocolos de limpieza estándar en las salas de los pacientes infectados, es improbable que ocurra la transmisión por SARS-CoV-2 por contacto en condiciones de vida real. La chance de transmisión a través de las superficies inanimadas es muy pequeña y tal vez sea posible si una persona infectada tose o estornuda sobre algo y rápidamente alguien toca dicha superficie (¿1-2 horas?) 93,94.
Transmisión por vía digestiva. La mayoría de los pacientes con COVID-19 tiene virus en la saliva y, como se mencionó arriba, la profusión de receptores en el epitelio de las glándulas las presenta como una puerta de entrada así como de salida (95,96.
La tasa de detección en heces va de 57% a 97% y la incidencia de diarrea propone la posibilidad de transmisión ambiental. La posibilidad de aerosolización durante la descarga del inodoro del baño es una hipótesis que podría explicar el hallazgo frecuente de RNA viral en los baños de los pacientes. El SARS-CoV-2 persiste en las aguas residuales por 14 días a 4°C por 2 días a 20°C, siendo detectable el RNA por 8 días. El rol de las heces en la transmisión de la COVID-19 aún es incierto (97-99.
Transmisión por vía sexual. En un estudio prospectivo, de 35 mujeres con COVID-19 que fueron sometidas a hisopado vaginal, 2 (5,7%) resultaron positivas 100. Se encontró el nuevo coronavirus en 6 casos (3,75%) de 160 muestras de semen 101. Estos hallazgos infrecuentes no apoyan la vía de transmisión sexual.
Transmisión vertical. Una revisión sistemática encontró 3,2% de transmisión vertical. Se detallan hallazgos del SARS-CoV-2 en aquellos que fueron sometidos a procedimientos diagnósticos (RT-PCR): hisopado nasofaríngeo 2%, en cordón umbilical 2,9%, en placenta 7,7%, hisopados rectales o heces 9,7%. Se constató IgM en 3 de 82 muestras (3,7%). Con estos datos se puede decir que la transmisión vertical de la COVID-19 es rara pero posible y las tasas son similares a otros patógenos que causan infecciones congénitas 102. Ya que la leche materna está libre de virus, la lactancia es segura aunque la madre debe tomar precauciones para minimizar el contagio respiratorio 103.
Otras vías. Se encontraron bajos títulos de ARN viral, no viables, en 12,7% de suero convaleciente 104,105. Una tasa de 3,7% de casos positivos se refiere en muestras de orina, todos con carga viral muy baja y sin viabilidad en cultivos celulares 106. Arora y cols, encontraron RT-PCR positivo para el virus en hisopado conjuntival evocando la posibilidad de transmisión por esta vía 107.
Aspectos básicos de la dinámica de la transmisión poblacional
Periodo de contagiosidad. El promedio de diseminación de RNA del SARS-CoV-2 es de 17 días (IC95% 15,5-18,6) en las vías aéreas superiores, 14,6 días (IC95% 9,3 -20) en las vías aéreas inferiores, 17,2 días (IC95% 14,4-20,1) en las heces y 16,6 días (IC95% 3,6-29,7) en muestras de suero. Los tiempos de diseminación máxima fueron de 83 días en vías aéreas superiores, 59 días en las vías aéreas inferiores, 126 días en las heces y 60 días en suero. El estudio encontró que el pico de carga viral en la vía aérea superior se da en la primera semana y existe cierta asociación entre la edad y el tiempo de diseminación, aunque el hallazgo más relevante fue que ningún ensayo demostró viabilidad viral más allá del día 9 de la enfermedad, incluso en vigencia de alta carga viral. La carga viral es similar entre asintomáticos y sintomáticos, pero el aclaramiento viral es más rápido entre los primeros 108.
En las vías respiratorias el periodo de incubación es de 5,2 días y el periodo de contagiosidad se inicia 1-2 días antes de los síntomas, adquiriendo pico máximo entre el inicio de síntomas y el 5to día, comenzando a descender después de la primera semana (109-111. En los adultos mayores, el periodo de incubación es más prolongado, 7,7 días (IC95% 6,9-8,4d) 112. El uso prolongado de corticoides extiende el periodo de incubación y portación viral 113.
Es trascendente mencionar que el periodo de contagiosidad es más corto que la duración de eliminación de RNA viral detectable. Después de una enfermedad leve a moderada, ya no se detectan virus viables después de 10 días de síntomas, pero la detección media en nasofaringe va hasta los 22 días en aquellos con enfermedad leve y hasta 33 días en los severos (114-116. La carga viral también tiene su rol en el tiempo de diseminación, ya que después de 8 días ya no se notan virus viables si el ciclo umbral (ct) fue superior a 24 117. En ciertas poblaciones (inmunocomprometidos) el virus puede persistir hasta 70 días (118.
Aspectos básicos de la tasa de transmisibilidad. El número reproductivo (R0) describe el número promedio de casos secundarios esperados desde un caso índice en la población susceptible. Las estimaciones para el R0 del SARS-CoV-2 van de 2 a 3, pero puede variar con el tiempo y según ciudades o países (ej, durante pico alto en New York y en Wuhan, R0=6). Dado que el 80% de los casos son leves, los R0 calculados son subestimaciones 119. Otro indicador es el número reproductivo efectivo en tiempo real (Re o Rt) que se define como el número medio de casos secundarios por un caso primario en un periodo de tiempo determinado. Se utiliza como un indicador dinámico. Por ejemplo, a inicios de enero el Re en Wuhan era de 4 y luego de solo semanas de medidas impuestas, el indicador bajó a 1 120.
El número de transmisiones secundarias muestra mucha heterogeneidad. Se denomina sobredispersión a la transmisión con alta heterogeneidad. En estos casos solo unos pocos eventos evocan muchas transmisiones secundarias. Un estudio filodinámico (secuencias genéticas) hecho en Israel demostró que menos del 10% de las infecciones conducían al 80% de los casos secundarios. Existe mucha evidencia que la transmisión por SARS-CoV-2 tiene una alta sobredispersión (presencia de una mayor variabilidad en un conjunto de datos de lo que se esperaría según un modelo estadístico dado) 121,122.
Ya hemos mencionado más arriba que los conglomerados de transmisión se deben a casos índices de jóvenes y pre sintomáticos, así como también se ha puntualizado que los ambientes internos son los sitios de mayor contagio. En este sentido hay una proporción de casi 12 a 1 cuando se comparan los contagios intradomiciliarios (tasa de ataque 18,8%) con los extradomiciliarios 123. Otros ambientes muy propensos a la diseminación son los albergues o asilos (tasa de ataque de hasta 66%) o las prisiones (hasta 80%) (124. Los estudios de seroprevalencia tienen una sensibilidad interesante para medir la real diseminación viral.
Asintomáticos y eventos de super diseminación
Durante la pandemia del COVID-19 se relatan dos fenómenos epidemiológicos bien peculiares.
Los asintomáticos. Este grupo se describe también en otras virosis. Examinemos las evidencias del SARS-CoV-2. a) Romagnani y cols., han encontrado un 50-75% de infectados sin síntomas 125; b) en el Crucero “Diamond Princess”, un caso índice generó 712 casos positivos y 58% no refirieron síntomas (126,127; c) durante un brote 23 casos de COVID-19 en un centro de cuidados crónicos de enfermería el 52% no tenían síntomas al momento de la prueba, pero posteriormente 89% de ellos desarrollaron síntomas (pre-sintomáticos). Murieron 15 personas durante ese brote 128; d) pueden darse diferentes intensidades de emisión viral (incluso altas cargas) en el grupo de asintomáticos (129,130. La transmisión asintomática del SARS-CoV-2 es el talón de Aquiles de las estrategias de salud pública en todo el mundo. No podemos identificar el ataque.
Eventos de super diseminación. En una iglesia del condado de Skagit (Washington) un coro de 61 integrantes practicó por un lapso de dos horas y media el 10 de marzo. Uno de los integrantes presentaba síntomas respiratorios leves desde hacía 3 días. Semanas después, 53 coristas resultaron enfermos, tres internados y dos fallecidos 131. Se llama Evento de super diseminación (ESD) y se asocia con un crecimiento explosivo temprano en un brote y una transmisión sostenida en etapas posteriores. Una regla empírica dice que el 20% de los infectados son responsables del 80 % de toda la transmisión (regla 20/80). Un análisis de los ESD se puede leer en el artículo de Stein 132. Casi siempre son identificados de modo retrospectivo. Parecen haber cuatro factores inherentes a los ESD: a) factores del patógeno: algunas cepas podrían ser más transmisibles; b) factores del huésped: portación viral prolongada, carga viral durante la infección, producción diferenciada de saliva y asintomáticos que pueden contaminar; c) la densidad poblacional y la disponibilidad y el uso de medidas de prevención y control de infecciones en los hospitales; y d) los factores de comportamiento que incluyen la higiene de la tos, las costumbres sociales y el cumplimiento de las guías de salud pública. La demora en el diagnóstico es la causa más común de los ESD. Un super diseminador no necesariamente es un paciente con enfermedad severa, sino que puede tener una vida social activa y en un corto periodo contagiar a un gran número de personas 133. Las causas de los ESD son multifactoriales y es novedoso analizar la variabilidad de producción de saliva entre los individuos y la demostración de emisores de diferente cantidad durante la respiración normal, dato no menor para adscribir causalidad relevante a este aspecto poco estudiado 134.
CONCLUSIONES
Hay muy pocas publicaciones en español sobre el tópico del modo de transmisión y la diseminación del nuevo coronavirus en el contexto del vendaval de informaciones científicas que, como nunca, se ha visto en la historia de la medicina.
En este trabajo de revisión se deja plasmado un nuevo concepto sobre el comportamiento de las emisiones respiratorias y se enmienda el antiguo concepto dicotómico de aerosoles y microgotas en base a nuevos experimentos realizados con tecnología actualizada.
Cuando analizamos los factores que modulan la transmisión, vemos que el SARS-CoV-2 ha revelado una dinámica conformacional desde el inicio de la pandemia y que puede tener consecuencias impredecibles. En lo que respecta al hospedador: aunque los receptores ACE2 aún destellan como actores principales, ya se teorizan sobre puertas alternativas. El rol de la genética y/o la epigenética (comorbilidades) como factores predisponentes o coadyuvantes de la infección se vislumbra también como una línea de investigación sólida. Finalmente, la serie de trabajos que analiza el componente ambiental y su intervención en la COVID-19, la ubica como elemento de primer orden y solidifica las recomendaciones de bioseguridad que enuncian como prioridad absoluta la ventilación de los espacios.
En cuanto al modo de transmisión está claro que la vía respiratoria es la más importante y las medidas sanitarias preconizadas para atenuar el impacto de la enfermedad (uso universal de mascarillas y distanciamiento social) tienen asidero fundamentado. Una apresurada interpretación de experimentos de laboratorio publicados sobre la persistencia del virus sobre superficies de contacto, sobredimensiona la importancia de los fómites como elementos de transmisión. Sabemos hoy que la transmisión por contacto es de baja frecuencia, así como la vía hematógena, gastrointestinal y de madre a hijo son excepcionales y raras.
Muchos aspectos han cambiado en el manejo global de la COVID-19 merced a un mejor entendimiento de la dinámica de la transmisión poblacional. Sabemos hoy que, en la mayoría de los enfermos, más allá de la mejoría clínica, se puede aún portar fragmentos de ARN viral no viables. Entendemos hoy que la transmisión intradomiciliaria o en espacios cerrados adquiere un rol capital en la red de diseminación de la enfermedad y que pese a la anarquía que significa la sobredispersión, los asintomáticos y los super diseminadores como determinantes de la fuerte pisada de la pandemia, hay tres alternativas: a) empeora todo; b) evanescencia viral, como en tantas otras pandemias; o c) torcemos el destino. Creo en esa última posibilidad, al igual que el Dr. Anthony Fauci “La ciencia, vendrá a nuestro rescate”.















