INTRODUCCIÓN
La Acanthamoeba es un protozoario oportunista, de vida libre, vive en el suelo y en todo tipo de agua (dulce y salada), e incluso en fluidos biológicos como la saliva. Por esta razón, las oportunidades de una potencial infección son elevadas1. Por su gran ubicuidad no es sorprendente que entren en contacto con los seres humanos y causar infecciones2-4) . Entre las especies más comunes capaces de provocar afectación ocular provocando infecciones corneales se pueden mencionar a A. castellanii, A. polyphaga, A. hatchetti, A. culbertsoni, A. rhysodes, A. griffini, A. quinayA. lugdunensis5.
Se estima una prevalencia de queratitis por Acanthamoeba de 1,2 por millón de adultos y con cifras que varían de 0,2 a 2 por cada 100.000 usuarios de LC por año en países como EEUU y el Reino Unido6,7. La queratitis por QA fue descrita por primera vez en Estados Unidos en 1973, en un caso post trauma corneal. Se hablaba de una epidemia, debido al aumento del número de casos por el uso masivo de los lentes de contacto, tanto con fines terapéuticos como también cosméticos. La asociación entre el uso de lentes de contacto (LC) y QA fue descrita en 1984. Al principio se describió que el principal factor de riesgo era el uso de LC en ambientes con agua contaminada. Posteriormente se encontró que esta queratitis estaba asociada también al uso de solución salina de dilución casera empleada para la asepsia de los LC. Todos los tipos de LC han sido asociados a QA, pero son los LC blandos (LCB) de uso diario y uso prolongado los que presentan un riesgo mayor. Esta infección puede ocurrir también en no usuarios de LC1,8.
La prueba de referencia para diagnosticar la presencia de Acanthamoeba es el cultivo que utiliza un agar no nutritivo ANN (monoxénico), la muestra es colocada en la placa de agar no nutritivo al 2 %, cubierta con una microcapa de Escherichia coli (0.5 Mc Farland, aproximadamente). Se emplea el agar base como solidificante y la solución Page para el cultivo9. La técnica de cultivo permite la identificación morfológica y su clasificación según las claves de Page, 198810, pero presenta limitaciones que pueden dar lugar a una demora en el diagnóstico debido al prolongado tiempo de incubación o a un diagnóstico equivocado. Un retraso en el diagnóstico se asocia a un peor pronóstico visual y una evolución más prolongada de la enfermedad11; por lo que son las técnicas moleculares las que permiten, mediante la amplificación de fragmentos específicos, identificar y realizar estudios epidemiológicos rápidos de género, especie, genotipo y subgenotipo. En 1992, Vodkinet y col., diseñaron una Reacción en Cadena de la Polimerasa, cuya sigla proviene de su nombre en inglés Polymerase Chain Reaction (PCR), que además de diferenciar las especies, diferencia su patogenicidad12. Más tarde, Gast et al. determinaron la secuencia genética completa de la subunidad de ARN ribosomal nuclear y propuso un sistema de clasificación basado en esta secuencia13.
En Paraguay existe un solo reporte de un caso clínico de queratitis por Acanthamoeba en usuaria de LC en el 200514. La falta de estudios sobre este microorganismo causante de queratitis y el gran incremento de usuarios de LC hace imperiosa la necesidad de contar con más datos de la situación actual de morbilidad que generan estos microorganismos en Paraguay.
TAXONOMÍA
Acanthamoeba es una ameba de vida libre que pertenece a la familia Acanthamoebidae, descrita por primera vez en 1930 como contaminante de un cultivo de hongos Cryptococcus pararoseus y clasificado como el género de Hartmannella, con el nombre de Hartmannella castellani. Fue separado del género Hartmannella y se estableció la familia Acanthamoebidae y el género Acanthamoeba por el movimiento lento ameboideo y “acanth” que en griego significa picos, por las estructuras espinosas o acanthapodios5,15. En 1977, el género fue sub-dividido en tres grupos en base al tamaño y las características morfológicas de los quistes. El grupo I incluye a aquellos que presentan trofozoitos y quistes grandes, con endoquistes en forma estrellada y ectoquistes lisos o rugosos con un tamaño aproximado de 18µm. En el grupo II se incluyeron aquellas amebas con quistes menor a 18µm, los endoquistes de este grupo se pueden presentar de forma poligonal, triangular redondo u ovalado y los ectoquistes de forma rugosa. Los del grupo III presentan quistes con diámetro menor a 18µm con endoquistes redondeados y ectoquistes delgados y ondulados. Esta clasificación resulta un tanto confusa debido a que la forma de los quistes puede cambiar por las condiciones del cultivo incluso en la misma especie. Actualmente la clasificación se basa en la secuencia del gen de la 18s rRNA 2.
Ciclo evolutivo
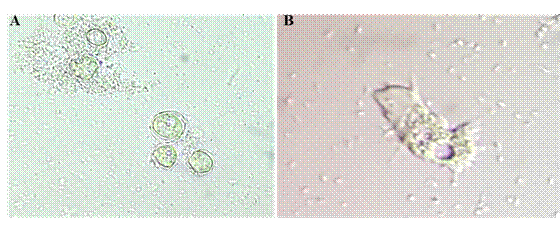
Acanthamoeba presenta dos formas dentro de su ciclo evolutivo: el trofozoito y quiste. El trofozoito es la forma metabólicamente activa, su tamaño oscila entre 12-35 µm de diámetro dependiendo de la especie, posee estructuras similares a espinas en la superficie llamadas acanthapodios (Figura 1-A), que son muy importantes y cumplen diversas funciones como locomoción, captura de alimentos y adhesión a superficies biológicas o inertes. Posee vacuolas contráctiles y un único núcleo, se alimenta activamente de bacterias, hongos, algas y compuestos orgánicos que encuentra en el medio. La captura de los alimentos la realiza por fagocitosis o pinocitosis. Las condiciones que favorecen el estado de trofozoito son las siguientes: temperatura entre 30-37 ºC, osmolaridad entre 50-80 mOsmol, pH neutro y suministro abundante de alimentos. Se reproduce por fisión binaria 15,16.
En condiciones adversas como privación de alimentos, cambios de pH o desecación, el trofozoito pasa a la forma quística (Figura 1-B), expulsando el exceso de alimentos, agua y material particulado, se condensa y adquiere una forma redondeada de pared doble; una interna (endoquiste) y otra externa (ectoquiste). Esta es una forma resistente, que permite que el parásito sobreviva en condiciones hostiles. Puede resistir a la actividad biocida, cloración, radiaciones gamma o ultravioleta y la presencia de diversos compuestos como los antibióticos. Los quistes poseen poros para controlar los cambios del medio, cuando percibe un ambiente favorable emerge del quiste el trofozoito y se reproduce activamente completando así el ciclo. El tamaño de los quistes oscila entre 12-20 µm según la especie15.
PATOGENICIDAD
Los protozoarios del género Acanthamoeba son considerados patógenos oportunistas y producen enfermedades que si bien son poco frecuentes, pueden ser fatales. Las patologías asociadas a este género son: la encefalitis amebiana granulomatosa (EAG), queratitis amebiana (QA), lesiones cutáneas como granulomas en la piel y otros tejidos. En 1958 se demostró por primera vez la capacidad patogénica de estas amebas tras observar el efecto citopático producido en estudios in vitro en células de riñón de mono y la muerte en animales de laboratorio in vivo9,17,18.
QUERATITIS AMEBIANA
La QA causada por especies de Acanthamoeba es muy dolorosa y amenaza la visión si no se diagnostica y trata a tiempo (Figura 2). El principal factor de riesgo para adquirir la infección es el uso de LC. Los casos de QA en pacientes que no son usuarios de LC a menudo se relacionan con traumatismos oculares y exposición posterior al parásito a través de agua o suelo contaminado 19-21. Las amebas llegan a los estuches de LC por prácticas de higiene inadecuada como limpieza de las lentes con agua de canilla o bañarse en ríos portando las lentes; esto debido al desconocimiento del usuario, favoreciendo así la contaminación de los mismos. Las amebas pueden multiplicarse hasta altas densidades y a través de las LC alcanzar la córnea causando la infección4,6.
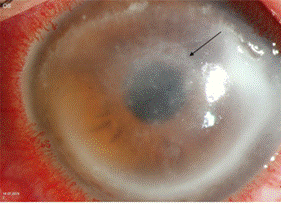
Fuente: Szentmáry 2019
Figura 2: Queratitis amebiana. Infiltrado en anillo incompleto (flecha) e infiltrados estromales multifocales en Queratitis por Acanthamoeba . (22) .
Los síntomas más comunes de QA incluyen dolor, fotofobia, enrojecimiento, sensación de cuerpos extraños, visión borrosa. Los hallazgos anatomopatológicos más frecuentes son; infiltrados epiteliales, perineuritis, estroma en anillo, úlceras epiteliales, perforación corneal, entre otros. Cabe resaltar que ninguno de estos hallazgos es específico de QA. Si bien la infección es principalmente corneal, en algunos casos pueden presentarse manifestaciones extracorneales como glaucoma, cataratas, escleritis, atrofia del iris e inflamación del segmento posterior19,23.
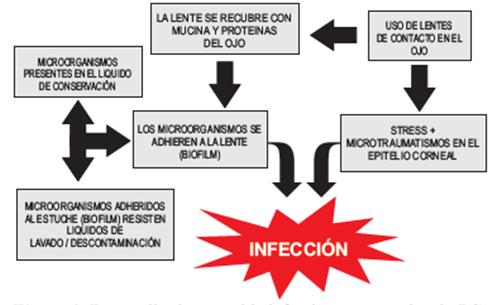
Los usuarios de LC corren mayor riesgo de adquirir QA por los malos hábitos que realizan, lo cual favorece la formación de biopelículas bacterianas que juegan un rol importante en la adherencia y colonización de las LC por Acanthamoeba, en la (Figura 3) se observa un esquema representativo del desarrollo de la infección corneal asociada a LC. Estudios previos han demostrado que los usuarios no toman las precauciones necesarias para evitar la contaminación de sus LC; Chang y colaboradores reportaron que de la población estudiada apenas el 28% cumplen las buenas prácticas. Otro estudio realizado por Ghanem y colaboradores reportó que el 88,6% de los usuarios de LC no las utiliza según los estándares de uso y descartabilidad recomendados. Los factores de riesgo más destacados son la falta de higiene de las manos, de las lentes y el estuche, incumplimiento en el periodo de reemplazo tanto de las lentes como del estuche, nadar o ducharse con LC puestos, lavado o almacenamiento de LC con agua de grifo y reutilización de LC sin haber realizado una desinfección previa 15,24.
Para evitar complicaciones relacionadas al uso de LC se recomienda a los usuarios realizar una limpieza y desinfección diaria de las lentes y su estuche, seguir las recomendaciones de uso y reemplazo de LC establecidos por los oftalmólogos, evitar uso de agua de grifo como solución de lavado o almacenamiento, realizar una desinfección de las LC antes de guardarlo en su estuche, no exceder las horas de uso recomendadas, evitar dormir con LC puestos y realizar la consulta médica al menos una vez al año. El médico debe explicar al paciente las complicaciones que implican el uso incorrecto de LC y en cada consulta recordarle los buenos hábitos que debe mantener26.
Mecanismos de patogenicidad
Existen factores que contribuyen directa e indirectamente a la patogenicidad
Factores que contribuyen directamente a la patogenicidad
El primer paso para adquirir la infección corneal está mediado por proteínas de unión a la manosa (MBP) expresadas en la superficie de Acanthamoeba de aproximadamente 130 KDa, otras adhesinas implicadas son las proteínas de unión a laminina de 28,2 kDa y 55 kDa. El reconocimiento primario de la MBP con su receptor interfiere en la señalización intracelular de la célula huésped y conduce a eventos secundarios como la inhibición del ciclo celular a través de inhibición de la síntesis de ciclinas y las quinasas dependientes de ciclinas que codifican proteínas para la progresión del ciclo celular induciendo de esa forma la muerte celular6,27.
Por otra parte la muerte celular también puede estar mediada por la fosfatidil inositol 3 quinasa (PI3K) que induce la liberación del citocromo c, pérdida del potencial de membrana mitocondrial, activación de Bad, Bax y caspasas que son mediadores de la apoptosis. La unión del parásito a la célula huésped induce a la activación de toxinas como neuraminidasas, ecto-ATPasas, superóxido dismutasa, elastasas, proteasas, entre otros. Las ecto-ATPasas, hidrolizan el ATP y el ADP resultante ejerce un efecto tóxico sobre la célula corneal, activa la caspasa-3 e induce a la apoptosis15.
Las neuraminidasas podrían jugar un papel importante en la colonización de las amebas y al daño del epitelio corneal. Las superóxido dismutasas identificadas en Acanthamoeba son dos; la superóxido dismutasa de hierro y la superóxido dismutasa de cobre y zinc que actúan como antioxidantes y antiinflamatorios, lo cual favorece la supervivencia de las amebas del estrés oxidativo6.
Acanthamoeba tiene la capacidad de activar el plasminógeno para formar plasmina que conduce a la activación de metaloproteasas que degradan la matriz extracelular. La elastasa producida por éste parásito degrada proteínas del tejido conectivo tales como fibrina y colágeno. Las proteasas tales como el MIP 133 que es una serina proteasa induce la degradación de queratocitos, células epiteliales y endoteliales corneales, células del cuerpo ciliar del iris, células epiteliales del pigmento retiniano, así como la inducción de la apoptosis en los macrófagos28.
Los receptores tipo Toll 4 (TLR4) participan en el reconocimiento de Acanthamoeba que a través de la proteína adaptadora MyD88 activa al factor nuclear-kappa B para la transcripción de proteínas mediadoras de la inflamación como citocinas, interleucina-8, interferón beta y factor de necrosis tumoral alfa en células corneales16.
Factores que contribuyen indirectamente a la patogenicidad
Entre otros factores que contribuyen a la patogenicidad de Acanthamoeba podemos citar: tamaño del inóculo, la capacidad del parásito de sobrevivir fuera del huésped en diferentes condiciones ambientales (osmolaridad, tolerancia a la temperatura y pH), resistencia a drogas, características morfológicas, quimiotaxis, ubicuidad entre otros. Acanthamoeba modula su unión a superficies biológicas a través de los acanthapodios y a través de la diferenciación celular de trofozoitos a quistes puede resistir a diversos agentes antimicrobianos. Por quimiotaxis el parásito se mueve hacia una mayor concentración de alimentos y huye de un ambiente amebicida dirigiendo su movimiento según las sustancias químicas presentes en el medio. Se cree que las biopelículas formadas en el estuche de lentes de contacto podrían jugar un papel importante en la contaminación por Acanthamoeba, ya que las mismas sirven como fuente de nutrientes para las amebas. Ciertos factores del huésped también influyen en la patogenicidad del parásito, entre los cuales podemos mencionar: susceptibilidad del huésped, factor lagrimal como la IgA anti-Acanthamoeba y especificidad tisular6.
DIAGNÓSTICO
El diagnóstico de la QA es un desafío ya que los síntomas son poco específicos siendo muy similares a queratitis de otra etiología, en la mayoría de los casos tienden a confundirse con queratitis fúngica o herpética lo que retrasa significativamente el diagnóstico y los pacientes son sometidos a semanas de tratamiento antimicrobiano ineficaz. En muchos casos incluso la enfermedad puede desarrollarse como una infección mixta dificultando más aún su diagnóstico29,30.
El diagnóstico temprano y correcto es fundamental para lograr un mejor pronóstico y asegurar el tratamiento adecuado y eficaz. El laboratorio es esencial para la detección del patógeno y por tanto es clave el diagnóstico etiológicamente correcto en casos de QA. Sin embargo, los métodos diagnósticos convencionales para detección de Acanthamoeba carecen de sensibilidad por lo que es necesario contar con técnicas moleculares altamente sensibles y específicas para un diagnóstico correcto y preciso31,32.
Métodos de diagnóstico
El diagnóstico se puede realizar a través del cuadro clínico que presenta el paciente, la microscopia confocal y los métodos laboratoriales de cultivo y molecular.
Microscopía confocal
Es una herramienta médica útil para el diagnóstico de la QA, no es invasiva, permite una rápida visualización de las estructuras oculares y es particularmente útil en los casos de queratitis donde el infiltrado corneal es profundo e inaccesible al raspado corneal. Sin embargo, no permite discriminar el organismo real causante de la infección por lo que es necesario realizar pruebas confirmatorias de laboratorio. Cabe resaltar que es muy dependiente de la experiencia del observador ya que los trofozoitos son muy similares a los queratocitos y leucocitos de la córnea pudiendo confundirse fácilmente si no es realizado por un personal experto. Además presenta un valor limitado en infecciones donde la densidad del parásito es baja generando resultados falsos negativos, como lo demostraron Padzik y colaboradores que reportaron el crecimiento de Acanthamoeba en muestras inicialmente negativas por microscopía confocal19,29.
Cultivo
La técnica de cultivo es el estándar de oro para el diagnóstico. Sin embargo, puede carecer de sensibilidad y lleva un tiempo prolongado pudiendo llegar hasta 7 días para la detección del parásito o incluso no obtener crecimiento aún en presencia del protozoario en la muestra6. La sensibilidad del cultivo depende de múltiples factores como el tipo de muestra y la cantidad, así como el tiempo que transcurre desde la colecta del material hasta su procesamiento, ya que se requiere al menos un microorganismo viable para que se reproduzca hasta cantidades suficientes para poder ser detectada. Otro factor importante a tener en cuenta es si el parásito se encuentra en la forma quística o de trofozoitos; los quistes tardan en cambiar a trofozoitos y reproducirse lo cual retrasa el diagnóstico por cultivo31.
En un estudio realizado por Walochnik y colaboradores, se observó que en las muestras de pacientes que recibieron tratamiento antimicótico o antibiótico tardaban más en detectar el parásito y en algunos casos los cultivos permanecieron negativos por completo, mientras que al realizar un seguimiento del paciente a medida que avanzaba con el tratamiento observaron una variada sensibilidad respecto a las muestras iniciales de 85% (primera muestra) a 10% (muestras de seguimiento) por el método de cultivo, lo que sugiere la necesidad de contar con métodos más sensibles y específicos para asegurar la detección del parásito33.
Métodos moleculares
Los métodos basados en la reacción en cadena de la polimerasa (PCR) tienen como principales ventajas su gran sensibilidad, especificidad y su rapidez, además del hecho de requerir poca cantidad de muestra6,29.
Existen varios estudios centrados en la amplificación del gen de la 18s rRNA y que permiten detectar todas las variantes de Acanthamoeba. El gen 18s rRNA es parte de una unidad ribosómica repetitiva que se encuentra en múltiples copias en la célula, se estima que Acanthamoeba tiene aproximadamente 600 copias de la unidad de repetición ribosómica. Este gen ha sido ampliamente estudiado en amebas de vida libre, permite la clasificación de especies y genotipado34.
En base a la secuenciación del gen 18s rRNA por técnicas moleculares se han podido identificar varios genotipos como T1, T2, T3, T4, etc., el genotipo T4 es el mayormente reportado como agente causal de infecciones amebianas y es considerado el más patógeno23.
TRATAMIENTO
El tratamiento de la QA es prolongado y agresivo sobre todo para eliminar los quistes altamente resistentes. No existe un tratamiento único, generalmente se aplica una combinación de fármacos como las biguanidas en combinación con diamidinas y se obtienen buenos resultados si se aplican al principio del desarrollo de la infección. El tratamiento es muy riguroso, la aplicación del fármaco se debe realizar cada hora durante los primeros días de terapia por un periodo de tres días, dependiendo de la respuesta la aplicación del fármaco se reduce a cada tres horas y requiere de un mínimo de tres a cuatro semanas pudiendo llegar a seis o doce meses de tratamiento en infecciones más severas, en muchos casos el paciente se ve obligado a abandonar la terapia por intolerancia al fármaco o las reacciones adversas6,27,35.
Cuando el paciente no responde al tratamiento con fármacos anti-Acanthamoeba y la infección ha progresado a una infiltración profunda como perforación corneal, se indica el tratamiento quirúrgico como única solución. Antes de realizar la queratoplastia el paciente debe ser sometido a una terapia anti-amebiana y continúa posterior a la operación para evitar la recurrencia de la infección. En muchos casos la córnea trasplantada vuelve a infectarse por remanentes de quistes que quedaron en el tejido, en el peor de los casos puede requerir enucleación. En un estudio previo realizado en Austria por Walochnik y colaboradores reportaron el caso de un paciente que fue sometido dos veces a trasplante de la córnea, otro paciente tuvo que ser sometido cuatro veces al trasplante corneal para despejar completamente Acanthamoeba de su ojo. La dificultad para eliminar completamente el parásito se debe a los quistes altamente resistentes. Otro estudio realizado por Antonelli y colaboradores. reportó el caso de un paciente que seguía dando positivo por cultivo y PCR tras ser sometido a 8 meses de terapia continua, lo que demuestra la alta persistencia y resistencia de Acanthamoeba (23,33,36.
El uso de corticoides está indicando para controlar la inflamación pero debe administrarse dos semanas posterior al inicio del tratamiento con biguanidas, sin suspender ésta y seguir con el tratamiento con el anti-Acanthamoeba en dosis bajas por cuatro semanas tras suspender los corticoides, si en ese periodo de cuatro semanas el ojo ha estado libre de inflamación se puede considerar que está curado y suspender todas las terapias19.
SITUACIÓN EN PARAGUAY
En Paraguay, existen pocos datos sobre queratitis en general, con un predominio de infecciones causadas por bacterias y hongos. Un estudio retrospectivo de 13 años de queratitis microbiana reportó como agentes causales a bacterias en el 51% de los casos, hongos en el 26% e infecciones mixtas (bacterias y hongos) en 23%. Estudios más recientes reportan que aproximadamente el 55% de los casos está asociado a hongos y 45% a bacterias. Las bacterias más comúnmente aisladas son Pseudomona aeruginosa y estafilococos coagulasa negativa, mientras que Fusarium sp. es el agente micótico más común aislado. El único antecedente de queratitis causada por Acanthamoeba que existe a nivel nacional es el reporte de un caso clínico en el cual se detectó el parásito a partir de raspado corneal por el método de cultivo14,37-41.
En el país, no se cuenta con un protocolo estandarizado para detección de Acanthamoeba, generando una necesidad de métodos de diagnóstico que permitan detectar al parásito en casos sospechosos. El departamento de Microbiología del Instituto de Investigaciones en Ciencias de la Salud (IICS), con el fin de contribuir al diagnóstico precoz y tratamiento oportuno de las infecciones amebianas, ha estandarizado métodos diagnósticos basados en PCR para la detección rápida y específica de Acanthamoeba sp. tomando al cultivo como estándar de oro.
Se estandarizaron con éxito el método de cultivo en medio Page, dos protocolos de PCR convencional y una PCR a tiempo real con límites de sensibilidad de 0,5 pg/µL, 2 pg/μL, y 1 pg/µL, respectivamente. Se aisló Acanthamoeba de una muestra (1%) de los 110 líquidos conservantes de lentes de contacto de usuarios aparentemente sanos analizados, por método de cultivo, mientras que la carga parasitaria en el líquido conservante fue inferior a los límites de detección de los métodos moleculares. El ADN obtenido del cultivo de dicha muestra fue positivo para Acanthamoeba en los tres sistemas de PCR. El uso combinado de técnicas convencionales y moleculares fue efectivo para la detección de Acanthamoeba en líquidos conservantes de lentes de contacto con frecuencia relativamente baja comparado con otros estudios42.
En el Congreso de la Asociación Panamericana de Infectología del 2019, se presentaron tres casos con sospecha clínica de queratitis por Acanthamoeba spp. en usuarios de lentes de contacto, dos de sexo femenino; todos consultaron por ojo rojo, dolor, fotofobia y disminución de la agudeza visual. La primera paciente de 13 años fue tratada como queratitis herpética sin mejoría. Ante la sospecha de queratitis amebiana, se inició tratamiento con polihexametilbiguanida 0,02%/clorexidina 0,02%, con buena evolución a los 2 meses de tratamiento. No se realizó estudio laboratorial. En el segundo caso, la paciente de 26 años, por la sospecha clínica y hábito de ducharse con lentes de contacto puestas, se envió el líquido de conservación para estudio laboratorial, arrojando PCR positiva para Acanthamoeba; iniciándose tratamiento específico con buena evolución. En el tercer paciente de 62 años, tratado como cuadro infeccioso con moxifloxacina por un mes sin mejoría, se realiza cultivo y PCR del líquido de conservación de la lente de contacto, dando positivo por ambas técnicas para Acanthamoeba, además por sospecha de neoplasia se le realizó biopsia. Actualmente recibe tratamiento para neoplasia por el resultado histopatológico, no así para QA. La importancia de este reporte radica en que las queratitis amebianas pueden simular cuadros infecciosos de carácter viral herpético o micótico, y por su baja frecuencia y difícil confirmación por falta de métodos laboratoriales apropiados, no se considera a la Acanthamoeba como agente etiológico, y en consecuencia hay retraso en el diagnóstico y tratamiento43.
Así mismo, en el año 2018 mediante otro estudio se determinó la frecuencia de malas prácticas en el uso de lentes de contacto en 110 estudiantes (edad media: 23 ± 3 años, 81,8% del sexo femenino) de la Universidad Nacional de Asunción, aparentemente sanos. El 97% de los participantes declaró realizar al menos una mala práctica que favorece contaminación de las lentes de contacto que fueron: uso diario (43,6%), exposición de las lentes de contacto al agua mientras se duchan (70%) o nadan en piscinas (43,6%), lavado de las lentes con agua de canilla (11,8%), falta de lavado de manos para manipular las lentes (6,4%), uso de lentes de contacto vencidos (40,9%), uso de lentes más de 10 horas diarias (48,2%), lavado poco frecuente del estuche de lentes de contacto (50%) y falta de cambio diario de la solución de lentes de contacto (70%). La alta frecuencia de malas prácticas sugiere la necesidad de implementar medidas educativas dirigidas a esta población tan vulnerable, a fin de prevenir el desarrollo de queratitis infecciosa44.
CONCLUSIÓN
La baja prevalencia de los casos de queratitis por Acanthamoeba spp. se debe probablemente a que esta ameba es subestimada como agente etiológico de esta patología, lo que desemboca en un erróneo y tardío diagnóstico con una evolución desfavorable para la salud visual del paciente. Siendo por ello un desafío para el oftalmólogo y para el laboratorio su correcto diagnóstico y tratamiento, donde la sospecha de la misma debería ser mayor al tener una población de pacientes usuarios de lente de contacto con alta popularidad de uso, ya sea con fines terapéuticos o simplemente estéticos y donde los buenos hábitos de higiene de los lentes de contacto, sus líquidos de conservación y sus estuches no se cumplen a cabalidad.
Antes de los trabajos realizados en el departamento de Microbiología del IICS, en el país no se contaba con ningún método de diagnóstico laboratorial para la detección de Acanthamoeba spp., siendo los mismos, los primeros en estandarizar los métodos convencionales y molecular para ser utilizados como útiles herramientas para el oportuno diagnóstico de esta patología, así como el estudio del comportamiento sobre los hábitos de higiene en los usuarios sanos de lentes de contacto.