INTRODUCCIÓN
El aumento de la producción en los cultivos es una necesidad en América Latina, debido a que la aplicación excesiva de fertilizantes de síntesis química ha ido disminuyendo la fertilidad de los suelos, afectando a sus propiedades físicas, químicas y biológicas (Bhatt, Labanya & Joshi, 2019). El uso de microorganismos en agricultura ha demostrado ser útil en la mitigación de problemas asociados al excesivo uso de fertilizantes químicos y pesticidas (Russo et al., 2012), ya que las bacterias presentes en el suelo juegan un papel vital en el ciclo de los nutrientes (Ingham, Trofymow, Ingham y Coleman, 1985).
El nitrógeno es un elemento mineral importante para el desarrollo de los cultivos y afecta directamente a la producción final, debido a que tiene un papel principal en la estructura de las proteínas y por tanto en el crecimiento celular (Robertson & Vitousek, 2009). La fijación biológica de nitrógeno es uno de los procesos biogeoquímicos más importantes en la naturaleza debido a que permite el reciclaje del nitrógeno atmosférico y lo hace accesible para las plantas. Este proceso es llevado a cabo por bacterias de vida libre o en simbiosis con plantas (Burris & Wilson, 1945). El término PGPR (plant growth promoting bacteria) hace referencia a las bacterias que colonizan raíces de las plantas (rizosfera) y mejoran su crecimiento vegetativo (Jha & Saraf, 2015). Entre los factores que influyen en la eficacia de las PGPR están los factores ambientales, su capacidad de supervivencia en el suelo, la compatibilidad con el cultivo o la interacción con la microbiota del suelo (Martínez-Viveros, Jorquera, Crowley, Gajardo & Mora, 2010). Se ha observado que las cepas seleccionadas para la producción de inoculantes deberían ser específicas de cada región para conseguir competitividad en el suelo hospedante y colonizar de forma efectiva las raíces (Zaidi, Ahmad, Khan, Saif & Rizvi, 2015).
Entre las bacterias de vida libre fijadoras de nitrógeno se encuentran las del género Azotobacter sp., comúnmente encontradas en los suelos y con efecto beneficioso en el crecimiento de los cultivos (Aquilanti, Favilli & Clementi, 2004). Además, también se conoce que sintetizan sustancias promotoras del crecimiento biológicamente activas como ácido indolacético, giberelinas y vitaminas-B en medios de cultivo (Sharma, 2005).
Existen diferentes estudios en los que la inoculación de Azotobacter sp. produjo efectos beneficiosos sobre la producción (Pérez Peñaranda, Oramas García, Sotolongo Valdés, Román Tabio & López Rodriguez, 2020), debido a un aumento en el contenido de nitrógeno fijado en el suelo (Zahir & Arshad, 1996). Se ha demostrado que la aplicación de PGPR al suelo o semillas afecta al crecimiento de cultivos agrícolas como el tomate (Bernabeu et al., 2015) o la lechuga (Chamangasht, Ardakani, Khavazi, Abbaszadeh & Mafakheri, 2012).
El objetivo del presente estudio fue evaluar el potencial agronómico de diferentes cepas aisladas de suelo y rizosfera sembrados con cultivos andinos en andisoles de la provincia de Tungurahua (Ecuador), en la germinación y primeras fases de desarrollo de plantas de tomate y lechuga.
MATERIALES Y MÉTODOS
El trabajo de campo se realizó en la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Ambato, Ecuador (2850 msnm, 01º 24’ 27’’ S, 78º 35’ 00’’ O) durante el año 2017. El suelo de la zona es un típico andisol (Parfitt & Clayden, 1991), proveniente de cenizas volcánicas y el clima es ecuatorial de alta montaña. Las muestras fueron recolectadas del suelo y la rizosfera de zonas sembradas con cultivos andinos de amaranto (Amaranthus quitensis Kunth), mora (Rubus glaucus Bentham), zanahoria blanca (Arracacia xanthorriza Bancr.) y mashua (Tropaeolum tuberosum Ruiz & Pav). Los muestreos se tomaron en áreas donde no hubo aplicación previa de biofertilizantes, a una profundidad de 10 a 20 cm.
Para aislar los microorganismos fijadores de nitrógeno, las muestras de suelo y raíz se diluyeron en agua destilada en una proporción 1/10. Posteriormente se hicieron diluciones seriadas 10-1, 10-3, 10-5 y 10-7 y se sembraron por goteo en placa utilizando el medio selectivo Ashby manitol. Las muestras se incubaron a 29ºC y pH = 7 y finalmente se realizaron 7 purificaciones.
La caracterización de las cepas se hizo mediante diferentes pruebas fisiológicas y bioquímicas: observación morfológica tras tinción Gram, catalasa, ureasa, prueba de hipersensibilidad en plantas de tabaco (Nicotiana tabacum) y determinación de ion amonio (kit Assay). Estas características fueron estudiadas de acuerdo a los métodos descritos en el manual de Bergey’s (Holt, 2000).
El ensayo del potencial agronómico de las cepas aisladas se realizó en la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Ecuador, provincia de Tungurahua (2850 msnm, 01º 24’ 27’’ S, 78º 35’ 00’’ O) entre los meses de febrero a abril de 2018. Para la evaluación agronómica se seleccionaron las cepas que por las pruebas fisiológicas y bioquímicas se asemejaban a las del género Azotobacter y fueron inoculadas en semillas de tomate (Solanum lycopersicum híbrido Yuval-810) y lechuga (Lactuca sativa cv. iceberg). El sustrato utilizado fue previamente sometido a tindalización. Las bandejas fueron esterilizadas en una cámara de flujo laminar con luz ultravioleta durante 10 minutos. Se utilizó un diseño experimental en bloques completos al azar con cuatro repeticiones para cada cultivo. Cada uno de los tratamientos constó de una bandeja de 162 alveolos y una vez sembradas, se procedió a la inoculación de las cepas bacterianas con 100 microlitros de solución bacteriana en cada semilla. Las variables medidas fueron: días de la germinación, altura de la planta (cm) y número de hojas durante cuatro semanas tras la siembra.
Los datos acerca de los efectos de los tratamientos fueron analizados utilizando el programa Infostat (www.infostat.com.ar) mediante análisis de varianza. Para comparar los tratamientos se utilizó el test de Tukey.
RESULTADOS Y DISCUSIÓN
En los suelos y rizosfera de los cuatro cultivos evaluados se aislaron un total de 26 cepas. En el cultivo de amaranto se obtuvo el mayor número de cepas aisladas, mientras que en el cultivo de zanahoria blanca no se encontraron cepas bacterianas para el medio selectivo Ashby manitol en las muestras de rizosfera (Tabla 1). Los aislamientos se obtuvieron mayoritariamente en concentraciones de 10-1, 10-3 y 10-5, no encontrándose presencia de crecimiento bacteriano a concentraciones de 10-7. La morfología de las cepas fue en forma de colonias irregulares y filamentosas, con forma celular de bacilos, diplobacilos y cocos, con elevación plana. La pigmentación de las cepas fue blanca, crema y amarillo.
De las 26 cepas se seleccionaron 12 para la evaluación de su potencial agronómico, en base a la fijación de amonio y a que sus características bioquímicas la asemejaban al género Azotobacter sp., un género muy utilizado en agricultura para la elaboración de biofertilizantes. Según Holt (2000) las bacterias del género Azotobacter son plemórficas sólas, en pareja o grupos irregulares, quimiorganotrofas, fijadoras de nitrógeno, catalasa positiva, gram negativas, crecen a pH = 7 y reaccionan al manitol. No obstante, cabe indicar que, para una mejor caracterización de las cepas, a nivel de especie, es necesario realizar análisis de biología molecular.
Tabla 1 Pruebas bioquímicas en las cepas aisladas de cultivos andinos.
| Cepa | Tinción Gram | Catalasa | Ureasa | Hipersensibilidad | Ashby Manitol | Fijación NH4 (mg/ml) |
|---|---|---|---|---|---|---|
| AR1 | + | + | + | - | + | 0,02 |
| AR2 | - | + | + | - | + | 0,01 |
| AR3 | - | + | - | - | + | 0,04 |
| AR4 | + | + | + | - | + | 0,04 |
| AS1 | - | + | - | - | + | 0,03 |
| AS2 | - | + | + | - | + | 0,03 |
| AS3 | - | + | + | - | + | 0,03 |
| AS4 | + | + | - | - | + | 0,03 |
| MR1 | - | + | + | - | + | 0,03 |
| MR2 | - | + | + | - | + | 0,03 |
| MR3 | + | + | + | - | + | 0,03 |
| MR4 | - | + | + | - | + | 0,03 |
| MR5 | - | + | + | - | + | 0,03 |
| MS1 | - | + | + | - | + | 0,03 |
| ZS1 | - | + | + | - | + | 0,02 |
| ZS2 | - | + | + | - | + | 0,03 |
| ZS3 | + | + | + | - | + | 0,02 |
| ZS4 | + | - | - | - | + | 0,03 |
| ZS5 | + | + | + | - | + | 0,01 |
| MsR1 | + | + | + | - | + | 0,03 |
| MsR2 | - | + | + | - | + | 0,03 |
| MsR3 | + | + | + | - | + | 0,03 |
| MsS1 | + | - | + | - | + | 0,02 |
| MsS2 | - | + | + | + | + | 0,03 |
| MsS3 | - | + | + | - | + | 0,03 |
| MsS4 | + | - | - | - | + | 0,03 |
AR: Amaranto rizosfera; AS: Amaranto suelo; MR: Mora rizosfera; MS: Mora suelo; ZS: Zanahoria blanca suelo; MsR: Mashua rizosfera; MsS: Mashua suelo.
Los días a la germinación en las semillas del cultivo de lechuga fueron similares en todos los tratamientos (Figura 1). En el cultivo de tomate, en cambio, si se observaron diferencias significativas en los tratamientos inoculados con dos cepas aisladas en el cultivo de amaranto (AR2, AS2) y en una cepa aislada en el cultivo de mora (MR1), adelantando el tiempo de germinación en 3-4 días con respecto al tratamiento control sin inocular. Estos resultados coinciden con los observados por Martínez, Dibut & Gonzalez (1993) quienes informaron que la inoculación de Azotobacter sp. en plantas de tomate acortaron el tiempo entre siembra y trasplante en 5-7 días. El efecto positivo de la inoculación sobre la germinación pudo deberse a la secreción de giberelinas por las bacterias (Sharma, 2005) ya que esta fitohormona está implicada en la germinación de las semillas. Las diferencias en el comportamiento observado entre las semillas de lechuga y tomate pueden explicarse por la alta especificidad que se establece entre la bacteria y la planta (CIAT, 1988), lo que puede incidir en la capacidad fijadora de nitrógeno y su posterior absorción por los cultivos.
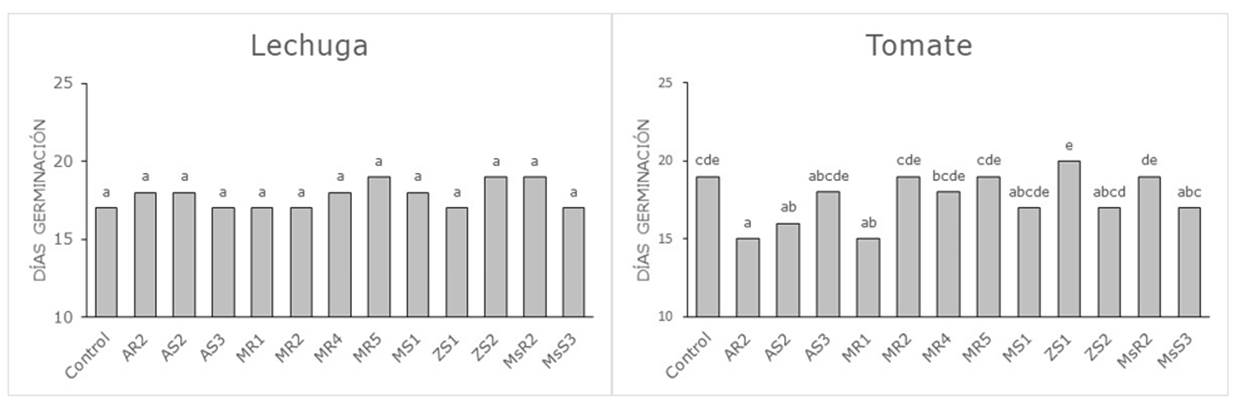
Figura 1 Días a la germinación en las semillas de lechuga y tomate inoculadas con las diferentes cepas bacterianas.
Control: Sin inocular; AR: Amaranto rizosfera; AS: Amaranto suelo; MR: Mora rizosfera; MS: Mora suelo; ZS: Zanahoria blanca suelo; MsR: Mashua rizosfera; MsS: Mashua suelo. Letras distintas en las columnas indican diferencias significativas a p<0,05.
La mayoría de las cepas inoculadas tuvieron efectos significativos sobre el crecimiento de las plantas de tomate y lechuga (Figura 2). En el caso de estudio de la lechuga, estos efectos se observaron más en la última medición, a los 28 días tras la germinación, en la que 9 de las 12 cepas estudiadas produjeron aumentos en el crecimiento en el rango del 45-125%. La cepa bacteriana que produjo un mayor aumento fue la aislada de la raíz de la mora, MR4. En las plantas de tomate los efectos también se observaron en mayor medida a los 28 días tras la germinación, donde 9 de las 12 cepas tuvieron un aumento de crecimiento significativo con respecto a las plantas sin inocular. En un ensayo con Azotobacter sp., en plantas de tomate, Escobar, Horna, Carreño & Mendoza (2011) observaron una influencia positiva en la altura de la planta. En el ensayo con tomate, las diferencias fueron menores que en el caso de la lechuga, con aumentos en el rango de 18-53% y también la cepa MR4 produjo el mayor aumento. El efecto beneficios de Azotobacter sp. en el crecimiento vegetal pudo deberse a un aumento en la fijación de nitrógeno que ayudó al crecimiento vegetativo de las plantas (Azcón & Barea, 1975).
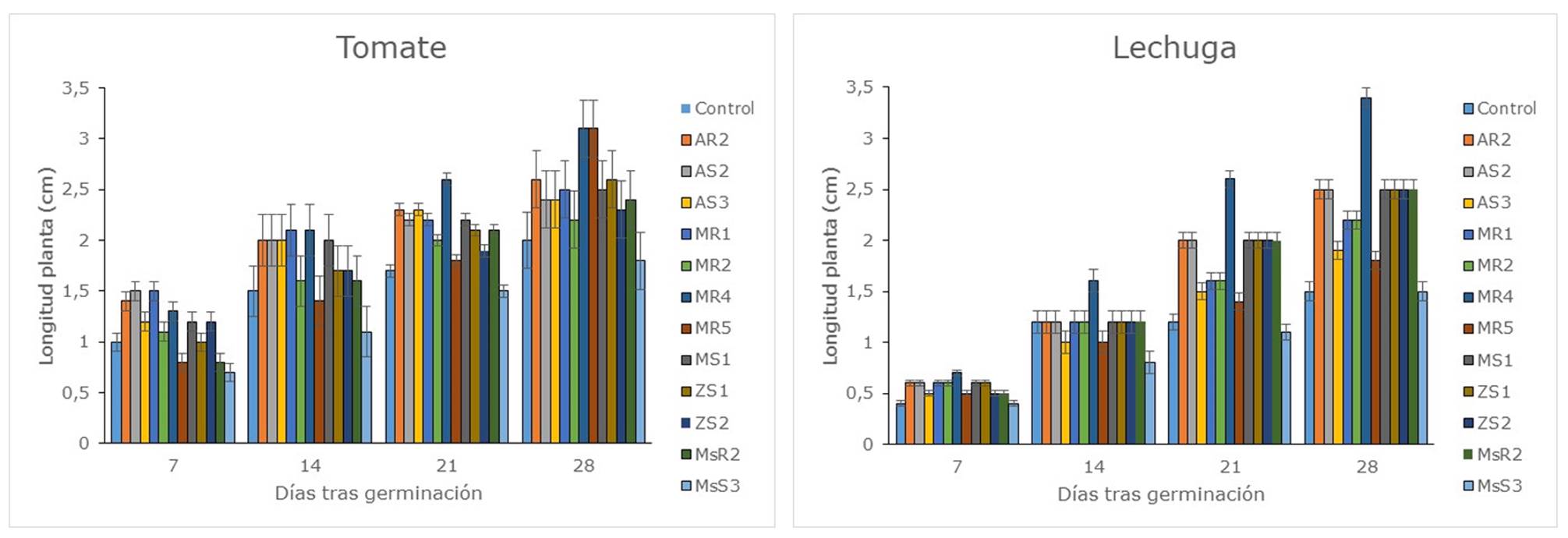
Figura 2 Altura de las plantas de lechuga y tomate inoculadas con las diferentes cepas bacterianas. Control: Sin inocular; AR: Amaranto rizosfera; AS: Amaranto suelo; MR: Mora rizosfera; MS: Mora suelo; ZS: Zanahoria blanca suelo; MsR: Mashua rizosfera; MsS: Mashua suelo.
En cuanto a los efectos de la inoculación de las bacterias sobre el número de las hojas en las plantas de lechuga y tomate también se observaron diferencias significativas (Figura 3). En las plantas de lechuga, a los 14 días tras la germinación se observó mayor número de hojas en 6 tratamientos, a los 21 días en un tratamiento y a los 28 días en 6 tratamientos. En el cultivo en semillero de tomate, los efectos en el número de hojas de los tratamientos fueron menores que en el cultivo de lechuga, observándose mayor número de hojas en 9 tratamientos a los 14 días tras la germinación, pero solo en un tratamiento a los 21 días y en 3 tratamientos a los 28 días. Reddy et al., (2018) obtuvieron mayor número de hojas en plantas de tomate inoculadas con Azotobacter sp. Varios estudios demostraron que la utilización de bacterias promotoras del crecimiento vegetal logró mejorar el crecimiento en plántulas de tomate y otras especies (Singh, Shah & Prasad, 2010; Noh Medina, Yam Chimal, Borges Gómez, Zúñiga Aguilar & Godoy Hernández, 2014).
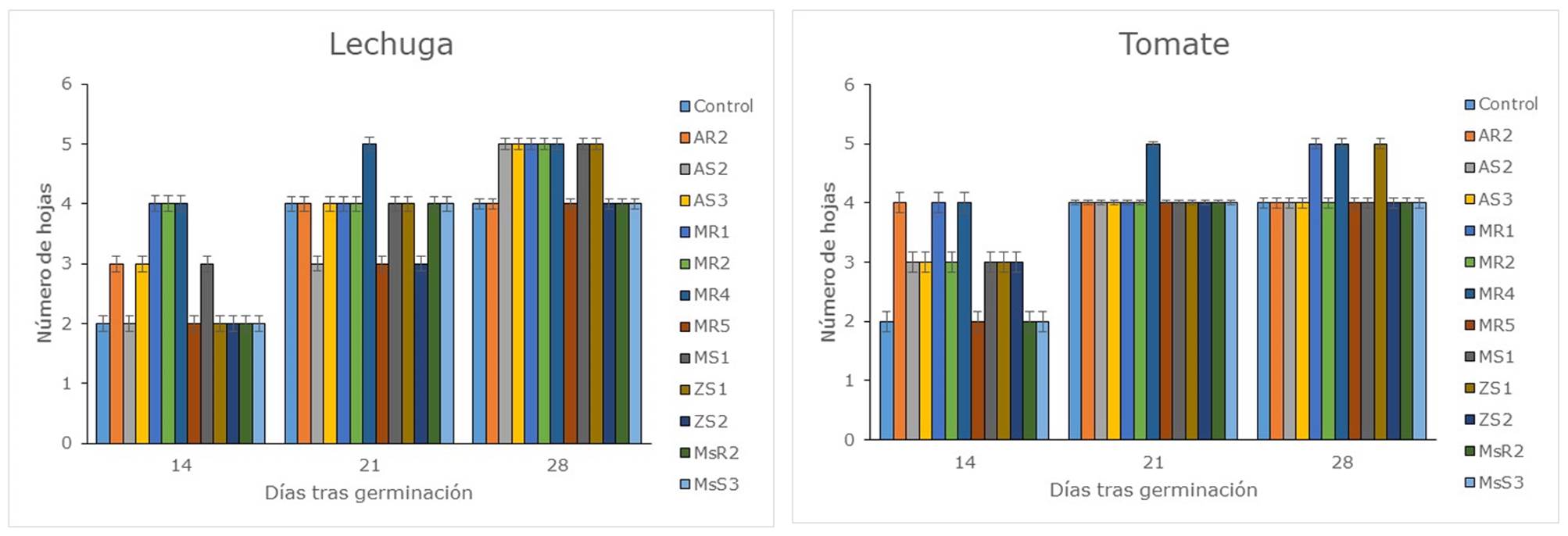
Figura 3 Número de hojas de las plantas de lechuga y tomate inoculadas con las diferentes cepas bacterianas. Control: Sin inocular; AR: Amaranto rizosfera; AS: Amaranto suelo; MR: Mora rizosfera; MS: Mora suelo; ZS: Zanahoria blanca suelo; MsR: Mashua rizosfera; MsS: Mashua suelo.
Basándose en los resultados, se confirma que la mayoría de las cepas tienen potencial para el desarrollo de biofertilizantes para mejorar la producción de cultivos y la fertilidad del suelo, aunque es necesario realizar más pruebas, principalmente en campo, antes de promover aplicaciones comerciales.
CONCLUSIONES
La utilización de bacterias fijadoras de nitrógeno atmosférico de vida libre aisladas en suelos sembrados con diferentes cultivos andinos demuestra su capacidad para mejorar tanto el crecimiento en altura como en el número de hojas en las primeras fases en plantas de tomate y lechuga. Existe especificidad entre la bacteria y la planta como se observa en los diferentes resultados obtenidos en distintos cultivos. Los resultados obtenidos difieren en ambos cultivos utilizados por lo que se sugiere una especificidad entre la bacteria y la planta. Aun así, las bacterias aisladas en la rizosfera de un cultivo de mora andina muestran mayores efectos en ambos cultivos. Un mayor conocimiento de estas interacciones puede ser útil para el desarrollo de técnicas de nutrición vegetal que mejoren la sustentabilidad de los cultivos.















