INTRODUCCIÓN
Uno de los principales rubros de producción de muchas familias del Departamento Central es la frutilla (Fragaria × ananassa Duchesne) ya que representa un rubro de gran importancia social y económica. La producción anual alcanza más de 3.000 toneladas siendo los distritos de Areguá, Itauguá e Ypacaraí las áreas frutilleras más importantes en Paraguay (Doldán Larrea y González, 2013; Dirección General de Estadística Encuestas y Censos, 2016).
Entre los principales problemas fitosanitarios que pueden presentarse en el cultivo de frutilla, se encuentran las enfermedades fisiológicas, causadas por desórdenes genéticos, falta/exceso de fertilizantes, heladas, deriva de herbicidas, etc. (Paulus, 1990; Neri, Baruzzi, Massetani, & Faedi, 2012); y las enfermedades causadas por microorganismos patógenos como la bacteriosis (Xanthomonas fragariae) (Gétaz, van der Wolf, Blom y Pothier, 2017), mancha marrón (Pestalotiopsis sp.) (Chamorro, Aguado & De los Santos, 2016), moho gris (Botrytis cinerea) (Petrasch, Knapp, van Kan & Blanco-Ulate, 2019), y antracnosis (Colletotrichum spp.) (Han et al., 2016).
La antracnosis, causada por un complejo de especies del género Colletotrichum (C. fragariae, C. acutatum y C. gloeosporioides), es una de las enfermedades más importantes de la frutilla debido a que puede dañar cualquier órgano de la planta: raíces, estolón, corona, hojas, yemas, pecíolos, flores y frutos (Garrido et al., 2009). Los síntomas de esta enfermedad son frutos inmaduros momificados, mientras que los maduros presentan lesiones de color castaño-oscuro, circulares, de centro hundido y bordes levantados. También provoca la pudrición de rizomas causando el marchitamiento y seca progresiva de las plantas (Aguado et al., 2014). Esta enfermedad es de difícil control debido a la gran capacidad de esporulación y la facilidad de diseminación de las esporas de Colletotrichum tanto por viento como por agua (Paynter, Gomez, Ko & Herrington, 2016).
Son pocos los fungicidas adecuados para el cultivo de frutilla, y muchos de ellos presentan largos periodos de carencia, razón por la cual este cultivo está entre los más propensos a contener residuos de fungicidas (McInnes, Black y Gatti et al., 1992; Han et al., 2018). La preocupación pública por residuos en los productos comestibles y el medio ambiente, además de la selección de cepas fitopatógenas resistentes a fungicidas, han acelerado la búsqueda de estrategias alternativas de control de enfermedades, siendo una de ellas el control biológico (Mochizuki, Yamamoto, Aoki & Suzuki, 2012; Benítez-Díaz, Miranda-Contreras, Balza-Quintero, Sánchez-Gil & Molina-Morales, 2015). La búsqueda de agentes de control biológico que puedan disminuir el inoculo inicial del patógeno es una intensiva pero necesaria tarea. Esto se debe a que agentes de control biológico previamente adaptados a las condiciones del medio al que son reintroducidos presentan una mayor efectividad (Sanabria Velázquez y Grabowski, 2016)
Trichoderma spp. es un hongo antagonista de varios patógenos de plantas. Existen reportes que indican que este tiene efecto antagonista sobre hongos del suelo como Phytophthora capsici (Bae et al., 2016), Pythium ultimun (Roberts et al., 2016), Sclerotium rolfsii (Louzada et al., 2016), Macrophomina phaseolina (Garcete Gómez y Orrego Fuente, 2011; Franco y Orrego Fuente, 2013). Las colonias de este hongo biocontrolador son fácilmente reconocibles por su crecimiento rápido y su color verde. Primeramente, presenta un micelio blanco, pocos días después toma un color verde, por la aparición de estructuras reproductivas (Carvalho et al., 2018). La versatilidad, adaptabilidad y fácil manipulación de los hongos de este género ha permitido su uso en el control biológico (Fernández-Larrea Vega, 2001, Diánez Martínez, Santos, Carretero & Marín, 2016).
En Paraguay se han realizado varios trabajos experimentales investigando el uso de Trichoderma en varios cultivos como soja (Franco y Orrego Fuente, 2013), sésamo (Garcete Gómez y Orrego Fuente, 2011), menta (Orrego Fuente et al., 2010), macadamia (Sanabria Velázquez y Grabowski, 2016) y estevia (Gamarra Sosa, 2013). Sin embargo, no se han redactado aun protocolos específicos para la evaluación de aislados nativos de Trichoderma spp. como agentes de control biológico en el cultivo de frutilla (Chiriboga, Gómes y Garces, 2015). Tampoco existen productos comerciales desarrollados utilizando como ingrediente activo cepas de Trichoderma spp. nativas de Paraguay (Grabowski, Orrego y Soilán, 2014). Por ello se planteó la realización de ensayos exploratorios para la selección de agentes biocontroladores y la evaluación del efecto ejercido por estos sobre la producción de frutilla. Este tipo de estudios permitirán ajustar las metodologías necesarias para la obtención de información confiable sobre el efecto de agentes biocontroladores en cultivos y sistemas de producción específicos, lo cual posibilitará que en el futuro se desarrollen bioinsumos agrícolas formulados a base de cepas de Trichoderma nativas del Paraguay.
Este trabajo es el primer reporte de la evaluación del efecto de aislados nativos de Trichoderma spp. en condiciones in vitro y de campo sobre el cultivo de frutilla en Paraguay. El objetivo fue seleccionar aislados nativos del género Trichoderma como biocontroladores de Colletotrichum spp., para ello se midió para cada aislado la velocidad media de crecimiento, el grado de sobreposición micelial y la capacidad de inhibición de crecimiento in vitro de Colletotrichum spp. y se evaluó el efecto de la aplicación de la suspensión de esporas de aislados de Trichoderma sobre la producción de frutilla bajo condiciones de infección natural del patógeno.
MATERIALES Y MÉTODOS
Aislamiento y preservación de Trichoderma spp.
Tabla 1. Muestras de suelo georreferenciadas para la obtención de aislados de Trichoderma spp.. CIHB-IPTA. Caacupé, Paraguay. 2014.
| Código de la muestra | Aislados de Trichoderma | Localidad | Coordenadas |
|---|---|---|---|
| 1KH | TKC14-01 | Cordillera | S 25,3883413 W 57, 1869743 |
| 2KH | TKC14-02 | Cordillera | S 25,38839495 W 57,1846740 |
| 3KH | TKC14-03 | Cordillera | S 25,38807153 W 57,18603803 |
| 1 Picofrutilla 4 | TFC14-04 | Cordillera | S 25,38756 W 57,18980 |
| 1 Picofrutilla 6.1 | TFC14-05 | Cordillera | S 25,38763 W 57,18969 |
| 1 Picofrutilla 6.2 | TFC14-06 | Cordillera | S 25,38765 W 57,18960 |
| C2 (Muestra de referencia) | TFLE-07 | Ecuador | ---------------------------- |
| C12(Muestra de referencia) | TFLE-08 | Ecuador | ---------------------------- |
El aislamiento de Trichoderma spp. se realizó mediante una adaptación del método de dilución del suelo. Este método consistió en diluir 3 g de suelo en 100 mL de agua destilada estéril y agitar la suspensión. Posteriormente, bajo la cámara de flujo laminar se retiró y colocó 1 mL de la suspensión en una placa de Petri esterilizada. Luego, se adicionó el medio de cultivo PDA (Papa-Dextrosa-Agar), y se agitó suavemente. Las placas fueron incubadas a 28ºC durante 5 días en la incubadora (Insaurralde, Sanabria Velázquez, Verdina, Sotelo & Barúa, 2017). Al cabo de los 5 días de incubación, se realizó la identificación morfológica de Trichoderma spp., utilizando las claves de identificación de Barnett & Hunter (1998). Se procedió a la monosporización del cultivo puro a fin de asegurar la pureza genética de los aislados. Para ello se agregó a la placa de Petri 10 mL de agua estéril y se removieron cuidadosamente las esporas del hongo con un ansa estéril raspando la superficie de la colonia. A partir de esta suspensión de esporas se realizaron diluciones sucesivas de 1:10, 1:100 y 1:1000, de esta última dilución se tomó 0,1 mL de la suspensión y se distribuyó en el centro de la placa de Petri. Los cultivos de Trichoderma spp. se incubaron durante 48 h a 25°C y las colonias individuales obtenidas a partir de una sola espora se transfirieron nuevamente a placas de Petri con medio de cultivo PDA. Los cultivos monospóricos de Trichoderma spp. fueron codificados y preservados en tubos de ensayo con medio de cultivo PDA a una temperatura de 4ºC (Tabla 1). Para los experimentos se extrajo una pequeña porción de micelio del hongo y se transfirió a las placas de Petri con medio de cultivo PDA. Dos de los aislados procedentes de Ecuador, TFLE-07 y TFLE-08, fueron proveídos por el Instituto Interamericano de Cooperación para la Agricultura (IICA) como aislados de referencia.
Aislamiento y preservación de Colletotrichum spp.
Las muestras de tejido vegetal colectadas de plantas de frutilla con síntomas de antracnosis se lavaron con agua corriente y fueron cortadas en trozos de 1 a 2 cm, después se desinfestaron mediante una solución con etanol (OH) al 70% y otra de hipoclorito de sodio (NaClO) al 2%, seguidamente se realizó un triple enjuague en agua destilada estéril, se dejó secar el tejido vegetal y se transfirió a placas de Petri con medio de cultivo PDA bajo cámara de flujo laminar. Posteriormente, se dejaron incubar a 28ºC durante 8 días. Para el reconocimiento de Colletotrichum spp. se observaron las colonias mediante el estereoscopio y el microscopio óptico identificando las estructuras típicas del hongo. Para la obtención del cultivo monospórico del hongo Colletotrichum spp., se realizaron diluciones y se sembraron en medio de cultivo PDA, luego mediante repiques de las colonias originadas a partir de una sola espora utilizando agujas de disección se obtuvo el cultivo puro del hongo, el cual fue preservado en tubos de ensayo con medio de cultivo PDA a una temperatura de 4ºC (French y Hebert, 1980).
Selección de aislados de Trichoderma spp. in vitro
El experimento se realizó en el Laboratorio de Patología de Hortalizas del Dpto. Fitopatología ubicado en el Centro de Investigación “Ing. Agr. Hernando Bertoni” en la ciudad de Caacupé, Paraguay. El trabajo fue desarrollado entre los meses de febrero y agosto de 2014. Este ensayo consistió en confrontar en cultivo pareado cada uno de los 8 aislados de Trichoderma spp. obtenidos de parcelas productoras de frutilla.
Se utilizó un Diseño Completamente al Azar (DCA) con 9 tratamientos siendo 8 los aislados de Trichoderma spp., enfrentados cada uno con Colletotrichum spp., y un testigo consistente en un cultivo puro del patógeno sin competencia. Cada tratamiento contó con 5 repeticiones, resultando 45 unidades experimentales, las cuales consistieron en una placa de Petri cada una. Para seleccionar los aislados de Trichoderma spp. con capacidad antagónica ante Colletotrichum spp. se empleó la técnica de cultivo pareado mencionada por Bell, Wells & Markham (1982) (Figura 1), la cual consistió en enfrentar dos discos de 5 mm de diámetro de Trichoderma spp. y del fitopatógeno Colletotrichum spp. obtenidos con un sacabocados y posicionarlos 7 cm separados entre sí en una placa de Petri de 9 cm con medio de cultivo PDA, incubando luego a 25ºC hasta que el tratamiento testigo haya cubierto totalmente la superficie del medio.
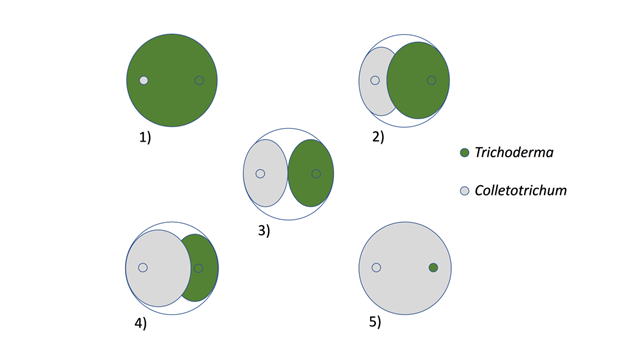
Figura 1 Escala propuesta por Bell et al. (1982) para la evaluación y clasificación del antagonismo. 1) Trichoderma spp. sobrecrece completamente al patógeno y cubre totalmente la superficie del medio 2) Trichoderma spp. sobrecrece las dos terceras partes de la superficie del medio. 3) Trichoderma spp. y el patógeno colonizan cada uno aproximadamente la mitad de la superficie y ningún organismo parece dominar al otro. 4) El patógeno coloniza las dos terceras partes de la superficie del medio y parece resistir a la invasión por Trichoderma spp. 5) El patógeno sobrecrece completamente a Trichoderma spp.. CIHB-IPTA. Caacupé, Paraguay. 2014.
Se evaluó la actividad antagónica de los aislados de Trichoderma spp. mediante la medición de la velocidad de crecimiento micelial promedio (mm día-1) y la sobreposición del micelio de Trichoderma spp. y el fitopatógeno Colletotrichum spp., para ello se utilizó la escala propuesta por Bell et al. (1982) (Figura 1). También se calculó el porcentaje de inhibición de crecimiento del patógeno mediante la siguiente fórmula adaptada de Franco y Orrego Fuente (2013): I = 100 - [(LMPCP / LMPCI)]*100. Donde: I: Inhibición del crecimiento de Colletotrichum spp. (%); LMPCP: Longitud del crecimiento de Colletotrichum spp. en cultivo pareado (mm); LMPCI: Longitud del crecimiento de Colletotrichum spp. en cultivo individual (mm).
Preparación suspensión de esporas de aislados nativos de Trichoderma spp.
Para la producción masiva los aislados seleccionados TKC14-03, TFC14-06 y TFLE-08 se repicaron en medio de cultivo PDA e incubaron a 25ºC durante 5 días. Posteriormente, se preparó una suspensión de 100 mL de Trichoderma spp. en agua destilada esterilizada, raspando superficialmente los propágulos contenidos en las placas cultivadas de manera a liberar los conidios del hongo. Luego con ayuda de una pipeta estéril se dispensó la suspensión de esporas de cada aislado de Trichoderma spp. en bolsas de polipropileno con 250 g de arroz y 125 mL de agua destilada, previamente esterilizadas en autoclave a 121ºC por 20 minutos. Una vez dispensada la suspensión de conidios, las bolsas con arroz se incubaron con luz artificial a temperatura ambiente (28-32ºC) durante 15 días. Transcurrido este periodo de tiempo el arroz adquirió una coloración verde debido a la formación de conidióforos y conidios de Trichoderma spp. (Sawangsri, Pengnoo, Suwanprasert & Kanjanamaneesathian, 2007). A continuación, se procedió a la cosecha de esporas agitando el arroz colonizado contenido en el recipiente Erlenmeyer de manera a liberar los conidios del hongo. Se adicionó agua y se diluyó la suspensión hasta obtener una concentración de 108 esporas/mL la cual fue distribuida en botellas de 1 L. La suspensión fue conservada durante 3 días a temperatura de 10ºC.
Efecto de aislados nativos de Trichoderma sobre la producción de frutilla en condiciones de campo
Las aplicaciones semanales de la suspensión de esporas de Trichoderma spp. se realizaron en las parcelas experimentales de frutilla de la variedad Dover bajo condiciones de infección natural de antracnosis, las cuales fueron tratadas únicamente con extractos de plantas para el control de ácaros, ubicadas en el Programa de Investigación de Cultivos Olerícolas (PICO) del Centro de Investigación Hernando Bertoni (CIHB), Caacupé. El periodo de aplicación estuvo comprendido entre los meses de julio y agosto de 2014 (total de 60 días).
Para la aplicación de la suspensión de esporas de Trichoderma spp. se empleó un pulverizador tipo mochila de 20 L con pico del tipo cono hueco, de uso exclusivo para productos biológicos. La dosis utilizada fue un litro de suspensión de esporas por cada 20 L de agua, obteniendo una concentración final de 5x106 esporas/mL. Se mezcló con agua y se agitó apropiadamente el pulverizador de manera a mejorar el mezclado y que el caldo sea homogéneo. La aplicación del caldo se realizó a la altura de la base de la planta.
Para el ensayo se utilizó el Diseño de Bloques Completamente al Azar (DBCA), con dos tratamientos y cinco repeticiones. Se consideró como unidad experimental el promedio de frutos obtenidos de cada bloque durante diferentes fechas de evaluación. En el tratamiento con Trichoderma el sustrato de las plantas fue tratado con una mezcla de tres aislados de Trichoderma spp. (TKC14-03, TFC14-06 y TFLE-08). Por otro lado, el tratamiento testigo consistió en plantas no tratadas con la suspensión. Para la evaluación, los frutos de frutilla se cosecharon en bolsas individuales. En cada cosecha se hizo un contaje del total de frutas y se las clasificó en sanas o enfermas mediante la observación directa y se calculó área bajo la curva de progreso de la enfermedad (AUDPC).
Análisis estadísticos
Los datos obtenidos, en ambos experimentos, fueron sometidos al análisis de Varianza (ANAVA), y al encontrarse diferencias significativas entre los tratamientos se aplicó el test de Tukey al 5% de probabilidad de error. Para los análisis estadísticos se utilizó el paquete estadístico InfoStat® (Di Rienzo et al., 2008).
RESULTADOS Y DISCUSIÓN
Tabla 2 Velocidad de crecimiento, escala de Bell y porcentaje de inhibición del crecimiento de Colletotrichum spp. enfrentado a aislados de Trichoderma spp. durante las pruebas de antagonismo in vitro. CIHB-IPTA. Caacupé, Paraguay. 2014.
| Aislado de Trichoderma | Velocidad (mm/día)* | Escala de Bell** | Inhibición del crecimiento (%)* |
|---|---|---|---|
| TFC14-04 | 17,1 a | 2 | 67,78 a b c |
| TFC14-06 | 16,7 a | 2 | 74,44 a |
| TFC14-05 | 16,6 a | 2 | 71,11 a b |
| TKC14-03 | 15,9 a b | 2 | 56,67 c d |
| TKC14-01 | 15,2 a b | 3 | 51,33 d |
| TKC14-02 | 14,9 a b c | 3 | 50,00 d |
| TFLE-07 | 13,6 b c | 3 | 59,56 b c d |
| TFLE-08 | 12,7 c | 3 | 52,22 d |
| Testigo | ---- | ---- | 0,00 e |
(*) Medias seguidas por la misma letra no difieren entre sí por el test de Tukey al 5% de probabilidad de error.
(**) Escala adaptada de Bell et al. (1982).
En la Tabla 2 se observa el crecimiento micelial lineal medido en mm/día (velocidad de crecimiento) para los 8 aislados de Trichoderma spp. a las 72 horas de incubación. Se hallaron diferencias significativas entre los aislados de Trichoderma spp. en cuanto su velocidad de crecimiento lineal, registrándose valores de 12,7 hasta 17,1 mm/día. Para los aislados TFC14-04, TFC14-06, TFC14-05, TKC14-03, TKC14-01, TKC14-02 no se encontraron diferencias estadísticas en cuanto a la velocidad de crecimiento lineal en cultivo pareado con Colletotrichum spp., observando crecimientos lineales de 14,9 a 17,1 mm/día.
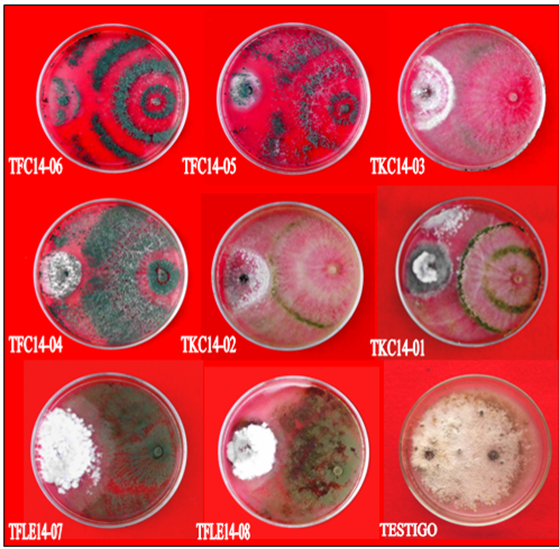
Figura 2 Sobreposición de colonias en cultivo pareado: Colletotrichum spp. (izquierda) y Trichoderma spp. (derecha). CIHB-IPTA. Caacupé, Paraguay. 2014.
Para el aislado TKC14-02 se observó un crecimiento lineal de 14,9 mm/día, no diferenciándose estadísticamente de los aislados TKC14-02, TFLE-07 y TFLE-08 cuyo crecimiento micelial fue el más lento entre todos los aislados con 12,7 mm/día. Los valores de crecimiento micelial lineal de los aislados evaluados en este ensayo fueron menores a los verificados en trabajos anteriores de control de fitopatógenos del suelo con aislados de Trichoderma spp. como los de Franco y Orrego Fuente (2013) quienes registraron valores máximos de 20,25 mm/día.
En cuanto a los grados de la escala de Bell et al. (1982) también se verificaron diferentes valores para los aislados de Trichoderma spp.. Para los aislados TFC14-04, TFC14-06, TFC14-05, TKC14-03 se registraron valores iguales a 2, lo que equivale a que los aislados de Trichoderma spp. sobrecrecieron las dos terceras partes de la superficie del medio. Los aislados TKC14-01, TKC14-02, TFLE-07, TFLE-08 y el patógeno Colletotrichum spp. colonizaron cada uno aproximadamente la mitad de la superficie y ningún organismo pareció dominar al otro, obteniendo el valor 3 de la escala.
Se verificaron diferencias significativas entre los aislados de Trichoderma spp. en cuanto a los porcentajes de inhibición de crecimiento de Colletotrichum spp. registrándose porcentajes de inhibición de 50,00 hasta 74,44% (Figura 2). Todos los aislados de Trichoderma spp. se diferenciaron del tratamiento testigo. Los aislados TKC14-03, TKC14-01, TKC14-02, TFLE-07 y TFLE-08 no fueron estadísticamente diferentes entre sí presentando porcentajes de inhibición de crecimiento de Colletotrichum spp. de entre 50,00 y 56,67%, sin embargo, estos dos aislados sí presentaron diferencias estadísticas respecto al aislado TFC14-06 el cual presentó un 74,44% inhibición de crecimiento del patógeno. Los aislados TFC14-04 y TFC14-05 no se diferenciaron estadísticamente entre sí, observándose porcentajes de inhibición de crecimiento de 67,78 a 71,11%. Estos valores son superiores a los registrados por Franco y Orrego Fuente (2013) quienes observaron 50,2% como máxima de inhibición de crecimiento del patógeno de suelo Macrophomina phaseolina al seleccionar aislados nativos de Trichoderma spp. para el tratamiento de semillas de soja.
Efecto de aislados nativos de Trichoderma sobre la producción de frutilla en condiciones de campo
No se hallaron diferencias significativas entre las plantas de frutilla tratadas con la suspensión de Trichoderma spp. y las no tratadas (testigo) en cuanto al efecto sobre el número total de frutas cosechadas semanalmente, registrándose un promedio de 24 frutas/planta para las tratadas con Trichoderma spp. y 22 frutas/planta para el testigo. No se observaron efectos fitotóxicos de la suspensión de esporas de Trichoderma spp. sobre las plantas o los frutos cosechados semanalmente. Tampoco se verificaron diferencias significativas en cuanto al efecto de la aplicación de la suspensión de Trichoderma sobre la incidencia de antracnosis en frutos de frutilla (Figura 3). Posibles causas de esto podrían ser la falta de inóculo de Colletotrichum spp. o condiciones poco favorables para el desarrollo de la enfermedad dando como resultado una baja incidencia. La inoculación de plantas en forma natural en condiciones de campo es muy arriesgada, debido a que, en casos como este, la baja presión de la enfermedad no permite observar diferencias significativas entre tratamientos. Se deberán centrar esfuerzos de manera a superar esta dificultad asegurando condiciones favorables para la enfermedad que posibiliten la evaluación de bioinsumos destinados a la protección vegetal (Budge y Whipps, 1991; Barratt, Moran, Bigler & van Lenteren, 2018).
De la misma manera no se observó control de la enfermedad causada por Macrophomina phaseolina en plantas de sésamo previamente tratadas con el producto comercial Trichonat® (Natural Rural S.A., Araraquara-SP, BR) formulado a base de cepas de Trichoderma nativas del Brasil. Sin embargo, sí se observó el efecto de la aplicación del formulado sobre la longitud de las raíces y altura de las plantas (Colman, 2011). Este efecto no fue observado durante las aplicaciones de la suspensión de esporas de aislados de Trichoderma paraguayos previamente seleccionados en pruebas in vitro en este trabajo. Por el contrario, los resultados en este experimento sí concuerdan con Orrego Fuente et al. (2010) quienes obtuvieron observaciones inconsistentes durante evaluaciones del efecto de las aplicaciones foliares de los productos comerciales Trichonat® y Biorrent® para el control de enfermedades en menta (Mentha arvensis L).
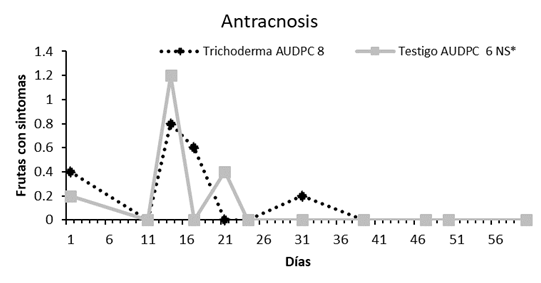
Figura 3 AUDPC para antracnosis en cultivos de frutilla de la variedad Dover tratadas con la suspensión de Trichoderma spp.. NS*: Diferencia no significativa al 5% de probabilidad de error. Caacupé, Paraguay. 2014.
Esto genera cuestionamientos acerca de las metodologías más adecuadas que podrían utilizarse para el screening de cepas nativas de Trichoderma spp.. Primeramente, información acerca del modo de acción y efectos ambientales (humedad, temperatura, radiación) deben ser obtenidos de experimentos in vitro. Posteriormente, se debe poner énfasis en el uso de bioensayos que permitan evaluar las condiciones ambientales requeridas para la efectiva implementación del control biológico (Steyaert et al., 2016).
Ensayos in vitro fueron la norma para el estudio de agentes de control biológico durante 1980 e inicios de los años 1990, época durante la cual la mayoría de los trabajos pioneros sobre control biológico fueron llevados a cabo. Subsiguientemente, la mayoría de estos ensayos implicaron ensayos con plantas en invernadero o campo (Whipps, 1987; Budge y Whipps 1991; Bunbury-Blanchette & Walker, 2019). Durante estos experimentos reducciones en la incidencia de enfermedades fueron reportados, pero solo parcialmente, lo cual es inconveniente para los productores que esperan obtener un control total de la enfermedad (Bennett, Leifert & Whipps, 2003).
El Instituto Paraguayo de Tecnología Agraria (IPTA) con el apoyo del Instituto Interamericano de Cooperación para la Agricultura (IICA) ha impulsado la investigación para el desarrollo y producción de bioinsumos para control biológico de enfermedades principalmente dirigido a pequeños productores hortícolas (Chiriboga et al., 2015). El uso y comercialización de productos a base de aislados de Trichoderma nativos del Paraguay como agente de control biológico en un programa de manejo integrado (MIP) para pequeños productores todavía tiene un largo camino. Primeramente, el screening de cepas a gran escala es todavía requerido de manera a encontrar cepas de Trichoderma que controlen enfermedades bajo condiciones ambientales específicas. Cualquier aislado candidato que tenga éxito en esta fase deberá ser apropiadamente caracterizado taxonómica y fisiológicamente de manera a asegurar un control reproducible bajo las condiciones de campo. Posteriormente, formular estos aislados de manera que puedan ser distribuidos y aplicados por los productores. Finalmente, será necesaria la realización del registro del formulado en el Servicio Nacional de Calidad y Sanidad Vegetal y de Semillas (SENAVE), este proceso por sí mismo puede tomar mucho tiempo y ser una limitante para obtener un bioinsumo a base de cepas nativas paraguayas en corto tiempo. Aún queda pendiente la discusión de si cepas promotoras de crecimiento deben ser registradas como tales o como defensivos agrícolas. Para ello, más experimentos que permitan identificar los mecanismos de acción de los aislados de Trichoderma son necesarios, siendo la inducción de resistencia y promoción de crecimiento uno de estos mecanismos (De Meyer, Bigirimana, Elad & Höfte, 1998; Lamdan, Shalaby, Ziv, Kenerley & Horwitz, 2015).
CONCLUSIONES Y RECOMENDACIONES
En las condiciones en las que se realizaron los experimentos y en base a los resultados obtenidos se concluye que:
- Los aislados de Trichoderma spp. obtenidos de diferentes parcelas de frutilla presentan diferencias en cuanto a la velocidad media de crecimiento, el grado de sobreposición micelial y su capacidad de inhibición de crecimiento de Colletotrichum spp. in vitro. Los aislados de Trichoderma spp. TFC14-04, TFC14-06, TFC14-05 seleccionados durante las pruebas in vitro presentan potencial antagónico ante Colletotrichum spp.. Se recomienda realizar experimentos que permitan identificar otros posibles mecanismos de acción de los diferentes aislados de Trichoderma, así como la identificación a nivel de especies utilizando técnicas de biología molecular.
- No se observan diferencias significativas en cuanto al efecto de la aplicación de la suspensión de esporas de aislados nativos de Trichoderma TKC14-03, TFC14-06 y TFLE-08 sobre el número de frutos de frutilla cosechados durante los ensayos de campo. Tampoco se observan efectos significativos sobre el número de frutos con síntomas de antracnosis entre los tratamientos testigo y tratados en condiciones de infección natural del fitopatógeno. Para futuros estudios se recomienda realizar inoculaciones artificiales con el patógeno durante ensayos de campo y al mismo tiempo ensayos de invernadero donde las condiciones ambientales puedan ser controladas.















