INTRODUCCIÓN
Del género Polystachya (del griego poly=muchos y stachis=espigas o mazorcas, en alusión a que muchas especies tienen las flores agrupadas en cortos racimos) se conocen más de 200 especies, de las cuales solo cuatro habitan en Bolivia. El género presenta una amplia distribución tanto en África, Asia como en América tropical (Vásquez y Ibish, 2004). En Argentina se extiende por las provincias de Misiones, Corrientes, Salta y Jujuy (Johnson, 2001). Es una planta herbácea epífita o raramente litofitica mediana que no supera los 15-20 cm de altura, con pequeños pseudobulbos no siempre perceptibles y densamente distribuidos sobre el rizoma abreviado. Posee una inflorescencia apical erguida, racemosa apiculada de 20 cm de longitud, multiflora, con las flores distribuidas en el tercio apical. La floración ocurre de enero a abril y crece en lugares húmedos y sombríos, generalmente enraizada entre musgos y o líquenes sobre rocas o ramas (Johnson, 2001). Según este autor, una de las características más llamativa de la familia de orquídeas se da en sus aspectos florales que, en la gran mayoría de los casos, coevolucionan con sus polinizadores. Aunque hay algunas orquídeas que se autopolinizan y como ejemplo cita las flores cleistogámicas de Polystachya concreta y Pleurosthallis triperantha.
La obtención de plantas de orquídeas a través del cultivo in vitro de semillas es una valiosa herramienta cuando se trata de propagar especies (Flachsland, Terada, Rey y Mroginski, 1996) o híbridos. Este método es utilizado en forma rutinaria en el Jardín Botánico de Kew, para producir especímenes de especies difíciles de conseguir por otros métodos. De esta manera se obtiene material reproducido artificialmente que son incorporados a las colecciones y también se evitan continuas extracciones de plantas silvestres (Fay y Clemente, 1977; Thompson, 1980).
Desde 2010 se viene ejecutando un proyecto de investigación en la Facultad de Ciencias Agropecuarias de Oro Verde, Entre Ríos (PID-UNER 2144, 2009) cuyo objetivo es propagar por técnicas de cultivo in vitro especies terrestres y epífitas de orquídeas nativas de la Provincia de Entre Ríos, hasta la etapa de aclimatación de plantas, confeccionando los respectivos protocolos de micropropagación y aclimatación. Los resultados del proyecto fueron transferidos a aficionados, viveristas y público en general, a través de charlas técnicas y cursos de capacitación, lo cual contribuye a la toma de conciencia en preservación de especies nativas y a la compra de plantas producidas por esta técnica. En tal sentido en 6 años se ha logrado la micropropagación y aclimatación de 12 especies nativas y dos híbridos (Lallana y García, 2016) con sobrevivencia de plantas en invernáculo de 70 al 100%, evaluada en periodos de 3 a 10 meses según las especies (Lallana y Wagner, 2017).
En un trabajo previo (Billard, Barsanti y Lallana, 2014) lograron la germinación axénica de P. concreta con un 98% de germinación a los 48 días y el establecimiento de plantas a los 9 meses de cultivo in vitro. Empleando sustratos comerciales de naturaleza orgánica alcanzaron más del 90% de supervivencia de las plantas en invernáculo, evaluada a los 90 días de aclimatación.
Es conocido que las plantas de orquídeas crecen lentamente y que la floración de plantas jóvenes puede tardar varios años (Thompson, 1980). Indudablemente se busca la floración de la especie en el menor tiempo posible, con fines a su comercialización. Existe muy poca información de los ciclos de vida de las especies desde germinación a primera floración si bien hay autores que estiman este periodo entre 3 y 5 años o más (Thompson, 1980; Rodríguez, González, Alvarado y Telles, 2007).
En Argentina existe muy poca información sobre el cultivo, ciclo de vida y producción de semillas de las especies nativas de orquídeas (Lallana y Di Persia, 2018). Chemisquy, Prevosti & Morrone (2009) plantea que hay poca información y descripción de las semillas de orquídeas terrestres argentinas. Tal como lo plantea Augustine, Yogendra & Sharma (2001), los estudios sobre morfología de semillas tan pequeñas como las orquídeas resultan de utilidad para resolver problemas de taxonomía, filogenia, fitogeografía y biología de las semillas.
Los objetivos de este trabajo son: a) evaluar la floración y fructificación de plantas de P. concreta, b) la producción de semillas (número por fruto y masa) y c) su calidad a través la prueba de viabilidad.
MATERIALES Y MÉTODOS
Se sembraron semillas (junio 2012) en medio axénico de Murshigue y Skoog (1962) al 50% y las plantas fueron cultivadas in vitro y repicadas cada 60-90 días en el mismo medio en el laboratorio de Cultivos de Tejidos Vegetales de la Facultad de Ciencias Agropecuarias de la UNER, durante 21 meses (grupo I) y 26 meses (grupo II). Posteriormente, en marzo (grupo I) y agosto (grupo II) de 2014, fueron aclimatadas 30 días en condiciones de laboratorio en bandejas multiceldas con sustrato TerraFértil® (compuesto por compost orgánico, turba de Sphagnum, acícula de pino, resaca de río y perlita), baja intensidad de luz y riegos diarios con aspersión y luego llevadas a invernáculo con techo de policarbonato transparente y paredes tejido romboidal cubierta de mediasombra (Billard et al., 2014). A partir de las plantas aclimatadas en bandejas multiceldas se seleccionaron al azar 18 plantas (grupo I) y 37 plantas (grupo II) para trasplante en 20 contenedores de Telgopor de 200 cc y de plástico de 300 cc de capacidad (Figura 1a) con sustrato entrefino (partículas menor a 2 cm) de cáscara de pino compostada y musgo de Sphagnun, y otras cinco plantas fueron montadas en palos (15 cm por 3 cm de diámetro) en forma directa, cubriendo las raíces con musgo de Sphagnum y atadas en forma firme con hilo encerado, manteniéndose suspensas en la pared del invernáculo a 1,30 m de altura (Figura 1b), con riego por aspersión cada 48 horas.

Figura 1 a. Trasplante de P. concreta en contenedores -dos a tres plantas por contenedor- y, b. en palos - plantas individuales- con musgo de Sphagnum.
Se efectuó una evaluación del porcentaje de floración en ambos grupos (03/05/16) tomando en cuenta el número total de plantas -con brotes de dos hojas o más por maceta- y brotes con espiga floral. En agosto de 2016 se evaluó el número de frutos final por espiga y se cosecharon al azar 10 espigas fructificadas (Figura 2). Se midió, en tres submuestras de 20 frutos al azar, el largo y ancho con calibre digital.
Se analizó al conjunto de plantas como una única muestra poblacional empleando estadística descriptiva para los parámetros medidos. Los dos grupos de plantas se evaluaron por separado en cuanto a floración y fructificación, pero las mediciones en semillas (número y masa) y viabilidad se analizó en conjunto tomando muestras al azar del número de frutos cosechados.
Sobre 10 cápsulas (frutos) se determinó la masa en g del fruto y de las semillas contenidas en cada uno. A partir de un “pool” de semillas cosechadas de varios frutos se tomaron 5 alícuotas de 1 mg para realizar el conteo del número de semillas por mg de acuerdo con la metodología descripta por Lallana (2015). A partir de los recuentos del número de semillas, 1 mg de muestra dispersadas al azar sobre una cuadricula de 100 cuadros de 0,5 x 0,5 cm, realizado sobre imágenes digitales de las semillas, se construyeron gráficos tridimensionales de la distribución de las semillas en la cuadricula de recuento.
Las dimensiones físicas de las semillas se efectuaron sobre imágenes obtenidas con microscopio digital modelo USB-Digital Microscope 20X - 800X con escala de referencia (cuadricula de 1 x 1 mm) utilizando el software ImageJ (Ferreira & Rasband, 2011) y de acuerdo al protocolo N° 41 (De La Cruz, Schimpf y Lallana, 2012). Para el cálculo de las dimensiones se utilizaron las ecuaciones propuestas por Arditti (1979), para el volumen de las semillas se utilizó 2[(A⁄2)2*(l/2)*(1,047)], donde A= ancho; l= longitud; 1,047= π/3 la cual considera las semillas de orquídeas como fusiformes (ahusadas). Para el cálculo del volumen del embrión se los consideró como esferoides alargados, determinando su volumen con la fórmula 4/3 πab2, donde a = 0,5 longitud y b = 0,5 ancho. Semillas con relación Largo/Ancho (L/A) menores a 6,0 se clasifican como truncadas y las mayores a 6,0 como elongadas, de acuerdo a Verma, Sharma, Thakur, Kaur & Prakash (2014). El porcentaje de aire de la semilla se obtuvo restando el volumen de la semilla al volumen del embrión y dividiendo este valor por el volumen de la semilla por 100 (Arditti, 1979).
Sobre las imágenes digitales se efectuó un ajuste de contraste y se determinó el color RGB del pool de semillas en seis puntos al azar, utilizando el software ImageJ (Ferreira & Rasband, 2011).
Se determinó la viabilidad de las semillas de un “pool” de semillas (2 mg) de 5 frutos al azar por la técnica de tetrazolio (García y Lallana, 2014). Las semillas se imbibieron en agua destilada por 24 h y luego en solución de tetrazolio (0,5 %) a 33°C en oscuridad otras 24 horas. Posteriormente se observaron y contaron bajo lupa el número de semillas viables, no viables y vanas.
RESULTADOS Y DISCUSIÓN
A principios de enero de 2016, las plantas comenzaron a emitir la inflorescencia. A mediados de febrero estaban en plena floración y algunos pocos frutos en formación. En marzo se observó varios frutos en formación (Figura 3a). En junio las espigas presentaban solo frutos en llenado y sin ninguna flor (Figura 3b). El porcentaje de floración fue de 84% y 60% para el grupo I y II, respectivamente y las plantas montadas en palo no florecieron, a pesar de presentar un buen desarrollo de raíces y de hojas.

Figura 3 a. Estado avanzado de floración-principio de fructificación (marzo 2016) y, b. plena fructificación (junio 2016).
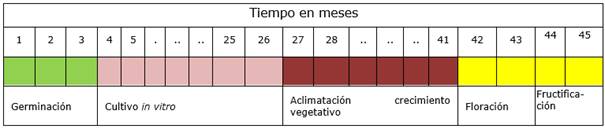
Con la información inicial de germinación y cultivo in vitro (Billard et al., 2014) más la observación de los estados fenológicos de la población en estudio se construyó una infografía de los estados de desarrollo hasta floración-fructificación (Figura 4). En ambos grupos se alcanzó el momento de floración a los 42 meses de inicio de la siembra in vitro desde semilla.
Los frutos presentan una forma oblonga con transición a la forma fusiforme (Figura 2). La cantidad media de frutos por espiga fue de 8,31±5,37 y 9,67±5,97, con un total de 216 y 116 frutos para el grupo I y II respectivamente en la primera observación. Al finalizar el ensayo los valores fueron: 9,37±5,83 y 8,8±4,98 con un total de 229 y 75 frutos para los grupos I y II respectivamente (Tabla 1). Las dimensiones de largo y ancho de los frutos fueron de 8,33±0,98 y 2,53±0,3 mm, respectivamente. La masa media de los frutos fue de 0,0011±0,0023 g (Tabla 1).
Tabla 1 Valores promedios de los parámetros evaluados en el proceso de floración-fructificación y evaluación de las semillas de P. concreta.
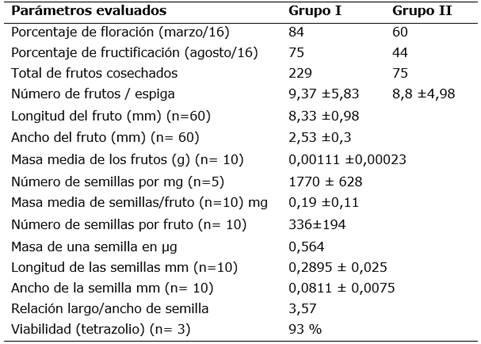
La masa media de semillas por fruto fue de 0,19 mg y el número medio de semillas por mg (n=5) fue estimado en 1770 (Tabla 1) y su distribución en la cuadricula de recuento (Figura 5) se observó en la mayoría de las muestras, una concentración de semillas en la parte media de la cuadricula. El método empleado permitió un conteo detallado en cada cuadro de la cuadricula.
Las semillas son pequeñas, de acuerdo a la clasificación por tamaños de Barthlott, Grobe-Veldmann & Korotkova (2014), de color blanquecino amarillento a pardo claro (RGB: 167; 158; 103) u ocre y de forma ovalada o globosa levemente truncada en un extremo, con una relación largo/ancho de 3,57. Embrión visible, de color pardo más oscuro; se ubica en la parte media de la semilla, ocupando más de mitad del volumen de la semilla (Figura 6). El volumen de aire de la semilla fue estimado en 33%, lo cual implica que el embrión ocupa el 67% del tamaño de la semilla.

Figura 5 Representación tridimensional de la distribución del número de semillas en las cuadrículas de conteo, para las 5 muestras de semillas (N= 1043, 1737, 1180, 2746 y 2147 semillas, respectivamente).

Figura 6 a. Microfotografías de semillas de P. concreta en su estado natural, b. “pool” de semillas y patrón de color RGB a la derecha de la imagen central y, c. después de la tinción con tetrazolio (prueba de viabilidad) donde se observa el embrión intensamente coloreado. La cuadricula representa 1 mm x 1 mm.
El color general de las semillas proviene, principalmente, de las células de la testa, que tienen una coloración propia. El embrión también contribuye, sobre todo en semillas pequeñas en las que ocupa mayor volumen respecto al tamaño total de la semilla y en aquellas que las células son transparentes (Ayuso, 2017). En el caso de Polystachya concreta el color es ocre (Figura 6) coincidente con el color del género (Ayuso, 2017). Por otra parte, la semilla presenta poco volumen de aire (33%) lo cual limitaría su flotabilidad en aire y el proceso de dispersión seria próximo a la planta madre. Al respecto Arditti & Ghani (2000) postulan que cuanto mayor es el volumen de aire de las semillas éstas presentan mayor flotabilidad lo cual les brinda más facilidad para su dispersión anemócora.
La viabilidad de las semillas a 6 días de cosechadas fue de 93,55% lo cual pone de manifiesto la calidad de la misma. Se observó un 3,22% de semillas vanas sobre un total de 801 semillas contadas en las cuadrículas de recuento (Tabla 2). De las semillas, al cabo de 24 horas de imbibición en agua, un 90% se depositaron en el fondo del vial.
Tabla 2 Resultados del ensayo de viabilidad y porcentaje de semillas vanas en P. concreta. R: repeticiones de los recuentos, n: número de semillas puras (viables + no viables).
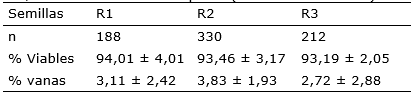
Lallana y García (2016), evaluaron la viabilidad de varias especies de orquídeas almacenadas en frio con distintos tiempos de almacenamiento comparando la situación inicial y final de los valores de viabilidad. En el caso de P. concreta, la viabilidad se mantuvo por un periodo de casi tres años disminuyendo levemente de 97 a 94%. Los resultados de este trabajo también muestran valores altos de viabilidad para semillas recién cosechadas (Tabla 1), lo cual estaría indicando que la especie no tuvo problemas en la formación de semillas con embrión viable, presentando un bajo porcentaje de semillas vanas (Tabla 2). En otras especies de orquídeas es común observar altos porcentajes de semillas vanas (Lallana y García, 2016), por ejemplo, 63, 33, 13, 33% para Bletilla striata, Clhorea membranacea, Bipinula pennicillata y Epidenrum ibagensis, respectivamente.
Las semillas de orquídeas crecen lentamente y requieren años para que la planta florezca, en general de 3 a 5 años (Thompson, 1980; Rodríguez et al., 2007), en el caso de P. concreta se alcanzó la primera floración en un periodo de 42 meses, demostrando ser relativamente precoz. Los dos grupos de plantas aclimatadas con diferencias de cinco meses de salida del cultivo in vitro, respondieron en forma distinta a la floración y fructificación. El grupo I permaneció cinco meses más de tiempo en el invernáculo que el grupo II, lo cual permitió un mayor crecimiento y adaptación a las condiciones ambientales, logrando un porcentaje mayor de floración y fructificación (Tabla 1).
CONCLUSIONES
Los porcentajes de floración y formación de frutos fueron más altos en las plantas que crecieron en contenedor, respecto a las trasplantadas en palo. Las plantas de P. concreta provenientes de semillas cultivadas in vitro y aclimatadas, llegaron a su primera floración en un tiempo de 42 meses.
El porcentaje de fructificación fue alto en relación a la floración, con pérdidas de 10 y 26% según los grupos de plantas considerados.
Teniendo en cuenta el pequeño tamaño de los frutos, la producción de semillas por fruto fue alta (150 a 500) con alto porcentaje de viabilidad.