INTRODUCCIÓN
El género Trichoderma fue introducido en la taxonomía por Persoon hace casi 200 años y se compone de hongos anamórficos aislados principalmente de suelo y materia orgánica en descomposición (Grondona et al. 1997). Debido a su distribución cosmopolita, se vuelve un candidato ideal para aplicaciones en programas de control biológico en diferentes hábitats, pero la sensibilidad de las cepas individuales a factores ambientales abióticos debe considerarse para el desarrollo del hongo (Hjeljord y Tronsmo 1998). Se caracteriza por una tasa de crecimiento rápido en medio de cultivo y la producción de numerosas esporas (conidios) de distintas tonalidades de verde (Howell 2003). El reverso de las colonias a menudo es incoloro, amarillo, ámbar o amarillo verdoso, y muchas especies producen cantidades de clamidosporas sumergido en el micelio (Gams y Bisset 1998). La mayoría de los estudios se basa en la caracterización morfológica, que permite una fácil identificación a nivel de género, pero llegar a nivel de especie es difícil de determinar, en especial para los aislamientos de interés como son los agentes de control biológico (Grondona et al. 1997).
Los métodos moleculares implican el uso de PCR (Polymerase chain reaction), los cuales se han descrito para diagnosticar, identificar, caracterizar y resolver la diversidad genética entre diferentes aislados de Trichoderma spp. siendo altamente sensibles y específicos (Hermosa et al. 2000). Datos de secuenciación obtenidos particularmente en la región del espaciador interno transcrito (ITS) del DNA ribosomal, son utilizados en los análisis filogenéticos de hongos, utilizando cebadores específicos con el objeto de detectar a nivel de especie varios géneros fúngicos (Ospina-Giraldo et al. 1999, Almeida et al. 2003, Babu et al. 2007).
El objetivo de este trabajo fue identificar molecularmente las cepas de Trichoderma spp. y evaluar el efecto de la temperatura sobre el crecimiento y aspecto de las colonias in vitro.
MATERIALES Y MÉTODOS
Aislados fúngicos: un total de siete cepas de Trichoderma spp. fueron aislados de suelos cultivados con Sésamo (Sesamum indicum L.) en el Departamento de San Pedro, Paraguay y procesadas en el Laboratorio de Fitopatología del Centro de Investigación Capitán Miranda (CICM) perteneciente al Instituto Paraguayo de Tecnología Agraria (IPTA), ubicada en el Distrito de Capitán Miranda, Departamento de Itapúa, Paraguay.
Aislamiento, purificación y conservación: las muestras de suelo se procesaron mediante una adaptación de la técnica de dilución en placas, descrita por Karthikeyan et al. (2008). De cada muestra se pesaron 10 g de suelo y en cámara de flujo laminar se mezclaron con 90 mL de agua destilada estéril produciendo la solución madre y agitando durante 20 a 30 min. Posteriormente, se tomó 1 mL de la solución inicial que se diluyó en un tubo de ensayo con 9 mL de agua destilada estéril, obteniendo una dilución a 10-1. Se realizaron diluciones sucesivas hasta llegar a 10-4. De las diluciones 10-2, 10-3 y 10-4 se tomaron 1 mL que se distribuyó homogéneamente sobre una placa de Petri con medio de cultivo papa-dextrosa-agar (PDA). Las placas se incubaron a 28°C en oscuridad hasta que se observó crecimiento abundante, pero sin exceder el contacto entre cepas. Las colonias que presentaron las típicas características coloniales de Trichoderma spp., las cuales son colonias de coloración verdosa y la formación de anillos concéntricos se resembraron en medio PDA e incubadas a 28ºC durante 5 días (Küçük y Kivanç 2003) para su purificación, utilizando la técnica monoconidial (Kumar et al. 2007). Los cultivos puros de cada aislado creciendo en placas de Petri con medio de cultivo PDA fueron transferidos a tubos inclinados con PDA e incubados a 25 ± 2ºC durante 72 h, hasta que la superficie del medio esté cubierta completamente con micelio del hongo. Los tubos se etiquetaron y se almacenaron a 4ºC (Iqbal y Mukhtar 2014).
Extracción de DNA: El DNA de cada cepa de Trichoderma se extrajo de colonias cultivadas en placas Petri con medio cultivo Papa Dextrosa Agar (PDA) e incubados a 25±2°C por tres días en fotoperiodo (12 h luz/oscuridad). El DNA se extrajo con el kit comercial DNeasy Plant Mini® siguiendo el protocolo del fabricante. Un total de 100 mg de micelio fresco fue molido en nitrógeno líquido con la ayuda de un mortero y transferidos a un tubo de microcentrifuga de 1,5 µL, se adicionaron 400 µL de Tampón AP1 y 4 µL de RNasa. Posteriormente fueron agitados en vórtex e incubados por 10 minutos a 65ºC en baño María, agitando por inversión 2 o 3 veces. Se adicionaron 130 µL de P3, se mezcló por inversión y se incubaron por 5 minutos en hielo. La mezcla fue colada en una columna de QIAshredder Mini spin y se centrifugó por 2 minutos a 14.000 rpm. El líquido que pasó por la columna fue transferido a un nuevo tubo de microcentrifuga de 2 µL adicionando 1,5 volúmenes del buffer AP3/E; se colocó en una columna DNeasy Mini spin y se centrifugó por 1 min a 8 000 rpm. Se transfirió en un nuevo tubo de 2 µL, se adicionó 500 µL de Buffer AW2 y centrifugo por 1 minuto a 8.000 rpm. Se adicionó otros 500 µL de Buffer AW2, y centrifugar por 2 minutos a 14.000 rpm, transfiriendo la columna DNeasy Mini spin a un tubo nuevo. Finalmente se adiciono 100 µL de Buffer AE para la elución, incubando por 5 minutos a temperatura ambiente (15-25ºC) posteriormente se centrifugó por 1 minuto a 8.000 rpm (QIAGEN 2012). La calidad de DNA obtenido fue verificada por electroforesis en gel de agarosa al 0,4% y teñidas con Gel Red. Como referencia se utilizó un marcador molecular de 100 pb, los geles fueron visualizados en un transiluminador UV. Las muestras de DNA se almacenaron a 4ºC hasta su uso.
PCR y Secuenciación: las muestras de ADN se enviaron a Macrogen Korea para su análisis por PCR. Se amplificaron las regiones ITS del ADN ribosomal con los primers ITS-5 (GGAAGTAAAAGTCGTAACAAGG) e ITS-4 (TCCTCCGCTTATTGATATG C) (White et al. 1990).
Las secuencias recibidas de Macrogen Korea fueron alineadas con el programa Cluster W versión 1.6 comparadas con todas las secuencias de referencia de la base de datos del GenBank utilizando BLASTn del Centro Nacional de Información Biotecnológica (NCBI) asignando la especie de acuerdo a los niveles de concordancia. Las secuencias alineadas se depositaron en la base de datos GenBank para obtener su número de acceso (Harrington et al. 2000, Choi et al. 2003, Larralde-Corona et al. 2008).
Crecimiento in vitro: para el estudio del crecimiento, las cepas se cultivaron en PDA y se incubaron a 25, 28 y 31°C en oscuridad durante siete días. Se vertió 15 mL de PDA autoclavado en placas Petri de 90 mm de diámetro, una vez solidificado se sembraron en el centro con un disco de 5 mm a partir de un cultivo en crecimiento activo de cada cepa fúngica.
Sobre la base del crecimiento en diámetro, los aislados se categorizaron como rápido (>71 mm), medio (51 a 70 mm), y lento (<51 mm) de acuerdo a una adaptación de la metodología descrita por Iqbal y Mukhtar (2015). Para la TC (mm día-1) se realizaron mediciones cada 24 h con una regla graduada en mm hasta que la colonia llenó toda la superficie de la caja, utilizando la fórmula de Zadoks y Schein (1979): TC (mm día-1) = Crecimiento final (mm) - Crecimiento inicial (mm) /Tiempo final (días) - Tiempo inicial (días).
Análisis estadístico
Los datos de tasa de crecimiento (mm día-1) se analizaron bajo un diseño completamente al azar, con cinco repeticiones en dos réplicas. Las medias fueron comparadas por la prueba de Tukey (p=0,05), con el paquete estadístico SAS versión 9.3.
RESULTADOS Y DISCUSIÓN
Identificación molecular de las cepas: Resultados del análisis molecular de cada cepa de Trichoderma mediante el análisis de las secuencias de nucleótidos realizado en Blastn reveló que las cepas MS9, MS10, MS12, MS15, MS16 y MS19 mostraron una similaridad del 100% con diversas secuencias correspondientes a cepas de T. asperellum (nº de acceso: KX620953, KX 620958, KX620954, KX620955, KX620956, KX620957); y que la cepa MS28 presentó una identidad del 100% con diferentes secuencias reportadas para T. erinaceum.
La correcta identificación de las cepas a nivel de especie es el primer paso para la utilización de todo el potencial de los hongos en aplicaciones específicas (Lieckfeldt et al. 1999).
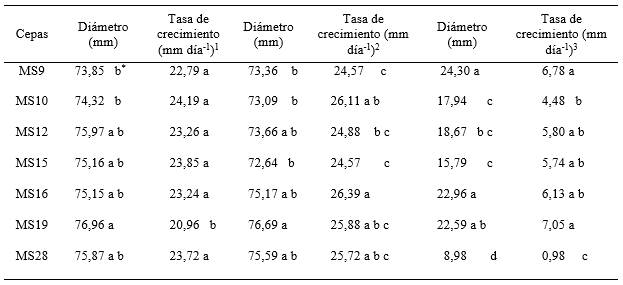
Crecimiento in vitro: La temperatura óptima de crecimiento para todas las cepas evaluadas fue en 25 y 28ºC, crecimiento rápido (Figura 1). Las cepas T. asperellum, MS10 - MS15 obtuvieron la mayor tasa de crecimiento (24,19 y 23,85 mm día-1) a 25ºC, MS16 - MS10 (26,39 y 26,11 mm día-1) a 28ºC y MS19 - MS9 (7,05 y 6,78 mm día-1) a 28ºC. (Tabla 1)
Al parecer el efecto de la temperatura sobre el crecimiento y desarrollo de Trichoderma depende de la especie y del aislamiento dentro de la misma especie. Lieckfeldt et al. (1999) en un ensayo realizado mencionan que T. asperellum tiene una temperatura de crecimiento óptimo de 30°C con un máximo de >35°C, resultado que no coincide con lo obtenido en este trabajo.
Especies de Trichoderma típica de regiones geográficas frías poseían temperatura de crecimiento óptima menor y máximas en comparación con las especies de las regiones climáticas cálidas. T. viride y T. polysporum toleran temperaturas máximas de 28 - 31°C y crecieron mucho mejor que otras especies a 7°C. La temperatura máxima de T. koningii varió de 32 a 35°C, T. hamatum de 30 a 35ºC, T. harzianum de 30 a 38°C, T. pseudokoningii y T. saturnisporum de 40 a 41ºC (Danielson y Davey 1973).

Figura 1 Crecimiento en medio papa-dextrosa-agar de las cepas de Trichoderma spp. a diferentes temperaturas, siete días después de la siembra (DDS).
En otro trabajo, Knudsen y Bin (1990) concluyen que en algunos aislamientos de T. harzianum la temperatura óptima para el crecimiento fue de 20ºC, lo que contradice a Danielson y Davey (1973).
Sin embargo, Antal et al. (2000) investigaron trescientos sesenta cepas de Trichoderma, de las cuales catorce identificados como T. aureoviride, T. harzianum y T. viride, con buen crecimiento a 5°C.
CONCLUSIÓN
De las siete cepas evaluadas de Trichoderma spp., seis de ellas corresponden a T. asperellum y la restante a T. erinaceum. La temperatura es un factor limitante en el crecimiento y aspecto de la colonia. La temperatura optima de crecimiento es de 25 - 28ºC. Las cepas T. erinaceum mostraron la mayor tasa de crecimiento en las tres temperaturas evaluadas.