Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.17 no.2 San Lorenzo Dec. 2015
https://doi.org/10.18004/investig.agrar.2015.diciembre.116-121
ARTÍCULO CIENTÍFICO
Efecto de la testa en la germinación in vitro de Bipinnula pennicillata (Rchb. F.) Sisternas & Salazar (Orchidaceae)
Effect of testa in vitro germination of Bipinnula pennicillata (Rchb. F.) Sisternas & Salazar (Orchidaceae)
Carlos Alberto Dalzotto1 y Víctor Hugo Lallana2*
1 Becario de Iniciación en la Investigación, Cátedra de Fisiología Vegetal y Proyecto PID-UNER 2172. Facultad de Ciencias Agropecuarias. Universidad Nacional de Entre Ríos. Argentina.
2 Docente-Investigador de la Cátedra de Fisiología Vegetal y Proyecto PID-UNER 2172. Facultad de Ciencias Agropecuarias. Universidad Nacional de Entre Ríos. Ruta 11, Km 10,5. (3101) Oro Verde, Entre Ríos, Argentina
* Autor para correspondencia (victorl@fca.uner.edu.ar)
Recibido: 11/09/2015; Aceptado: 16/11/2015.
RESUMEN
Bipinnula pennicillata es una orquídea terrestre que habita en pastizales de Entre Ríos (Argentina). El objetivo de este trabajo fue evaluar el efecto de la cubierta de la semilla en la germinación in vitro, de B. pennicillata en comparación a su viabilidad determinada por la técnica de tetrazolio (Tz). La viabilidad de las semillas almacenadas en frio (4ºC) se evaluó a los 24, 28, 32 y 35 meses, a través de la prueba de tetrazolio (24 h – 0,5% Tz). Con semillas conservadas en refrigerador durante 35 meses, se efectuó la siembra in vitro en un medio MS a la mitad de la concentración, previa desinfección de las semillas. Los tratamientos (T) evaluados fueron: T1, semillas enteras y T2, semillas cortadas. La viabilidad fue de 80%. La germinación, ocurrió a los 61 días después de la siembra (dds). A los 76 días se registró el máximo de germinación con 49% y 53% para los T1 y T2, respectivamente, no encontrándose diferencias significativas (p = 0,05) entre tratamientos; demostrando que la testa no limitó la germinación in vitro. La germinación en comparación con la viabilidad fue significativamente menor. La viabilidad de las semillas fue alta y disminuyó levemente (8%) en un periodo de 35 meses. La oxidación de los protocormos afectó levemente los porcentajes de germinación en ambos tratamientos. La testa no limita la germinación asimbiótica de las semillas en condiciones in vitro, sí lo hace en el tiempo de obtención de protocormos con yema apical y rizoides (61 dds), logrando un 8% más que las semillas enteras.
Palabras claves: Bipinnula pennicillata, orquídea terrestre, germinación, cultivo axénico, viabilidad.
ABSTRACT
Bipinnula pennicillata is a terrestrial orchid native to the Entre Rios grasslands (Argentina). The aim of this study was to evaluate the effect of seed coat in in vitro germination of B. pennicillata compared to its viability as determined by the tetrazolium viability determination method (Tz). The viability of seeds stored in cold conditions (4 °C) was evaluated at 24, 28, 32 and 35 months, through tetrazolium testing method (24 hours - 0.5% Tz). In vitro planting was carried out using seeds preserved in refrigerator for 35 months, in a M and S medium at half the concentration. Seeds were disinfected before planting. Treatments (T) evaluated were T1 for whole seeds and T2 for cut seeds, obtained viability was 80%. Germination occurred 61 days after sowing (das). Maximum germination took place 76 days after sowing with 49% and 53% germination rate for T1 and T2 respectively, with no significant differences (p = 0.05) between treatments; showing that seed coat did not limit in vitro germination. Germination was significantly lower as compared with seed viability. Seed viability was high and it slightly decreased (8%) over a period of 35 months. Protocorms oxidation slightly affected germination rates in both treatments. It was concluded that seed coat does not limit asymbiotic seed germination under in vitro conditions, though it does when obtaining protocorms with apical bud and rhizoids (61 das), achieving 8% more than whole seeds.
Key words Bipinnula pennicillata terrestrial orchids, germination, axenic culture, viability.
INTRODUCCIÓN
Bipinnula pennicillata es una orquídea terrestre, conocida vulgarmente como abejorra, boca de sapo, cabeza de víbora, tiene una altura entre 10-30 cm, con 2 a 5 hojas basales con una longitud ente 4 a 10 cm. Presenta tallos floríferos erectos y raíces carnosas, tuberiformes. Es una especie de Brasil austral, Uruguay y Argentina (Entre Ríos, sierras australes de Buenos Aires). Florece en primavera, de flores resupinadas, vistosas verdosas y la polinización natural la realizan avispas a través del mecanismo de pseudocopulación (Hurrell 2009). Habita en pastizales del Parque Nacional El Palmar, además de contar con registros en el Jardín Botánico Oro Verde (Entre Ríos, Argentina).
Las semillas de orquídeas son las más pequeñas del reino vegetal (Rasmussen 1995) y se las conoce como semillas “polvo” por su aspecto similar a una fécula. El número de semillas por cápsula es variable, siendo en general menor a 100.000 (Silva Pereira et al. 2014) aunque existen reportes de más de un millón de semillas por cápsula (Arditi 1961, Lallana et al. 2010) según las especies. La producción de un gran número de semillas por cápsula ha sido descripta como una característica común de plantas que poseen requisitos muy específicos de germinación (Rasmussen 1995).
Las semillas de orquídeas terrestres tienen como características que su testa es de tipo reticulada y fuerte, más que el de las orquídeas epífitas. La testa y el embrión de diferentes taxones de Orchidaceae pueden variar en sus dimensiones, forma, color y en la proporción de sus volúmenes, lo cual puede explicar su capacidad de dispersión (Arditti et al. 1980, Augustine et al. 2001). La dificultad de humedecer la superficie exterior de la testa, y sus grandes espacios internos aéreos, le permite a las semillas flotar en el agua por tiempo prolongado (Arditti e Ghani 2000). El espacio lleno de aire en las semillas de orquídea es de gran interés morfológico. Durante la maduración de las semillas se produce un aumento en el porcentaje de espacio de aire, lo cual hace que las semillas sean más livianas y flotantes. Este aspecto de la biología es muy útil en cuanto a la anemócora y la distribución fitogeográfica de las orquídeas (Krishna Swamy et al. 2004).
La germinación natural de las orquídeas y el desarrollo subsiguiente de la plántula, dependen de la relación simbiótica con hongos pertenecientes al género Rhizoctonia; a este tipo de germinación se le llama simbiótica (Pierik 1990, Arditti y Ernst 1993). Analizando el comportamiento germinativo, Hadley (1982) observó que las orquídeas epífitas por lo general germinan más rápidamente; el hongo crece en el exterior; en contraste, las terrestres germinan lentamente y el hongo penetra en el córtex del protocormo (Pierik 1990). Estas últimas también pueden presentar un patrón de dormición (Johansen y Rasmussen 1992).
El objetivo fue evaluar el efecto de la cubierta de la semilla (testa) en la germinación in vitro de Bipinnula pennicillata en comparación a su viabilidad analizada por la técnica de tetrazolio.
MATERIALES Y MÉTODOS
El ensayo se llevó a cabo en el Laboratorio de Cultivos de Tejidos Vegetales, del espacio curricular Fisiología Vegetal, de la Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos (UNER). Se trabajó con semillas de la especie de orquídea Bipinnula pennicillata, extraídas de un fruto cosechado el 10/12/08 en la ciudad de Paraná, provincia de Entre Ríos (Argentina).
El fruto fue conservado en heladera en sobre de papel durante 15 días y al comenzar su dehiscencia se procedió a cortar sus extremos con bisturí y recoger las semillas en cápsulas plásticas con tapa y conservarlos en refrigerador (4ºC) hasta el momento de su siembra, 03/11/11.
Periódicamente a partir de diciembre de 2010, se efectuaron cuatro ensayos de viabilidad, a los 24, 28, 32 y 35 meses; con las semillas almacenadas en frío para establecer su longevidad. Para cada ensayo se tomó una alícuota de 2 a 4 mg de semillas y se colocaron en un vial con agua destilada durante 24 h en imbibición, luego se extrajo el agua con una jeringa de 1 mL y se agregó solución de 2,3,5 trifenil tetrazolium (TZ) al 0,5%, incubando en oscuridad a 33°C durante 24 h (Singh 1981, Lallana y García 2012). Al final del periodo de imbibición e incubación (24 h en agua + 24 h en solución TZ) se observó la flotabilidad de las semillas en el vial. El recuento bajo lupa binocular se realizó en cajas de Petri de 6 cm de diámetro, fijando en la base una cuadrícula de acetato (0,5 x 0,5 cm) y contando diez cuadros al azar. Se consideraron semillas viables aquellas que presentaron coloración rosa a rojo oscuro (Figura 1); y no viables las que presentaron embrión sin coloración. Los datos se expresaron en porcentaje de semillas viables. Simultáneamente se evaluó el número de semillas vanas (sin embrión) de las muestras, las cuales resultó imposible separar antes del análisis de viabilidad, para trabajar con semilla pura tal cual lo establecen las normas ISTA (2012). De esta forma al número de semillas viables y no viables se sumó el número de semillas vanas y se obtuvo el total de semillas de la muestra y sobre este valor se calculó el porcentaje de semillas vanas de la muestra.
El medio del cultivo que se empleó para la germinación asimbiótica, fue el MS (Murashige y Skoog 1962), a la mitad de su concentración, suplementado con 30 g L-1 de sacarosa y 5 g L-1 de Agar Agar Britania; ajustando el pH a 5,6 – 5,8; y se distribuyó 40 cm3 en frascos de vidrio de 150 cm3. El medio de cultivo se esterilizó en autoclave a 121 ºC y 1 kg cm-2 durante 15 min.
Para la siembra in vitro las semillas se desinfectaron utilizando la metodología de Mweetwa et al. (2008) modificado y el de matraz y pipeta (Pierik 1990) modificado, según Billard et al. (2014). Se tomaron dos alícuotas de semillas, con una espátula metálica; y se las colocaron en tubos de vidrio de 7 cm de altura con 5 mL de solución desinfectante (hipoclorito de sodio) en una concentración de producto comercial de 0,5% (con 55 g L-1 de producto activo); con el agregado de Tween 20 (0,1%). Luego se las colocó en un agitador orbital de Kline (Vicking) a 225 rpm durante 7 min y se dejaron reposar por 8 min. En cámara de flujo laminar, las semillas se enjuagaron tres veces con agua destilada esterilizada, con intervalos de 3 min entre enjuagues; para extraer la solución se emplearon jeringas de 1 mL con aguja. Se plantearon dos tratamientos (T): T1, semillas enteras y T2, semillas cortadas.
Una vez finalizada la desinfección, a las semillas para el T2 se realizó una escisión en el extremo de la cubierta seminal (testa) (Figura 1); el corte se llevó a cabo bajo una lupa binocular, en condiciones asépticas, utilizando bisturí y pinza de punta fina.
De cada tratamiento se hicieron 10 repeticiones (frascos de vidrio) y se sembraron 15 semillas por cada repetición. Cada frasco fue cubierto con doble capa de film de PVC y se incubó durante dos meses en condiciones de oscuridad a 24 ± 1ºC. Posteriormente, los frascos fueron expuestos a un fotoperíodo de 16 h, con growlux, a la misma temperatura.
A los 61, 76, 94, 109, 122 y 137 días después de la siembra (dds) se evaluó el porcentaje de germinación para ambos tratamientos. Los datos se analizaron estadísticamente a partir de un diseño totalmente al azar; efectuándose prueba de T para observaciones apareadas para un nivel de significación del 95% (p = 0,05) utilizando el software InfoStat (Di Rienzo et al. 2012).
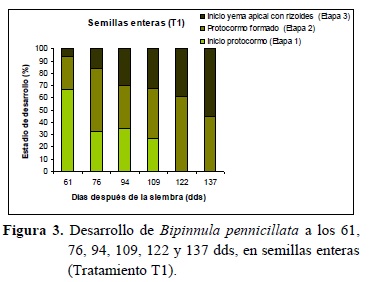
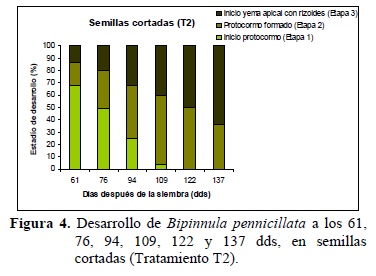
En cada fecha de observación se registraron los diferentes estadios de desarrollo de los protocormos, en base a las etapas propuestas por Mitchell (1989).
RESULTADOS Y DISCUSIÓN
La semilla presenta forma alargada, ahusada, color pardo claro, un extremo agudo y otro truncado, testa traslúcida y paredes celulares en red o reticulada (Figura 1). El embrión es de color pardo oscuro, ovalado y ocupa un 39% del volumen de la semilla (Di Persia y Lallana 2014).

Luego de 48 h de imbibición (24 h en agua + 24 h en solución de Tetrazolio) las semillas se distribuyeron en proporciones semejantes tanto en la superficie del agua como en el fondo del vial. Otras semillas, en especial las del género Gomesa, se depositan en el fondo del vial en su mayor parte cuando son colocadas en agua. Esta observación se vincula con el volumen de aire de las semillas y el grado de permeabilidad de la testa. El volumen de aire de las semillas de orquídeas es un factor de interés por la implicancia en la dispersión, sin embargo Arditti y Ghani (2000), indicaron que se han realizado pocos estudios. En la fracción de semillas sobrenadantes se observaron las tres categorías evaluadas (viables, no viables y las vanas). El embrión fue fácilmente distinguible, aun sin teñir.
Al evaluar la viabilidad se comprobó una lenta disminución, con porcentajes de 87, 93, 72 y 80% a los 24, 28, 32 y 35 meses, respectivamente. Por otra parte, se determinó que la fracción de semilla pura de las muestras era alta, tal como lo indicaron los porcentajes de semillas vanas que variaron entre 9 y 19%.
El valor de viabilidad considerado para comparar con los datos de germinación de este trabajo corresponde a noviembre de 2011 (80%) coincidente con la fecha de inicio del ensayo de germinación.
Lallana y García (2015) evaluaron la longevidad de B. pennicillata durante un periodo de 52 meses de almacenamiento que ajustó significativamente a una función cuadrática (y = 9E-05x2 - 0,2201x + 207,26), siendo esta especie la que conservó mayores valores de viabilidad al ser comparada con otras 12 especies del estudio. Lallana y García (2012), determinaron que las semillas recién cosechadas, del género Gomesa presentan altos valores de viabilidad (mayor al 90%) pero que su viabilidad se redujo a la mitad en un periodo de 24 meses de almacenamiento en frío (5ºC), mientras que las de B. pennicillata en 42 meses de almacenamiento disminuyó la viabilidad de 87% a 64% y las de Bletilla striata en 15 meses disminuyó de 70% a 36% (Lallana y García 2015).
La germinación de B. pennicillata, ocurrió a los 61 días (Figura 2), de acuerdo a este resultado; Arditti y Ernest (1993) han referido que las orquídeas terrestres, germinan y se desarrollan in vitro más lentamente que las epífitas, y generalmente requieren de medios de cultivos más complejos. Trabajos previos sobre especies epífitas del genero Gomesa indican un periodo de germinación variable entre 15 a 25 días (Billard et al. 2014, Dalzotto y Lallana 2013) y para Epidendum campaccii, 15 días (Dalzotto et al. 2015), mientras que para especies terrestres este lapso es mayor, 30 a 48 días (Billard et al. 2013, Dalzoto y Lallana 2013).
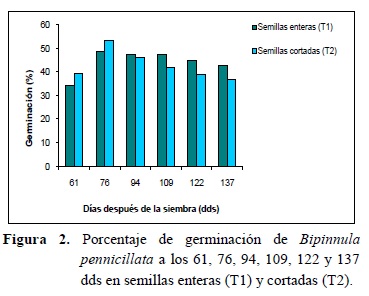
El máximo de germinación alcanzado para la especie fue a los 76 días de 49% y 53% para el T1 (semillas enteras) y T2 (semillas cortadas), respectivamente, no encontrándose diferencias significativas (p <= 0,05) entre tratamientos (Figura 2). Estos resultados demuestran que la testa no limitó la germinación asimbiótica de las semillas en condiciones in vitro, en comparación a los resultados obtenidos por Lauzeret al. (2007), en donde establecen que la escisión de la testa permitió aumentar significativamente la germinación de Aplectrum hyemale (Muhl. Ex Willd.) Torr (orquídea terrestre).
Los porcentajes de germinación de ambos tratamientos fueron menores en comparación con el porcentaje de viabilidad (80%) estimado por la técnica de tetrazolio, siendo la diferencia de 30,6% para el T1 y 26,6% para el T2 (Figura 2). Esta diferencia entre la proporción de semillas viables y aquellas que germinaron, pudo deberse a la dosis y/o tiempo de desinfección de las semillas tal como fue demostrado para otras especies (Dalzotto et al. 2013). Mientras que Lauzeret al. (2007) en su investigación con Aplectrum hyemale, obtuvo resultados similares y esa diferencia la atribuyen a requerimientos especiales de nutrientes para la germinación.
A los 94 dds, se comenzó a visualizar en ambos tratamientos, la oxidación de los protocormos y a los 137 dds el porcentaje de oxidación fue de 34% y 41% para T1 y T2, respectivamente. Considerando que los protocormos oxidados no evolucionan en nuevas plantas; el porcentaje de germinación máximo alcanzado a los 76 días disminuyó paulatinamente hasta el final del ensayo de un 49% a 43% para las semillas enteras y de 53% a 37% para las semillas cortadas. No encontrándose diferencias significativas (p <= 0,05) entre tratamientos en la germinación para cada una de las fechas de observaciones, desde el momento en que se registró la oxidación de los protocormos (Figura 2).
En ambos tratamientos se registraron los estadios de desarrollo propuestos por Mitchell (Figura 3 y 4). A los 61 dds el porcentaje de inicio de formación de protocormos (Etapa 1) fue similar entre los tratamientos (T1: 67% y T2: 68%), sin embargo se evidenció mayor cantidad de protocormos en Etapa 3 en el T2 (T2: 14%, T1: 6%). A los 109 dds las semillas cortadas presentaron un 57% de protocormos en Etapa 2 y 40% en Etapa 3; mientras que para las semillas enteras fueron de 41% de protocormos en Etapa 2 y 37% en Etapa 3. A los 137 dds los resultados son muy semejantes en las Etapas logradas para ambos tratamientos (Etapa 2: T1 45% y T2 36%; Etapa 3: T1 55% y T2 64%). Los protocormos desarrollados en la Etapa 3, a los 137 dds, lograron el tamaño necesario para ser repicado a nuevo medio de cultivo.
CONCLUSIONES
La técnica de tinción por tetrazolio en semillas de Bipinnula pennicillata permite distinguir claramente las viables delas no viables y las vanas. La viabilidad de las semillas disminuye levemente (8%) en un periodo de 35 meses. La testa no limita la germinación asimbiótica de las semillas de B. pennicillata en condiciones in vitro, pero retarda la obtención de protocormos con yema apical y rizoides.
AGRADECIMIENTOS
Trabajo realizado en el marco de un proyecto de investigación financiado por la Universidad Nacional de Entre Ríos (PID 2172). Parte de estos resultados corresponden a una tesina de grado realizada por el primer autor.
REFERENCIAS BIBLIOGRÁFICAS
Arditti, J. 1961. Cycnoches ventricosum Batem. var. chlorochilon (Klotzsch) P. H. Allen Comb Nov Ceiba 9:11-22. [ Links ]
Arditti, J; Michaud, JD; Healey, PL. 1980. Morphometry of orchid seeds: II Native California and related species of Calypso, Cephalanthera, Corallorhiza and Epipactis. Amer J Bot 67:347-365. [ Links ]
Arditti, J; Ernst, R. 1993. Micropropagation of Orchids. New York, John Wiley & Sons. 640 p. [ Links ]
Arditti, J; Ghani, AKA. 2000. Tansley review no 110. Numerical and physical properties of orchid seeds and their biological implications. New Phytologist 145: 367-421. [ Links ]
Augustine, J; Kumar, Y; Sharma, J. 2001. Orchids of India-II: Biodiversity and status of Bulbophyllum Thou. Daya publishing house, Trinagar, New Delhi. 113 p. [ Links ]
Billard, CE; Dalzotto, CA; Lallana, VH. 2013. Germinación de Bletilla striata (Thunb.) Rchb. f. en medio líquido y evolución de plantas en medio semisólido. Investig Agrar 15(1):1-8. [ Links ]
Billard, CE; Dalzotto, CA; Lallana, VH. 2014. Desinfección y siembra asimbiótica de semillas de dos especies y una variedad de orquídeas del género Oncidium. Polibotánica. 38:69-81. [ Links ]
Dalzotto, CA.; Billard, CE; Barsanti, VM; Lallana, VH. 2015. Germinación, cultivo in vitro y aclimatación de Epidendrum campaccii Hágsater & L. Sanchez. II SIMBRAORQ - Simpósio Brasileiro sobre Cultivo de Orquídeas. Jaboticabal, SP. Brasil. UNESP/FACV 03 al 06 de marzo de 2015. Livro de Resumos. p. 60-64. [ Links ]
Dalzotto, CA; García, FL; Lallana, VL. 2013. Efecto del pretratamiento con hipoclorito de sodio en la prueba de viabilidad de semillas de Oncidium bifolium Sims. I Congreso Brasilero de Producción de Orquídeas. Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 42-44. [ Links ]
Dalzotto, CA; Lallana, VH. 2013. Viabilidad, germinación asimbiótica y vigor de tres especies de orquídeas nativas. Rev Cient Agropecu 17(1-2):39-49. [ Links ]
Di Persia, JF; Lallana, VH. 2014. Caracterización morfométrica de semillas de cuatro especies de orquídeas terrestres nativas de Argentina. 78º Reunión de Comunicaciones Científicas de la ACNL. Museo Provincial de Ciencias Naturales Dr. Ángel Gallardo, Rosario, 26 de junio de 2014. Resúmenes, p. 54. [ Links ]
Di Rienzo, JA; Casanoves, F; Balzarini, MG; Gonzalez, L; Tablada, M; Robledo, CW. 2012. InfoStat versión 2012. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Disponible en: http://www.infostat.com.ar [ Links ]
Hadley, G. 1982. Orchid mycorrhiza. In: Arditti, J, ed. Orchid biology: Reviews and perspectives II. Cornell Universtiy Press, Ithaca. p. 83-118. [ Links ]
Hurrell, J. 2009. Flora rioplatense. Parte 3: Monocotiledóneas/Julio Hurrell; Gustavo Delucchi; Maevia Correa. Buenos Aires, LOLA Literatura of Latín América. v. 4, 424 p. [ Links ]
International Seed Testing Association (ISTA). 2012. International Rules for Seed Testing. Basserdorf, Switzerland 362 p. [ Links ]
Johansen, B; Rasmussen H. 1992. Ex situ conservation of orchids. Opera Bot 113:43-48. [ Links ]
Krishna Swamy, K; Krishna Kumar, HN; Ramakrishna, TM; Ramaswamy, SN. 2004. Studies on seed morphometry of epiphytic orchids from western ghats of Karnataka. Taiwania. 49:124-140. [ Links ]
Lallana, VH; Billard, CE; Klug, LM. 2010. Germinación y desarrollo de plántulas in vitro de Oncidium bifolium Sims var. bifolium (Orchidaceae). In: Comp. por Claudia Gallardo y Elena Gagliano. V Congreso Argentino de Floricultura y Plantas Ornamentales. Paraná, Universidad Nacional de Entre Ríos. Libro de resúmenes. p. 272-274. [ Links ]
Lallana, VH; García LF. 2012. Conservación de semillas de orquídeas y estudio de su viabilidad en el tiempo. Revista Análisis de Semillas 6(23):58-61. [ Links ]
Lallana, VH; García, LF. 2015. Longevidad de semillas de orquídeas almacenadas en frío. II SIMBRAORQ, Simposio Brasilero de producción de Orquideas. Jaboticabal, SP, Brasil. UNESP/FACV 03 al 06 de marzo de 2015. Livro de Resumos. p. 26-30. [ Links ]
Lauzer, D; Renaut, S; ST–Arnaud, M; Barabe, D. 2007. In vitro asymbiotic germination, protocorm development, and plantlet acclimatization of Aplectrum hyemale (Muhl. Ex Willd.) Torr. (Orchidaceae). Journal of the Torrey Botanical Society 134(3):344-348. [ Links ]
Mitchell, R. 1989. Growing hardy orchids from seeds at Kew. Plantsman 11: 152-169. Citado En: Verdugo, G; Marchant, J; Cisternas, M; Calderón, X; Peñaloza, P. 2007. Caracterización morfométrica de la germinación de Chloraea crispa Lindl. (Orchidaceae) usando análisis de imagen. Gayana Bot 64(2):232-238. [ Links ]
Murashige, T; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15:473-497. [ Links ]
Mweetwa, AM; Welbaum, GE; Tay, D. 2008. Effects of development, temperature, and calcium hypochlorite treatment on in vitro germinability of Phalaenopsis seeds. Scientia Horticulturae 117:257-262. [ Links ]
Pierik, RLM. 1990. Cultivo in vitro de las plantas superiores. Madrid, Mundi Prensa. 301 p. [ Links ]
Rasmussen, HN. 1995. Terrestrial orchids: from seed to mycotrophic plant. Cambridge, Cambridge University Press. 460 p. [ Links ]
Silva P. S; Damásio da Costa Júnior, O; Azevedo dos Santos, L; Pessoa F. L; Pereira da Costa, N. 2015. Contagem de sementes de cápsulas de Spathoglottis plicata Blume e Polystachya estrellensis Rchb. f. II SIMBRAORQ. Joboticabal, SP. Brasil. UNESP/FAC V 3 al 6 de marzo de 2015. Livro resumos. p. 22-25. [ Links ]
Singh, F. 1981. Differential staining of orchid seeds for viability testing. American Orchid Society Bulletin 50:416-418. [ Links ]














