Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Investigación Agraria
versión On-line ISSN 2305-0683
Investig. Agrar. vol.16 no.2 San Lorenzo dic. 2014
ARTÍCULO CIENTÍFICO
Control biológico del complejo de hongos causantes de la mancha foliar en maíz dulce (Zea mays var. saccharata) con bacterias benéficas
Biological control of the fungi complex that cause leaf spot on sweet corn (Zea mays var. saccharata) with beneficial bacteria
Adriana Fleitas Centurión1 y Cristhian J. Grabowski Ocampos*1
1 Área de Protección Vegetal, Facultad de Ciencias Agrarias, Universidad Nacional de Asunción. San Lorenzo, Paraguay.
* Autor para correspondencia (cgrabowski@agr.una.py)
Recibido: 12/09/2014; Aceptado: 20/11/2014.
RESUMEN
Con el objetivo de evaluar la eficiencia de Bacillus sp., Pseudomonas fluorescens y Streptomyces sp. en el control de hongos causantes de la mancha foliar en maíz dulce y determinar su mecanismo de acción, se realizaron experimentos en el Laboratorio de Fitopatología y en el campo experimental de la Facultad de Ciencias Agrarias, San Lorenzo. El Experimento 1 consistió en determinar la inhibición in vitro del crecimiento y desarrollo del complejo de patógenos asociados a esta etiología a través de la producción de compuestos anti microbianos hidrosolubles y de gases volátiles inespecíficos producidos por las bacterias. Se registró el porcentaje de reducción de crecimiento micelial y el porcentaje de inhibición de la germinación de conidios. El experimento 2 consistió en determinar a campo la reducción de la intensidad de la enfermedad en plantas de maíz dulce. Los tratamientos fueron la suspensión de cada bacteria, un testigo absoluto y un testigo químico (Azoxystrobin 20% + Tebuconazole 20%). In vitro se redujo significativamente el crecimiento micelial de Bipolaris sp., Curvularia sp. y Exserohilum turcicum y se inhibió la germinación de E. turcicum por las tres bacterias. A campo se constató la eficiencia significativa de control de las tres bacterias estudiadas. Bacillus sp. redujo la intensidad en 43%, Pseudomonas fluorescens en 36% y Streptomyces sp. en 19%. Las tres bacterias benéficas son agentes de control biológico por su efecto antagónico y por disminuir la severidad de la mancha foliar en maíz dulce.
Palabras clave: Zea mays, complejo de hongos, control biológico, bacterias benéficas.
ABSTRACT
In order to evaluate the efficiency of Bacillus sp., Pseudomonas fluorescens, and Streptomyces sp. in the control of leaf spot of sweet corn and determine the mechanism of action exerted by them, experiments were carried out at the Phytopathology Laboratory and in the experimental field of the Facultad de Ciencias Agrarias, San Lorenzo. Experiment 1 consisted in determining in vitro the inhibition of the growth and development of the complex of pathogens associated with this etiology through the production of anti microbial water soluble compounds and non-specific volatile gases produced by bacteria. It was registered the percentage reduction of mycelial growth and percentage inhibition of the germination of conidia. The experiment 2 consisted in determining under field conditions the reduction of the intensity of the disease in sweet corn plants. The treatments were each bacteria suspension, an absolute control and a chemical control (Azoxystrobin 20% + Tebuconazole 20%). In vitro, the mycelial growth of Bipolaris sp., Curvularia sp. and Exserohilum turcicum reduced significantly and the germination of E. turcicum was inhibited by the three bacteria. In the field experiment, it was confirmed the significant control efficiency of the three studied bacteria. Bacillus sp. reduced the intensity by 43%, Pseudomonas fluorescens by 36% and Streptomyces sp. by 19%. The three beneficial bacteria are agents of biological control for producing antagonistic effect and reducing the severity of leaf spot in sweet corn.
Key words: Zea mays, beneficial bacterias, biological control, fungi complex.
INTRODUCCIÓN
El maíz dulce (Zea mays var. saccharata) es una planta originaria de América y se caracteriza por la presencia de genes mutantes que alteran la síntesis del almidón en el endospermo el cual proporciona el sabor dulce a los granos.
La importancia del maíz dulce radica en que es consumido principalmente in natura o como productos industrializados, producido por pequeños y medianos productores quienes lo consideran como una hortaliza debido a su maduración más temprana y a los cuidados intensivos que requieren (Ordás et al. 2007). Así también, el maíz dulce ha sido objeto de estudio no sólo por el alto valor económico que representa, sino por la gran demanda del producto en nuestro país.
Sin embargo, como cualquier otro cultivo presenta problemas fitosanitarios y en especial enfermedades como las manchas foliares que limitan la producción reduciendo el rendimiento (Greenwood y Halstead 2002). Las pérdidas atribuidas a este tipo de enfermedad se asocian con la destrucción de tejidos fotosintéticos, limitando la intercepción de la radiación solar y la producción de fotoasimilados para el llenado de granos (Formento 2010).
La hoja de la espiga y aquellas que se encuentran por debajo y encima de la misma pueden representar el 33% y 40% del área total de la planta. Así, una destrucción de 25% del área foliar del maíz en su porción terminal, próxima a la floración, puede reducir 32% la producción (Pereira Filho et al. 2003).
La mancha foliar causada por el complejo de hongos Bipolaris sp., Curvularia sp., Drechslera sp. y Exserohilum turcicum (Sin: Helminthosporium turcicum) (Cardona y González 2006) puede determinar una reducción entre 18 y 50% de rendimiento de granos en función del estado fenológico del cultivo, las condiciones climáticas, presencia del inóculo en el área y la susceptibilidad del material (CIMMYT 2004). Pese a que la medida de control más empleada es la química con fungicidas, no se dispone de productos eficientes e indicados para esta enfermedad en esta especie vegetal.
Ante la necesidad de favorecer una agricultura sustentable y menos dependiente de productos fitosanitarios, se ha propiciado el estudio de alternativas de manejo como el control biológico de enfermedades, que parte de la premisa de la utilización de antagonistas que compiten por espacio y nutrientes con los patógenos, porque llegan a nichos ecológicos donde el patógeno se encuentra protegido de otras medidas de control (Altieri 1999, Handlesmann y Stabb 1996).
Con esta investigación se busca evaluar la eficiencia del control biológico, ejercido por potenciales bacterias benéficas como Bacillus sp., Pseudomonas fluorescens y Streptomyces sp. sobre el complejo de hongos causantes de la mancha foliar en maíz dulce, en condiciones in vitro e in vivo.
MATERIALES Y MÉTODOS
Lugar y periodo experimental
Los experimentos fueron realizados en el laboratorio de Fitopatología perteneciente al Área de Protección Vegetal, y en el campo experimental del Centro Horti-Frutícola perteneciente al Área de Producción Agrícola de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción, San Lorenzo; Paraguay, entre los meses de diciembre de 2013 a mayo de 2014.
Multiplicación y conservación de las bacterias benéficas
Para la multiplicación de las bacterias benéficas Bacillus sp. (Bc), Pseudomonas fluorescens (Pf) y Streptomyces sp. (St) pertenecientes a la colección del Área de Protección Vegetal fueron sembradas en placas de Petri con medio de cultivo 523 de Kado y Heskett (1970), y luego de 48 horas de incubación fueron repicadas en tubos de ensayo para su conservación.
Aislación y preservación de los hongos causantes de la mancha foliar del maíz dulce
Hojas de maíz dulce variedad Bright Jean fueron colectadas del campo experimental del Centro Horti-Frutícola con signos y síntomas característicos de la enfermedad para la aislación de hongos asociados a la mancha foliar. Una vez obtenido los cultivos puros por medio de repiques sucesivos de hifas en crecimiento de cada patógeno aislado, e identificados de acuerdo a Carmichael et al. (1980) fueron repicadas en tubos de ensayo con medio de cultivo PDA.
Experimento 1: Antagonismo in vitro de bacterias benéficas contra Bipolaris sp., Curvularia sp. y Exserohilum turcicum
Tratamiento y diseño experimental
Se siguieron dos metodologías. Método A: inhibición del crecimiento micelial de Bipolaris sp. (Bi), Curvularia sp. (Cu) y E. turcicum (Et) por la producción de compuestos volátiles inespecíficos, y Método B: inhibición de la germinación de conidios de Et (Grabowski et al. 2011). El primer método estuvo compuesto por cuatro tratamientos y cuatro repeticiones totalizando dieciséis unidades experimentales (UE) constituida cada una por una placa de Petri. El segundo método estuvo compuesto por tres tratamientos y cinco repeticiones totalizando quince UE constituida cada una por una lámina en la cual se cuantificaron los conidios. Ambos métodos fueron dispuestos en un Diseño Completamente al Azar.
Instalación de los experimentos
Método A: para comprobar la producción de compuestos volátiles, por un lado, 500 µl de cada bacteria con 48 horas de crecimiento fueron extraídas de tubos de ensayo y sembradas en un erlenmeyer con 200 mL de medio 523. Luego se cargó las placas con la mezcla medio-bacteria y se dejó solidificar. Esta operación se repitió para cada bacteria estudiada. Por otro lado, en el centro de placas de Petri fueron sembrados discos de PDA de 5 mm de diámetro con fragmentos de hifas en crecimiento activo de cada patógeno. Luego de la siembra, las tapas de las placas fueron retiradas pareando las bases bacteria-hongo. Las placas fueron incubadas a 25°C dejando al antagonista en la base y al fitopatógeno en la parte superior. La reducción del crecimiento de los patógenos se evaluó diariamente a partir del segundo hasta el séptimo día de incubación. Para ello se midió el diámetro de crecimiento micelial de cada hongo con la ayuda de un escalímetro digital y luego se comparó con el crecimiento micelial del hongo en la placa testigo y con los datos obtenidos se calculó el porcentaje de reducción del crecimiento de cada fitopatógeno utilizando la fórmula %RC= (D1-D2)/D1x100 (Acuña y Grabowski 2012), donde RC = % de reducción del crecimiento, D1 = diámetro de crecimiento del patógeno en el testigo, D2 = diámetro de crecimiento del patógeno pareado con cada bacteria benéfica.
Método B: para determinar la inhibición de la germinación de conidios se preparó una suspensión de conidios del hongo y una suspensión de cada bacteria en una relación 1:1. En un extremo de láminas de vidrio se montó la mezcla de 35 µl de la suspensión de conidios de Et con 35 µl de la suspensión de cada bacteria, y en el otro extremo se montó 35 µl de suspensión de conidios del fitopatógeno, utilizado como testigo. Estas láminas fueron incubadas a 25°C y al cabo de 24 horas de incubación se procedió al conteo de conidios germinados en cada lámina. La evaluación se realizó con la ayuda de microscopio óptico, determinando el número de conidios germinados. Se consideró como conidio germinado a aquel que presentaba la longitud del tubo germinativo mayor que la mitad de la extensión del conidio. Estos datos fueron utilizados para calcular el índice de germinación (IG) aplicando la fórmula (IG = CGA/CGT) donde CGA = Conidios Germinados del Antagonista y CGT = Conidios Germinados en el Testigo (Grabowski et al. 2011).
Experimento 2: Control biológico del complejo de hongos causantes de la mancha foliar en maíz dulce con bacterias benéficas en condiciones de campo
Tratamiento y diseño experimental
Los tratamientos consistieron en la utilización de 3 bacterias benéficas: Bc, Pf y St; un testigo absoluto y un testigo químico en el cual se utilizó el fungicida compuesto por los ingredientes activos Azoxystrobin 20% + Tebuconazole 20% en su dosis comercial indicada para esta enfermedad (Tabla 1). Los tratamientos fueron dispuestos en un Diseño Completamente al Azar con cinco tratamientos y cuatro repeticiones totalizando veinte UE, cada una constituida por cuatro hileras de plantas con 6,5 m de largo.
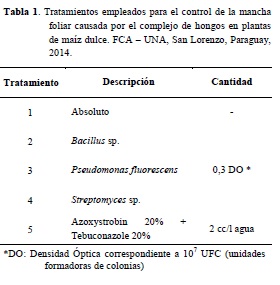
Aplicación de bacterias benéficas en plantas de maíz dulce
La aplicación foliar de las bacterias consistió en preparar una suspensión de cada una de las mismas con una concentración de 107 UFC (unidades formadoras de colonias), que fueron utilizadas para pulverizar las plantas en los estados fenológicos V7 y VT de manera a asegurar el establecimiento de las bacterias.
La variable evaluada fue el porcentaje de severidad de la mancha foliar. Para ello se marcó una hoja en el estrato inferior, medio y superior de 10 plantas de maíz dulce variedad Bright Jean seleccionadas al azar a partir de las dos hileras centrales de cada UE y se utilizó la escala diagramática adaptada de James (1971) en las cuales las notas representaron el grado de severidad en cada nivel.
Análisis estadístico
Los datos obtenidos en los experimentos 1 y 2 fueron sometidos a Análisis de Varianza y test de Tukey al 5% de probabilidad del error.
RESULTADOS Y DISCUSIÓN
Antagonismo in vitro de bacterias benéficas contra Bipolaris sp., Curvularia sp. y Exserohilum turcicum
El diámetro de crecimiento micelial in vitro alcanzado por las colonias testigo de Bi, Cu y Et fue de 7,7; 7,5 y 6,1 cm respectivamente demostrando que las condiciones de crecimiento fueron aptas (Tabla 2).
El efecto ejercido por las bacterias sobre el crecimiento micelial de los hongos en todos los casos mostró diferencias significativas. Con respecto a Bi todos los tratamientos redujeron su crecimiento destacándose la bacteria benéfica Bc con un porcentaje de reducción del 35,6%. Para Cu se observó que Bc se destacó nuevamente por presentar el mayor porcentaje de inhibición (31,1%). En relación a Et al igual que en los casos anteriores la máxima inhibición ocurrió en el tratamiento con Bc que redujo 63,2% su crecimiento y Pf en 39,3% (Tabla 2).
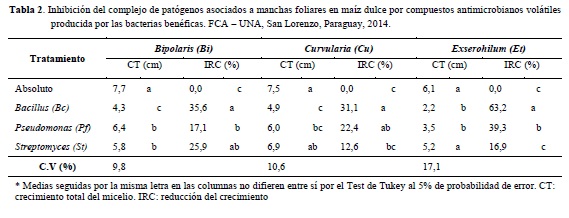
De esta manera se puede afirmar que Bacillus sp. fue la bacteria quien se destacó por presentar los mayores porcentajes de inhibición del crecimiento micelial de Bipolaris sp. (35,6%), Curvularia sp. (31,1%) y Exserohilum turcicum (63,2%), por poseer amplias y excepcionales acciones antagónicas debido a la producción de metabolitos como Iturin A, Fengycin y Gramicidina S que se encuentran biológicamente activos (Layton et al. 2011). Este antagonismo fue demostrado por Rojas Badía et al. (2011) quienes observaron que 85 a 92% del crecimiento de Pyricularia grisea, Alternaria alternata, Fusarium sp. y Curvularia sp. fueron inhibidos por la misma bacteria.
Con relación a la siguiente bacteria eficiente se encuentra P. fluorescens que logró inhibir 17,1% el crecimiento de Bipolaris sp., 22,4% el de Curvularia sp. y 39,3% de E. turcicum. De acuerdo con Soesanto et al. (2011) esta bacteria tiene un alto potencial como agente de control biológico mediante la producción de sideróforos, pero requieren tiempo para sintetizarlos (Santoyo et al. 2010). Esto fue comprobado por los mismos autores al observar mayores porcentajes de inhibición cuando cepas de P. fluorescens fueron sembradas 24 horas antes que los hongos fitopatógenos Colletotrichum lindemuthianum, C. gloeosporioides y Phytophthora cinnamomi.
Finalmente pese a que la eficiencia de Streptomyces sp. en reducir el crecimiento de Bipolaris sp., Curvularia sp. y E. turcicum fue menor que los anteriores tratamientos biológicos, logró reducir a los hongos en un 25,9, 12,6 y 16,9% respectivamente. Esta acción antagónica coincide con los resultados obtenidos por González et al. 2011 quienes demostraron que Streptomyces sp. produce enzimas como la gluconasa y proteasa que causan lisis de las hifas de patógenos como Rhizoctonia solani.
Inhibición in vitro de la germinación de conidios de E. turcicum
Los resultados en la prueba de inhibición de la germinación de conidios demostraron que las bacterias utilizadas ejercieron efecto antagónico sobre el hongo Et observándose diferentes niveles en los porcentajes de inhibición. En la Figura 1 se presenta el efecto de las bacterias seleccionadas para la prueba in vitro de la inhibición de la germinación de conidios de Et y se puede observar que los tratamientos más eficientes fueron Pf y Bc por presentar diferencias significativas con el testigo, caso contrario a lo observado en el tratamiento con St.
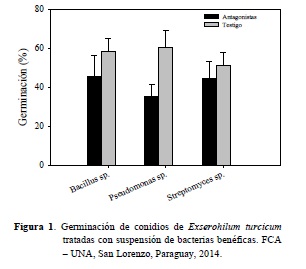
El tratamiento con el antagonista Pf fue donde se observó el menor porcentaje de conidios germinados (35,4%) lo que evidencia su mayor grado de inhibición. Este resultado concuerda con Sneh et al. (1984) quienes mencionaron que en medio liquido Pf provocó lisis del tubo germinativo e inhibición de la germinación de clamidosporas de Fusarium oxysporum f. sp. cucumerinum hecho que atribuyen a la producción de sideróforos.
Así mismo en el tratamiento con las bacterias Bc y St fue observado un porcentaje de germinación de 45,6 y 44,6% respectivamente, mayor que el tratamiento con Pf, lo que evidencia una menor eficiencia en la inhibición de la germinación de Et, coincidiendo con Gutiérrez et al. (2003) quienes observaron la inhibición de la germinación de Colletotrichum gloeosporioides por metabolitos fungitóxicos producidos por Bacillus subtilis. Por otro lado Bressan (2003) afirmó que la bacteria St es un efectivo controlador biológico de hongos fitopatógenos ya que en un experimento demostró la inhibición del desarrollo de Aspergillus sp., Curvularia lunata y Drechslera maydis loque respalda el efecto observado en este experimento con el patógeno Et.
En los experimentos in vitro se observó que las bacterias presentaron potencial inhibitorio sobre los patógenos asociados a la mancha foliar, donde se destacan Bc y Pf, seguido por St. Por lo expuesto, estas bacterias fueron capaces de reducir tanto el crecimiento micelial como la germinación de los conidios de los patógenos, verificados por los distintos mecanismos estudiados como ser el antagonismo directo por producción de compuestos antimicrobianos y la producción de compuestos volátiles inespecíficos.
Control biológico del complejo de hongos causantes de la mancha foliar en maíz dulce con bacterias benéficas en condiciones de campo
Los resultados obtenidos en este experimento indicaron que en todos los estratos la mayor cantidad de enfermedad se registró en el tratamiento absoluto y la menor en el tratamiento químico. En la Figura 2 se representan las curvas de progreso de la enfermedad en los tratamientos en cada estrato y la severidad máxima alcanzada por la misma. La mayor acumulación de enfermedad se observó en el estrato medio de la planta con un Ymax de 63% y la menor intensidad con el tratamiento químico con 23% de severidad (Figura 2). Según Pereira et al. 2003, las hojas de esta sección de la planta representan el 40% del área total de la planta cuya pérdida en 25% podría significar una reducción del 32% de la producción, lo que se traduce en la importancia de mantener sano el tejido de las hojas de este estrato.
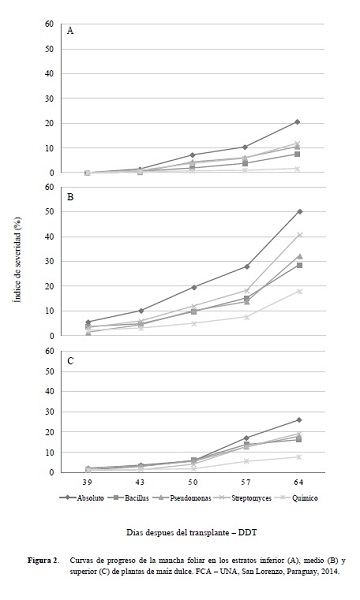
Contrastando los tratamientos biológicos se observa que Pf y Bc redujeron significativamente el área bajo la curva del progreso y la severidad final de la mancha foliar en el estrato medio, lo que coincide con los resultados obtenidos por Perelló et al. (2001) quienes señalaron la eficiencia que poseen cepas de Bacillus subtilis en reducir la severidad de manchas foliares en trigo causadas por Bipolaris sorokiniana. También Sopher y Satton (2009) demostraron que la bacteria Pf redujo la intensidad de la pudrición de raíz en hortalizas causada por Pythium sp. (Figura 2). En el tratamiento con la bacteria St se observa también una reducción de 19% de la severidad de la enfermedad en el estrato medio sin diferenciarse estadísticamente del testigo absoluto y los demás tratamientos biológicos, lo que coincide con lo observado por Dhanasckaran et al. (2005) quienes verificaron la reducción de la agresividad de la enfermedad damping off causada por R. solani (Figura 2).
Con relación al efecto de las bacterias benéficas sobre el progreso de las enfermedades Rivera et al. (2014) confirmaron que Pf tiene actividad antagónica sobre Phytophthora sp. reduciendo entre 30,2 a 38,5% el nivel de severidad del tizón tardío de la papa. Así mismo, Bettiol et al. (2009) demostraron el efecto antagónico de Bc reduciendo en un 80% la incidencia de la enfermedad moho verde de los cítricos causado por Penicillium digitatum. Con respecto a St, Ezziyyani et al. (2005) afirmaron que S. rochei redujo efectivamente el avance de Phytophthora capsici en el cultivo de pimiento.
Finalmente, en el estrato superior no se observaron diferencias estadísticamente significativas entre los tratamientos biológicos y el testigo absoluto, sin embargo cabe resaltar que la infección del estrato superior de las plantas de maíz dulce compromete mínimamente el potencial del rendimiento por lo que la protección de los estratos inferior y medio observada con los tratamientos biológicos es significativa. El tratamiento químico redujo la severidad diferenciándose significativamente de los demás tratamientos (Figura 2).
De acuerdo a lo mencionado por Harlapur (2005) el estado de desarrollo de la planta es importante para el progreso de la enfermedad. Según Formento (2010) las lesiones pueden aparecer desde etapas muy tempranas pero cuando la infección se establece antes o durante la aparición de los estigmas, los daños son mayores (CIMMYT 2004). Esto fue comprobado por Harlapur (2005) mediante un experimento donde la infección fue observada a los 25 días de edad de las plantas, en la cual aumentó progresivamente hasta alcanzar una severidad máxima de 96,3% coincidiendo con el estado de emisión de los estigmas. Esto coincide con los resultados obtenidos en el presente experimento donde el mayor porcentaje de severidad se identificó en el estrato medio periodo en el cual ocurría el desarrollo de los estigmas y que podrían comprometer la producción.
Al combinar los resultados obtenidos en los experimentos de antagonismo directo y el de progreso de la enfermedad, se evidenció que las bacterias benéficas Bc, Pf y St son consideradas agentes de control biológico del complejo de hongos causantes de la mancha foliar del maíz dulce. Sin embargo bajo condiciones naturales St no presentó una reducción significativa de la severidad. Este antagonismo ejercido por las bacterias benéficas fue también demostrado por Layton et al. (2011) quienes mencionan que cepas de Bc, como B. brevis y B. subtilis, poseen amplias y excepcionales acciones antagónicas contra microorganismos de diversas etiologías y que la acción biocontroladora de esta bacteria está mediada por su perfil bioquímico ya que son productores de múltiples metabolitos biológicamente activos como Iturin A y Fengycin producidos por B. subtilis y Gramicidina S por B. brevis.
Por otra parte, con respecto a la bacteria del género Pf, Soesanto et al. (2011) mencionan que la misma tiene un alto potencial como agente de control biológico de enfermedades en vegetales ya que pueden formar enzimas extracelulares como amilasa, proteasa, quitinasa, celulasa y gelatinasa de manera a retener hierro (Fe) y así producir sideróforos. Además Valencia-Cantero et al. (2005) mencionaron que existe un mecanismo alterno de inhibición que actúa de forma dependiente de los sideróforos ya que en un experimento encontraron que cepas mutantes incapaces de producir sideróforos inhibieron el crecimiento de Fusarium oxysporum. Evidencias presentadas por Tran et al. (2007) indican la presencia de un importante componente denominado Massetolide A que según Bruijn et al. (2008) es producido por varias cepas de Pseudomonas.
Con relación a St, éstos son conocidos por desarrollar actividades como el mejoramiento de la estructura del suelo y la producción de compuestos como los antibióticos que tienen actividad antagónica contra microorganismos patógenos (Franco-Correa 2009). También han sido descritos como colonizadores de la rizósfera capaces de ejercer biocontrol, por producción de sideróforos y sustancias promotoras del crecimiento vegetal (Tokala et al. 2002).
Además por su capacidad de producir enzimas biodegradativas como quitinasas, glucanasas, peroxidasas y otras, involucradas en el papel del micoparasitismo que llevan a cabo estos microorganismos (Franco-Correa 2009, Tokala et al. 2002). Trabajos realizados por González et al. (2011) demostraron que las enzimas gluconasa y proteasas actuando en conjunto son muy importantes en el micoparasitismo debido a que son responsables de la lisis de hifas de fitopatógenos como Rhizoctonia solani a través de la digestión de la mayoría de los componentes de la pared celular.
Actualmente la promoción de disminuir la utilización de productos fitosanitarios que afectan al ecosistema es cada vez mayor para lo cual se buscan alternativas entre las que se encuentra el control biológico con microorganismos o sus metabolitos (Villa et al. 2005). Se considera como buen agente de control biológico a aquel que replica los resultados satisfactorios obtenidos en laboratorio reduciendo la intensidad de la enfermedad en condiciones de campo. Asimismo fue verificado que las bacterias utilizadas en el experimento redujeron la severidad de la enfermedad en plantas de maíz dulce mediante mecanismos que fueron determinados en condiciones de laboratorio contra los agentes etiológicos Bi, Cu y Et. Las bacterias Bc y Pf se destacaron por reducir significativamente el crecimiento y desarrollo del complejo de patógenos estudiados y el progreso de la enfermedad que causan, mediante la producción de compuestos anti microbianos hidrosolubles y la producción de compuestos volátiles inespecíficos, lo que las hace una excelente alternativa para el control biológico de esta enfermedad.
CONCLUSIONES
A partir de los datos obtenidos en esta investigación de los potenciales agentes de control biológico se puede concluir que:
La bacteria benéfica Bacillus sp. ejerce antagonismo por producción de compuestos antimicrobianos hidrosolubles y volátiles inespecíficos sobre el complejo de patógenos y redujo 43% la severidad de la mancha foliar.
La bacteria benéfica Pseudomonas fluorescens ejerce antagonismo por producción de compuestos antimicrobianos hidrosolubles y volátiles inespecíficos sobre el complejo de patógenos y redujo 36% la severidad de la mancha foliar.
La bacteria benéfica Streptomyces sp. ejerce antagonismo por producción de compuestos antimicrobianos hidrosolubles y volátiles inespecíficos sobre el complejo de patógenos y redujo 19% la severidad de la mancha foliar.
Las bacterias benéficas Bacillus sp. Pseudomonas fluorescens y Streptomyces sp. son consideradas agentes de control biológico por producir efecto antagónico al reducir el crecimiento y desarrollo del complejo de patógenos y disminuir la severidad de la mancha foliar en maíz dulce.
REFERENCIAS BIBLIOGRÁFICAS
Acuña Gamarra, EM; Grabowski Ocampos, CJ. 2012. Inducción de resistencia en plantas de trigo (Triticum aestivum L.) a la mancha amarilla (Drechslera tritici-repentis) y marrón (Bipolaris sorokiniana). Investigación Agraria 14(2):71-79. [ Links ]
Altieri, MA. 1999. Manejo y ecología de las enfermedades de los cultivos. In Altieri, M. Agroecología: bases científicas para una agricultura sustentable. Editorial Nordan - Comunidad. p. 287. [ Links ]
Bettiol, W; Mattos, LPV; Gonçalves, GG; Morais, LAS. 2009. Efeito de agentes de biocontrole sobre o bolor verde (Penicillium digitatum) em frutos cítricos. In Tropical Plant Pathology: XLII Congresso Brasileiro de Fitopatologia, Rio de Janeiro, BR. v. 34. p. S54. [ Links ]
Bressan, W. 2003. Biological control of maize seed pathogenic fungi by use of actinomycetes. BioControl 48:233-240. [ Links ]
Bruijn, I de; Kock, MJD de; Waard, P de; Vaan Beck, TA; Raaijmakers, JM. 2008. Massetolide a biosynthesis in Pseudomonas fluorescens. Journal of Bacteriology 190(8):2777-2789. [ Links ]
Cardona, R; González, M. 2006. Técnicas para la preservación e inducción a la esporulación de hongos del complejo Helminthosporium. Fitopatología Venezolana 19(1):19-20. [ Links ]
Carmichael, JW; Kendrick, WB; Conners, IL; Sigler, L. 1980. Genera of Hyphomycetes. University of Alberta Press. 386 p. [ Links ]
CIMMYT (Centro Internacional de Mejoramiento de Maíz y Trigo, ME). 2004. Programa de Maíz CIMMYT Enfermedades del maíz: una guía para su identificación en el campo. 4 ed. México, D.F. [ Links ]
Dhanasckaran, D; Sivamani, P; Panneerselvam, A; Thajuddin, N; Rajakumar, G; Selvamani, S. 2005. Biological control of tomato seedling damping off with Streptomyces sp. Plant Pathology Journal 4(2):91-95. [ Links ]
Ezziyyani, M; Requena, ME; Pérez-Sánchez, C; Candela, ME. 2005. Efecto del sustrato y la temperatura en el control biológico de Phytophthora capsici en pimiento (Capsicum annuum L.) Murcia, ES. Anales de Biología 27:119-126. [ Links ]
Formento, AN. 2010. Enfermedades foliares reemergentes del cultivo de maíz: royas (Puccinia sorghi y Puccinia polysora), tizón foliar (Exserohilum turcicum) y mancha ocular (Kabatiella zeae). INTA. Paraná, AR. 15 p. [ Links ]
Franco-Correa, M. 2009. Utilización de los actinomycetos en procesos de biofertilización. Bogotá, CO. Revista Peruana de Biología 16(2):239-242. [ Links ]
González, I; Infante, D; Peteira, B; Martínez, B; Arias, Y; González, N; Miranda, I. 2011. Caracterización bioquímica de aislamientos de Trichoderma spp. promisorios como agentes de control biológico: II Expresión de actividad glucanasa, Mayabeque, CU. Revista de Protección Vegetal 26(1):23-29. [ Links ]
Grabowski Ocampos, C; Santiago, TR; Moreira, NF; Milagres, EA; Oliveira, JR. 2011. Caracterização da potencialidade antagônica dos isolados bacterianos UFV-215 e UFV-247 selecionadas do filoplano da couve contra a alternariose e podridão negra. In XLIV Congresso Brasileiro de Fitopatología-Bento Gonçalves RS. [ Links ]
Greenwood, P; Halstead, A. 2002. Royal Horticultural Society: enciclopedia de las plagas y enfermedades de las plantas. Editorial Blume. 223 p. [ Links ]
Gutiérrez Alonso, JG; Gutiérrez Alonso, O; Nieto Angel, D; Téliz Ortiz, D; Zavaleta Mejía, E; Delgadillo Sánchez, F; Vaquera Huerta, H. 2003. Evaluación in vitro de agentes biológicos y físicos para el control de Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. Revista Mexicana de Fitopatología 21(2)199-206. [ Links ]
Handelsmann, J; Stabb, EV. 1996. Biocontrol of soilborne pathogens. Plant Cell 8: 1855-1869. [ Links ]
Harlapur, SI. 2005. Epidemiology and management of turcicum leaf blight of maize caused by Exserohilum turcicum (Pass.) Leonard and Suggs. Thesis Dr. Dharwad, IN. University of Agricultural Sciences. 150 p. [ Links ]
James, C. 1971. A manual of assessment keys for plant diseases. Key no. 1.7. [ Links ]
Kado, CL; Heskett, MG. 1970. Selective media for isolation of Agrobacterium, Corynebacterium, Erwinia, Pseudomonas and Xanthomonas. Phytopathology 60: 969-979. [ Links ]
Layton, C; Maldonado, E; Monroy, L; Corrales, LC; Sánchez, LC. 2011. Bacillus spp.; perspectiva de su efecto biocontrolador mediante antibiosis en cultivos afectados por fitopatógenos. Bogotá, CO. NOVA 9(15):177-187. [ Links ]
Ordás, B; Romay, MC; Revilla, P. 2007. Maíz dulce ¿Por qué no?. In Horticultura: cultivo de Primula vulgaris, la primera nota de color en el jardín 25(5):14-18. [ Links ]
Pereira Filho, IA; Cruz, JC; Gomez e Gama, EE. 2003. Cultivares para o consumo verde. In Pereira Filho, IA. O cultivo do milho-verde. EMBRAPA Informação Tecnológica. Brasilia, DF, BR. p. 17-30. [ Links ]
Perelló, A; Simón, MR; Arambarri, AM; Cordo, CA. 2001. Greenhouse screening of the saprophytic resident microflora for control of leaf spot of wheat (Triticum aestivum). Phytoparasitica 29(4):1-11. [ Links ]
Rivera, MC; Wright, ER. 2014. Control biológico de enfermedades de plantas en Argentina. In Bettiol, W; Rivera, MC; Mondino, P; Montealegre, JR; Colmenárez, YC. Control biológico de enfermedades de plantas en América Latina y el Caribe. p. 9-81. [ Links ]
Rojas Badía, MM; Tejera Hernández, B; Larrea Murrel, JA; Mahillon, J; Heydrich Pérez, M. 2011. Aislamiento y caracterización de cepas de Bacillus asociadas al cultivo del arroz (Oryza sativa L.). Revista Brasileira de Agroecología 6(1):90-99. [ Links ]
Santoyo, G; Valencia-Cantero, E; Orozco-Mosqueda, M; Peña-Cabriales, J; Farías-Rodríguez, R. 2010. Papel de los sideróforos en la actividad antagónica de Pseudomonas fluorescens Zum80 hacia hongos fitopatógenos. Chapingo, MX. Terra Latinoamericana 28(1):53-60. [ Links ]
Sneh, B; Dupler, M; Elad, Y; Baker, R. 1984. Chlamydospore germination of Fusarium oxysporum f. sp. cucumerinum as effected by fluorescent and lytic bacteria from a Fusarium-supressive soil. The American Phytopathological Society 74(9):1115-1124. [ Links ]
Soesanto, L; Mugiastuti, E; Rahayuniati, RF. 2011. Biochemical characteristic of Pseudomonas fluorescens P60 Purwokerto, ID. Journal of Biotechnology and Biodiversity 2:19-26. [ Links ]
Sopher, CR; Sutton, JC. 2009. Pseudomonas chlororaphis 63-28 controls Pythium root rot and enhances growth in hydroponic sweet peppers (Capsicum annuum) regardless of high temperature predisposition to the disease. In Tropical Plant Pathology: XLII Congresso Brasileiro de Fitopatologia, Río de Janeiro, BR. v. 34. p. S60. [ Links ]
Tokala, RK; Strap, JL; Jung, KM; Crawford, DL; Hamby Salove, M; Deobald, LA; Franklin Bailey, J; Morra, MJ. 2002. Novel plant-microb rhizosphere interaction involving Streptomyces lydicus WYEC108 and the pea plant (Pisum sativum). Applied and Environmental Microbiology 68(5):2161-2171. [ Links ]
Tran, H; Ficke, A; Asiimwe, T; Hofte, M; Raaijmakers, JM. 2007. Role of the cyclic lipopeptide massetolide A in biological control of Phytophthora infestans and in colonization of tomato plants by Pseudomonas fluorescens. New Phytologist 175:731-742. [ Links ]
Valencia-Cantero, E; Villegas-Moreno, J; Sánchez-Yáñez, JM; Peña-Cabriales, JJ; Farías-Rodríguez, R. 2005. Inhibición de Fusarium oxysporum por cepas mutantes de Pseudomonas fluorescens ZUM80 incapaces de producir sideróforos. Terra Latinoamericana 23(1):81-88. [ Links ]
Villa, PM; Frías, A; González, G. 2005. Evaluación de cepas de Pseudomonas sp. para el control de hongos fitopatógenos que afectan cultivos de interés económico. ICIDCA Sobre los Derivados de la Caña de Azúca 39(3):40-44. [ Links ]













