Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.16 no.1 San Lorenzo June 2014
ARTÍCULO CIENTÍFICO
Seletividade de Metarhizium anisopliae a Telenomus podisi (Hymenoptera: Scelionidae)
Selectivity of Metarhizium anisopliae to Telenomus podisi (Hymenoptera: Scelionidae)
Marcos Arturo Ferreira Agüero1,2* y Pedro Manuel Oliveira Janeiro Neves1
1 Programa de Pós-Graduação em Agronomia, Universidade Estadual de Londrina, CP 6001, Londrina, PR, Brasil.
2 Departamento de Protección Vegetal, División: Entomología, Universidad Nacional de Asunción, Facultad de Ciencias Agrarias, Pedro Juan Caballero, Paraguay.
* Autor para correspondencia (ingeniero.ferreira1@gmail.com)
Recibido: 08/12/2013; Aceptado: 02/01/2014.
RESUMO
A seletividade do fungo entomopatogênico M. anisopliae ao parasitóide de ovos T. podisi foi avaliada com a realização de tres bioensaios: no primeiro, foram pulverizados suspensões de conídios de M. anisopliae sobre ovos esterilizados de Euschistus heros e expostos ao parasitismo; no segundo bioensaio, as suspensões do fungo foram pulverizadas sobre ovos parasitados, e no terceiro bioensaio, as suspensões do fungo foram pulverizadas sobre placas de vidro das jaulas de exposição (IOBC/WPRS) e secas a temperatura ambiente, formando uma película de conídios para permitir o contato com os parasitóides adultos. As testemunhas foram pulverizadas com água destilada estéril + Tween 80 a 0,01%. Para avaliar a porcentagem de parasitismo, emergência e viabilidade dos parasitóides, as cartelas de ovos contendo os parasitóides foram acondicionadas em sacos plásticos e observadas a traves de um microscópio estereoscópico. Os resultados obtidos neste estudo indicam que o M. anisopliae não afeta o parasitismo e a viabilidade de T. podisi, porêm, a emergência do parasitóide pode reduzir 25,81% se o fungo é pulverizado sobre ovos parasitados. Possivelmente, o fungo penetra o ovo do hospedeiro e infeta ao parasitóide em alguma fase. Entretanto, a reducção da emergência em comparação á testemunha é baixa. Por tanto, M. anisopliae pode ser considerado seletivo a T. podisi, e ambos podem ser utilizados conjuntamente, separando ao máximo as pulverizações do fungo e as liberações do parasitóide.
Palavras chave: Euschistus heros, compatibilidade, controle biológico, fungo entomopatôgeno, parasitóides de ovos.
ABSTRACT
Selectivity of entomopathogenic fungus M. anisopliae to egg parasitoid T. podisi was evaluated. Three bioassays were realized: in the first, a suspension of M. anisopliae conidia was sprayed over sterilized eggs of Euschistus heros and exposed to parasitism, in the second, conidial suspensions were sprayed over parasitized eggs and in the third, the suspensions were sprayed over glass plates (IOBC/WPRS) and dried at ambient temperature, forming a layer of conidia for adult parasitoids contact. The control group was sprayed with sterile distillated water + Tween 80 (0.01%). To evaluate the percentage of parasitism, emergence and viability of parasitoids, the cards containing parasite eggs were introduced in plastic bags and observed using a stereoscopic microscope. The results indicate that M. anisopliae do not affect T. podisi viability and parasitism, but its emergence can be reduced 25.81%, if the fungus is sprayed on parasitized eggs. Possibly, the fungus penetrates the egg and infects the parasitoid at some stage. Nevertheless, emergence reduction compared to control was low. Therefore, M. anisopliae can be considered selective to T. podisi, and can be used jointly, separating at maximum the spraying of fungus and the releases of parasitoid.
Key words: Euschistus heros, compatibility, biological control, entomophatogenic fungus, eggs parasitoid.
INTRODUÇÃO
O emprego dos agentes de controle biológico Telenomus podisi Ashmead (Hymenoptera: Scelionidae) e Metarhizium anisopliae são importantes no Manejo Integrado de Pragas. Assim, é necessário que a compatibilidade entre o fungo entomopatogênico e o parasitóide seja elucidada.
Como alternativas ao uso dos inseticidas químicos convencionais, podem ser utilizados parasitóides e microorganismos entomopatogênicos, devido a sua eficácia no controle de pragas, seletividade e baixo risco ao meio ambiente (Parra et al. 2002).
Os parasitóides de ovos são importantes inimigos naturais liberados em diversas culturas. As espécies T. podisi e Trissolcus basalis Wollaston (Hymenoptera: Scelionidae) são abundantes nas lavouras de soja da Região Norte do Paraná (Corrêa-Ferreira 1993, Cividanes e Parra 1994) e de muita importância, especialmente pela elevada densidade populacional de seu hospedeiro preferencial Euschistus heros Fabricius (Heteroptera: Pentatomidae).
Com o aumento da utilização dos fungos entomopatogênicos, M. anisopliae e Beauveria bassiana, para o controle de pragas de varias culturas (Alves 1998), surge a preocupação sobre os possíveis efeitos colaterais em organismos não-alvo, já que com sua aplicação pode entrar em contato com diversas espécies, incluindo inimigos naturais que ocupam o mesmo habitat da praga (Magalhães et al.1998, Sosa-Gómez et al.1998). Diversos estudos de compatibilidade de fungos entomopatogênicos a inseticidas químicos e botânicos têm sido realizados para avaliar a seletividade (Neves et al. 2001, Santos et al. 2009 a y b). Entretanto, poucas pesquisas foram realizadas para determinar o efeito de microrganismos entomopatogênicos sobre parasitóides (Tounou et al.2003, Santos Jr et al.2006, Potrich et al. 2009).
Nesse intuito, Polanczyk et al. (2010) testaram o efeito de duas formulações comerciais à base de B. bassiana e M. anisopliae sobre Trichogramma atopovirilia Oatman e Platner (Hymenoptera: Trichogramatidae), avaliando-se, índice de parasitismo, emergência do parasitóide, número de indivíduos por ovo e razão sexual. Verificaram que os entomopatogenos não interferiram nos parâmetros avaliados e que não houve esporulação do fungo no adulto, indicando que T. atopovirili, B. bassiana e M. anisopliae foram compatíveis.
Em outro estudo avaliou-se a seletividade de M. anisopliae e B. bassiana em adultos de Oomyzus sokolowskii Kurdjumov (Hymenoptera: Eulophidae),importante parasitóide de Plutella xylostella L. (Lepidoptera: Plutellidae), onde se observou que B. bassiana e M. anisopliae não reduziram a longevidade do parasitóide. Entretanto, a mortalidade provocada por B. bassiana foi de 21% e de M. anisopliae 9%, mostrando a sensibilidade deste parasitóide aos fungos, em especial a B. bassiana (Santos Jr et al. 2006).
Também foram testados isolados de B. bassiana, M. anisopliae e Isaria sp. pulverizando-se sobre ovos de Anagasta kuehniella Zeller(Lepidoptera: Pyralidae), onde se observou a repelência de Trichogramma pretiosum, com maior parasitismo na testemunha, e apenas para um dos isolados de Isaria sp., o parasitismo foi semelhante em relação à testemunha (Potrich et al. 2009).
Existe a necessidade de estudar os possíveis efeitos negativos dos fungos entomopatogenicos sobre os inimigos naturais (De la Rosa et al.2000). Assim, o objetivo deste estudo foi avaliar a seletividade do fungo M. anisopliae ao parasitóide de ovos T. podisi.
MATERIAL E MÉTODOS
Os experimentos foram realizados no laboratório de Controle Microbiano de Insetos da Universidade Estadual de Londrina (UEL). Para a criação do parasitóide foram oferecidos ovos de E. heros como hospedeiro em cartelas e como alimento um filete de mel na lateral do tubo de plástico. O fungo M. anisopliae (Isolado UEL 50) foi produzido em meio de cultura (Alves 1998). Após incubação por oito dias em câmara climatizada (25±1ºC e 12 h de fotófase), os conídios foram recolhidos raspando-se a superfície do meio de cultura e utilizados na preparação das suspensões. Em cada tratamento foi aplicado 1,5 mL de suspensão, utilizando-se torre de Potter automática, calibrada a uma pressão de 12 lb/pol² para depositar aproximadamente 1,75±0,25 mL de calda por cm2 (Manzoni et al. 2007). Os bioensaios foram realizados em condições de ambiente controlado (25±1oC, 70±10% UR, e fotófase de 12 h). O delineamento experimental adotado foi inteiramente casualizado com 20 repetições de acordo com protocolos padronizados da IOBC/WPRS descritos por Hassan (1992).
Bioensaio I: Pulverização de M. anisopliae sobre ovos de E. heros não parasitados
Foram pulverizadas suspensões de M. anisopliae (1,0×1010 conídios viáveis/mL+ 0,01% de Tween 80) sobre vinte cartelas (1×2 cm) contendo cada uma aproximadamente 100 ovos de E. heros esterilizados e não parasitados. Na testemunha foi pulverizada água destilada estéril + 0,01% de Tween 80. Após a pulverização, as cartelas foram secas em temperatura ambiente durante 1 h, individualizadas em gaiolas de exposição e submetidas ao parasitismo por fêmeas copuladas de T. podisi, por 24 h. Posteriormente, as cartelas, já com ovos parasitados, foram retiradas das gaiolas e armazenadas em sacos plásticos, mantidos nas mesmas condições citadas, até a emergência e morte dos parasitóides.
Bioensaio II: Pulverização de M. anisopliae sobre ovos de E. heros parasitados por T. podisi
Vinte cartelas com aproximadamente 100 ovos de E. heros cada, foram pulverizadas treze dias após o parasitismo de T. podisi, com 1,5 mL de suspensão de 1,0×109 conídios viáveis/mL+ 0,01% de Tween 80 de M. anisopliae, quando o parasitóide encontrava-se na fase de pupa, com variação média de 24 h. Em seguida, as cartelas foram secas como descrito anteriormente e logo inseridas nas gaiolas. Posterior à emergência dos parasitóides dos ovos pulverizados, foram oferecidos cartelas com ovos do hospedeiro, diariamente, nos primeiros três dias e no sexto dia. Após cada período, as cartelas com ovos parasitados foram retiradas das gaiolas e transferidas para sacos plásticos, para avaliar a percentagem de emergência, parasitismo e viabilidade dos parasitóides.
Bioensaio III: Teste de contato de adultos de T. podisi com M. anisopliae
Pulverizou-se 1,5 mL de suspensão de M. anisopliae (1,0×109 conídios viáveis/mL + 0,01% de Tween 80) diretamente sobre placas de vidro (13x13 cm por 2 mm de espessura). Em seguida as placas permaneceram à temperatura ambiente por 1 h, para secarem, formando uma película de conídios. Com as placas de vidro pulverizadas, foram montadas gaiolas de exposição para o teste de contato entre o fungo e o parasitóide. Os adultos de T. podisi foram inseridos nas gaiolas através de conexão com tubos de emergência permitindo a entrada dos parasitóides no interior das gaiolas (Carmo et al. 2010). Cartelas de ovos não parasitados foram inseridas diariamente nas gaiolas, para avaliar o parasitismo no 1º, 2º, 3º e 6º dia após o início do bioensaio.
Avaliações
Ao término de cada etapa do bioensaio, quantificaram-se o número de parasitóides emergidos, número total de ovos, ovos parasitados com e sem orifício e não parasitados. A partir desses dados calculou-se a percentagem de parasitismo, viabilidade e redução do parasitismo. Os cadáveres dos parasitóides e as massas de ovos foram acondicionados em câmara úmida (25±1ºC, 12 h de fotófase) para observar se ocorreu conidiogênese de M. anisopliae sobre os cadáveres dos parasitóides e ovos do hospedeiro. Quando se desenvolveu o fungo com características de M. anisopliae sobre os cadáveres ou ovos, este foi isolado em meio (BDA) para confirmação e identificação.
No segundo bioensaio, avaliou-se ainda a emergência dos parasitóides a partir de ovos pulverizados com o fungo, a redução da emergência e a capacidade de parasitismo das fêmeas emergidas desses ovos. No terceiro bioensaio, avaliou-se o parasitismo provocado pelas fêmeas que caminharam sobre placas de vidro contaminadas com a suspensão, a viabilidade e a redução do parasitismo. O número de ovos parasitados em cada tratamento foi obtido mediante a contagem de ovos parasitados, sob microscópio estereoscópico, durante o período de execução do experimento.
A viabilidade foi calculada através da razão entre o número de ovos parasitados e o número de orifícios (parasitóides emergidos). A redução da emergência (RE) e a redução na emergência em relação ao tratamento testemunha foi calculada pela equação RE (%) = (1-Vt/Vc)x100, em que: E (%) é a percentagem de redução da viabilidade do parasitismo; Vt é a viabilidade do parasitismo médio para o tratamento testado; e Vc é a viabilidade do parasitismo médio observado para o tratamento testemunha.
A redução do parasitismo (RP) pelo o fungo foi determinada através da comparação com a testemunha, calculada por meio da fórmula: RP = (1-Rt/Rc) x 100, descrita por Hassan et al. (2000), onde RP é a percentagem de redução no parasitismo, Rt o valor do parasitismo médio para cada tratamento e Rc o parasitismo médio observado na testemunha (água destilada+ Tween 80).
Os efeitos do fungo entomopatogênico foram classificados de acordo com as normas padronizadas da IOBC/WPRS em: classe 1 – inócuo (< 30%), classe 2 – levemente nocivo (30 – 79%), classe 3 – moderadamente nocivo (80 - 99%) e classe 4 nocivo (> 99%) (Hassan 1992).
Os resultados obtidos foram submetidos às análises exploratórias para avaliar as pressuposições de normalidade dos resíduos, a homogeneidade de variância dos tratamentos e a aditividade do modelo, através da ANAVA pelo programa SAS® (SAS Institute 2001). As médias foram comparadas pelo teste de Tukey, a 5% de significância.
RESULTADOS E DISCUSSÃO
Bioensaio I: Pulverização de M. anisopliae sobre ovos de E. heros não parasitados
A pulverização de M. anisopliae sobre ovos não parasitados de E. heros não reduziu o parasitismo de T. podisi, sendo de 73,66% de parasitismo na testemunha e 74,37% no ovo pulverizado com o fungo (Tabela 1). Da mesma forma, não houve diferenças na viabilidade de T. podisi a partir dos ovos de E. heros pulverizados com M. anisopliae (68,80%) e a testemunha (70,61%). Assim, o parasitismo não foi afetado, bem como o desenvolvimento do parasitóide no interior do ovo do hospedeiro, para ovos pulverizados com o fungo antes do parasitismo. Em estudos semelhantes, Silva et al. (2010) verificaram que a aplicação de M. anisopliae sobre ovos de A. kuehniella não causou repelência ao parasitismo por T. pretiosum mesmo com chance de escolha. Os resultados observados indicam que a presença de conídios de M. anisopliae sobre os ovos de E. heros não interferiu no parasitismo de T. podisi. Por tanto, pode-se considerar que M. anisopliae não afetou o comportamento de postura/parasitismo das fêmeas adultas de T. podisi, liberadas logo após a pulverização de M. anisopliae sobre o ovo do hospedeiro (Tabela 1).

Bioensaio II: Pulverização de M. anisopliae sobre ovos de E. heros parasitados por T. podisi.
A suspensão de conídios de M. anisopliae pulverizada sobre ovos de E. heros (pós-parasitismo) por T. podisi, em fase de pupa, afetou a emergência dos parasitóides, cujo parasitismo foi de 84,36% na testemunha e 58,55% nos ovos tratados com M. anisopliae (Tabela 2). Isso indica que a pulverização do fungo sobre os ovos, quando T. podisi encontra-se na fase de pupa, reduz a emergência dos parasitóides adultos. A redução de 25,81% na emergência ocorreu provavelmente pela infecção das pupas do parasitóide com a penetração do fungo através do córion do ovo do hospedeiro e crescimento do fungo no interior desse ovo, dificultado a emergência do adulto. Resultados semelhantes foram obtidos por Potrich et al. (2009), onde a emergência de T. pretiosum foi afetada, quando M. anisopliae foi aplicado sobre ovos de A. kuehniella parasitados.
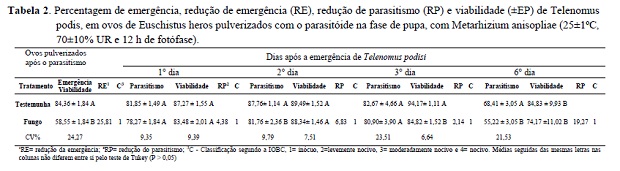
Existem poucas informações sobre o efeito de M. anisopliae sobre pupas de parasitóides em ovos hospedeiros. Alguns estudos indicam que M. anisopliae pode apresentar efeito ovicida em Aedes aegypti (Luz et al. 2008, Santos et al. 2009 a y b) e metabólicos tóxicos podem contribuir para a redução da viabilidade desses ovos (Russell et al. 2001). Também foi demonstrado que isolados de M. anisopliae afetam a eclosão das lagartas de Tuta absoluta Meyrick (Lepidoptera: Gelechiidae) já que os conídios penetram nos ovos com as larvas de T. absoluta, dos quais esporula o fungo (Pires et al. 2010). Além de infectar ovos de dípteros (Luz et al. 2011) e ter atividade sobre as pupas de parasitóides em ovo hospedeiro, M. anisopliae pode ocasionar mortalidade de larvas ou lagartas pelo contato com os conídios no momento da eclosão. Ainda, durante o desenvolvimento do parasitóide, no ovo hospedeiro onde foi aplicado o fungo, pode ocorrer competição pelos nutrientes do ovo, afetando a emergência do parasitóide (Srinivasan et al. 2009).
Embora no segundo dia após a emergência de T. podisi, tenha sido verificada diferença na percentagem de parasitismo entre o tratamento com o fungo (81,85%) e a testemunha (87,8%), a redução do parasitismo foi percentualmente pequena (6,8%), pois valores acima de 80% de parasitismo podem ser considerados satisfatórios. No terceiro dia não houve diferenças entre o parasitismo na testemunha (82,67%) e no tratamento com M. anisopliae (80,90%), sendo a redução no parasitismo somente de 2,14%. Já a viabilidade do parasitismo na testemunha (94,4%) diferiu com relação ao tratamento com o fungo (84,8%). Apesar da redução, a viabilidade do parasitismo, mesmo com a aplicação do fungo foi elevada e segundo a classificação da IOBC, M. anisopliae foi inócuo para T. podisi.
No sexto dia de avaliação, como era esperada, a percentagem de parasitismo de T. podisi diminuiu, já que a capacidade de parasitismo do parasitóide diminui com o passar do tempo. Assim, a redução no parasitismo de 19,27% foi significativa comparando os ovos de E. heros tratados com M. anisopliae (55,2%) e a testemunha (68,4%) (Tabela 2). Entretanto, a viabilidade de parasitismo da testemunha e do tratamento manteve-se elevada com 84,83% e 94,17% respectivamente, indicando que a emergência de adultos de T. podisi foi elevada. Assim, o fungo pode ser considerado inócuo para o parasitóide segundo a classificação da IOBC.
Bioensaio III: Teste de contato de adultos de T. podisi com M. anisopliae
O contato de adultos de T. podisi com M. anisopliae não afetou sua capacidade de parasitismo e a viabilidade dos parasitoides, podendo ser considerado ao fungo entomomatógeno M. anisopliae seletivo e inócuo para adultos do parasitoide T. podisi. As fêmeas dos parasitóides foram capazes de parasitar eficientemente os ovos do hospedeiro E. heros até o sexto dia de avaliação, quando comparados com a testemunha. Também houve elevada porcentagem de viabilidade de parasitismo durante todas as avaliações (Tabela 3). As maiores percentagens de parasitismo, dos insetos que tiveram contato com o fungo foram observadas nos três primeiros dias (Tabela 3). Esse comportamento é normal e foi constatado para T. pretiosum Pratissoli et al. (2004). Resultados semelhantes também foram descritos para T. podisi sobre ovos dos percevejos E. heros, Piezodorus guildinii (Heteroptera: Pentatomidae)onde houve maior percentagem de descendentes por fêmeae em menor proporção para Nezara viridula (Heteroptera: Pentatomidae) (Pacheco e Corrêa-Ferreira 1998).
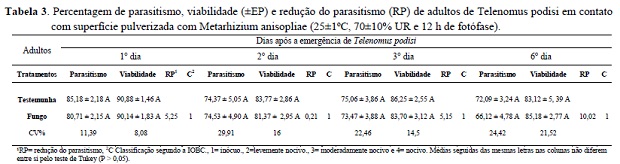
A viabilidade do parasitismo foi satisfatória em todas as avaliações, considerando os níveis propostos pela IOBC e os padrões de controle de qualidade em criações massais de parasitóides. Entretanto, reduções naturais no parasitismo e viabilidade ocorrem gradativamente com o aumento da idade das fêmeas e queda do desempenho dos parasitóides, como observado no sexto dia de avaliação, com 10,02% de redução no parasitismo (Tabela 3). Isso se deve a longevidade de aproximadamente 15 a 18 dias de T. podisi e tanto o parasitismo e sua viabilidade pode dependender da alimentação, temperatura, umidade relativa, gasto de energia durante a cópula e oviposição (Pacheco e Corrêa-Ferreira 1998).
CONCLUSÕES
1. M. anisopliae é seletivo a adultos de T. podisi, não afeta seu parasitismo e viabilidade, mesmo quando os parasitóides são expostos ao contato direto com o fungo.
2. T. podisi em fase de pupa é susceptível a infecção por M. anisopliae o que pode afetar sua emergência.
3. T. podisi e M. anisopliae podem ser utilizados conjuntamente no manejo integrado de pragas, espaçando-se ao máximo as aplicações do fungo e liberações do parasitóide para conseguir maior eficiência.
4. Estudos de campo devem ser realizados para verificar a compatibilidade desses agentes de controle, já que em laboratório os insetos têm exposição máxima aos tratamentos.
REFERÊNCIAS BIBLIOGRÁFICAS
Alves, SB. 1998. Fungos entomopatogênicos. In Alves, SB (ed.). Controle microbiano de insetos. Piracicaba, FEALQ. p. 289-391. [ Links ]
Carmo, EL; Bueno, AF; Bueno, RCOF. 2010. Pesticide selectivity for the insect egg parasitoid Telenomus remus. BioControl, Dordrecht 55(4):455-464. [ Links ]
Cividanes, FJ; Parra, JRP. 1994. Biologia em diferentes temperaturas e exigências térmicas de percevejos pragas da soja II Euschistus heros (Fabr.) (Heteroptera: Pentatomidae). Pesquisa Agropecuária Brasileira 29:1841-1846. [ Links ]
Corrêa-Ferreira, BS. 1993. Utilização do parasitóide de ovos Trissolcus basalis (Wollaston) no controle de percevejos da soja. Londrina: EMBRAPA-CNPSo. Circular Técnica 11. 40 p. [ Links ]
De la Rosa, W; Segura, HR; Barrera, JF; Williams, T. 2000. Laboratory valuation of the impact of entomopathogenic fungi on Prorops nasuta (Hymenoptera: Bethylidae), a parasitoid of the coffee berry borer. Environmental Entomology 29:126-131. [ Links ]
Hassan, SA. 1992. Guidelines for testing the effects of pesticides on beneficials organisms: description of test methods. International Union of Biological Sciences, Bulletin OILB/SROP/XV 3:18-39. [ Links ]
Hassan, SA; Halsall, N; Gray AP; Kuehner, C; Moll, M; Bakker, FMJ; Roembke, A; Yousef, FN; Abdelgader, H. 2000. A laboratory method to evaluate the side effects of plant protection products on Trichogramma cacoeciae Marchal (Hymenoptera Trichogrammatidae). In Candolfi, MP; Blümel, S; Forster, R; Bakker, FM; Grimm C; Hassan, SA; Heimbach, U; Mead-Briggs, MA; Reber, B; Schmuck, R; Vogt, H. Guidelines to evaluate side-effects of plant protection products to non-target arthropods: IOBC/WPRS. 158 p. [ Links ]
Luz, C; Mnyone, LL; Russel, LT. 2011. Survival of anopheline eggs and their susceptibility to infection with Metarhizium anisopliae and Beauveria bassiana under laboratory conditions. Parasitology Reseach 107(5):1271-1274. [ Links ]
Luz, C; Tai, MHH; Santos, AH; Silva, HHG. 2008. Impact of moisture on survival of Aedes aegypti eggs and ovicidal activity of Metarhizium anisopliae under laboratory conditions. Memórias do Instituto Oswaldo Cruz 103:214-215. [ Links ]
Magalhães, BP; Monnerat, R; Alves, SB. 1998. Interações entre entomopatógenos, parasitóides e predadores. In Alves, SB. (ed.). Controle microbiano de insetos. Piracicaba, FEALQ. p. 195-216. [ Links ]
Manzoni, CG; Grützmacher, AD; Giolo, FP; Lima, CAB de; Nörnberg, SD; Harter, WDAR; Müller, C. 2007. Seletividade de Agroquímicos utilizados na produção integrada de maçã aos parasitóides Trichogramma pretiosum Riley e Trichogramma atopovirilia Oatan and Platner (Hymenoptera: Trichogrammatidae). BioAssay 2(1):1-11. [ Links ]
Neves, PMOJ; Hirose, E; Tchujo, P; Moino, JRA. 2001. Compatibility of entomopathogenic fungi with neonicotinoid insecticides. Neotropical Entomology 30:263-268. [ Links ]
Pacheco, DJP e Corrêa-Ferreira, BS. 1998. Potencial reprodutivo e longevidade do parasitóide Telenomus podisi Ashmead, em ovos de diferentes espécies de percevejos. Anais da Sociedade Entomológica do Brasil 27:585-591. [ Links ]
Parra, JRP; Botelho, PSM; Corrêa-Ferreira, BS; Bento, JMS. 2002. Controle Biológico uma visão inter e multidisciplinar. In Parra, JRP; Botelho, PSM.; Corrêa-Ferreira, BS; Bento, JMS. (eds.). Controle Biológico no Brasil: parasitóides e Predadores. São Paulo, Manole. p. 125-142. [ Links ]
Pires, LM; Marques EJ; Oliveira JV; Alves, SB. 2010. Seleção de Isolados de Fungos Entomopatogênicos para o controle de Tuta absoluta (Meyrick) (Lepidoptera: Gelechiidae) e sua compatibilidade com alguns inseticidas usados na cultura do tomateiro. Biological Control 39:977-984. [ Links ]
Polanczyk, RA; Pratissoli, D; Dalvi, LP; Grecco, ED; Franco, CR. 2010. Efeito de beauveria bassiana (bals.) Vuillemin e Metarhizium anisopliae (metsch.) sorokin nos parâmetros biológicos de trichogramma atopovirilia Oatman e Platner, 1983 (Hymenoptera: Trichogrammatidae). Ciência e Agrotecnologia 34(6):1412-1416. [ Links ]
Potrich, M; Alves, LFA; Haas, J; Silva ERL da; Daros, A; Pietrowski, V; Neves PMOJ. 2009. Seletividade de Beauveria bassiana e Metarhizium anisopliae a Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae). Neotropical Entomology 38:822-826. [ Links ]
Pratissoli, D; Thuler, RT; Pereira, FF; Fialho ER; Ferreira, AT. 2004. Ação transovariana de lufenuron (50 G/ L) sobre adultos de Spodoptera frugiperda (J. E. Smith) (Lepidoptera: Noctuidae) e seu efeito sobre o parasitóide de ovos Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae). Ciência e Agrotecnologia 28:9-14. [ Links ]
Russell, BM; Kay, BH; Shipton, W. 2001. Survival of Aedes aegypti (Diptera: Culicidae) eggs in surface and subterranean breeding sites during the Northern Queensland dry season. Journal of Medical Entomology 38:441-445. [ Links ]
Santos Jr, HJG dos; Marques, EJ; Barros, R; Gondim Jr, MGC. 2006. Interação de Metarhizium anisopliae (Metsch.) Sorok., Beauveria bassiana (Bals.) Vuill. e o parasitóide Oomyzus sokolowskii (Kurdjumov) (Hymenoptera: Eulophidae) sobre larvas da traça-das-crucíferas, Plutella xylostella (L.) (Lepidoptera: Plutellidae). Neotropical Entomology 35(2):241-245. [ Links ]
Santos, ABS; Silva, TFB; Santos, AC; Paiva, LM; Lima, ELA. 2009a. Efeito fungitoxico do óleo de nim sobre Metarhizium anosopliae var. acridum e Metarhizium anisopliae var. anisopliae. Revista Caatinga 22:17-22. [ Links ]
Santos, AH; Tai, MHH; Rocha, LFN; Silva, HHG; Luz, C. 2009b. Dependence of Metarhizium anisopliae on high humidity for ovicidal activity on Aedes aegypti. Biological Control 50:37-42. [ Links ]
SAS Institute (Cary, Estados Unidos). 2001. SAS user's guide: statistics 8.2. Cary. 1028 p. [ Links ]
Silva, M; Golvea, A; Potrich, M; Nava, GR; Puretz, BO; Foquesato, C; Silva, ERL. 2010. Efeito de fungos entomopatogênicos comerciais sobre o parasitismo de Trichogramma pretiosum riley (Hymenoptera: Trichogrammatidae). UTFPR (em línea). Dois Vizinhos, Ed. Acesso em: 18 abr. 2010. Disponível emhttps://web.dv.utfpr.edu.br:448/seer/index.php/SSPA/.../508 [ Links ]
Sosa-Gómez, DR; Pereira, RM; Alves, SB. 1998. Impacto ambiental de entomopatógenos. In Alves, S.B (ed). Controle microbiano de insetos. Piracicaba, FEALQ. p. 1075-1095. [ Links ]
Srinivasan, TR; Samiappan, M; Gopalan, M; Mahadevan, NR. 2009. Interaction of some green muscardine fungi with laboratory cultured beneficial insects. Recent Research in Science and Technology 1:074-077. [ Links ]
Tounou, AK; Agboka, K; Poehling, HM; Raupach, K; Langewald, J; Zimmermann, G; Borgemeister, C. 2003. Evaluation of the entomopathogenic fungi Metarhizium anisopliae and Paecilomyces fumosoroseus (Deuteromycotina: Hyphomycetes) for control of the green leafhopper Empoasca decipiens (Homoptera: Cicadellidae) and potential side effects on the egg parasitoid Anagrus atomus (Hymenoptera: Mymaridae). Biocontrol Science and Technology 13:715-728. [ Links ]














