Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Investigación Agraria
versión On-line ISSN 2305-0683
Investig. Agrar. v.16 n.1 San Lorenzo jun. 2014
ARTÍCULO CIENTÍFICO
Efectos de la aplicación de bioestimulantes sobre la tolerancia del Sorghum bicolor (L.) Moench al estrés salino
Effects of the application of biostimulants on the tolerance of Sorghum bicolor (L.) Moench to salt stress
Ignacio Achón Forno1*, Pedro Luis Paniagua Alcaraz1, Nancy Villalba Romero1 y Mario Romero Gavilán1
1 Facultad de Ciencias Agrarias, Universidad Nacional de Asunción (FCA/UNA).
* Autor para correspondencia (nachoachon08@hotmail.com)
Recibido: 07/01/2014; Aceptado: 05/05/2014.
RESUMEN
Con el objetivo de determinar el efecto de la aplicación de bioestimulantes sobre la tolerancia del Sorghum bicolor (L.) Moench a distintos niveles de salinidad, se condujo una investigación en un invernadero ubicado en la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción. El diseño experimental fue completamente al azar con arreglo factorial 4 x 2, los tratamientos consistieron de cuatro niveles de conductividad eléctrica (CE) en el agua de riego (0, 2, 4 y 6 dS/m) y la aplicación o no de los bioestimulantes, en la inoculación de semillas (6% de amino ácidos libres) y vía foliar (30% de amino ácidos libres), dando ocho tratamientos de acuerdo a la combinación de ambos factores y cinco repeticiones. Las variables evaluadas fueron porcentaje de emergencia, peso fresco de la parte aérea (PFPA), tasa de crecimiento absoluto (TCA), evolución de la altura, altura final, número, ancho y largo de hoja, diámetro del tallo, color de hoja, índice de mortandad y relación K+/Na+ en hoja, tallo y raíz. Con los datos se realizó análisis de varianza, test de Tukey (p≤0,05), análisis de regresión y de correlación. El aumento de la CE tuvo efecto negativo sobre todas las variables evaluadas, siendo las diferencias estadísticamente significativas. La aplicación de los bioestimulantes produjo un incremento del 64% en el PFPA y la TCA. A los 4 y 6 dS/m se produjo 43% de mortandad. Se evidenció una reducción de la relación K+/Na+ con el aumento de la CE en todos los órganos estudiados.
Palabras clave: Sorghum bicolor (L.) Moench, bioestimulantes, salinidad.
ABSTRACT
In order to determine the effect of the application of biostimulants on Sorghum bicolor (L.) Moench tolerance to different levels of salinity, a research was conducted in a greenhouse at the Facultad de Ciencias Agrarias of the Universidad Nacional de Asunción. The experimental design was completely randomized with 4 x 2 factorial arrangement, treatments consisted of four electrical conductivity (EC) levels in irrigation water (0, 2, 4 and 6 dS/m) and the application or not of the biostimulants in seed inoculation (6% free amino acids) and on the foliage (30% free amino acids), reaching eight treatments according to the combination of both factors and five replicates. The evaluated variables were percentage of emergence, fresh weight of the aerial part (FWAP), absolute growth rate (AGR), evolution of the height, final height, number, length and width of leaf, stem diameter, leaf color, mortality index and K+/Na+ in leaf, stem and root. Data were analyzed for variance, Tukey test (p ≤ 0.05), regression and correlation analysis. The increase in EC had a negative effect on all evaluated variables, been the differences statistically significant. The application of biostimulants produced a 64% increase in FWAP and AGR. At the 4 and 6 dS/m the mortality index was 43%. A reduction of the K+/Na+ with an increase of the EC was observed in all organs studied.
Key words: Sorghum bicolor (L.) Moench, biostimulants, salinity.
INTRODUCCIÓN
La zona de transición entre el Chaco húmedo y el Chaco seco presenta como característica un nivel alto de la napa acuífera salobre, lo que se manifiesta con la presencia de lagunas, cauces y campos bajos salobres de forma natural y con el riesgo elevado de salinización de tierras agrícolas y ganaderas, por la subida capilar del agua freática salina (Glatzle 1999). Además, en el Chaco paraguayo existe una tendencia de importante aumento de las tasas de deforestación, pasando de 988 a 1.210 hectáreas por día, entre los años 2010 a 2011 (Guyra Paraguay 2011), generándose riesgos de salinización en estas superficies agropecuarias.
El sorgo es conocido por su moderada tolerancia al estrés tanto hídrico como salino, pudiendo constituirse en una valiosa alternativa de cultivo en tales condiciones. El uso del sorgo en la alimentación animal, se justifica también por sus características bromatológicas que, similares al maíz, posibilitan una fermentación adecuada y su almacenamiento consecuente en forma de ensilaje, debido a los elevados tenores de carbohidratos solubles y así también, de proteína bruta en algunas variedades. Es importante considerar también sus características agronómicas que, entre otras, incluyen una elevada productividad de biomasa, siendo una opción sumamente válida para suplir la deficiencia de forraje en los periodos invernales secos (Bosco de Oliveira y Gomes-Filho 2009).
La salinidad afecta negativamente la germinación, el stand de plantas, el desarrollo vegetativo del cultivo, la productividad y, en los casos más graves causa la muerte de las plántulas (Reyes et al. 2012). Estos efectos se presentan debido al estrés osmótico y a la toxicidad iónica. El estrés osmótico es el resultado de la presencia de sales en la solución del suelo, provocando altos valores de presión osmótica, que reducen la capacidad de las plantas de absorber agua, mientras que la toxicidad iónica ocurre por el ingreso de una excesiva cantidad de sal al flujo de transpiración, que posteriormente dañan las células de las hojas, comprometiendo la tasa fotosintética (Morales et al. 2012).
El grado de tolerancia de las distintas especies depende, por tanto, de la eficiencia de mecanismos morfológicos y fisiológicos que aumentan la capacidad de las plantas para enfrentar el aumento de la concentración de sales en el suelo (Silva et al. 2007). Destacándose, en lo que respecta al ajuste osmótico en el medio radicular, la mantención de la relación K+/Na+ en el citosol de las células foliares, a través de la retención de Na+ en las raíces y tallos, limitando la salinidad de la savia xilemática, o acumulando Na+ en la vacuola en contra del gradiente de manera activa (Leidi y Pardo 2006), y por otro lado, la síntesis de citosolutos, aumenta de forma considerable el contenido de aminoácidos libres o azucares simples, para contribuir a regular el potencial osmótico citoplasmático (Franco 2004).
En base a esto, la aplicación de bioestimulantes con un elevado porcentaje de aminoácidos libres y fácilmente translocables, potencian los mecanismos naturales de la planta para tolerar la salinidad, contribuyendo con el ajuste osmótico permitiendo a la planta superar el déficit hídrico presente en condiciones de estrés salino.
El presente trabajo fue realizado con el objetivo de evaluar los efectos de la aplicación de bioestimulantes sobre la tolerancia del Sorghum bicolor (L.) Moench en condiciones de estrés salino.
MATERIALES Y MÉTODOS
El experimento fue realizado en un invernadero del Departamento de Protección Vegetal, ubicado en el Campo Experimental de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción, durante el periodo comprendido entre el 10 de octubre y el 19 de noviembre de 2013. El diseño experimental fue completamente al azar con arreglo factorial 4 x 2, donde los tratamientos fueron constituidos por dos factores; la utilización de soluciones de NaCl en cuatro niveles de conductividad eléctrica (CE) para el riego de las macetas: 0, 2, 4 y 6 dS/m, y la aplicación o no de bioestimulantes, totalizando ocho tratamientos con cinco repeticiones cada uno. Cada unidad experimental estuvo constituida por 5 macetas, alcanzando 200 macetas de 30 cm de diámetro y 60 cm de altura.
Para el experimento se utilizaron semillas de Sorghum bicolor híbrido Buster. El sustrato utilizado, suelo clasificado como Luvisol, fue extraído de los primeros 20 cm de profundidad en la Estación Experimental del Instituto Paraguayo de Tecnología Agraria (IPTA) ubicada en Cruce Pionero, Departamento de Presidente Hayes. El sustrato presentaba una clase textural arenosa, pH 6 y CE de 0,2 dS/m.
Previo a la siembra las macetas fueron regadas hasta llegar a capacidad de campo y se mantuvieron en esa condición durante toda la experimentación mediante riegos diarios.
El volumen diario de riego fue de 200 ml y cada tres días se realizó un riego de lavado, solo con agua, para evitar el acúmulo de sales en el perfil radicular.
La siembra se realizó a 1,5 cm de profundidad, fueron sembradas 10 semillas por maceta en dos hileras separadas a 5 cm y 2 cm entre semillas. En los tratamientos que recibieron las aplicaciones de los bioestimulantes las semillas fueron inoculadas con un bioestimulante con una concentración de aminoácidos libres del 6%y posteriormente recibieron aplicaciones foliares de bioestimulante con una concentración de aminoácidos libres del 30%, a los 15 y 30 días después de la siembra (DDS).
A los 7, 14 y 21 DDS, se evaluó el porcentaje de emergencia, que fue determinado mediante el conteo de plantas emergidas (coleóptilo visible) con relación al número de semillas sembradas. A los 40 DDS se evaluaron: número, ancho y largo de hoja, altura final, diámetro de tallo, peso fresco de la parte aérea (PFPA), tasa de crecimiento absoluto (TCA), tasa de crecimiento en altura (TCA; medida de altura a los 15 y 30 DDS) índice de mortandad, color de hoja a través de la “Munsell Color Chart for Plant Tissues” (Munsell Color 1977) y relación K+/Na+ mediante la extracción de los iones por medio ácido y determinación del contenido de K+ y Na+ por espectrofotometría de absorción atómica.
Los datos se analizaron mediante el análisis de varianza (ANAVA) y las medias fueron comparadas mediante el test de Tukey al 5 % de probabilidad de error. También se realizaron análisis de regresión y correlación.
RESULTADOS Y DISCUSIÓN
No se observó interacción entre la aplicación de bioestimulante y los niveles de CE, en las variables estudiadas. A los 7 DDS, los tratamientos de 2 y 4 dS/m presentaron un mayor porcentaje de emergencia (Tabla 1). Asimismo, Capote y Socorro (2007) plantean que durante la germinación la entrada de iones de sodio y cloruro hacia el interior de la semilla, crea un gradiente osmótico favorable para que el proceso de imbibición sea más rápido y por tanto se obtenga un mayor porcentaje de germinación y desarrollo de las plántulas, al favorecer los procesos metabólicos intracelulares, los niveles mayores, como de 6 dS/m, produjeron una inhibición de la emergencia. Transcurridos 14 y 21 días, los tratamientos de 0 dS/m mostraron los mayores porcentajes de emergencia, llegando a ser superiores en 26, 44 y 70% a los 2, 4 y 6 dS/m, respectivamente.
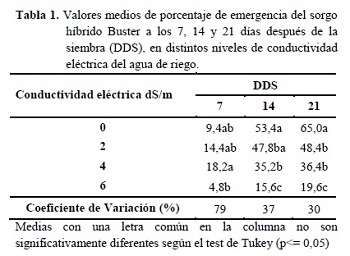
Oliveira et al. (2009) observaron en un test de germinación un efecto lineal inversamente proporcional a la salinidad, siendo este comportamiento similar a los resultados de esta experimentación. De acuerdo con Braccini et al. (1996), la disminución acentuada de la germinación de las semillas a mayores concentraciones de NaCl se debe a la menor cantidad de agua absorbida por las semillas en función a la reducción del potencial osmótico de la solución del suelo.
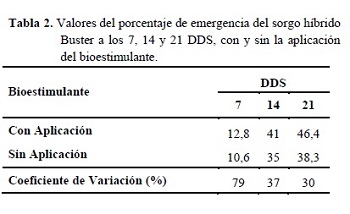
No se observaron diferencias estadísticas significativas en el porcentaje de emergencia por efecto de la aplicación de bioestimulantes (Tabla 2). Sin embargo, en todas las evaluaciones las semillas tratadas, presentaron valores numéricos mayores de emergencia. Esto podría ser atribuido a la estimulación en la germinación y emergencia que se genera cuando en condiciones de estrés se provee a las plantas la cantidad adecuada de aminoácidos (Franco 1998).
Se observaron diferencias estadísticas significativas, en CE, TCA, PFPA y altura final, siendo notorio el efecto negativo del NaCl, lo que coincide con lo expresado por Carpici et al. (2009), quienes reportaron una relación negativa entre los parámetros de crecimiento y el incremento de la salinidad.
A los 40 DDS el PFPA se redujo 77 y 96% con 4 y 6 dS/m, respectivamente. De Lacerda et al. (2001) determinaron una reducción del 30 al 40% del peso de la parte aérea de plántulas de sorgo sometidas a riegos crecientes de 2,5 a 10 dS/m de NaCl en un periodo de ocho días.
Una de las explicaciones más aceptadas para la inhibición del crecimiento por la sal es el desvío de energía del crecimiento para la manutención, asociada a la adaptación a la salinidad (Tal 1985).
En lo que respecta a la TCA, Azevedo y Tabosa (2000) en una experimentación con plántulas de maíz, sometidas a riegos con NaCl luego de la emergencia, mencionan TCA de 0,66; 0,6; 0,52 y 0,48 g/día, para niveles de 0; 2,5; 5 y 7,5 dS/m respectivamente, valores similares a los registrados en esta experimentación (Figura 1B). Se tiene demostrado que la TCA es un parámetro fuertemente influenciado por las concentraciones de iones de Na+ en el tejido vegetal. Azevedo Neto et al. (1996) verificaron correlaciones negativas altamente significativas entre la TCA de las plántulas de maíz y los tenores de Na+ (r= -0,92) en las plantas, en esta experimentación se observó una correlación alta y negativa entre estas variables (r= -0,81).
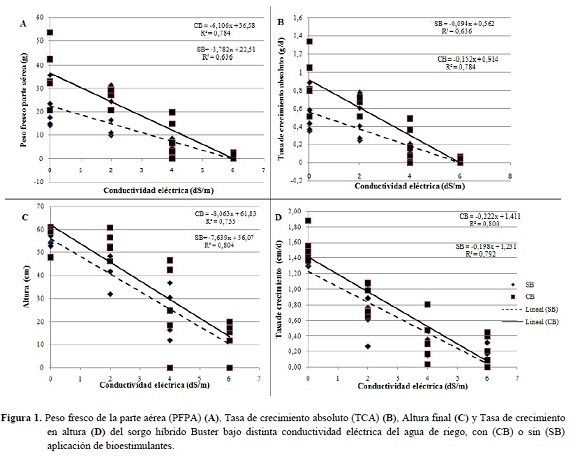
El análisis de regresión (Figura 1B) muestra una disminución de la TCA del 21 y 14% por cada aumento unitario de la CE, con o sin la aplicación de bioestimulantes, respectivamente. Blanco et al. (2007) encontraron una reducción de la TCA del 22% en plántulas de maíz por el incremento unitario de la CE por encima de 1,5 dS/m.
La altura final se vio fuertemente afectada por el aumento de la CE, registrándose una disminución del 56 y 79% a los 4 y 6 dS/m. Sin embargo, García y Medina (2008) en dos genotipos de caña de azúcar regados con una solución de 10 dS/m de NaCl a partir de un mes después del trasplante y por un periodo de 60 días, encontraron reducciones del 53 y 47% con relación al testigo (sin adición de NaCl).
El análisis de regresión (Figura 1C) muestra una disminución de 8 cm (14%) por el aumento de 1 dS/m, de la CE de la solución del suelo, para los tratamientos con bioestimulantes, y una reducción de 7 cm (13%) en la altura final, para los tratamientos sin bioestimulantes. Blanco et al. (2007) determinaron una reducción del 13% en plántulas de maíz por el incremento unitario de la CE del sustrato, en niveles superiores a 1,9 dS/m.
La tasa de crecimiento de altura (Figura 1D) también sufre los efectos de la acumulación de NaCl en el suelo, ya que esta genera una deficiencia nutricional, toxicidad iónica y estrés osmótico (Nublat et al. 2001).
En todas las variables de crecimiento, los tratamientos que recibieron bioestimulantes (CB) presentaron valores superiores, inclusive existiendo diferencias estadísticas significativas para las variables TCA y PFPA, con un incremento del 64% en ambas variables, esto se debería a que los bioestimulantes pueden potenciar los mecanismos naturales que posee la planta para resistir la salinidad, dotándola de aminoácidos fácilmente translocables; además, puede incrementar la velocidad de respuesta de la planta frente a estas condiciones ya que no ha de invertir tiempo en sintetizar estos aminoácidos imprescindibles en estas circunstancias (Franco 1998).
Las características morfológicas del sorgo estudiadas (número, ancho y largo de hojas, y diámetro del tallo a los 40 DDS) presentaron diferencias estadísticas significativas atribuidas al efecto de los riegos con niveles crecientes de NaCl.
El número de hojas sufrió reducciones del 2, 28 y 46% a 2, 4 y 6 dS/m, respectivamente. Esta variable ha sido señalada como muy importante en la tolerancia a las sales en este cultivo, ya que su reducción refleja una menor capacidad para mantener en funcionamiento los tejidos fotosintéticamente activos, bajo esta condición (Wahid et al. 1997).
Las reducciones observadas pueden ser explicadas por lo expuesto por Cavalcanti et al. (2005), quienes comentaron que, en condiciones de seca fisiológica, es común que ocurran alteraciones morfológicas y anatómicas en las plantas, reflejándose en la disminución de la transpiración (menor área transpiratoria) como alternativa para mantener la absorción de agua, siendo una de esas adaptaciones la reducción en el número de hojas.
Tanto el ancho como el largo de hoja sufrieron reducciones (Figuras 2B y 2C), lo que indica que a medida que aumentan los niveles de CE, disminuye el valor de área foliar. Totawat y Mehta (1985) trabajando con genotipos de maíz y sorgo verificaron que el área foliar de ambas especies fue influenciada negativamente por el estrés salino. Con una CE de 12 dS/m, las plantas de maíz y sorgo tuvieron su área foliar reducida en 46 y 60%, respectivamente.
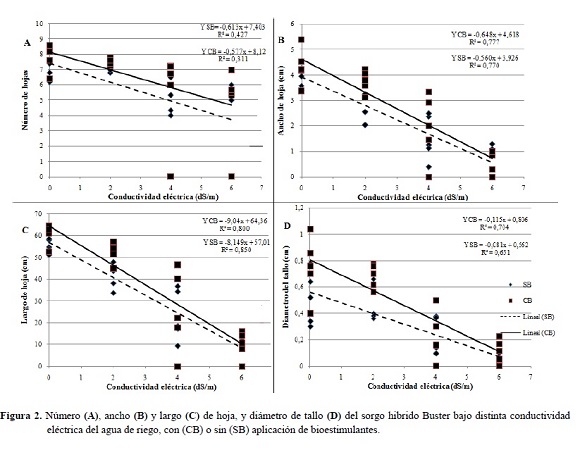
El diámetro del tallo de las plántulas sometidas a niveles crecientes de NaCl también sufrió una reducción (Figura 2D), llegando a ser 83% menor a los 6 dS/m. Al respecto, en una investigación en plantas de tomate, sometidas a una CE de 4 dS/m por 40 días, se registró una reducción significativa en el diámetro del tallo, debido a que las plantas expuestas a estrés salino muestran constricciones del tallo y menores tasas de crecimiento de éste en comparación con las plantas control (Goldhamer y Fereres 2001).
La acumulación excesiva de Na+ en el tallo, mecanismo de tolerancia presente en el sorgo, puede influenciar su crecimiento, afectando directamente las regiones de los meristemas intercalares, como fue sugerido por Bernstein et al. (1993). Esto refuerza la idea de que diferencias en el crecimiento de tallo y limbo foliar se deben principalmente a los mecanismos de protección que las plantas utilizan para sus diferentes órganos; la retención diferencial de iones favorece el crecimiento foliar en detrimento del tallo.
Este mecanismo de tolerancia a la salinidad se refleja en esta experimentación, ya que con 4 dS/m el diámetro de tallo tuvo la mayor reducción, de 67%, en comparación con el largo (58%) y ancho de hoja (57%) (Figuras 2D, 2C y 2B).
Se encontraron coeficientes de correlación altos entre las variables; ancho de hoja y PFPA (r = 0,93), largo de hoja y PFPA (r = 0,89), numero de hojas y altura (r = 0,82), los cuales indican la alta correlación que existe entre el área foliar y el crecimiento de la planta.
La reducción del número, ancho y largo de hoja viene acompañada de la disminución de la densidad y la conductancia de los estomas, la transpiración y la asimilación de CO2. Esta disminución del área foliar se genera por causa de la senectud y la muerte temprana de las hojas, una tasa de crecimiento reducida, menor ancho y largo, y la aparición retrasada de hojas (Romero-Aranda et al. 2001).
De igual manera, en plantas de Psidium guajava expuestas a estrés salino se encontró una reducción en el peso total de la planta, que fue asociada al incremento en la resistencia de los estomas y a la reducción en la eficiencia fotoquímica de las plantas, produciendo, en consecuencia, una disminución en la tasa fotosintética (Ebert et al. 2002).
No hubo diferencias estadísticas significativas en las variables número, ancho y largo de hoja, y diámetro del tallo, al considerar la aplicación de bioestimulantes.
En la Figura 3 se muestra que el aumento de la CE produjo una disminución del número de hojas de color verde normal y se incrementaron las hojas que presentaban clorosis o necrosis, estas últimas principalmente en la parte basal.
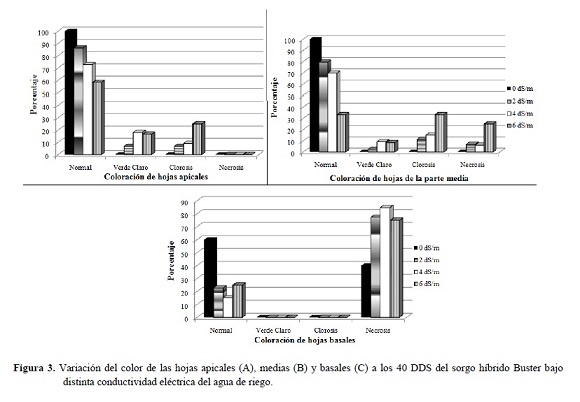
Se observaron los síntomas característicos del efecto de las sales en el tejido foliar de las plantas sometidas a estrés salino que consistieron en clorosis moderada o necrosis de los bordes de las hojas (se inició en el extremo distal de los foliolos y luego avanzó hasta el extremo proximal, presentándose una franja clorótica intermedia entre el área necrótica y sana). Mientras, que en las plantas testigo, las hojas conservaron su color verde normal, como fuera observado por Morales et al. (2012) y Casierra-Posada y García (2005).
En las concentraciones 2, 4 y 6 dS/m, la necrosis fue más aguda en las hojas adultas (parte basal) que en las jóvenes (parte apical), lo cual indica que el sorgo acumula los iones tóxicos (Na+ y Cl-) en las hojas más viejas como respuesta a la toxicidad por NaCl (Munns 2002).
Las plantas expuestas al estrés salino presentaron una anomalía denominada “Síndrome de desarrollo perturbado de la hoja” asociado con una deficiencia del calcio, lo que demuestra que en estas condiciones la concentración de Ca2+ en las láminas foliares se reduce (Netondo et al. 2004).
Entre los 8 y 15 DDS, algunas plántulas sometidas a 4 y 6 dS/m, presentaron hojas enrrolladas, con la puntas secas y necrosis, síntomas similares a los citados por Gong et al. (2006) en plantas de arroz.
Entre las variables indicadoras de tolerancia a la salinidad, se encuentra el índice de mortandad, el cual llegó a superar los 40% a los 4 y 6 dS/m (Figura 4). Esto se puede deber a un comportamiento del sorgo similar a lo que reportan Capote y Socorro (2007) en maíz, en el que es más tolerante a la salinidad durante la germinación pero sensible en otras etapas del desarrollo, más en la fase de plántula que en la maduración o llenado del grano. También se le atribuye estos valores de mortandad al efecto tóxico de los iones Na+ y Cl-, los cuales van aumentando su concentración en tejidos fotosintéticos (foliares) o de crecimiento (Munns 2002).
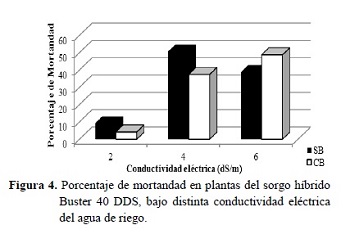
La variable índice de mortandad presentó diferencias estadísticas significativas entre los tratamientos de 4 y 6 dS/m con los de CE 0 dS/m, sin embargo, no existieron diferencias estadísticas significativas con los tratamientos de 2 dS/m, donde la mortandad fue solo del 6% (Figura 4).
Otra variable estudiada para determinar la tolerancia a la salinidad es la relación K+/Na+ en hojas, tallos y raíces, en este trabajo se encontraron diferencias estadísticas significativas para la relación K+/Na+ en todos los órganos (Tabla 3). Esto demuestra como a medida que aumentan las concentraciones de NaCl se provoca una reducción en la relación K+/Na+ en los órganos estudiados, debido a una menor absorción de K+ en situaciones de estrés salino (Romero 2012).
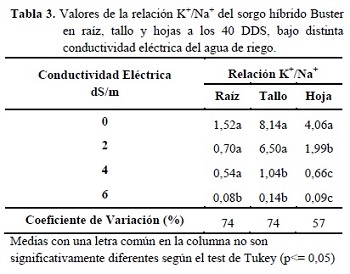
La mayor acumulación de Na+ se presentó en las raíces, las cuales mostraron en todas las CE la menor relación de K+/Na+. El mismo comportamiento fue observado en plántulas de sorgo sometidas a 10 dS/m, en riegos crecientes de 2,5 dS/m, durante 15 días, lo cual se vincula con una mayor retención de iones en las raíces, una importante retraslocación de estos a las raíces vía floema y la exclusión de iones, particularmente de Na+, a la solución externa. Por su parte, la contribución del K+, Ca2+ y Mg2+ en el potencial osmótico de las raíces disminuye con el incremento de la CE en la solución del suelo (De Lacerda et al. 2001).
En el tallo se presentaron las mayores relaciones K+/Na+ para todas las concentraciones de NaCl. La salinidad influencia significativamente las razones entre los tenores de Na+, K+ y Cl- en los tallos y vainas (Silva et al. 2007).
El hecho que en esta investigación los valores de K+ en los tallos fueron mayores que en otros trabajos citados, se debería a que al realizar el análisis de hojas fueron incluidas las láminas y las vainas. Sin embargo en los demás trabajos los análisis fueron realizados solo de las láminas foliares. El sorgo presenta una gran capacidad de retención de Na+ en los tallos, con las vainas ejerciendo un papel importante en ese mecanismo. Esta retención es de suma importancia, ya que demuestra que el sorgo exporta poco Na+ de los tallos para los limbos foliares, evitando así el exceso de iones tóxicos en los tejidos fotosintéticos (Silva et al. 2007).
La importante reducción de la relación K+/Na+ en las hojas se puede considerar como una característica que determina la sensibilidad de este híbrido al estrés salino, contrario a lo expresado por Bosco de Oliveira y Gomes-Filho (2009). Esto indica una menor capacidad de acumular K+ en las hojas y por otro lado, varios autores mencionan una correlación entre la tolerancia a la salinidad y la manutención de una adecuada nutrición potásica (Taleisnik y Grunberg 1994).
Se presentó una correlación positiva y alta entre la relación K+/Na+ y la PFPA y TCA (r = 0,79 y 0,74, respectivamente). Estos resultados se apoyan en el hecho que el K+ está asociado al transporte de productos de la fotosíntesis y la producción de almidón. Su presencia es fundamental en el desarrollo de las raíces y en el contenido de materia seca total, siendo considerado un nutriente requerido en grandes cantidades por las plantas (Dechen et al. 1999).
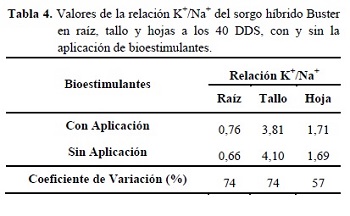
No se presentaron diferencias estadísticas significativas en la relación K+/Na+ con la aplicación de bioestimulantes (Tabla 4).
CONCLUSIONES
No existió interacción entre la conductividad eléctrica y la aplicación de bioestimulantes.
El riego con niveles crecientes de conductividad eléctrica generó importantes reducciones en las variables estudiadas.
La aplicación de bioestimulantes produjo un incremento del 64% en cuanto al peso fresco de la parte aérea y tasa absoluta de crecimiento.
El índice de mortandad del 43% a los 4 y 6 dS/m indica la sensibilidad del sorgo híbrido Buster al estrés salino en la fase de plántula.
La relación K+/Na+ disminuyó en todos los órganos estudiados, a medida que aumentaba la conductividad eléctrica.
REFERENCIAS BIBLIOGRÁFICAS
Azevedo Neto, AD; Bezerra Neto, E; Barreto, LP; Tabosa, JN. 1996. Resposta de cultivares de milho ao estresse salino: II correlação entre os teores teciduais de Cl-, Na+ e K+ com o crescimento. Pesquisa Agropecuária Brasileira 14(1):71-100. [ Links ]
Azevedo, AD; Tabosa, JN. 2000. Estresse salino em plântulas de milho: Parte II distribuição dos macronutrientes catiônicos e suas relações com sódio. Rev Bras Eng Agric Amb 4:165-171. [ Links ]
Bernstein, N; Silk, W; Lauchli, A. 1993. Growth and development of sorghum leaves under conditions of NaCl stress. Spatial and temporal aspects of leaf growth inhibition. Planta 191:443-439. [ Links ]
Blanco, F; Folegatti, M; Gheyi, H; Fernandes, P. 2007.Emergence and growth of corn and soybean under saline stress. Scientia Agricola 64(5):451-459. [ Links ]
Bosco de Oliveira, A; Gomes-Filho, E. 2009. Germinação e vigor de sementes de Sorgo forrajero sometidas a estreses hídrico y salino. Revista Brasileira de Sementes 31(3):48-56. [ Links ]
Braccini, AL; Ruiz, HA; Braccini, MCL; Reis, MS. 1996. Germinação e vigor de sementes de soja sob estresse hídrico induzido por soluções de cloreto de sódio, manitol e polietileno glicol. Revista Brasileira de Sementes 18(1):10-16. [ Links ]
Capote, A; Socorro, A. 2007. Selección in vitro para tolerancia a la salinidad de embriones de maíz cv. ´P 315´ y caracterización de las vitroplantas obtenidas. Boletín del Instituto de Investigaciones Fundamentales en Agricultura Tropical 2 (3):25-47. [ Links ]
Carpici, E; Celik, N; Bayram, G. 2009. Effects of salt stress on germination of some maize (Zea mays L.) cultivars. African Journal of Biotechnology 8(19): 4918-4922. [ Links ]
Casierra-Posada, F; García, N. 2005. Crecimiento y distribución de materia seca en cultivares de fresa (Fragaria sp.) bajo estrés salino. Agronomía Colombiana 23(1):83-89. [ Links ]
Cavalcanti, M; Fernandes, P; Hans, R; Barros, G; Soares, F; Siquiera, E. 2005. Tolerância da mamoneira BRS 149 à salinidade: germinação e características de crescimento. Revista Brasileira de Engenharia Agrícola e Ambiental 9:57-61. [ Links ]
Dechen, AR; Furlani, AMC; Furlani, PR. 1999. Tolerância e adaptação de plantas aos estresses nutricionais. Viçosa, BR. 25 p. [ Links ]
De Lacerda, C; Cambraia, J; Oliva, M; Ruiz, H. 2001. Plant growth and solute accumulation and distribution in two sorghum genotypes, under NaCl stress. Revista Brasileira de Fisiologia Vegetal 13(3):270-284. [ Links ]
Ebert, G; Eberle, H; Ali-Dinar,H; Ludders, P. 2002. Ameliorating effects of Ca(No3)2 on growht, mineral uptake and photosynthesis of NaCl-stressed guava seedlings (Psidium guajava L.). Scientia Hort. 93(2):125-135. [ Links ]
Franco, J. 1998. Efectos de la aplicación de hidrolizados de proteínas (aminoácidos) en cultivos hortícolas bajo condiciones salinas. Agrícola Vergel 197:268-273. [ Links ]
Franco, J. 2004. Aminoácidos (en línea). Cartagena, CO. Consultado 4 jun. 2012. Disponible en: http://www.blueberrieschile.cl/paper/paper52.pdf [ Links ]
García, M; Medina, E. 2008. Crecimiento y acumulación de prolina en dos genotipos de caña de azúcar sometidos a salinización con cloruro de sodio. Revista de la Facultad de Agronomía. 20(2):168-179. [ Links ]
Glatze, A. 1999. Compendio para el manejo de pasturas en el Chaco. Asunción, PY, El Lector. 188 p. [ Links ]
Goldhamer, D; Fereres, E. 2001. Irrigation scheduling protocols using continuously recorded trunk diameter measurements. Irrigation Science 20:115-125. [ Links ]
Gong, H; Randall, D; Flowers, T. 2006. Silicon deposition in the root reduces sodium uptake in rice (Oryza sativa L.) seedlings by reducing bypass flow. Plant, Cell and Environment 29(10): 1970-1979. [ Links ]
Guyra Paraguay, PY. 2011. Monitoreo Ambiental del Chaco Sudamericano, Informe técnico: Resultados del monitoreo de los cambios de uso de la tierra, incendios e inundación (en línea). Asunción, Py. Consultado 14 nov. 2013. Disponible en: http://www.guyra.org.py/index.php/informe-de-deforestacion [ Links ]
Leidi, E; Pardo, J. 2006. Tolerancia de los cultivos al estrés salino: que hay de nuevo (en línea). Sevilla, ES. Consultado 21 jul. 2012. Disponible en: http://www.fcagr.unr.edu.ar/Investigacion/revista/rev2/5.htm [ Links ]
Morales, S; Trejo-Téllez, L; Gómez, C; Caldana, C; Espinosa, D; Herrera, E. 2012. Growth, photosynthetic activity, and potassium and sodium concentration in rice plants under salt stress. Acta Scientiarum Agronomy 34(3):317-324. [ Links ]
Munns, R. 2002. Comparative physiology of salt and water stress. Plant, Cell and Environment 25:239-250. [ Links ]
Munsell Color. 1977. Munsell color charts for plant tissues. 2 ed. Baltimore, US, Macbeth Division of Kollmorgen Instruments Corporation. 78 p. [ Links ]
Netondo, G; Onyango, J; Beck, E. 2004. Sorghum and salinity: I. Response of growth, water relations and ion accumulation to NaCl salinity. Crop Science 44:797-805. [ Links ]
Nublat, A; Desplans, J; Casse, F; Berthomieu, P. 2001. Sas1, an Arabidopsis mutant overaccumulating sodium in the shoot, shows deficiency in the control of the root radial transport of sodium. Plant Cell 13:125-137. [ Links ]
Oliveira, A; Gomes-Filho, E; Parida, A. 2009. Germination and vigor of sorghum seeds under water and salt stress. Revista Brasileira de Sementes 31:48-56. [ Links ]
Reyes, Y; Martinez, L; Rosabal, L. 2012. Efecto de la 24- Epibrasinólida en el crecimiento, los niveles de prolina y de malondialdehido de plántulas de arroz (Oryza sativa L.) sometidas a estrés salino. Cultivos Tropicales 3(1):19-27. [ Links ]
Romero-Aranda, R; Soria, T; Cuartero, J. 2001. Tomato plant-water uptake and plant-water relationships under saline growht conditions. Plant Science 160(2):265-272. [ Links ]
Romero, M. 2012. Diferencias intraespecíficas en la exclusión de Na+ en el girasol (Helianthus annuus L.): Efecto sobre la tolerancia a la salinidad. Tesis Mag. Sc. Córdoba, ES, UCO. 18 p. [ Links ]
Silva, A; De Lacerda, C; Alves, M; Gomes-Filho, E; Nonato, R. 2007. Crescimento, partição de matéria seca e retenção de Na+, K+ y Cl- em dos genótipos de sorgo irrigados com águas salinas. Rev Bras Ci Solo 31:961-971. [ Links ]
Tal, M. 1985. Genetics of salt tolerance in higher plants: theoretical an practical considerations. Plant and Soil, Dordrecht 89:199-226. [ Links ]
Taleisnik, E; Grunberg, K. 1994. Ion balancein tomato cultivars differing in salt tolerance. I. Sodium and potassium accumulation and fluxes under moderate salinity. Physiologia Plantarum 92:528-534. [ Links ]
Totawat, K; Mehta, A. 1985. Salt tolerance of maize and sorghum genotypes. Annals of Arid Zone 24:229-236. [ Links ]
Wahid, A; Rao, A; Rasul, E. 1997. Identification of salt tolerance traits in sugarcane lines. Field Crop Res 54:9-17. [ Links ]














