Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.15 no.2 San Lorenzo Dec. 2013
NOTA DE INVESTIGACIÓN
Efecto de pretratamientos en la prueba de viabilidad de semillas de Trichocentrum jonesianum (Orchidaceae)
Pre-treatment effects on the viability test in Trichocentrum jonesianum (Orchidaceae) seeds
Víctor Hugo Lallana1* y Luz Fabiola García1
1. Docentes investigadores, Cátedra de Fisiología Vegetal y Proyecto PID-UNER 2144. Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos. Oro Verde, Ruta 11, Km 10,5. Entre Ríos, Argentina.
*Autor para correspondencia (victorl@fca.uner.edu.ar).
Recibido: 05/11/2013; Aceptado: 22/11/2013.
RESUMEN
La determinación periódica de la viabilidad de las semillas permite conocer el grado de conservación de las muestras. En algunas especies de orquídeas se ha reportado un aumento en la precisión de la prueba de viabilidad por tetrazolio cuando se realizan pretratamientos con soluciones de sacarosa durante la imbibición de las semillas. El objetivo fue evaluar la viabilidad de semillas de Trichocentrum jonesianum mediante la prueba de tetrazolio con y sin pretratamiento con agua y sacarosa. Se empleó una solución al 0,1% de 2,3,5-Trifenil Tetrazolio Cloruro (TTC), manteniendo las semillas a 33ºC en oscuridad por 24 h o 48 h según los tratamientos: T1) Semillas inmersas en TTC por 24 h, T2) Semillas inmersas en TTC por 48 h, T3) Pretratamiento con hipoclorito de sodio al 0,1% más Tween 20 (detergente) al 0,1% durante 7 min con agitación y 8 min de reposo. Las semillas se enjuagaron tres veces con agua destilada y luego inmersas en TTC por 24 h, T4) 24 h de imbibición en sacarosa al 10% y luego extraída la solución y reemplazada por 2 mL de TTC por 24 h y T5) 24 h de imbibición en agua destilada, luego extraída el agua y reemplazada por 2 mL de TTC por 24 h. Cada tratamiento contó con 3 repeticiones, registrando como semillas viables las que presentaban coloración del rosado al rojo oscuro; no viable las semillas sin tinción con embrión visible y semillas vanas sin embrión. Los valores de viabilidad más altos se obtuvieron con el T5 (90%), sin diferencias significativas con T4 (85%). El T3 presentó el menor valor de viabilidad (68%), mientras que T1 (78%) y T2 (77%) mostraron diferencias significativas con T4 y T5. Las semillas vanas variaron entre 76 y 86%. Se concluye que el T4 (agregado de sacarosa) no mejora el grado de precisión de la prueba de viabilidad convencional.
Palabras clave: Orquídeas, pretratamientos, viabilidad.
ABSTRACT
Periodic determination of seed viability is an important evaluating information to know the conservation degree of samples. In some orchid species, an increase in precision of tetrazolium viability test has been reported when performing pre-treatments with sacarose solutions during seed imbibition. The objective was to evaluate the viability of Trichocentrum jonesianum seeds using the tetrazolium test with and without water and sacarose pre-treatment. It was used a solution of 1% 2,3,5-triphenyltetrazolium chloride (TTC), keeping seeds at 33 ºC in darkness for 24 h or 48 h: T1) Seeds immersed in TTC solution for 24 h, T2) Similar to T1–48 h, according to treatments: T3) Pre-treatment with 0.1% sodium hypochlorite plus 0.1% tween 20 (detergent) during 7 min with agitation and 8 min resting. Seeds were rinsed three times with distilled water and then immersed in TTC for 24 h, T4) 24 h of imbibition in 10% sacarose, being extracted and replaced by 2 mL TTC for 24 h and T5) 24 h of imbibition in distilled water, being then extracted and replaced by 2 mL TTC for 24 h. Each treatment was repeated three times recording as viable seeds those with pink to dark red color; as non-viable those colorless with visible embryo and embryoless seeds. The highest viability were obtained with T5 (90%) showing no significant differences with T4 (85%). T3 presented the lowest viability (68%), while T1 (78%) and T2 (77%) showed significant differences with T4 and T5. Embryoless seeds ranged between 76% and 86% depending on the treatments. T4 (sacarose added) did not improve the conventional viability test performance.
Key words: Orchids, pretreatments, viability.
INTRODUCCIÓN
Trichocentrum jonesianum (Rchb.f.) M.W.Chase & N.H.Williams, es una orquídea epifita, con hojas alargadas y lineales, que nacen de pequeños pseudobulbos. Las hojas crecen en forma pendiente, y tienen forma de sección circular o elíptica (hojas terete), de 20 cm hasta 50 cm de largo. Las flores nacen de la base del pseudobulbo, dispuestas en una inflorescencia basal que puede contener de 6 a 12 flores, de 3 a 5 cm de diámetro, con pétalos y sépalos blancos con máculas pardas rojizas y labelo predominantemente blanco. Esta especie es nativa de Misiones y considerada en peligro de extinción, habita además en las provincias de Chaco y Corrientes (Insaurralde y Rodins 2007).
La determinación periódica de la viabilidad de las semillas es importante para conocer el grado de conservación de las muestras, y más aún teniendo en cuenta el pequeño tamaño de las semillas y el desarrollo de un embrión inmaduro sin endosperma característico de las orquídeas (Arditti y Ernst 1993). Experiencias previas (Lallana y García 2010, 2012a y b) han reportado el acondicionamiento de procedimientos de la prueba topografica de tetrazolio para semillas de orquídeas empleando distintas dosis y tiempos de exposición a la sal 2,3,5 cloruro de trifenil tetrazolium (TTC). En general, para el ensayo con semillas de orquídeas, se realiza un acondicionamiento previo de las mismas por un periodo de imbibición en agua durante 24 h y luego, se retira el agua y se coloca en la solución de TTC al 1% o menos (0,5%), durante 24 h a 30-33ºC en oscuridad (Singh 1981, Lallana y Garcia 2012a, Preti et al. 2013).
La prueba de viabilidad por coloración con tetrazolio es utilizada para evaluar la viabilidad de las semillas en función de la coloración del embrión, siendo considerados viables los embriones de color naranja a rojo (Pritchard y Prendergast 1990). Recientemente, fue demostrado en semillas de varias especies del genero Cattleya que la utilización de un pretratamiento con solución de sacarosa 10% aumenta la precisión de la prueba de viabilidad cuando se compara la tasa de germinación in vitro (Hosomi et al. 2012). De igual forma Márquez Palmeira et al. 2013, trabajando en Cyrtopodium fowliei hallaron un 10% más de viabilidad con el pretratamiento de semillas con sacarosa.
Algunas especies de orquídeas poseen semillas con latencia (Rasmussen 1995), y requieren condiciones ambientales y de nutrientes específicos para germinar (Arditti et al. 1982). Cuando hay latencia la coloración química de semillas de orquídeas, mediante la prueba de tetrazolio, para determinar el porcentaje de semillas con embriones viables es una herramienta muy útil para monitorear la conservación de orquídeas y la posibilidad de su propagación in vitro (Pritchard y Prendergast 1990).
El objetivo de este estudio fue evaluar la viabilidad de semillas de T. jonesianum mediante la prueba topográfica de tetrazolio (TTC) con y sin pretratamiento de las mismas con agua o sacarosa.
MATERIALES Y MÉTODOS
Se colectaron semillas originadas de una cápsula madura formada por autofecundación manual (alogamia) de una planta de Trichocentrum jonesianum perteneciente a la colección de referencia de Orquídeas, de la Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos. Las semillas colectadas fueron homogeneizadas y luego separadas en 5 fracciones o lotes para constituir los distintos tratamientos. El diseño experimental utilizado fue completamente aleatorizado con 5 tratamientos y 3 repeticiones.
Para la prueba de viabilidad de las semillas se utilizaron cantidades de 0,02 a 0,03 g por muestra, las que fueron sometidas a los siguientes tratamientos:
T1) Sin pretratamiento. Semillas inmersas en frasco de vidrio (de 2 cm de diámetro x 3,5 cm de alto) con tapón de goma, de 7 mL de capacidad conteniendo 3 mL de solución de TTC 0,1% y mantenidas a 33°C en baño termostático por 24 horas en oscuridad.
T2) Sin pretratamiento. Semillas inmersas en solución de TTC 0,1% y mantenidas a 33°C por 48 horas en oscuridad.
T3) Pretratamiento con solución de hipoclorito de sodio al 0,1% más Tween 20 al 0,1%, como solución detergente, durante 7 min con agitación y 8 min de reposo. Seguidamente las semillas se enjuagaron 3 veces con agua destilada esterilizada, pasando entre enjuagues 3 minutos y se emplearon jeringas de 1 mL con aguja para extraer la solución y posteriormente fueron inmersas en solución de TTC 0,1% y mantenidas a 33 °C en baño termostático por 24 horas en oscuridad.
T4) Pretratamiento de las semillas 24 horas inmersas en solución de sacarosa al 10% y luego extraída la solución con jeringa y reemplazada por 2 mL de TTC 0,1% y mantenidas a 33 °C por 24 horas en oscuridad.
T5) Pretratamiento de inmersión 24 horas en agua destilada, luego extraída el agua con una jeringa y reemplazada por 2 mL de TTC 0,1% y mantenidas a 33 °C por 24 horas en oscuridad.
Finalizado los tiempos de pretratamiento y tratamiento con solución de TTC, inmediatamente se extrajo de los envases con una jeringa de 1 mL la solución de TTC y se agregó una alícuota de 3 mL de agua destilada en cada envase. Con ayuda de gotero se extrajo la muestra de semillas en suspensión y se depositó en una caja de Petri de 6 cm de diámetro. A continuación se colocó sobre el agua un círculo de papel de filtro del diámetro de la caja de Petri, para eliminar el exceso de agua y que las semillas quedaran adheridas entre el vidrio y el papel de filtro. Posteriormente, se realizó la observación con la ayuda de lupa binocular con 10 x de aumento, para lo cual se dio vuelta la caja de Petri y se colocó una grilla de acetato con cuadriculas de 0,5 cm de lado, procediendo al recuento de semillas viables, no viables y semillas vanas, realizando 7 observaciones al azar. Fue evaluada la viabilidad de las semillas en cada tratamiento y repetición, para ello se consideraron semillas viables a aquellas que presentaban una coloración que variaba del rosado al rojo oscuro; y no viables las semillas sin tinción con embrión visible. Los datos promedios de los campos observados por tratamiento se expresaron en porcentaje.
La prueba de viabilidad, según las normas ISTA (1996), debe realizarse en la fracción pura de las semillas, es decir, libre de impurezas y semillas vanas. Dado el pequeñísimo tamaño de las simientes de orquídeas, resulta imposible separar a priori las semillas vanas del total de la muestra en estudio, por lo tanto el recuento de semillas vanas «identificadas por el tegumento visible sin embrión» se hizo junto con la determinación de semillas viables y no viables y se calculó el valor de semillas totales de la muestra (STM) como sumatoria de semillas viables, no viables y vanas, para poder estimar sobre este total la fracción de semillas vanas en % [(Número de semillas vanas / STM) x 100)].
Para el análisis estadísticos los valores de porcentaje de semillas viables, no viables y vanas fueron transformados a ArcSen raíz de X, se verificó la normalidad de los mismos (Shapiro-Wilks) y se efectuó un análisis de variancia y la diferencia entre medias empleando la prueba de Duncan para un nivel de significación del 95% (p<0,05) utilizando el programa estadístico InfoStat (Di Rienzo et al. 2008).
RESULTADOS Y DISCUSIÓN
El análisis de la variancia permitió distinguir claramente las diferencias del efecto de los pretratamientos T4 y T5 respecto a las semillas viables de los demás tratamientos (Tabla 1). El modelo tuvo un ajuste R de 62,4%, un coeficiente de variación de 11,53% y fue altamente significativo (p<0,0001). El T3 presentó los menores valores de semillas viables (Figura 1 y Tabla 1). Los tratamientos T1 y T2 no mostraron diferencias entre sí en el porcentaje de semillas viables, pero si con el resto de los tratamientos (Figura 1 y Tabla 1).
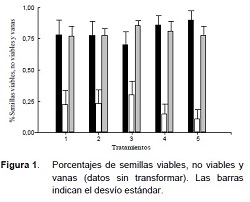
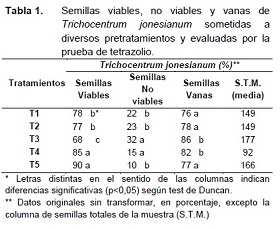
Los valores de viabilidad más altos se obtuvieron con el tratamiento convencional (T5) al igual que con el pretratamiento de inmersión en solución de sacarosa (T4), pero por practicidad se recomienda utilizar el tratamiento convencional (T5) en esta especie. En otras especies eg. Cattleya (Hosomi et al. 2012) han encontrado una respuesta favorable de 10% superior al testigo con el pretratamiento con sacarosa en la determinación de viabilidad.
El T3 resultó con los mayores valores de semillas no viables, indicando que el pretratamiento de desinfección con hipoclorito de sodio ejerció influencia negativa sobre el valor de viabilidad, aumentando la proporción de semillas no viables, tal como fue demostrado para Oncidium bifolium por Dalozotto et al. (2013).
En el caso de las semillas vanas, los tratamientos T3 y T4 no presentan diferencias entre sí, pero sí con el resto de los tratamientos. En general se observó que la proporción de semillas vanas fue alta, variando entre el 76 y 86% según los tratamientos (Tabla 1 y Figura 1).
El tratamiento 3, con desinfección y lavado a que son sometidas las semillas antes de la siembra “in Vitro” (Billard et al. 2013, Dalzotto et al. 2013, Dalzotto y Lallana 2013), afectó significativamente la viabilidad del lote de semillas de 90% (T5) a 68% (T3) (Tabla 1).
La desinfección de las semillas con soluciones crecientes de hipoclorito de sodio (0,1 a 2%) reducen la expresión de la germinación tal como fue demostrado en semillas de Oncidium bifolium (Dalzotto et al. 2013), si bien la concentración de 0,1% de hipoclorito no tuvo diferencia con el testigo para esta especie. Similares resultados son citados para la especie Cattleya mendelli cuando se evaluó la germinación después de aplicar 6 dosis de hipoclorito de sodio (0,5 al 3%) en la desinfección (Salazar-Mercado 2012).
En el caso de T. jonesianun la dosis empleada de 0,1%, produjo un efecto adverso sobre la viabilidad de la muestra, lo cual en condiciones de germinación in vitro se traduciría también en una menor cantidad de plantas logradas.
CONCLUSIONES
El pretratamiento con sacarosa no permite mejorar la lectura de la viabilidad de la prueba de tetrazolio por lo que no se recomienda su uso para semillas de T. jonesianum. El pretratamiento de imbibición con agua destilada es suficiente para la determinación de la viabilidad en esta especie.
El uso de hipoclorito de sodio por 15 min para la desinfección de T. jonesianum afecta significativamente la viabilidad de los embriones.
REFERENCIAS BIBLIOGRÁFICAS
Arditti, J; Clements, Ma; Fast, G; Hadley, G; Nishimura, G; Ernest R. 1982. Orchid seed germination and seedling culture - a manual. In: Arditti J, ed. Orchid biology - reviews and perspectives II. Ithaca: Cornell University Press, Cap.7 , p. 243-370. [ Links ]
Billard, CE; Dalzotto, CA; Lallana, VH. 2013. Germinación de Bletilla striata (Thunb.) Rchb. f. en medio líquido y evolución de plantas en medio semisólido. Investig. Agr. 15(1):1-8. [ Links ]
Dalzotto, CA; García, LF; Lallana, VH. 2013. Efecto del pretratamiento con hipoclorito de sodio en la prueba de viabilidad de semillas de Oncidium bifolium sims. I Congreso Brasilero de Producción de Orquídeas. Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 42-44. Edición CD-ROM. [ Links ]
Dalzotto, CA; Lallana, VH. 2013. Tiempos de desinfección con hipoclorito de sodio para la siembra in vitro de semillas de Oncidium longicornu Mutel. I Congreso Brasilero de Producción de Orquídeas. Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 67-69. Edición CD-ROM. [ Links ]
Di Rienzo, JA; Casanoves, F; Balzarini, MG; González, L; Tablada, M; Robledo, CW. 2008. InfoStat, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
Hosomi, ST; Custódio, CC; Seaton, PT; Marks, TR; Machado-Neto, NB. 2012. Improved assessment of viability and germination of Cattleya (Orchidaceae) seeds following storage. In Vitro Cell.Dev.Biol.Plant, 48:127-136. [ Links ]
Insaurralde, IS; Radins, JA. 2007. Misiones orquídeas / orchids. 1ra. Ed. Bs. As. Golden Company, 192 p. [ Links ]
ISTA (International Seed Testing Association). 1996. International Rules for Seed Testing. Seed Science & Technology, v. 24, supplement. 335 p. [ Links ]
Lallana, VH; García, LF. 2012a. Conservación de semillas de orquídeas y estudio de su viabilidad en el tiempo. Revista Análisis de Semillas, 6(23):58-61. [ Links ]
Lallana, VH; García, LF. 2012b. Protocolo para determinar viabilidad mediante el test de tetrazolio en semillas de orquídeas. 3er. Congreso de Orquideología, Conservación y Bromeliaceas. Resúmenes de trabajos y Ponencias p. 77-78. Montecarlos, Misiones 18, 19, 20, 21 de julio de 2012. [ Links ]
Lallana, VH; García, LF. 2010. Puesta a punto de la prueba de tetrazolio en semillas de orquídeas. 75º Reunión de Comunicaciones Científicas de la Asoc. Cienc. Nat. Del Litoral. Santa Fe, 23/06/10. Resúmenes, p. 8. [ Links ]
Márquez Palmeira, PH; Lajovic Carneiro, L.; Mota Silva, D; Lorrayne Nunes, G; Tadeu Sibov, S. 2013. Testes de viabilidade de sementes de Cyrtopodium fowliei L.C. Menenzes (Orchidaceae). I Congreso Brasilero de Producción de Orquídeas. Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 34-35. Edición CD-ROM. [ Links ]
Preti, EA; Zandona, AP; Lopes Da Silva, G; Takahashi, LS; Janeiro Neves, CSV; Ricardo Tadeu De Faria, R. 2013. Tetrazólio no teste de viabilidade de sementes de orquídea Cattleya loddigesii. I Simposio Brasilero de Cultivo de Orquídeas, Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 31-33. Edición CD-ROM. [ Links ]
Pritchard, HW; Prendergast, FG. 1990. Viability testing in terrestrial orchid seed. Acta Universitatis Wratislaviensis, 1055:11-16. [ Links ]
Rasmussen, HN. 1995. Terrestrial orchids from seed to mycotrophic plants. Cambridge: Cambridge University Press, 460 p. [ Links ]
Salazar-Mercado, SA. 2012. Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). Acta Agronómica. 61(1):69-78. [ Links ]
Singh, F. 1981. Differential staining of orchid seeds for viability testing. American Orchid Society Bulletin 50:416-418. [ Links ]














