Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.14 no.1 San Lorenzo June 2012
ARTÍCULO CIENTÍFICO
Control de los hongos del suelo Rhizoctonia sp., Fusarium sp. y Sclerotium sp. con extractos vegetales
Control of soil fungi Rhizoctonia sp., Fusarium sp. and Sclerotium sp. with plant extracts
Alice Rocío Chávez1 y Alicia Susana Aquino Jara2*
1. Departamento Protección Vegetal, Facultad de Ciencias Agrarias, Universidad Nacional de Asunción. San Lorenzo, Paraguay.
2. Docente Investigador del Departamento Protección Vegetal, Facultad de Ciencias Agrarias, Universidad Nacional de Asunción. San Lorenzo, Paraguay.
*Autor para correspondencia (aaquino@agr.una.py).
Recibido: 22/03/2012; Aceptado: 10/05/2012.
RESUMEN
En el Laboratorio e Invernadero del Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción, fueron evaluados los extractos de ajo (Allium sativum), piri’i (Cyperus spp.), caraguata’i (Eryngium elegans) y ortiga (Urtica dioica), para el control de los hongos: Rhizoctonia sp., Fusarium sp. y Sclerotium sp.; empleándose el diseño experimental completamente al azar con cinco tratamientos y diez repeticiones. Los extractos fueron obtenidos licuando por separado las hojas de las especies vegetales y los bulbos de ajo, luego filtrados e incorporados al medio de cultivo PDA al 20% y distribuidos en placas de Petri. Seguidamente se adicionó en el centro de las placas un disco de 4 mm de diámetro con cultivo puro de cada hongo e incubadas a 28 ºC. Fueron evaluados: crecimiento micelial, esporulación y producción de esclerocios de los hongos. Los resultados demostraron que el extracto de ajo inhibió el crecimiento micelial de los tres hongos; así como la esporulación de Fusarium sp. y la producción de esclerocios de Sclerotium sp. En invernadero, las semillas fueron sembradas en sustrato inoculado con los hongos y los extractos fueron aplicados desde la siembra hasta los 20 días mediante riego, evaluándose la incidencia del Damping off. Los resultados indicaron que los extractos no controlan la enfermedad. Se concluye que ninguno de los extractos fue eficiente para el control del Damping off.
Palabras clave: Extractos vegetales, control alternativo, hongos de suelo.
ABSTRACT
In the laboratory and Greenhouse of the Plant Protection Department of the protection of the Faculty of Agricultural Sciences of the National University of Asunción, there were evaluated extracts of garlic (Allium sativum), Cyperus spp., Eryngium elegans and Urtica dioica to control fungi Rhizoctonia sp, Fusarium sp. and Sclerotium sp., using a completely randomized experimental design with five treatments and ten replicates. The extracts were obtained separately, blending the leaves of plants and bulbs of garlic, then filtered and incorporated into the PDA 20% culture medium and distributed in Petri dishes. Then, it was added in the center of the plates a disk of 4 mm in diameter with a pure culture of each fungus and incubated at 28 °C. There were evaluated: mycelial growth, sporulation and production of sclerotia of fungi. The results demonstrate that garlic extract inhibited mycelial growth of the three fungi, and sporulation of Fusarium sp. and sclerotia production of Sclerotium sp. In the greenhouse, seeds were sown in substrate inoculated with the fungus and the extracts were applied from planting to 20 days by watering, the incidence of Damping off was evaluated. The results indicated that the extracts do not control the disease. It is concluded that none of the extracts was efficient for the control of Damping off.
Key words: Plant extracts, alternative control, soil borne fungi.
INTRODUCCIÓN
En los últimos años el uso de productos químicos para el control de las enfermedades de plantas se ha intensificado, incrementando los costos de producción, para reducir el uso de estos productos, la agricultura debe establecer nuevas alternativas. Una de ellas es el uso de extractos vegetales, que ha cobrado especial interés por parte de los investigadores; presentando resultados satisfactorios, tanto en laboratorio como a campo, por ello, es importante la realización de más trabajos acerca del tema, con el fin de determinar especies de plantas, que podrían utilizarse efectivamente para el control de los diferentes hongos fitopatógenos en los cultivos.
El uso de extractos vegetales es más factible en cultivos intensivos, en la producción de mudas, donde el principal problema es ocasionado por hongos del suelo como Rhizoctonia sp., Fusarium sp. y Sclerotium sp.; causando la enfermedad conocida como Damping off. Se conoce con este nombre a la incapacidad de las semillas de germinar en el terreno y también a la muerte de plántulas en post emergencia debido a la acción patógena de muchos microorganismos (Fernández Valiela 1978). Los métodos de control de esta enfermedad varían considerablemente y pueden clasificarse de la siguiente manera: cultural, biológico, físico y químico (Agrios 1995). También existe el control alternativo o control natural, de acuerdo con Stoll (1989), que consiste en la utilización de los medios que proporciona la naturaleza para la protección de los cultivos. Conforme a lo mencionado por Hernández et al. (2007), las plantas producen sustancias con propiedades antimicrobianas que pueden ser empleadas para controlar diferentes enfermedades. La obtención de los extractos vegetales y el estudio de sus compuestos activos propician su empleo contra diferentes fitopatógenos, como los causantes del Damping off.
Este trabajo fue realizado con el fin de determinar el efecto de los extractos de caraguata’i (Eryngium elegans.), piri’i (Cyperus rotundus), ajo (Allium sativum) y ortiga (Urtica dioica) sobre los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp. en condiciones in vitro, y en plántulas de tomate y pimiento causando Damping off en invernadero. Para ello se observó el crecimiento micelial, la producción de esporas y esclerocios de los hongos en estudio, en condiciones in vitro; y se cuantificó la incidencia del número de plántulas con síntomas de Damping off, en el invernadero.
METODOLOGÍA
Los experimentos fueron llevados a cabo en el laboratorio e invernadero del Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias (FCA), ubicado en el campus de la Universidad Nacional de Asunción (UNA) en la ciudad de San Lorenzo. Para el experimento in vitro, el diseño experimental utilizado fue el completamente al azar, con cinco tratamientos y diez repeticiones para cada hongo en estudio. Los tratamientos consistieron en los extractos de caraguata’i, piri’i, ajo, ortiga y un testigo absoluto. Cada unidad experimental estaba representada por una placa de Petri. Los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp. fueron aislados de plantas de petunia (Petunia x hibrida), tomate (Lycopersicon esculentum) y pimiento (Capsicum annum).
Para la aislación, los tallos de las plantas con síntomas fueron cortados en pequeños trozos y desinfectados con hipoclorito de sodio. Posteriormente, bajo campana de aislación fueron depositados en placas de Petri en medio de cultivo, a razón de tres trozos de tallos por placa e incubados a 28 ºC, durante 48 horas. Una vez obtenido el crecimiento micelial, se identificaron los patógenos con ayuda de claves de identificación (Barnett y Hunter 1998) luego se efectuaron repiques del micelio, para obtener cultivos puros de los hongos (French y Hebert 1980).
Para la obtención de los extractos vegetales se colectaron hojas de especies vegetales provenientes del campus de la FCA-UNA: caraguata’i (Eryngium elegans), piri’i (Cyperus spp.) y ortiga (Urtica dioica); y fueron adquiridos del mercado local bulbos de ajo (Allium sativum) de origen argentino. Las hojas de piri’i, caraguata’i y ortiga fueron lavadas con agua corriente y desinfectadas con una solución de hipoclorito de sodio, pesadas y licuadas a razón de 50 g de hojas en 200 ml de agua destilada, posteriormente el extracto obtenido fue filtrado primeramente con un paño de algodón y luego filtro de papel. Para el extracto de ajo se pesaron 150 g de bulbos frescos sin cáscara que fueron licuados por 2 minutos en un litro de agua destilada y filtrado como los extractos de hojas (Sarubbi 2002). Los extractos obtenidos fueron utilizados inmediatamente.
Para la realización del antibiograma, previamente, bajo campana de aislación se adicionó 20 ml de cada uno de los extractos con 100 ml del medio de cultivo PDA (200 g papa, 20 g dextrosa, 20 g agar), agitándose para su homogenización (Araujo et al. 2008) y distribuidos en placas de Petri. Una vez solidificado el medio de cultivo con los extractos, se procedió a sembrar en el centro de cada placa, un disco de 4 mm de diámetro con cultivo puro del hongo. Este procedimiento fue efectuado para cada uno de los hongos en estudio. Las placas de Petri fueron incubadas a 28±2 ºC. El tiempo de incubación dependió del desarrollo de cada uno de los hongos.
Las variables evaluadas fueron:
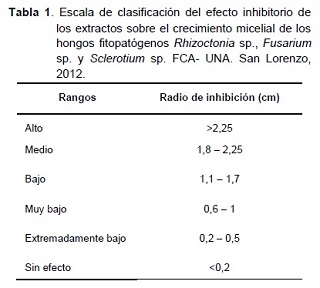
- Crecimiento micelial: una vez que el tratamiento testigo cubrió por completo el área de la placa, se procedió a medir el diámetro de crecimiento micelial de los hongos, con ayuda de una regla milimetrada, luego se halló el área del mismo, y los resultados fueron expresados en centímetros cuadrados (cm2). Se clasificó el efecto inhibitorio de los extractos, de acuerdo al radio del crecimiento micelial de los hongos en 6 rangos (Tabla 1), utilizando la escala adaptada de Viveros y Castaño (2006).
- Cuantificación de esporas de Fusarium sp.: para cuantificar las esporas se empleó la cámara de Neubauer siguiendo la metodología establecida por French y Hebert (1980).
- Cuantificación de esclerocios de Sclerotium sp.: para cuantificar el número de esclerocios se extrajo una porción de 1 cm2 de PDA, conteniendo el cultivo puro del hongo con esclerocios, y se procedió a contar los mismos. Los datos obtenidos representaron el número promedio de esclerocios para cada tratamiento.
Para el experimento en invernadero fueron empleadas semillas de tomate de la variedad Pyta Guasu adquiridas del Instituto Agronómico Nacional (IAN, Caacupé) y semillas de pimiento de la variedad Cascadura Ikeda obtenidas de frutos provenientes del mercado Municipal de San Lorenzo.
El diseño empleado fue completamente al azar con cinco tratamientos y cinco repeticiones, para cada uno de los hongos en estudio, siendo los tratamientos: extractos de piri’i, caraguata’i, ortiga, ajo y el testigo absoluto (agua corriente). La unidad experimental estuvo constituida por una bandeja de plástico, con veinte celdas de 2,5 cm de lado cada una, conteniendo sustrato comercial (vermiculita, cáscara de pino, turba y carbón vegetal) y en donde fueron sembradas dos semillas en cada celda para las dos especies vegetales en forma separada.
Los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp. fueron multiplicados sobre granos de arroz según la metodología adaptada de Grabowski (2005).La inoculación consistió en colocar 10 granos de arroz con crecimiento del hongo puro, en el centro de cada celda, a 0,5 cm de profundidad; luego se regó con agua corriente. La siembra de las semillas se realizó dos días después de la inoculación.
La metodología empleada para la preparación de los extractos vegetales fue la misma utilizada en el experimento in vitro. La aplicación de los mismos se realizó mediante riego, dos días después de la siembra y luego día de por medio, hasta que las plántulas alcanzaron los veinte días de edad.
La variable evaluada fue la incidencia del Damping off en plántulas de tomate causado por Rhizoctonia sp. y Fusarium sp., y en plántulas de pimiento el Damping off causado por Sclerotium sp. Se cuantificó el número de plántulas con síntomas causado por los hongos fitopatógenos en estudio, en los diferentes tratamientos. Los resultados obtenidos fueron expresados en porcentaje sobre el número total de plantas de acuerdo a lo establecido por French y Hebert (1980).
Los datos obtenidos fueron sometidos al análisis de varianza (ANAVA), y habiendo diferencia estadística, los mismos fueron sometidos al test de Tukey al 5%. Los datos obtenidos en cuanto al número de esporas de Fusarium sp. fueron transformados a raíz cuadrada.
RESULTADOS Y DISCUSIÓN
El efecto de los extractos vegetales sobre el crecimiento micelial de Rhizoctonia sp., Fusarium sp. y Sclerotium sp. in vitro pueden ser observados en la Tabla 2.
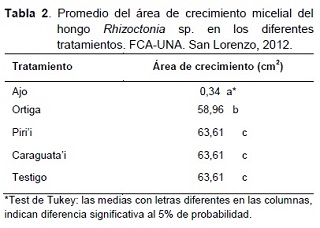
Según el análisis de varianza realizado existe diferencia estadística significativa entre los tratamientos; el extracto de ajo presentó menor área de crecimiento, con 0,34 cm2, siendo estadísticamente diferente a los demás tratamientos y presentando un efecto inhibitorio alto, de acuerdo con la escala adaptada de Viveros y Castaño (2006).
El extracto de ortiga presentó un área de crecimiento micelial, ligeramente menor en comparación con los extractos de piri’i, caraguata’i y el testigo, el análisis indica que existe diferencia estadística entre los mismos. Los extractos de piri’i y caraguata’i, así como el testigo no inhibieron el crecimiento micelial del hongo.
Con relación al extracto de ajo, los resultados concuerdan con los obtenidos por Sarubbi (2002), quien observó una inhibición del 100% del crecimiento micelial de Rhizoctonia solani utilizando extracto de ajo a 30.000 ppm, in vitro, en tanto que, López et al. (2005) obtuvieron inhibición del crecimiento del hongo del 98 y 100% utilizando extracto de ajo en concentraciones de 5 y 10%, respectivamente.
El extracto de ortiga, presentó un efecto extremadamente bajo sobre Rhizoctonia sp., sin embargo, Viveros y Castaño (2006), verificaron un efecto inhibitorio muy bajo del extracto de ortiga al 50% sobre Mycosphaerella fijiensis; lo cual supone que su efecto se reduce al disminuir la concentración del extracto.
En la Tabla 3, se presentan los resultados del área de crecimiento micelial del hongo Fusarium sp., donde el extracto de ajo logró inhibir por completo el desarrollo del hongo, mostrando un efecto inhibitorio alto, y siendo estadísticamente diferente a los demás tratamientos.
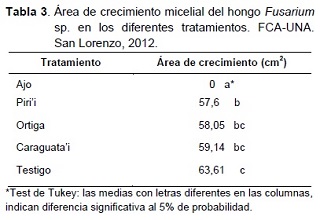
Los extractos de caraguata’i y ortiga no se mostraron diferentes al testigo, sin embargo, los mismos fueron estadísticamente iguales al extracto de piri’i, que a su vez resultó diferente al testigo.
El extracto de piri’i, presentó un efecto inhibitorio extremadamente bajo, lo cual concuerda con lo observado por Bravo et al. (2000), donde verificaron que el polvo de hojas de piri’i, en mezcla con PDA, no presentaba efecto inhibitorio sobre el crecimiento micelial de Fusarium moniliforme.
En relación al extracto de ajo, que inhibió por completo el desarrollo micelial de Fusarium sp., este resultado concuerda con lo mencionado por López et al. (2005), quienes señalan que en concentraciones del 5 y 10%, el extracto de ajo inhibe el 68,5 y 69,8% del crecimiento de Fusarium oxysporum f. sp. lycopersici, respectivamente. Por lo cual se deduce que a mayor concentración del extracto de ajo, mayor es el efecto inhibitorio.
El extracto de ortiga presentó un efecto inhibitorio extremadamente bajo de Fusarium sp., en contraposición a lo observado por Feitosa et al. (2007), quienes obtuvieron 100% de inhibición del crecimiento de Colletotrichum gloeosporioides, con extractos acuosos y alcohólicos de esta planta.
En la Tabla 4, se expone los resultados del área de crecimiento micelial del hongo Sclerotium sp. El extracto de ajo, fue el único que logró inhibir totalmente el desarrollo del hongo, siendo estadísticamente diferente a los demás tratamientos, los cuales no presentaron diferencias entre sí.
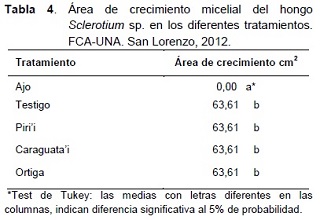
El extracto de ajo logró menor área de crecimiento, mostrando un alto efecto inhibitorio, coincidiendo con los resultados obtenidos por Stauffer et al. (2000), quienes en una investigación sobre extractos vegetales con efecto fungicida y bactericida, registraron la inhibición del crecimiento micelial de varios hongos fitopatógenos, tratados con extractos de bulbo de ajo.
Sin embargo, Hernández et al. (2004), mencionan que cepas de Sclerotium rolfsii, aisladas de tomate y cebolla, tuvieron su mayor tasa de crecimiento en un medio de cultivo compuesto por extracto de ajo más PDA esterilizados, lo cual no concuerda con lo observado en este experimento, probablemente debido al tratamiento de esterilización. Este hecho confirma lo mencionado por Bastos (1992), citando a Caballito y Bailey (1944), y también por Gasparín et al. (1998), quienes indican que el principal componente con acción fungicida del ajo, la alicina, posee características volátiles degradándose rápidamente, en condiciones normales, y más aún a altas temperaturas.
Los demás extractos no inhibieron el crecimiento del hongo, lo cual no coincide con Bezerra et al. (2007), quienes observaron que el extracto acuoso de ortiga, mezclado con PDA, redujo significativamente el crecimiento micelial de Sclerotium rolfsii, in vitro.
El efecto de los extractos vegetales sobre la producción de esporas de Fusarium sp. y la producción de esclerocios de Sclerotium sp. in vitro, se presentan en la Tabla 5.
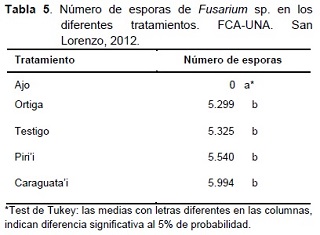
De acuerdo a la Tabla 5, existe diferencia estadística significativa entre el extracto de ajo y los demás tratamientos. Ninguno de los extractos tuvo un efecto antiesporulante sobre el hongo, a excepción del ajo. La ausencia de esporulación observada en el tratamiento con extracto de ajo, estuvo acompañada con la falta de crecimiento micelial del hongo.
Con respecto al extracto de piri’i, los resultados obtenidos no concuerdan con lo señalado por Bravo et al. (2000), quienes mencionan una reducción del 79% de la esporulación de Fusarium moniliforme utilizando polvo de hojas en mezcla con PDA. Esta diferencia en los resultados, podría deberse a que polvo de hojas presenta mayor concentración de sustancias inhibitorias para la esporulación del hongo, comparado con los extractos vegetales.
En la Tabla 6, se pueden observar los resultados del número de esclerocios de Sclerotium sp., en los diferentes tratamientos. Sólo el extracto de ajo mostró diferencia en relación a los demás tratamientos. El tratamiento testigo presentó la mayor cantidad de esclerocios, con un promedio de 25 por cm2 de medio de cultivo PDA, seguido por los extractos de piri’i, ortiga y caraguata’i con 23,8; 23 y 22,5 esclerocios, respectivamente.
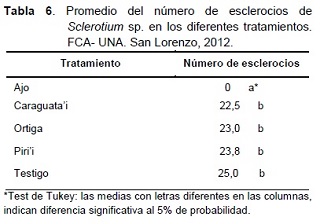
Hernández et al. (2004), reportan que diferentes aislados de S. rolfsii, tuvieron su mayor producción de esclerocios en un medio de cultivo compuesto por PDA más extracto de ajo, esto no concuerda con este experimento, ya que debido a la ausencia de crecimiento micelial tampoco hubo formación de esclerocios.
El efecto de los extractos vegetales sobre los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp. en pruebas de invernadero, pueden ser observados en la Tabla 7.
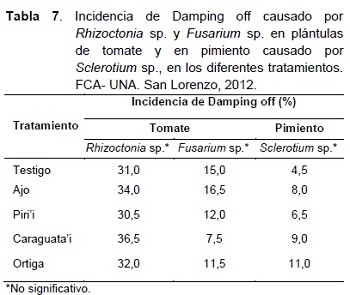
Como se puede observar en la Tabla 7, el porcentaje de incidencia de Damping off en las plántulas de tomate y pimiento, fue similar en todos los tratamientos. El análisis de varianza indicó que no existe diferencia entre los tratamientos.
La similitud de la incidencia de la enfermedad en todos los tratamientos, pudo deberse a que las cepas utilizadas para la inoculación del sustrato, perdieron su capacidad patogénica, debido a los sucesivos repiques y al largo periodo que permanecieron en cultivo in vitro, de acuerdo con lo mencionado por Cañedo y Ames (2004) y García et al. (2006).
Con los extractos vegetales no se evidenció el control del Damping off, causado por Rhizoctonia sp. y Fusarium sp., en plántulas de tomate, pero se observó una marcada diferencia en el crecimiento de las mismas (Figura 1 y 2). Las plántulas tratadas con los extractos de ajo y ortiga presentaron mayor desarrollo en altura y número de hojas.


En el experimento, en el cual, la inoculación del sustrato se realizó con Rhizoctonia sp., se pudo observar un alto porcentaje de plántulas con síntomas de Damping off de pre germinación y pre emergencia, lo cual concuerda con lo señalado por Smith et al. (1992), quienes afirman que Rhizoctonia invade y produce la muerte de las semillas, antes o después de que empiece la germinación.
En cuanto al Damping off causado por Sclerotium sp. en plántulas de pimiento, la baja incidencia de la enfermedad, pudo deberse a las inestables condiciones de temperatura durante la conducción del experimento.
CONCLUSIONES
- El extracto de ajo (Allium sativum), en condiciones in vitro, presenta un efecto inhibitorio alto sobre el crecimiento micelial de los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp.
- Los extractos de caraguata’i (Eryngyum elegans), piri’i (Cyperus sp.) y ortiga (Urtica dioica), en condiciones in vitro, no tienen efecto inhibitorio sobre el crecimiento micelial de los hongos Rhizoctonia sp., Fusarium sp. y Sclerotium sp.
- El extracto de ajo, en condiciones in vitro, inhibe la esporulación de Fusarium sp. y la formación de esclerocios de Sclerotium sp.
- Los extractos de piri’i, caraguata’i y ortiga, en condiciones in vitro, no reducen la esporulación de Fusarium sp. y estimulan la producción de esclerocios de Sclerotium sp.
- Los extractos de ajo, piri’i, caraguata’i y ortiga no controlan el Damping off causado por Rhizoctonia sp. y Fusarium sp. en plántulas de tomate, tampoco al causado por Sclerotium sp. en plántulas de pimiento.
LITERATURA CITADA
Agrios, G. 1995. Fitopatología. Trad. M Guzmán Ortiz. México, Limusa. 756 p. [ Links ]
Araujo, D; Rodríguez, D; Sanabria, ME. 2008. Respuesta del hongo Fusarium oxysporum f sp. cubense, causante del mal de Panamá, a algunos extractos vegetales y fungicidas. (en línea). Fitopatología Venezolana 21(1): 2-8. Consultado 12 abr. 2012. Disponible en: http://www.sovefit.com.ve/boletines/21-1/Documento1.pdf [ Links ]
Bastos, C. 1992. Inibição do crescimento micelial e germinação de esporos de Crinipellis perniciosa e Phytophthora palmivora por extrato de bulbo de alho (Allium sativum). Fitopatologia Brasileira 17 (4):454-457. [ Links ]
Barnett, HL; Hunter, BB. 1998. Ilustrated genera imperfect fungi. 4 ed. The American Phytopathological society. Minnesota, US. 218 p. [ Links ]
Bezerra, EJS; Bentes, JLS; Silva, AM; Coelho Neto, RA. 2007. Efeito in vitro de extratos vegetais no crescimento micelial de Sclerotium rolfsii. Fitopatologia Brasileira 32: 131. [ Links ]
Bravo, L; Bermúdez, K; Montes, R. 2000. Inhibición de Fusarium moniliforme mediante polvos vegetales y algunos de sus componentes químicos. Manejo Integrado de Plagas No.57:29-34. [ Links ]
Cañedo, V; Ames, T. 2004. Manual de Laboratorio para el Manejo de Hongos Entomopatógenos. (en línea). Centro Internacinal de la Papa. Lima, Perú. Consultado 5 feb. 2012. Disponible en: http://books.google.com.py/books?id=lFfNuqTeit8C&pg=PA52&dq=perdida+patogenicidad+hongos&hl=es&sa=X&ei=vqHOT5TEEKbh0wHX_cS4CA&redir_esc=y#v=onepage&q=perdida%20patogenicidad%20hongos&f=false. [ Links ]
Feitosa, FM; Carvalho, PRS; Carvalho, EMS. 2007. Efeito de extratos vegetais aquosos e alcoólicos sobre Colletotrichum gloeosporioides, agente causal da antracnose do cajueiro. Fitopatologia Brasileira 32: 162. [ Links ]
Fernández Valiela, MV. 1978. Introducción a la Fitopatología. Volumen 3. Hongos. Colección Científica del INTA. 3 ed. Buenos Aires, AR. 779 p. [ Links ]
French, ER; Hebert, TT. 1980. Métodos de investigación fitopatológica. San José, CR, Instituto Interamericano de Ciencias Agrícolas. 289 p. [ Links ]
García, M; Villamizar, L; Torres, L; Cotes, A. 2006. Efecto de subcultivos sucesivos de Beauveria bassiana sobre sus características yactividad contra Premnotrypes vorax. (en línea). Manejo Integrado de Plagas y Agroecología. No. 77. Consultado 5 feb. 2012. Disponible en: http://orton.catie.ac.cr/repdoc/A1729E/A1729E.PDF [ Links ]
Gasparín, MD; Moraes, LM; Schwan Estrada, K; Stangarlin, JR. 1998. Efeito do óleo essencial e do extrato bruto de alho no crescimento de Rhizoctonia solani e Alternaria stevia. Summa Phytopathologica. BR. 24(1): 74. [ Links ]
Grabowski, C. 2005. Eficiencia de sustratos sobre la esporulación de hongos entomopatógenos Beauveria bassiana, Metarhizium anisopliae y Paecilomyces sp. Tesis Ing. Agr. San Lorenzo, PY, FCA. UNA. 45 p. [ Links ]
Hernández, J; Montes, R; Flores, HE; Nava, R; Chanona, J. 2004. Caracterización de aislamientos de Sclerotium rolfsii Sacc. en diferentes medios de cultivo. Revista Mexicana de Fitopatología 22(3). Consultado 4 feb. 2012. Disponible en: http://redalyc.uaemex.mx/61222305redalyc/src/inicio/ArtPdfRed.jsp?iCve= [ Links ]
Hernández, AN; Bautista, S; Velázquez, MG. 2007. Prospectiva de extractos vegetales para controlar enfermedades postcosecha hortifruticolas. Revista Fitotecnia Mexicana 30(2). Consultado 29 jul. 2010. Disponible en: http://redalyc. uaemex.mx/redalyc/pdf/610/61030202.pdf [ Links ]
López, A; López, S; Vásquez, M; Rodriguez, S; Mendoza, M; Padrón, E. 2005. Inhibición del crecimiento micelial de Fusarium oxysporum Schlechtend. f. sp lycopersici (Sacc.) Snyder y Hansen, Rhizoctonia solani Kuhn y Verticillium dahliae Kleb. mediante extractos vegetales acuosos (en línea). Revista Mexicana de Fitopatología. 23(2):183-190. Consultado 22 jul. 2010. Disponible en: http://sociedadmexicanadefitopatologia.org/archives/61221102.pdf [ Links ]
Sarubbi, HJ. 2002 Control alternativo de Rhizoctonia solani Kuhn en petunia (Petunia x hibrida). Tesis Maestría. San Lorenzo, PY. FCA. UNA. 37 p. [ Links ]
Smith, IM; Dunez, J; Lelliott, RA; Phillips, DH; Archer, SA. 1992. Manual de enfermedades de plantas. Madrid, ES, Mundi Prensa. 671 p. [ Links ]
Stauffer, A; Orrego, A; Aquino, A. 2000. Selección de extractos vegetales con efecto fungicida y/o bactericida. (en línea). Revista de Ciencia y Tecnología, Dirección de Investigaciones UNA. 1(2):29-33. [ Links ]
Stoll, G. 1989. Protección natural del cultivo: con recursos provenientes de las granjas en zonas tropicales. Trad. N Jelenic; D Domamm-Weikesheim. Magrat. 184 p. [ Links ]
Viveros, J; Castaño, J. 2006. Evaluación in vitro de extractos vegetales sobre Mycosphaerella fijiensis Morelet. (en línea). Agronomía. Consultado 4 feb. 2012. Disponible en: http://agronomia.ucaldas.edu.co/downloads/Agronomia14-1_5.pdf [ Links ]














