INTRODUCCIÓN
La rabia es una zoonosis producida por un virus ARN, género Lysavirus, de la familia Rabdoviridae 1, que infecta a numerosos animales, especialmente mamíferos. Desde el punto de vista anatomoclínico, es una encefalomielitis aguda viral. Su vía de transmisión puede ser directa (mordeduras, lameduras, rasguños producidas por el animal enfermo) o indirecta (inhalación de secreciones e incluso trasplantes de órganos de individuos enfermos) 2,3. La rabia clínicamente manifiesta (urbana, selvática o por murciélagos) siempre es letal 4.
La rabia paralítica recibe en cada país de América Latina diferentes nombres: “mal de caderas” y “rabia paresiante” en la Argentina; “peste das cadeiras” en el Brasil; “hueguera” y “renguera” en Colombia y Costa Rica; “derriengue”, “derrengue” y “tronchado” en Mexico; “huequera” en Panamá; “mal de caderas” y “Tumbyvava” en el Paraguay 5.
La rabia ocurre en la mayoría de los países del mundo, excepto en países insulares que son capaces de excluirla por rígidas medidas de cuarentena o prohibición de la entrada de perros. La rabia paralítica de los bovinos, transmitida por murciélagos vampiros, es enzoótica en regiones tropicales que se extienden del norte de México al norte de Argentina y la isla de Trinidad. La rabia selvática es ahora el problema más importante en Europa. Los zorros son los principales vectores y, como en Canadá, los bovinos son los principales receptores. En Norteamérica, las mofetas son los vectores comunes. En Canadá occidental, los principales reservorios de la infección son las mofetas, murciélagos y zorros 6.
La rabia no tiene una distribución uniforme en los países infectados, ya que en muchos de ellos existen áreas libres, de endemicidad baja y alta, y otras con brotes epizoóticos 7. En el Paraguay es enzoótica en los Departamentos de Presidente Hayes, Concepción, San Pedro y Cordillera.
Los resultados obtenidos de investigaciones anteriores en el Paraguay demostraron que el virus de la rabia selvática se encuentra presente en el principal vector, el murciélago hematófago (Desmodus rotundus), específicamente en las zonas geográficas de los Distritos de Tobatí y Caacupé del Departamento de Cordillera (Mayo a Junio de 2009). Con la utilización de redes niebla, se procedió a la captura de 100 murciélagos hematófagos, 50 ejemplares en cada distrito. Las muestras fueron congeladas y luego remitidas al Laboratorio de División de Rabia del SENACSA para su análisis, en el que se utilizó el método de inmunofluorescencia directa sobre los tejidos y órganos siguientes: cerebro, grasa parda, bazo, pulmón e hígado. El virus rábico fue detectado en 48 murciélagos hematófagos, de los especímenes capturados del Distrito de Tobatí (n:50) el 40% dio resultado positivo y los del Distrito de Caacupé (n:50) el 56% dio resultado positivo, las reacciones positivas por medio de la inmunofluorescencia directa en diferentes tejidos y órganos obtenidos dieron la siguiente distribución: fue detectado virus rábico en tejido cerebral de 24 muestras, en grasa parda de 24 muestras, en bazo de 13 muestras, en el pulmón en 9 muestras y en hígado en 4 muestras 8.
La rabia continúa siendo un problema de salud pública importante en muchos países en desarrollo. Según cifras de la Organización Mundial de la Salud (OMS), se estima que cada año mueren 55.000 personas de rabia en el mundo. La mayoría de las muertes se producen en niños. Debido al carácter zoonótico de esta enfermedad y a que la mortalidad es del 100%, se hace necesario mantener una vigilancia epidemiológica permanente, con el objeto de controlar la aparición de brotes de rabia en los animales o de casos en la población humana, ya que una vez que los síntomas se desarrollan es fatal 9.
La solución más sostenible de la lucha contra la rabia es la prevención desde el origen animal. Tanta es su importancia que se desarrolló un plan de acción mundial para la eliminación de esta enfermedad, que sigue siendo prioridad para la alianza tripartita OIE/FAO/OMS en el marco del enfoque “Una sola salud”, cuyo objetivo es terminar con las muertes humanas debidas a la rabia canina para el 2030 10.
La rabia en rumiantes transmitida por murciélagos hematófagos, es un problema que incumbe no solo a la salud veterinaria sino también al sector económico. En los países de producción ganadera de América Latina es la de mayor frecuencia, sin embargo ésta sufre de un alto grado de sub-notificación debido a las dificultades como el traslado de muestras, el reducido número de profesionales capacitados y las distancias implicadas. Se estima que en áreas marginales de América Latina, la mortalidad anual es de 50 mil cabezas de ganado, cifra que se incrementa al considerar las pérdidas indirectas por mordeduras de murciélagos “vampiros” (carne, leche y devaluación total aproximada de 50 millones de dólares anuales) 11.
El virus rábico posee dos antígenos principales, uno externo, glucoproteico, responsable de anticuerpos neutralizantes y otro interno, núcleoproteico, grupoespecífico, que genera anticuerpos útiles en el diagnóstico de la rabia intracerebral, sin eficacia protectora 3.
El diagnóstico definitivo es efectuado por un laboratorio oficial que cuenta con las técnicas validadas para el diagnóstico de la Rabia. Se basa en el estudio de material nervioso (encéfalo) mediante varias técnicas disponibles, en particular la Inmunoflorescencia Directa (IFD) y la inoculación intracerebral a ratones (EB). El diagnóstico de la Rabia siempre debe apoyarse en técnicas de laboratorio, ya que no existen signos clínicos ni lesiones macroscópicas post mortem que puedan considerarse patognomónicas en animales domésticos ni salvajes. Es decir, el cuadro clínico de la Rabia, no es determinante para el diagnóstico de la enfermedad, siendo siempre necesaria la confirmación por laboratorio. El único modo de alcanzar un diagnóstico fiable de la Rabia, consiste en identificar el virus o alguno de sus componentes específicos mediante pruebas de laboratorio.
El principio fundamental de la utilización de la vacuna contra la rabia es proteger la salud humana mediante la prevención y control de la rabia en los animales; asegurando así también la salud y el bienestar del ganado que redundara en beneficio de la economía de los productores.
La inyección de una vacuna libera el inmunógeno al organismo de la especie a la cual es destinada, pretendiendo obtener una respuesta inmune aceptable, en este caso contra la rabia. El presente trabajo de investigación buscó determinar si los niveles de anticuerpos generados tras la aplicación de la vacuna comercial cepa PV/BHK cumplen con este requisito; resultado que llevara a determinar si se justifica la vacunación del ganado caprino con este tipo de cepa comercial.
MATERIALES Y MÉTODOS
Tipo de estudio: Se realizó un estudio observacional, descriptivo, prospectivo y de corte longitudinal. El trabajo de investigación se llevó a cabo en un establecimiento del Departamento de Cordillera, Región Oriental de la República del Paraguay; la zona se caracteriza por la serranía cordillerana, gran vegetación que sirve de refugio para las especies quirópteras que son principales vectores de la rabia. El análisis por el método de seroneutralización en ratones adultos fue realizado en SENACSA (Servicio Nacional de Calidad y Salud Animal) en el laboratorio central del Departamento de Rabia, ubicado en la dirección de Ciencias Veterinarias N° 265 casi ruta Mcal. Estigarribia km 10,5; en la ciudad de San Lorenzo, Paraguay. Fueron seleccionados aleatoriamente animales de la especie caprina, clínicamente sanos, sin distinción de sexo, ni raza (Toggemburg, Saanen, Mestizas), mayores a 3 meses, que pertenezcan al Departamento de Cordillera, que fueron muestreados en los meses de agosto y setiembre del año 2016, que cumplieron con los criterios de selección. Fueron excluidos del estudio animales sin registro de vacunación, mayores a 1 año de edad y que hayan sido vacunados contra la rabia. Tipos de muestreos: La selección del establecimiento fue no probabilístico, por conveniencia y la selección de los animales fue probabilístico aleatorio simple.
Método de Campo: Una vez llegado al establecimiento, vistiendo indumentaria apropiada, se procedió a la selección de los animales. Posterior a la reseña, anamnesis y exploración física, se realizó la toma de muestra mediante extracción de sangre de la vena yugular, un volumen de 3 mL para la obtención de suero sanguíneo. Posterior a la toma de muestra, los animales se vacunaron; inyectando 2 mL de vacuna cepa PV/BHK por animal (caprino en estudio). Ulterior a la obtención de las muestras y la correcta identificación de los tubos, se procedió a la colocación en una conservadora de isopor, utilizando como conservante hielo seco, y envío al laboratorio.
Método Laboratorial: las muestras fueron procesadas en el Departamento de Rabia del Laboratorio Central del SENACSA (Servicio Nacional de Calidad y Salud Animal), San Lorenzo, Paraguay. La técnica utilizada fue la “Prueba por el método de seroneutralización en ratones adultos para determinación de anticuerpos contra la rabia en organismos vacunados”: Dilución del suero problema frente a virus constante CVS Virus Estándar de Confrontación (Óptimo de 10 a 60 DL50%) 12. Los resultados fueron medidos por el método de Reed y Muench. Para el cálculo de dosaje de anticuerpos antirrábicos se utilizó la fórmula de Reed y Muench para calcular el punto final del 50% de mortalidad de las diluciones del virus. Se calculó el punto final del 50% con la fórmula de Reed y Muench del suero de referencia internacional y sueros problema. La titulación serológica se interpretó como protegido (mayor o igual a 1:25 partes totales) y no protegido (menor a 1:25 partes totales). Se considera la protección efectiva de la vacuna si el 80% de las muestras presentan títulos protectivos contra rabia 13.
RESULTADOS Y DISCUSIÓN
Los animales objeto de estudio fueron 20 caprinos, sin distinción de razas (Toggemburg, Saanen, Mestizas), ni sexo, con edades comprendidas entre 3 a 12 meses, clínicamente sanos, y que no hubieran recibido la vacuna antirrábica (Gráfico 1).
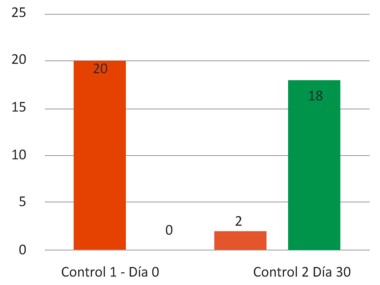
Gráfico 1. Resultado obtenido mediante pruebas de seroneutralización para determinación de anticuerpos antirrábicos, controles uno y dos. Caacupemí-Azcurra. Caacupé. Cordillera, Paraguay. Año 2016.
Al momento del control 1 (día 0) se puede apreciar que la cantidad de animales no protegidos es del 100% (20). Al momento del control 2 (día 30) se puede observar la cantidad de animales protegidos y no protegidos. Los no protegidos 10% 2, son aquellos que no alcanzaron los niveles de anticuerpos mínimos para ser considerados protegidos que es de 1:25 Partes Totales. Es decir sus niveles fueron inferiores a este parámetro, niveles tan bajos como 1:8 y 1:16 Partes Totales. (Gráfico 1).
De las muestras analizadas en el control 2, 18 (90%) presentaron títulos de anticuerpos superiores a 1:25 partes totales (0,5 UI/mL), indicando un nivel de protección considerado aceptable según la OIE. Los restante 2 (10%) de los animales, no tuvieron títulos con niveles de protección a 1:25 partes totales (0,5 UI/mL).
El 90% de los caprinos en estudio obtuvieron niveles iguales o superiores a 1:25 Partes Totales, llegando a alcanzar niveles muy superiores como 1:398; 1:318; 1:316; 1:251.
Del total de muestras analizadas, 3 (15%) presentaron un título de anticuerpos elevado (>4 UI/mL), 15 (75%) un nivel suficiente de protección (0,5-4 UI/mL), 1 (5%) tuvo un nivel insuficiente de anticuerpos para generar protección y 1 (5%) no se detectó niveles de anticuerpos antirrábicos (0,125 UI/mL). Esta clasificación se realiza teniendo en cuenta los criterios avalados por la OIE. 14 (Gráfico 2)
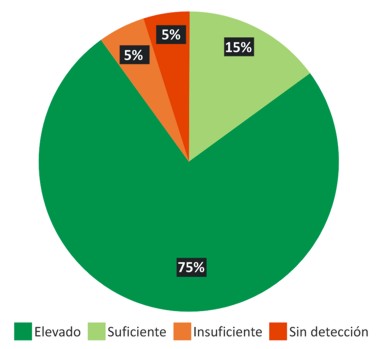
Gráfico 2 Clasificación de la protección postvacunal obtenida por los caprinos a los 30 días de la vacunación. Caacupemí-Azcurra. Caacupé. Cordillera, Paraguay. Año 2016.
Con respecto al 10 % de los animales cuyos títulos eran inferiores a 1:25 Partes Totales o 0,5 UI/mL Se podría considerar como causas de la no respuesta frente a la vacunación, la edad, el estado inmunológico, la vía de administración de la vacuna, entre otras; aunque algunos autores consideran que este suceso es desconocido. Se ha planteado también el hecho de que los niveles bajos o la ausencia de anticuerpos al virus rábico no indican que el vacunado esté desprotegido, teniendo en cuenta que tanto la inmunidad humoral como la celular desempeñan un papel importante para la protección frente a la exposición al virus rábico 15.
Existen muchas razones por las que una vacuna no logra conferir inmunidad a un animal. En algunos casos es realmente ineficaz, ya sea porque contiene una cepa incorrecta de microorganismos, porque los antígenos no son apropiados, porque el método de fabricación destruyó los epítopos protectores, o simplemente porque la vacuna contenía cantidades insuficientes de antígeno. Los problemas de este tipo son raros, y se evitan utilizando vacunas procedentes de laboratorios de prestigio reconocido 13, como la utilizada en este trabajo. Reviste mucha mayor importancia el hecho de que una vacuna eficaz no logre estimular inmunidad protectora, ello puede atribuirse a técnicas deficientes de administración. En una vacuna de microorganismos vivos, éstos pueden morir por errores de almacenamiento, por el uso de antibióticos junto con vacunas bacterianas vivas, por la aplicación de sustancias químicas para esterilizar jeringas o por el uso de una cantidad excesiva de alcohol para limpiar la piel, los animales que reciben las vacunas por vías ordinarias no quedan protegidos 13.
Una segunda categoría de causas de vacunación fallida corresponde a la supresión de la respuesta inmunitaria normal. Por ejemplo, los animales muy parasitados o desnutridos, pueden tener inmunosupresión y no deben vacunarse. Algunas infecciones virales inducen una inmunosupresión profunda. El estrés en general, incluyendo el ocasionado por preñez, temperaturas extremas, fatiga, hace que disminuya la respuesta inmunitaria, probablemente al incrementar la cantidad de esteroides. La causa más importante de este tipo de falla de la vacunación se debe a la presencia de inmunidad pasiva procedente de la madre a las crías de poca edad. En general animales con enfermedad grave o fiebre alta no deben ser vacunados a menos que haya una razón de peso 13.
En el caso de las enfermedades con diseminación ineficiente, como la rabia, una protección del 70% basta para bloquear la transmisión de la enfermedad en una población, y puede ser muy satisfactoria desde el punto de vista de salud pública 16.
En ocasión de una primo vacunación, es decir el primer contacto del animal con una vacuna determinada independientemente de la edad en la que se practique la citada vacunación. A efectos de conseguir una correcta primo vacunación con la mayoría de las vacunas-a excepción de las vivas-, es necesario que el animal reciba dos contactos con el antígeno lo que se denomina “efecto booster” 17.
Tras la segunda inoculación los linfocitos B de memoria, específicamente generados en el primer contacto con el antígeno, se movilizan rápidamente y producen una mayor cantidad de anticuerpos específicos. De aquí la importancia de una segunda inoculación tras la primo vacunación para conseguir una respuesta vacunal más eficaz. Además, la aparición de Ig G es mucho más rápida, acortando el periodo de latencia 17; de ahí la trascendencia de la re-vacunación, producción de anticuerpos en menor tiempo pero con una respuesta más prolongada de los mismos; el objetivo en sí de una vacunación es mantener un nivel de anticuerpos séricos neutralizantes.
CONCLUSIÓN
El presente estudio reporta una tendencia de la capacidad inmunogénica de la vacuna antirrábica cepa PV/BHK en la especie caprina; la respuesta inmunogénica evidenciada tras la utilización del método de seroneutralización en ratón y la posterior medición por el método de Reed y Muench; que indican que el margen de producción de anticuerpos en la primo vacunación es óptima. Por lo tanto se justifica la vacunación del ganado caprino con esta cepa comercial.
Se sugiere dar continuidad a los trabajos de investigación relacionados al tema para conocer el estatus inmunitario en zonas consideradas de riesgo en el país y en especial poblaciones de pequeños rumiantes, considerando el incentivo a la producción de estas especies en estos últimos años.
En base a los resultados obtenidos se recomienda seguir un adecuado esquema de vacunación, dependiendo del tipo de cepa vacunal utilizada, cumpliendo con las instrucciones del fabricante, de conservación y administración adecuada de la vacuna, en lo que compete a inmunización del ganado; que es una de las estrategias dentro de la prevención en cuanto a la estructura epidemiológica de la Rabia, además del control de la población del vector. Igualmente se recomienda seguir las directrices del Servicio Veterinario Oficial en nuestro país.














