Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Compendio de Ciencias Veterinarias
versión On-line ISSN 2226-1761
Compend. cienc. vet vol.6 no.2 San Lorenzo dic. 2016
https://doi.org/10.18004/compend.cienc.vet.2016.06.02.7-12
ARTICULO ORIGINAL
EVALUACIÓN DE COLIFORMES FECALES EN EFLUENTES DE UNA EXPLOTACIÓN PORCINA SOMETIDAS A TRATAMIENTO MEDIANTE BIODIGESTOR TUBULAR CON RÉGIMEN DE CARGA ESTACIONADA
EVALUATION OF FECAL COLIFORMS IN EFFLUENTS OF A SWINE EXPLOITATION SUBJECT TO A TUBULAR BIODIGESTER TREATMENT WITH STACIONARY FREIGHT SYSTEM
*Branda LN1, Ruíz Díaz A2, Ramírez M3, Martínez J3
1Universidad Nacional de Asunción - Centro Multidisciplinario de Investigaciones Tecnológicas - Dirección General de Investigación Científica y Tecnológica - San Lorenzo - Paraguay
2Corporación Avícola S.A. - Sajonia - Asunción - Paraguay
3Universidad Nacional de Asunción - Facultad de Ciencias Veterinarias - Departamento Producción Animal - División Ganado Porcino - San Lorenzo - Paraguay
RESUMEN. El presente trabajo de investigación fue realizado con el objetivo de evaluar el efecto del biodigestor tubular plástico de flujo semi-continuo sobre los parámetros bacteriológicos (contenido de coliformes fecales) en el tratamiento de efluentes en explotación porcina a pequeña escala. Tres puntos dentro del sistema fueron utilizados para la toma de muestras: agua de bebida de los cerdos, purines de cerdo (agua que ingresa al biodigestor), biol (agua que emerge del biodigestor), cada 21 días en un periodo de 70 días, a partir del mes de julio de 2015. Las muestras fueron sometidas a análisis para determinar los coliformes totales y fecales por el método del Número Más Probable (NMP). El estudio reveló que las muestras de agua del bebedero de los animales arrojaron resultados microbiológicos negativos, en tanto que de los purines y el biól obtuvieron resultados positivos. Se pudo constatar la presencia de coliformes de las especies: Proteus spp, Escherichia coli, Klebsiella, Citrobacter freundii. Sin embargo, las muestras obtenidas antes de ingresar al biodigestor (B) con las tomadas luego del proceso anaeróbico (C), mantuvieron la máxima carga bacteriana, no encontrándose diferencias estadísticamente significativas (p>0,05).
Palabras clave: coliformes, biodigestor, efluentes, carga estacionada, porcino
ABSTRACT. This research was conducted in order to evaluate the effect of plastic biodigester semi-continuous flow of bacteriological parameters (coliforms) in the treatment of effluents in small-scale pig farm. Three points within the system were used for sampling: drinking water pigs, pig slurry (water entering the digester), Bio (water that emerges from the digester), every 21 days over a period of 70 days, from July 2015. the samples were subjected to analysis to determine total and fecal coliforms by the method of Most Probable Number (MPN). The study revealed that drinking water samples from animals tested negative microbiological results, while the purines and the biol positive microbiological results were obtained. It was found the presence of coliform species: Proteus spp, Escherichia coli, Klebsiella, Citrobacter freundii. However, samples obtained before entering the digester (B) with then taken anaerobic process (C), maintained the maximum bacterial load, with no statistically significant differences (p> 0.05).
Keywords: coliforms, biodigestor, effluents,stacionary freight, pigs
INTRODUCCIÓN
Una de las principales causas del deterioro del medio ambiente surge a consecuencia de la cantidad de residuos orgánicos acumulados y no tratados en diferentes unidades de cría, constituyéndose en focos de infección, que afectan a la población en general. De allí surge la necesidad de buscar alternativas de reciclaje de los desechos animales, principalmente de los cerdos, que por sus componentes químicos y orgánicos tienen mayor poder contaminante y es difícil de degradar.
La unidad de producción porcina en confinamiento, concentra un gran número de animales en pequeñas áreas causando serios problemas a los productores en cuanto al manejo y la utilización de los efluentes cloacales. Los purines de cerdo corresponden a los desechos líquidos que fluyen de los galpones de cría y que están constituidos por una mezcla de deyecciones sólidas y líquidas, remanentes de alimentos, aguas de lavado y en algunos casos también de escorrentía superficial (1,2).
Un biodigestor o digestor de desechos orgánicos es un contenedor cerrado, hermético e impermeable, dentro del cual se deposita el material orgánico a fermentar con determinada disolución de agua, especificidad digestiva acorde a la temperatura adecuada, requerimiento de tiempo en función a la temperatura de la masa cloacal sometida a tratamiento mediada por microorganismos apuntados al propósito del trabajo (efecto sobre los coliformes) para lograr su descomposición produciéndose biogás y fertilizantes orgánicos. Existen varios tipos de biodigestores, entre los que se destacan aquellos utilizados para realizar investigaciones (3, 4, 5, 6, 7, 8, 9, 10,11).
Se reconocen cuatro grupos de bacterias que poseen diferentes funciones catabólicas sobre el carbono, en el proceso de degradación de la materia orgánica hasta el metano, estos grupos son: - Grupo I: Bacterias hidrolíticas: catabolizan sacáridos, proteínas, lípidos y otros constituyentes menores de la biomasa; - Grupo II: Bacterias acetogénicas, productoras de hidrógeno: catabolizan ciertos ácidos grasos y productos finales neutros. - Grupo III: Bacterias homoacetogénicas: catabolizan compuestos monocarbonatos, y/o hidrolizan compuestos multicarbonados hacia la producción de ácido acético; - Grupo IV: Bacterias metanogénicas: catabolizan acetato, compuestos monocarbonados para producir metano. Se destacan cuatro géneros: Metanobacterium, Methanococcus, Methanospirillum y Methanosarcosina (3, 10, 11).
La temperatura es uno de los factores de mayor relevancia en el proceso anaeróbico, afecta el tiempo de retención para la digestión y degradación del material dentro del digestor. La degradación se incrementa con los aumentos de temperatura ambiental, como así también la producción de gas. Se considera que la temperatura óptima oscila entre 28 a 35°C (12).
Los microorganismos que conforman el grupo de coliformes totales son: Escherichia, Enterobacter, Klebsiella, Serratia, Edwarsiella y Citrobacter y viven como saprófitos independientes o como bacterias intestinales; los coliformes fecales (Escherichia) son de origen intestinal y termotolerantes por su capacidad de soportar temperaturas más elevadas. La capacidad de reproducción de los coliformes fecales fuera del intestino de los animales homeotermos es favorecida por la existencia de condiciones adecuadas de materia orgánica, pH, humedad, etc(4).
Los Streptococcus fecales, actualizados taxonómicamente como Enterococcus incluyen un número de especies que se encuentran en las heces de los humanos y animales de sangre caliente. Esto es muy importante, ya que la contaminación fecal, puede involucrar riesgos sanitarios, por lo que hay que tener en cuenta los microorganismos más abundantes y frecuentes en las heces de los animales, sobre todo en los de producción; vaca, cerdo, oveja, caballo, gallina y pato. En todos ellos se encuentran coliformes y Streptococcus fecales, aunque son más los Streptococcus fecales (4).
A nivel nacional existen pocos proyectos de utilización de esta biotecnología, debido al desconocimiento de los productores, principalmente de los pequeños productores pecuarios y la escasa información local. El objetivo general del trabajo fue evaluar el efecto del biodigestor tubular plástico de flujo semi-continuo sobre los parámetros bacteriológicos (contenido de coliformes) en el tratamiento de efluentes en explotación porcina a pequeña escala.
MATERIALES Y MÉTODOS
La población estuvo conformada por: agua (A) (proveniente de la fuente utilizada en la Sección Comercialización e Industrialización Porcina), afluente o purín (B) (entrada) y efluente o biol (C) (salida) del proceso de biodigestión, de la unidad productora de biogás, pertenecientes a la Sección Comercialización e Industrialización de Porcinos.
Al inicio del trabajo de investigación se realizaron tareas a fin de poner en condiciones el biodigestor tubular plástico de flujo semi-continuo laminar, considerando la importancia de mantener la temperatura adecuada en función a las necesidades de los microorganismos metanogénicos, adecuando la media sombra y minimizando grandes variaciones de temperatura.
La carga para el tratamiento anaeróbico fue realizado en forma manual, con un recipiente de 20 L, en una relación 4:1, (4 líquido, 1 materia fecal) (12).
Las muestras fueron obtenidas cada 21 días durante un periodo de 70 días, teniendo en cuenta todas las medidas de bioseguridad. Se colectaron tres muestras de 100 mL en frascos estériles, identificadas y refrigeradas fueron trasladadas al laboratorio de Microbiología e Inmunología de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Asunción, para pruebas bacteriológicas.
La determinación de coliformes totales y fecales se realizó mediante la técnica del NMP que consta de una prueba presuntiva, una confirmativa y una prueba completa. Se prepararon 3 series de tubos: la primera de 5 tubos conteniendo 10 mL de caldo Lauril sulfato de doble concentración; la segunda de 5 tubos conteniendo 5 mL de caldo Lauril sulfato de simple concentración y por último la tercera serie de 5 tubos conteniendo 5 mL de caldo Lauril sulfato de simple concentración. A los tubos de las 3 series se les colocó una campanita de Durham para observar la producción de gas.
La muestra original se cultivó de la siguiente forma: 10 mL en la primera serie de tubos; 1 mL en cada uno de los cinco tubos de simple concentración (segunda serie de tubos), y por último se sembró 0,1 mL en cada uno de los cinco tubos de simple concentración (tercera serie de tubos). Posteriormente las 3 series de tubos fueron llevados a la incubadora a 37 °C durante 24 a 48 h.
A las 24 h se realizó la primera lectura registrando el número de tubos positivos que mostraron presencia de gas en la campanita de Durham. Se volvió a incubar los tubos negativos (Prueba presuntiva). Luego de 48 h de realizar la lectura y calcular el número presuntivo de coliformes totales en 100 mL de lactosa verde brillante bilis, se incubó a 37 °C por cada 24 a 48 h para la confirmación de coliformes totales. De los tubos positivos de la prueba presuntiva, se sembró con ansa en caldo Escherichia Coli (EC) y se incubó a 44,5° C por 24 a 48 h en baño maría para la confirmación de coliformes fecales en 100 mL de muestra (Prueba confirmatoria).
Se realizó una colonia típica en agar nutritivo y se incubó por 24 h a 37°C. A estas colonias se les practicó pruebas bioquímicas confirmatorias denominadas IMVIC (indol, rojo metilo, Voges Proskauer, citrato). -Indol: se tomó la colonia con ansa en punta y se colocó en un tubo con medio SIM por punción y se llevó a la incubadora a 37 °C por 24 h. A las 24 h se colocó el reactivo de Ehrlich y se realizó la lectura. -Rojo metilo: se tomó la colonia con ansa en punta y se colocó en tubos con caldo RM-VP, posteriormente se llevó a la incubadora a 37 °C por 48 h. A las 48 h se le agregó el reactivo indicador de pH rojo metilo y se realizó la lectura. -Voges Proskauer: se tomó la colonia con ansa en punta y se colocó en tubos con caldo RMVP y se incubo a 37 °C por 48 h. Posteriormente a ese tiempo se agregó el reactivo VP de Barritt y se realizó la lectura.
-Citrato: se tomó la colonia con ansa en punta y se inoculó en un tubo con citrato en pico flauta, por punción y estría en la superficie. Se incubó a 37 °C por 24 h y se realizó la lectura.
-TSI (Tres azucares, SH2, Hierro): se tomó con ansa en punta la colonia y se inoculó por punción y estría en un tubo con TSI. Se incubó por 24 h a 37 °C y se realizó la lectura.
-LIA (lisina descarboxilasa): se tomó con ansa en punta la colonia y se inoculó por punción y estría en un tubo con LIA en pico de flauta y se incubó a 37 °C por 24 h. Se realizó la lectura (Prueba completa).
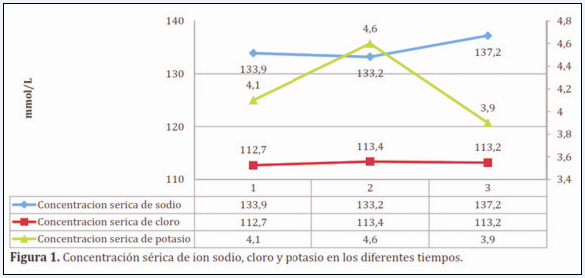
Es importante destacar que para la medición de los parámetros bacteriológicos, fue empleada la tabla del Número Más Probable (NMP), en la cual se indico el NMP de microorganismos presentes en 100 ml de las muestras obtenidas. Los resultados fueron interpretados como positivos, aquellos tubos en donde se observó turbidez (crecimiento) y producción de gas después de un período de incubación de 24 a 48 horas. Fueron considerados negativos aquellos tubos en los que no se observó turbidez o producción de gas. Para la determinación de significancia se utilizó Infostat versión estudiantil (Figura 1).
RESULTADOS Y DISCUSIÓN
El promedio de temperatura ambiental desde la carga del biodigestor al día de la primera obtención de muestra fue de 21.5° C, 23.8°C en la segunda y 30,4°C el último día de la recolección de muestras.
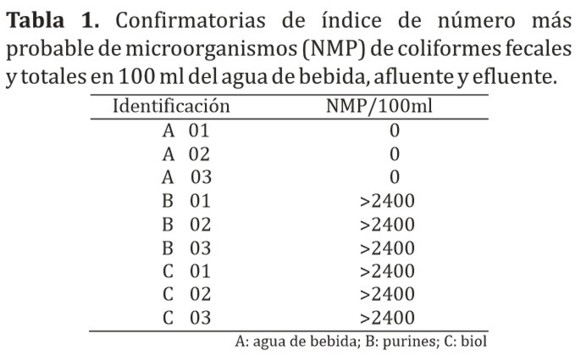
La Tabla 1 muestra las confirmatorias de índice de NMP coliformes fecales y totales en 100 ml; observándose que en las tres muestras correspondientes al agua de bebida de los cerdos (A) la presencia de colonias de coliformes totales y fecales resultaron negativas, sin embargo en las tres muestras correspondientes a purines de cerdos (B) y biól (C) la presencia fue positiva, expresando el máximo valor posible de la tabla, NMP: >2400 NMP/100 ml de muestras.
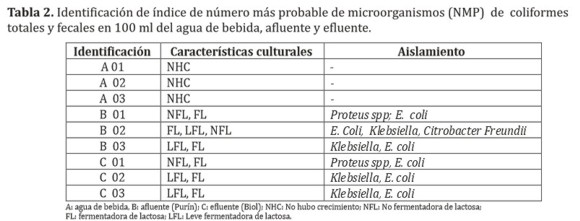
Las colonias de coliformes fecales y totales aisladas de las muestras positivas fueron identificadas por medio de las pruebas bioquímicas INVIC, TSI y LIA. Las especies encontradas tanto en los purines como en el biol fueron: Proteus spp, Escherichia coli, Klebsiella, Citrobacter freundii. Los resultados mostraron la ausencia de colonias en el agua de bebida (A), indicando que el agua no presentó contaminación bacteriana reciente, pues su presencia constituiría un indicador de degradación de los cuerpos de agua y generaría infecciones oportunistas en el tracto respiratorio superior e inferior; además de bacteremia, infecciones de piel y tejidos blandos, enfermedad diarreica aguda y otras enfermedades severas en el ser humano (13).
En la Tabla 2, se muestra la identificación de índice de NMP de coliformes totales y fecales en 100 mL de agua de bebida (A), afluente (B) y efluente (C) de porcino.
Teniendo en cuenta estos resultados, no se encontró diferencia estadísticamente significativa entre las muestras obtenidas antes de ingresar al biodigestor (B) con las obtenidas luego del proceso anaeróbico (C) (p>0,05), manteniéndose la máxima carga bacteriana, por lo tanto según las directrices de la Organización Mundial de la Salud (OMS) sobre calidad microbiológica de aguas residuales para irrigación no se recomienda la utilización de dichos efluentes, (Ver Tabla 1) que establece un máximo de 1000 coliformes fecales en 100 ml de muestra para irrigación en cultivos probablemente de consumo crudo, cultivos industriales, forrajes, pastos y árboles (1).
Teniendo en cuenta estos resultados, no se encontró diferencia significativa entre las muestras tomadas antes de ingresar al biodigestor (B) con las tomadas luego del proceso anaeróbico (C) (p>0,05), manteniéndose la máxima carga bacteriana, por lo tanto según las directrices de la Organización Mundial de la Salud (OMS) sobre calidad microbiológica de aguas residuales para irrigación no se recomienda la utilización de dichos efluentes, (Ver tabla 1) que establece un máximo de 1000 coliformes fecales en 100 ml de muestra para irrigación en cultivos probablemente de consumo crudo, cultivos industriales, forrajes, pastos y árboles (1).
En contra partida, las normas nacionales dictadas por la Secretaría del Ambiente dependiendo de la utilización que se le dé al agua, establece (para irrigación de hortalizas o plantas fructíferas que se manejan en el suelo y que son consumidas crudas, sin remoción de las cáscaras o película) un límite de 200 coliformes fecales por 100 mL en 80% de por lo menos 5 muestras mensuales. Para irrigación de hortalizas que se consumen cocidas y plantas fructíferas con remoción de cáscara y para la utilización en la cría natural y/o intensiva (acuicultura) de especies destinadas para la alimentación humana no deberá exceder el límite de 1000 coliformes por 100 mL en 80% o más de por lo menos 5 muestras mensuales. Sin embargo para la irrigación arbórea, jardín y forrajeras establece hasta 4000 coliformes por 100 mL en 80% de las muestras. La Secretaría del Ambiente en su articulado establece que los efluentes de cualquier fuente poluidora solamente podrán ser lanzados directa o indirectamente a los cuerpos de aguas si presenta coliformes totales hasta 4000 NPM/100 ml(14).
Es importante destacar que la temperatura ambiental registrada durante la realización del trabajo, se presentó por debajo de los valores mínimos para la digestión de los efluentes tratados, como así también la media sombra del biodigestor que impedía la penetración directa de los rayos solares. Las bajas temperaturas no permiten un buen desarrollo de los microorganismos metanogénicos y por lo tanto se necesita mayor tiempo para la digestión y depuración.
En referencia a la reducción de enterobacterias existentes en los efluentes cloacales del ganado porcino, un estudio realizado en la Granja Didáctica Experimental de la Facultad de Ciencias Veterinarias â U.N.A. en el año 2013 determinó que posterior al tratamiento anaeróbico existió reducción de enterobacterias, para ello se obtuvieron tres muestras antes y tres muestras después del tratamiento anaeróbico con el fin de evaluar la reducción de enterobacterias en los efluentes cloacales, se analizó la presencia de coliformes fecales y totales por la técnica del NMP, se realizaron las pruebas bioquímicas al crecimiento de las colonias identificándose a la E. Coli, Enterobacter y Klebsiella antes del tratamiento y posterior al tratamiento solo se identificó Enterobacter y Klebsiella, eliminándose por completo la E. coli (15).
CONCLUSIÓN
La totalidad de las muestras correspondientes a agua de bebida de los cerdos arrojaron resultados negativos, sin embargo los purines así como el biol arrojaron valores positivos siendo NMP >2400. Se pudo constatar a través de las pruebas bioquímicas la presencia de coliformes de las especies Proteus spp, Escherichia coli, Klebsiella, Citrobacter freundii. Teniendo en cuenta los resultados obtenidos y las normativas internacionales respecto a las normativas de la Secretaría del Ambiente, se sugiere actualizar la resolución 222/02, por la cual se establece el padrón de las aguas en el territorio nacional, así mismo a los organismos competentes controlar la utilización de biol como fertilizante, como también para su vertido directo en cuerpos hídricos. A su vez se sugiere dar continuidad a los trabajos de investigación similares considerando las condiciones climáticas, principalmente lo referente a temperatura ambiental.
BIBLIOGRAFÍA
1. Sancha A. 2005. "Criterios de calidad de aguas o efluentes tratados para uso en riego". (Internet). Santiago de Chile: Universidad de Chile, Departamento de Ingeniería Civil, División de Recursos Hídricos y Medio Ambiente; 2005. (Citado el 12 de abril de 2014). Disponible en: http://www.bibliotecadigital.sag.gob.cl/documentos/informe_final.pdf [ Links ]
2. Instituto Autónomo de Investigaciones Agropecuarias. Unidad de Documentación e Información Técnica Agropecuaria Agricultura orgánica. Quito- Ecuador: INIAP ; 2002. 12 p. [ Links ]
3. Duhart F. El biogás puede mejorar la sustentabilidad del agro en América Latina. (Internet). Santiago de Chile, Chile: FAO; 2013. (Citado el 17 de abril de 2014). Disponible en: www.scidev.net/america [ Links ]
4. Aparcana S. "Aprovechamiento energético de los residuos de un matadero frigorífico industrial y la biomasa regional en Arequipa, Perú bajo la aplicación de la gestión de flujos de materiales y energía". Arequipa, Perú: (S.n.); 2005. 75 p. [ Links ]
5. Ríos M. "Generación y utilización del biogás: experiencias en Alemania y el potencial en Paraguay" (Internet). Asunción, Paraguay: MOPC, VMME, GIZ; 2012. (Citado el 18 de abril de 2014). Disponible en: www.ssme.gov.py [ Links ]
6. Deublein D, Steinhauser A. Biogas from waste and renowable resources: an introduction. Weinhim: Wiley-VCH editorsVerlagGmbH ; 2008. 447 p. [ Links ]
7. Sathianathan MA, Barnett, A, Pyle L, Subramanian SK. Biogas achievement and ahallenges: the biogas technology in the third world, a multidisciplinary review. New Delhi, India: Association of Voluntary Agencies and Rural Development; 1975. 254 p. [ Links ]
8. Mccabe BJ, Eckenfelder NW. "Biological Treatment of Industrial Wastes" En: Vol. II "Anaerobic Digestion and Solids-Liquid Separation" New York: Reinhold Publishing; 1957. 330 p. [ Links ]
9. Campos AE. "Optimización de la digestión anaerobia de purines de cerdos mediante codigestión con residuos orgánicos de la industria agropecuaria" (Tesis Doctoral). Barcelona: Laboratorio de Ingeniería Ambiental, Dpto. de Medio Ambiente y Ciencias del Suelo de la Universidad de Lérida; 2001. 394 p. [ Links ]
10. Garcete A. Biogás: alternativa válida de producción (Internet). Hernandarias, Paraguay: Itaipú. (Citado el 18 de abril de 2014); 2013. Disponible en: http://www.itaipu.gov.py/es/sala-de-prensa/noticia/biogas [ Links ]
11. Duarte A. Proyecto "Mejoramiento de las bases de datos para una política energética sustentable en Paraguay" (Internet). Asunción, Paraguay: MOPC, VMME, GIZ; 2012. (Citado el 18 de abril de 2014). Disponible en: www.ssme.gov.py [ Links ]
12. Guevara Vera, A. Fundamentos básicos para el diseño de biodigestores anaeróbicos rurales. (en línea). Lima, Perú . OPS. 1996. (Citado el 8 de abril de 2014). Disponible en: www.bvsde.paho.org/bvsacd [ Links ]
13. Arcos M, Ávila S, Estupiñan S, Gómez A. Indicadores microbiológicos de contaminación del agua. Cundinamarca: Universidad Colegio Mayor de Cundinamarca; 2005. 311 p. [ Links ]
14. Secretaría del Ambiente, Paraguay. Resolución 222/02 Por la cual se establece el padrón de las aguas en el territorio Nacional. (Internet). Asunción: SEAM; 2005. (Citado el 13 de septiembre de 2014). Disponible en: http://www.seam.gov.py/resoluciones. [ Links ]
15. Méndez A. Evaluación de la reducción de enterobacterias existentes en los efluentes cloacales del ganado porcino de la granja experimental de la Facultad de Ciencias Veterinarias- UNA por medio de la fermentación anaeróbica. (Tesis de Grado). San Lorenzo, Paraguay: FCV, UNA; 2013. [ Links ]
*Dirección para correspondencia: Prof. Dra. Lourdes Branda - Universidad Nacional de Asunción - Centro Multidisciplinario de Investigaciones Tecnológicas - Dirección General de Investigación Científica y Tecnológica â San Lorenzo â Paraguay - Casilla de Correo N° 1061 - Ruta Mcal. Estigarribia Km 10,5 - Campus Universitario - San Lorenzo- Paraguay.
E-Mail:lbranda@rec.una.py