Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Compendio de Ciencias Veterinarias
On-line version ISSN 2226-1761
Compend. cienc. vet vol.5 no.2 San Lorenzo Dec. 2015
https://doi.org/10.18004/compend.cienc.vet.2015.05.02.38-46
ARTICULO DE REVISIÓN
SÍNDROME REPRODUCTIVO Y RESPIRATORIO PORCINO: EPIDEMIOLOGÍA, SINTOMAS Y LESIONES
PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME (PRRS): EPIDEMIOLOGY, SYMPTOMS AND LESIONS
*Amarilla S1, Avalos A1, Suarez M1, Marecos E1, González E1
1Departamento de Ciencias Patológicas - Facultad de Ciencias Veterinarias- Universidad Nacional de Asunción – San Lorenzo – Paraguay.
RESUMEN.
El virus del síndrome reproductivo y respiratorio porcino (PRRSV) es el causante del síndrome reproductivo y respiratorio porcino (PRRS), una enfermedad que a pesar de los esfuerzos realizados por controlarla y disminuir su impacto económico, sigue siendo considerada una de las enfermedades más importantes que afectan al sector porcino. Los dos genotipos del PRRSV, el Europeo o tipo 1 (PRRSV-1) y Norteamericano o tipo 2 (PRRSV-2), presentan entre sí una elevada variabilidad genética, biológica e incluso antigénica. Estas diferencias junto con las elevadas pérdidas económicas que ocasionan en la producción porcina justifican la realización de estudios que tengan como objetivo aclarar los mecanismos patogénicos desencadenados por las diferentes cepas de este virus. En la actualidad en el Paraguay no se han reportado casos de PRRS, no obstante es importante considerarla debido al aumento de la importación de animales y semen para el mejoramiento genético, desde países con alta prevalencia. Esta revisión tiene como objetivo dar a conocer las características más importantes del PRRSV y los aspectos epidemiológicos, síntomas y lesiones del PRRS.
Palabras clave: virus del síndrome reproductivo y respiratorio porcino (PRRSV), síndrome reproductivo y respiratorio porcino (PRRS), cerdos
ABSTRACT.
Porcine reproductive and respiratory syndrome virus (PRRSV) is the causative agent of a swine disease, named as porcine reproductive and respiratory syndrome (PRRS). Despite efforts in controlling it and reducing its economic impact, PRRS is still considered as one of the most important diseases affecting the swine industry. PRRSV is divided into two distinct genotypes, European genotype or Type 1 (PRRSV-1) and North American genotype or Type 2 (PRRSV-2), with high biological, genetic and antigenic diversity among both genotypes. The wide biological, genetic and antigenic diversity of the different PRRSV strains, as well as the high economic losses to the pig industry associated with this disease justify studies that aim to clarify the pathogenic mechanisms triggered by the different virus strains. At present, no cases of PRRS have been reported in Paraguay, however it is important to consider it because of the increase in imported animals and semen from breeding countries of high-prevalence. This review aims to present the most important features of PRRSV in terms of epidemiology, symptoms and lesions.
Keywords: porcine reproductive and respiratory syndrome virus (PRRSV), porcine reproductive and respiratory syndrome (PRRS), pig.
INTRODUCCIÓN
Desde 1987/1988 en Carolina del Norte, Minnesota y Iowa se produjeron brotes de fallos reproductivos y respiratorios en rebaños de cerdos, designándole a esta enfermedad como "Enfermedad misteriosa porcina"; para 1990, la misma había sido identificada en 11 estados de los Estados Unidos, 2 provincias de Canadá y en Europa, específicamente en Münster (Alemania) fue reportada a finales de este año, extendiéndose también rápidamente por otros países europeos como Holanda, Francia, Bélgica y Dinamarca, así como Inglaterra (1).
El primer reporte del aislamiento fue hecho por Wensvoort et al (1991), a partir de muestras provenientes de cerdos infectados a campo en Lelystad-Holanda, denominándose a esta cepa Lelystad virus (LV). Seis meses después, Collins et al (1993), reportaron el primer aislamiento del virus del síndrome de infertilidad y respiratorio porcino (SIRS) en los Estados Unidos, que cumplió los postulados de Koch, llamándola a esta tipo Americano (VR-2332) y Benfield et al (1992), describieron las características de dicha cepa. Varios nombres fueron designados en los diferentes países del mundo, pero fue en el Primer Simposio Internacional sobre SIRS, celebrado en St. Paul, Minnesota, EE.UU., donde se decidió llamarle "Síndrome reproductivo y respiratorio porcino" (PRRS) y a su agente causal "Virus del síndrome reproductivo y respiratorio porcino" (PRRSV) (2,3,4,5).
Ambos aislados del PRRSV (Europeos y Norte Americano) a pesar de compartir similitud con los virus que conforman la Familia Arteriviridae, muestran una lejana relación filogenética y existen evidencias claras de que el aislado Norte Americano induce trastornos respiratorios más severos que el Europeo, pero sorprendentemente, a pesar de estas diferencias, los aislados del PRRS aparecieron casi al mismo tiempo en diferentes continentes, con las mismas características clínicas y epidemiológicas (6).
En la actualidad está claro que todos los aislados Europeos están estrechamente relacionados entre sí, al igual que los aislados Norte Americanos, pero no existe relación entre ellos; considerándose dos genotipos de PRRSV biológica y genéticamente diferentes conocidas como: Europea o Tipo 1 y Norte Americana o Tipo 2; y considerada una enfermedad endémica de distribución mundial (7,8).
Después de aproximadamente 27 años de estudio del PRRSV aún siguen siendo frustrantes los esfuerzos para eliminarlo de los rebaños; este patógeno no solo tiene la capacidad intrínseca de adaptarse y persistir, sino también de evolucionar, causando devastadores daños económicos en granjas de cerdos sobre todo en los últimos 5 años, debido a la aparición continua de cepas cada vez más divergentes y virulentas como por ejemplo la pandemia en China en el año 2006 (6).
La amplia variabilidad biológica, genética y antigénica de los diferentes aislados del PRRSV, así como las elevadas pérdidas económicas que ocasiona en el sector porcino, justifican la realización en la actualidad de estudios específicos sobre esta patología que tengan como objetivo aclarar los mecanismos patológicos que producen los diferentes aislados, a fin de controlar y en lo posible erradicar la enfermedad con todas las estrategias biológicas y no biológicas disponibles al alcance de los productores.
II. Virus del síndrome reproductivo y respiratorio porcino (PRRSV)
El virus del síndrome reproductivo y respiratorio porcino es un virus ARN, de cadena simple, de sentido positivo y envuelto, con tamaño aproximado de entre 50-65 nanómetros; pertenece al orden Nidovirales y familia Arteriviridae, la cual se compone de otros 4 virus más que comparten características genéticas y biológicas similares (6).
Los macrófagos alveolares porcinos (del inglés porcine alveolar macrophage, PAM) son hasta la fecha considerados las células diana del PRRSV, no obstante, se ha reportado replicación del virus en otros macrófagos residentes del pulmón (macrófagos intersticiales e intravasculares), subpoblaciones de macrófagos de diferentes órganos linfoides (tonsila, nódulos linfáticos y bazo), macrófagos intravasculares de la placenta, cordón umbilical y células dendríticas. Recientemente se ha descrito un cierto tropismo de cepas altamente virulentas como el aislado JXwn06-81c a células epiteliales (9).
La interacción virus/célula aun no está completamente definida, aunque la mayoría de los estudios coinciden que el CD163 podría ser el receptor primario del PRRSV y determinador de la susceptibilidad de las células al virus (10) y la sialoadhesin puede funcionar como una proteína accesoria (11).
En resumen, la replicación del PRRSV vincula estrechamente tres características claves:
A) Re-ordenamiento de las membranas del huésped para estabilizar el complejo de replicación viral (RC),
B) La síntesis y expresión del gRNA y C) La transcripción de sgRNA para la expresión eficiente de las proteínas estructurales (6).
Como se mencionó anteriormente, se reconocen dos genotipos principales del PRRSV. El genotipo Europeo o tipo 1 (PRRSV-1) representado por la cepa Lelystad y el genotipo Norte Americano o tipo 2 (PRRSV-2), cuyo prototipo es el aislado ATCC-VR-2332. Ambos genotipos solo comparten entre un 55% a 70% de los nucleótidos y el 50% a 80% de los aminoácidos (12).
Inicialmente se creía que todas las cepas del genotipo Europeo eran genéticamente homólogas, pero en la actualidad estudios genéticos en base a los análisis de la secuencia del ORF5 y OFR7 justifican la división del PRRSV-1 en cuatro subtipos genéticos bien diferenciados: subtipo 1 o Pan-Europeo, subtipos 2, 3 y 4 de Europea del Este. Con relación al genotipo Norte Americano se describen nueve linajes basados en el análisis filogenético de la secuencia del ORF5. Es importante destacar que esta construcción filogenética no representa la diversidad completa del genotipo Norte Americano, debido a la falta de información con relación a la secuencia Canadiense (8,13).
Un reflejo de la diversidad no solo genética sino también fenotípica (patogenicidad y virulencia) del PRRSV es la aparición de brotes atípicos agudos. Merece la pena mencionar en este punto que esta variabilidad es un problema tanto en el diagnóstico serológico como molecular del virus (14).
III. Síndrome reproductivo y respiratorio porcino (PRRS)
1. Epidemiología.
Actualmente el PRRS se considera una enfermedad endémica con distribución mundial, a pesar que aún no ha sido reportada en varios países de Latinoamérica y África; y en países como Finlandia, Bulgaria y Australia (13). El PRRS presenta un comportamiento epidémico asociado con la forma reproductiva de la enfermedad y un comportamiento endémico relacionado con fallo en la respuesta inmunológica y presentación respiratoria (15).
La transmisión vertical fue reportada poco tiempo después de la aparición de la enfermedad y a pesar que la misma es más marcada al final de la gestación, también es posible al comienzo de la misma (16). Con relación a la transmisión horizontal son varios los mecanismos propuestos para la propagación del PRRSV como: vía aerógena o transmisión mediante el aire, mediante vectores, como insectos (Aedes vexans y Musca domestica) (17) y por contacto indirecto a través de fómites contaminados (vestuario, agujas, vehículos de transporte, botas, guantes, equipos, visitantes etc.), que cumplen un rol importante en la transmisión de la enfermedad (18,19). El transporte de animales de una granja infectada a otra susceptible por un vehículo común, las pajuelas de semen y mecanismos iatrogénicos, así como la utilización de vacuna con virus vivo atenuado y el indiscriminado uso de agujas contaminadas son tambien agentes transmisores (18).
El mecanismo más ampliamente reportado del PRRS es la directa o comúnmente llamada por contacto directo de animales infectados con animales sanos a través de sangre, aerosoles, excreciones (orina, semen y heces) y secreciones (saliva, leche o calostro y secreciones nasales) de cerdos infectados. Aunque aún contradictorios los estudios basados en la transmisión oral del PRRSV; los análisis de músculos de cerdos infectados, sugieren una vía de transmisión alternativa (20).
Se postula que en un brote de la enfermedad es más eficiente la transmisión del virus a amplias zonas geográficas (13) y que el uso adecuado y controlado de las posibles fuentes del PRRSV que actúan como origen de transmisión junto con la implementación de estrategias de manejo, reducen el nivel de contaminación del virus y su diseminación mecánica (19).
El PRRSV no es un virus resistente a condiciones desfavorables de temperatura, pH y exposición a ciertos detergentes; aunque soporta bajas temperaturas durante largos periodos de tiempo y es estable entre pH 6.5 – 7.5 (4,21).
2. Patogenia
En el transcurso de la infección con PRRSV se pueden establecer dos fases, una infección aguda, caracterizada por una viremia de 9 a 15 días, que puede alcanzar el mes en animales adultos y en cerdos jóvenes el promedio es entre 28-35 días, puediendo llegar hasta 3 meses, con pico de replicación vírica más o menos conservada entre cepas a nivel pulmonar durante la primera semana de infección; y una infección crónica, caracterizada por ausencia de viremia, aunque el antígeno vírico puede estar persistente y ser aislado de los órganos linfoides secundarios incluso hasta 300 días después de la infección (22).
El PRRSV ingresa al organismo del cerdo comúnmente por la vía oro-nasal, desde donde el virus alcanza los pulmones e interactúa con los PAMs y en menor medida con los macrófagos septales. El proceso molecular de replicación es alta y en tan solo 6 a 12 hs post-infección es posible detectar antígeno vírico en el citoplasma de las células infectadas (23).
Diversos estudios experimentales coinciden con que los picos de replicación viral se observan entre los 7 y 14 días post-inoculación (DPI) y postulan que durante la replicación, las células son conducidas hacia un estadio de anti-apoptosis, de forma que cuando la replicación ha culminado la célula entra en apoptosis(23). De esta manera la liberación del PRRSV se produce mediante la lisis de la célula infectada (24). Este proceso de lisis, junto con los fenómenos directos e indirectos de apoptosis y la liberación de diferentes tipos de citocinas pro-inflamatorias (IL-1a y ß, TNF-a, IL-6) y anti-inflamatorias (IL-10, IL-12, IFN-a e IFN-?) por parte de los macrófagos infectados y no infectados, linfocitos y neutrófilos, cumplen un papel relevante en la patogénesis y establecimiento de las lesiones en la enfermedad (23). Como consecuencia de los fenómenos descritos, infecciones con PRRSV incrementan la susceptibilidad de los animales a un amplio rango de patógenos durante un período aproximado de hasta 4 semanas (15), generándose severos signos clínicos y daños tisulares (25).
Una vez liberado el virus de los PAMs se disemina a través de la vía hematógena en su forma libre (12 hs post-infección) y asociada a monocitos y linfocitos (1 día post-infección); se describe una posible diseminación por vía linfática, principalmente a tonsilas, nódulos linfáticos y bazo. Varios estudios sugieren al pulmón como sitio principal de persistencia del virus y por ende fuente de viremia sobre todo en animales jóvenes, otros resultados demuestran que los nódulos linfáticos son otro de los órganos preferentes de replicación y liberación al torrente circulatorio del PRRSV de manera constante y, este hecho, explicaría la viremia prolongada de la enfermedad. El virus se puede recuperar de varios órganos durante las primeras 2 semanas post-infección y solamente algunos órganos (pulmones, suero, amígdalas y nódulos linfáticos) son positivos a partir de la segunda semana (25-28).
2.1 PRRS como enfermedad respiratoria.
Se ha descrito que la presencia del virus en la mucosa nasal destruye el sistema mucociliar, aunque de forma transitoria produce la destrucción masiva de PAMs en la primera semana post-infección e induce apoptosis o necrosis de linfocitos (25), en consecuencia predispone a la invasión de agentes secundarios por comprometimiento de las barreras de defensa del sistema respiratorio (29).
Varios estudios han revelado el papel relevante de las citocinas como mediadores de enfermedad respiratoria viral en cerdos y aunque el PRRSV no se comporta como un "clásico" virus respiratorio es capaz de inducir la producción de citocinas pro-inflamatorias y anti-inflamatorias principalmente en los macrófagos septales pulmonares de los animales infectados que mediarán los fenómenos inflamatorios locales y posiblemente generales dando lugar a la lesión pulmonar (25, 28, 30).
2.2 PRRS como enfermedad reproductiva.
Durante la diseminación orgánica el PRRSV accede al aparato reproductor. En el verraco la eliminación del virus es de manera intermitente a través del semen y en muy bajas cantidades, por lo que en condiciones de campo parece difícil alcanzar la dosis infectiva de transmisión (31). En las cerdas las consecuencias de la infección dependerán en gran medida del momento reproductivo (16). La importancia de la infección al comienzo de la gestación (día 1 al 21 de gestación) es relativamente baja en comparación con las afectadas al final de la misma (85 días de gestación en adelante); debido a la necesidad que se produzca la placentación para que el virus pueda infectar a los embriones y fetos en desarrollo (31).
3. Presentación clínica y signos clínicos
La presentación clínica y los signos clínicos varían considerablemente entre los rebaños, dependiendo del tipo de cepa, el estado inmune y susceptibilidad del huésped, la exposición a lipopolisacáridos , infecciones concurrentes y otros factores de manejo (flujo de cerdos, diseño de edificios, regulación de la temperatura, etc.) (32).
En la infección aguda del PRRS, clínicamente en la primera fase de aproximadamente 2 semanas de duración, desde el 5 al 75% de los animales de todas las edades presentan anorexia y letargo como consecuencia de la viremia aguda. Se inicia en una o más etapas de la producción y en solo 3 a 7 días se puede propagar en toda la granja. Clínicamente los animales afectados pueden exhibir linfopenia, hipertermia (39-41°C de temperatura rectal), hiperpnea, disnea, e hiperemia transitoria cutánea, "manchas" o cianosis en las extremidades. La segunda fase puede prolongarse de 1 a 4 meses, caracterizada por fallo reproductivo, principalmente en las cerdas que eran virémicas en su tercer trimestre de gestación, con alta mortalidad pre-destete (32).
Los verracos pueden ser asintomáticos durante la enfermedad aguda, o carecer de líbido con reducción variable de la calidad del semen aunque con diferencias individuales muy marcadas. Entre las alteraciones descritas entre las 2 a 10 semanas posteriores a la infección están la disminución de la motilidad, aumento de las morfo-anomalías (gotas citoplasmáticas proximales y distales) y alteraciones del acrosoma. En cambio, las cerdas (aunque no todas las afectadas presentan enfermedad clínica en fase aguda) pueden perder entre el 1 al 3% de los lechones cuando se infectan entre los 21 a 109 días de gestación (abortos abiertos), posterior a esta fase presentan estros irregulares y bajas tasas de concepción. La mortalidad en cerdas es baja (1-4%) y puede observarse de manera irregular agalaxia, falta de coordinación, y/o una exacerbación dramática de enfermedades endémicas de la granja como la sarna sarcóptica, rinitis atrófica, o cistitis/pielonefritis (32).
Normalmente entre el 5 al 80% de las cerdas de ciclo cerrado de 100-118 días de gestación presentan camadas compuestas por lechones normales, débiles, de tamaño variable y muertos durante el parto, fetos autolisados y/o total o parcialmente momificados. Los cerdos nacidos muertos varían desde el 0 al 100% de cada camada afectada y del 7 al 35% del total de los lechones nacidos en un grupo de parto (32).
La categoría con síntomas clínicos más variados son los lechones infectados en el útero o aquellos infectados pocas horas o días después de su nacimiento; estos presentan una sintomatología variable, desde una severa disnea y taquipnea, hasta edema periocular y palpebral, conjuntivitis, inapetencia, fiebre, eritema cutáneo, diarrea y signos nerviosos. La mortalidad es de aproximadamente 100% y en etapas de pre-destete puede ser hasta del 60%. En los cerdos en fase de transición y cebo, la infección aguda se caracteriza por una marcada hiperpnea y/o disnea sin toser como resultado de la neumonitis, acompañada de anorexia, letargia, hiperemia cutánea, pelo áspero y reducción de la ganancia media diaria, lo que genera grupos irregulares (32).
En condiciones de campo las infecciones de PRRS suelen ir acompañadas de infecciones secundarias, se reportan mayor incidencia habitual de enfermedades endémicas en la granja con mortalidad de entre el 12 al 20%. Las enfermedades más frecuentes incluyen meningitis estreptocócica, salmonelosis septicémica, enfermedad de Glasser, dermatitis exudativa, sarna sarcóptica, bronconeumonía bacteriana, gripe porcina, circovirus porcino tipo 2, coronavirus respiratorio porcino y Aujeszky. Las infecciones crónicas del PRRS ocurren en casi todos los casos y más a menudo es visto como brotes irregulares u ocasionales del PRRS, típicos agudos en cerdos susceptibles (cerdas jóvenes o verracos de recambio) en etapas finales de crecimiento (32).
4. Lesiones.
Las lesiones macroscópicas y microscópicas se observan constantemente entre los 4-28 días post-infección en pulmones y nódulos linfáticos, donde la replicación viral es más frecuente; pero co-existen lesiones microscópicas en otros órganos (riñón, cerebro, corazón) donde existe menor cantidad de virus entre los 7 a 14 días post-infección.
Se reportan de manera esporádica lesiones microscópicas en útero de hembras con fallo reproductivo y en testículos de verracos infectados. La intensidad y distribución de las lesiones dependen de la cepa, del huésped (edad, estado inmunológico y factores genéticos) y factores ambientales (7,25,26,28,29).
4.1 Aparato respiratorio
La gravedad y distribución de las lesiones pulmonares varían considerablemente, observándose pulmones aparentemente normales hasta neumonía leve a grave con distribución multifocal a difusa; enmascaradas por lesiones de infecciones secundarias o concomitantes por otros virus y/o bacterias dando lugar al complejo respiratorio porcino (7,25,28,30).
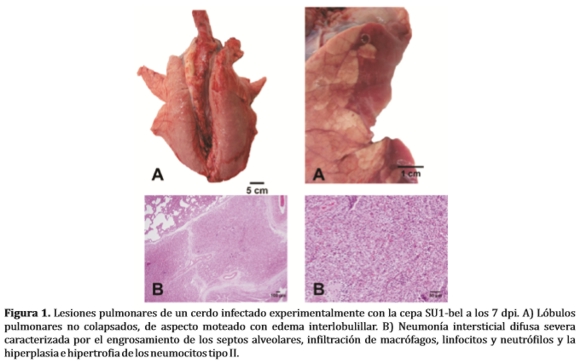
La observación de neumonía intersticial asociada con el aumento de tamaño de los nódulos linfáticos mediastínicos son consideradas lesiones compatibles con PRRS, aunque no confirman la enfermedad, debido a que una amplia variedad de otras enfermedades virales y bacterianas pueden causar lesiones similares. La neumonía intersticial se observa entre los 3 a 28 DPI, siendo más grave entre los 10 y 14 DPI. Cuando las lesiones neumónicas son leves, el pulmón es ligeramente firme, no colapsado, con aspecto moteado de color gris-marrón y húmedo. En cambio, en lesiones graves la distribución es difusa, el pulmón esta firme, húmedo y rojizo (Figura 1A) (7,25,28,30).
Microscópicamente, se observa el engrosamiento de los septos alveolares por infiltración de macrófagos y en menor número de linfocitos; hiperplasia e hipertrofia de los neumocitos tipo II, presencia de detritus, material proteináceo, macrófagos y ocasionalmente células sincitiales en los alveolos (Figura 1B).
En estadios más crónicos se observa un infiltrado mononuclear linfoplasmocitario alrededor de las vías aéreas y vasos sanguíneos; y en ocasiones se describe una hipertrofia del tejido linfoide asociado a bronquios (7,28,30). Se ha identificado antígeno del PRRSV en alguna célula epitelial bronquial con tumefacción y pérdida de cilios y en la sub-mucosa de la cavidad nasal a los 7 DPI. En etapas avanzadas el epitelio de la mucosa nasal puede presentar la ausencia de cilios con tumefacción del epitelio, pérdida del mismo o metaplasia escamosa (7).
4.2 Órganos linfoideos.
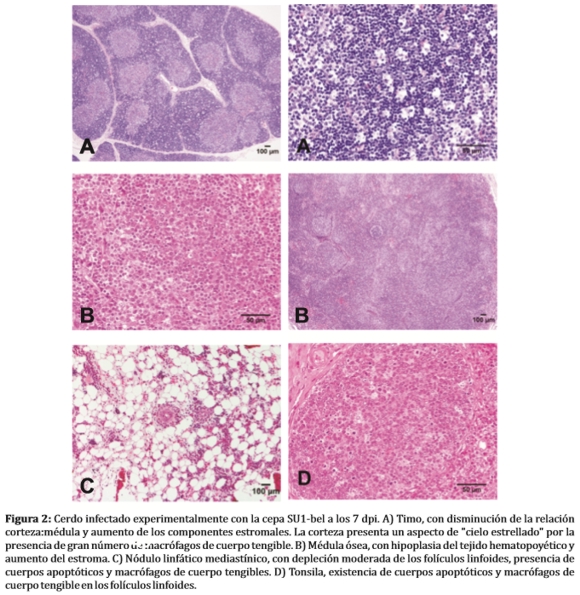
Después de la infección/inoculación temprana, varios nódulos linfáticos aumentan de tamaño de 2 a 10 veces, presentan un aspecto edematosos, bronceado y moderadamente firme, con el tiempo se vuelven firmes, de color blanco o marrón claro con un patrón nodular o difuso y con poca frecuencia, pueden observase múltiples quistes de 2-5 mm de diámetro en cortical. En los órganos linfoides primarios (timo) y secundarios (vainas linfoides peri-arteriolares del bazo, y en los folículos linfoides de las amígdalas y placas de Peyer del intestino) se observa atrofia, depleción, hiperplasia e hipertrofia y en ocasiones necrosis con sincitios celulares de los centros germinales (Figura 2A, C, D) (26,27,29,33).
Infecciones en cerdas preñadas en el tercio final de la gestación con PRRSV, resultaron en lechones con lesiones severas en médula ósea y timo al nacimiento, y con mayor susceptibilidad a infecciones severas cuando se lo expuso a Streptococcus suis. Los efectos sobre la médula ósea posiblemente impidan una producción suficiente cuantitativa y/o cualitativa de células responsables de una respuesta inmunológica, como por ejemplo los pro-timocitos, que luego deberían migrar al timo (Figura 2 A, B, C) (29,33).
4.3 Aparato reproductor.
En el aparato reproductor las alteraciones son escasas y en la mayoría microscópicas. Se describen endometritis caracterizada por edema e infiltrado perivascular linfohistiocitario y con menor frecuencia micro-separaciones entre el epitelio del trofoblasto y el endometrio placentario con contenido proteico eosinofílico y restos celulares. Además, atrofia de los túbulos seminíferos en verracos desde los 7 a 25 DPI, con presencia de células gigantes, apoptosis y agotamiento de las células germinales. (16,32).
4.4 Fetos y lechones.
Las lesiones en fetos y lechones nacidos muertos son infrecuentes y rara vez contribuyen a un diagnóstico definitivo de la enfermedad, pero la ausencia de lesiones no descarta la presencia de PRRS. Lesiones fetales descritas incluyen ascitis e hidrotórax, edema perirrenal y en el ligamento esplénico y mesentérico. Los lechones muertos son comúnmente recubiertos con una gruesa mezcla de meconio amarronado y líquido amniótico, este hallazgo sugiere estrés y/o hipoxia fetal (31).
Lechones de 13 días de edad inoculados con PRRSV presentaron trastornos en el drenaje (edema subcutáneo, periocular y escrotal), desde los 2 DPI con lesiones microscópicas leves y no supurativas. Las lesiones más relevantes del PRRSV se sitúan en pulmón; los demás tejidos y/o órganos con vasculitis consistente en infiltrados inflamatorios linfoplasmocitarios en la túnica media con posible extensión transmural y en raras ocasiones con necrosis fibrinoide, a nivel de tejido nervioso, leucoencefalitis linfohistiocitaria leve o encefalitis con infiltración de histiocitos en los plexos coroideos (31,32).
CONCLUSIÓN.
Está mundialmente aceptado que el PRRS sigue siendo una de las enfermedades que ocasiona un impacto económico negativo en la producción porcina. Por otra parte el aumento crecimiento de la producción porcina en los últimos años en el país y la importación de material genético procedente de países endémicos con PRRS; nos responsabiliza como profesionales veterinarios a conocer las características más importantes de esta enfermedad. El virus del PRRS modula la respuesta inmune del hospedador para favorecer su replicación, distribución y latencia en los cerdos infectados. Además instaura un estado de inmunosupresión modulado por los fenómenos de apoptosis junto con la asociación o no de la replicación del virus como de la expresión de diferentes citoquinas. Con esta revisión se pretende actualizar e informar a los profesionales dedicados a la porcinocultura en Paraguay sobre la epidemiologia, síntomas y lesiones del PRRS.
AGRADECIMIENTOS.
A los Doctores Librado Carrasco Otero, Jaime Gómez-Laguna, Javier Salguero, Irene M. Rodríguez e Inmaculada Barranco y a la técnico de laboratorio Gema Muñoz del Edificio de Sanidad Animal de la Facultad de Veterinaria de la Universidad de Córdoba-España. A todos ellos por su colaboración para la realización de diferentes estudios sobre el PRRS durante la realización de la tesis doctoral y la corrección de esta revisión.
BIBLIOGRAFÍA.
1. Conzelmann KK, Visser N, Van Woensel P, Thiel HJ. Molecular characterization of porcine reproductive and respiratory syndrome virus, a member of the arterivirus group. Virology. 1993 Mar;193(1):329-39. [ Links ]
2. Wensvoort G, Terpstra C, Pol JM, ter Laak EA, Bloemraad M, de Kluyver EP, et al. Mystery swine disease in The Netherlands: the isolation of Lelystad virus. Vet Q. 1991 Jul;13(3):121-30. [ Links ]
3. Collins JE, Benfield DA, Christianson WT, Harris L, Hennings JC, Shaw DP, et al. Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2332) in North America and experimental reproduction of the disease in gnotobiotic pigs. J Vet Diagn Invest. 1992 Apr;4(2):117-26. [ Links ]
4. Benfield DA, Nelson E, Collins JE, Harris L, Goyal SM, Robison D, et al. Characterization of swine infertility and respiratory syndrome (SIRS) virus (isolate ATCC VR-2332). J Vet Diagn Invest. 1992 Apr;4(2):127-33. [ Links ]
5. Terpstra C, Wensvoort G, Pol JM. Experimental reproduction of porcine epidemic abortion and respiratory syndrome (mystery swine disease) by infection with Lelystad virus: Koch's postulates fulfilled. Vet Q. 1991 Jul;13(3):131-6. [ Links ]
6. Kappes MA, Faaberg KS. PRRSV structure, replication and recombination: Origin of phenotype and genotype diversity. Virology. 2015 May;479-480C:475-86. [ Links ]
7. Han K, Seo HW, Park C, Oh Y, Kang I, Chae C. Comparative pathogenesis of type 1 (European genotype) and type 2 (North American genotype) porcine reproductive and respiratory syndrome virus in infected boar. Virol J. 2013 May 21;10(1):156. [ Links ]
8. Stadejek T, Stankevicius A, Murtaugh MP, Oleksiewicz MB. Molecular evolution of PRRSV in Europe: current state of play. Vet Microbiol. 2013 Jul 26;165(1-2):21-8. [ Links ]
9. Hu SP, Zhang Z, Liu YG, Tian ZJ, Wu DL, Cai XH, et al. Pathogenicity and distribution of highly pathogenic porcine reproductive and respiratory syndrome virus in pigs. Transbound Emerg Dis. 2013 Aug;60(4):351-9. [ Links ]
10. Wang X, Wei R, Li Q, Liu H, Huang B, Gao J, et al. PK-15 cells transfected with porcine CD163 by PiggyBac transposon system are susceptible to porcine reproductive and respiratory syndrome virus. J Virol Methods. 2013 Nov;193(2):383-90. [ Links ]
11. De Baere MI, Van Gorp H, Delputte PL, Nauwynck HJ. Interaction of the European genotype porcine reproductive and respiratory syndrome virus (PRRSV) with sialoadhesin (CD169/Siglec-1) inhibits alveolar macrophage phagocytosis. Veterinary Research. 2012 Jan-Feb;43(1):47.
12. Nelsen CJ, Murtaugh MP, Faaberg KS. Porcine reproductive and respiratory syndrome virus comparison: divergent evolution on two continents. J Virol. 1999 Jan;73(1):270-80. [ Links ]
13. Shi M, Lam TT, Hon CC, Hui RK, Faaberg KS, Wennblom T, et al. Molecular epidemiology of PRRSV: a phylogenetic perspective. Virus Res. 2010 Dec;154(1-2):7-17. [ Links ]
14. Truyen U, Wilhelm S, Genzow M, Schagemann G. Porcine reproductive and respiratory syndrome virus (PRRSV): a ring test performed in Germany to assess RT-PCR detection methods. J Vet Med B Infect Dis Vet Public Health. 2006 Mar;53(2):68-74. [ Links ]
15. Drew TW. A review of evidence for immunosuppression due to porcine reproductive and respiratory syndrome virus. Vet Res. 2000 Jan-Feb;31(1):27-39. [ Links ]
16. Karniychuk UU, Van Breedam W, Van Roy N, Rogel-Gaillard C, Nauwynck HJ. Demonstration of microchimerism in pregnant sows and effects of congenital PRRSV infection. Vet Res. 2012;43:19. [ Links ]
17. Otake S, Dee SA, Rossow KD, Moon RD, Trincado C, Pijoan C. Transmission of porcine reproductive and respiratory syndrome virus by houseflies (Musca domestica). Vet Rec. 2003 Jan 18;152(3):73-6. [ Links ]
18. Otake S, Dee SA, Rossow KD, Joo HS, Deen J, Molitor TW, et al. Transmission of porcine reproductive and respiratory syndrome virus by needles. Vet Rec. 2002 Jan 26;150(4):114-5. [ Links ]
19. Dee S, Torremorell M, Thompson B, Deen J, Pijoan C. An evaluation of thermo-assisted drying and decontamination for the elimination of porcine reproductive and respiratory syndrome virus from contaminated livestock transport vehicles. Can J Vet Res. 2005 Jan;69(1):58-63. [ Links ]
20. Molina RM, Nelson EA, Christopher-Hennings J, Hesse R, Rowland RR, Zimmerman JJ. Evaluation of the risk of PRRSV transmission via ingestion of muscle from persistently infected pigs. Transbound Emerg Dis. 2009 Mar;56(1-2):1-8. [ Links ]
21. Bloemraad M, de Kluijver EP, Petersen A, Burkhardt GE, Wensvoort G. Porcine reproductive and respiratory syndrome: temperature and pH stability of Lelystad virus and its survival in tissue specimens from viraemic pigs. Vet Microbiol. 1994 Dec;42(4):361-71. [ Links ]
22. Wills RW, Doster AR, Galeota JA, Sur JH, Osorio FA. Duration of infection and proportion of pigs persistently infected with porcine reproductive and respiratory syndrome virus. J Clin Microbiol. 2003 Jan;41(1):58-62. [ Links ]
23. Costers S, Lefebvre DJ, Delputte PL, Nauwynck HJ. Porcine reproductive and respiratory syndrome virus modulates apoptosis during replication in alveolar macrophages. Arch Virol. 2008;153(8):1453-65. [ Links ]
24. Sirinarumitr T, Zhang Y, Kluge JP, Halbur PG, Paul PS. A pneumo-virulent United States isolate of porcine reproductive and respiratory syndrome virus induces apoptosis in bystander cells both in vitro and in vivo. J Gen Virol. 1998 Dec;79 ( Pt 12):2989-95. [ Links ]
25. Gomez-Laguna J, Salguero FJ, Pallares FJ, Carrasco L. Immunopathogenesis of porcine reproductive and respiratory syndrome in the respiratory tract of pigs. Veterinary Journal. 2013 Feb;195(2):148-55. [ Links ]
26. Barranco I, Gomez-Laguna J, Rodriguez-Gomez IM, Salguero FJ, Pallares FJ, Bernabe A, et al. Immunohistochemical detection of extrinsic and intrinsic mediators of apoptosis in porcine paraffin-embedded tissues. Veterinary Immunology and Immunopathology. 2011 Feb 15;139(2-4):210-6. [ Links ]
27. Rodriguez-Gomez IM, Barranco I, Amarilla SP, Garcia-Nicolas O, Salguero FJ, Carrasco L, et al. Activation of extrinsic- and Daxx-mediated pathways in lymphoid tissue of PRRSV-infected pigs. Vet Microbiol. 2014 Aug 6;172(1-2):186-94. [ Links ]
28. Amarilla SP, Gomez-Laguna J, Carrasco L, Rodriguez-Gomez IM, Caridad YOJM, Morgan SB, et al. A comparative study of the local cytokine response in the lungs of pigs experimentally infected with different PRRSV-1 strains: Upregulation of IL-1alpha in highly pathogenic strain induced lesions. Vet Immunol Immunopathol. 2015 Apr 15;164(3-4):137-47. [ Links ]
29. Feng W, Laster SM, Tompkins M, Brown T, Xu JS, Altier C, et al. In utero infection by porcine reproductive and respiratory syndrome virus is sufficient to increase susceptibility of piglets to challenge by Streptococcus suis type II. J Virol. 2001 May;75(10):4889-95. [ Links ]
30. Weesendorp E, Rebel JM, Popma-De Graaf DJ, Fijten HP, Stockhofe-Zurwieden N. Lung pathogenicity of European genotype 3 strain porcine reproductive and respiratory syndrome virus (PRRSV) differs from that of subtype 1 strains. Vet Microbiol. 2014 Nov 7;174(1-2):127-38. [ Links ]
31. Prieto C, Garcia C, Simarro I, Castro JM. Temporal localization of porcine reproductive and respiratory syndrome virus in reproductive tissues of experimentally infected boars. Theriogenology. 2003 Nov;60(8):1505-14. [ Links ]
32. Zimmerman;Jeffrey J; Benfield DAD, Scott A; Murtaugh, Michael P; Stadejek, Tomasz; Stevenson,Gregory W and Torremorell, Montserrat. Porcine Reproductive and Respiratory Syndrome Virus (Porcine Arterivirus). In: Jeffrey J. Zimmerman LAK, Alejandro Ramirez, Kent J. Schwartz and Gregory W. Stevenson, editor. Diseases of swine. 10th ed. UK: Willwy-BlackWeel A John Wiley and Sons, Inc; 2012. p. 461-86 [ Links ]
33. Amarilla SP, Gomez-Laguna J, Carrasco L, Rodriguez-Gomez IM, Caridad YOJM, Morgan SB, et al. Thymic depletion of lymphocytes is associated with the virulence of PRRSV-1 strains. Veterinary Microbiology. 2016 April; (188) 47-58 [ Links ]
*Dirección para correspondencia: Prof. Dra. Shyrley Paola Amarilla - Facultad de Ciencias Veterinarias - Universidad Nacional de Asunción - Casilla de Correo N° 1061 - Ruta Mcal. Estigarribia Km 10,5 - Campus Universitario - San Lorenzo- Paraguay
E-Mail:ashyrleypaola@yahoo.com
Recibido: 10 de octubre 2015 / Aceptado: 06 de noviembre de 2015