Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Compendio de Ciencias Veterinarias
On-line version ISSN 2226-1761
Compend. cienc. vet vol.5 no.2 San Lorenzo Dec. 2015
https://doi.org/10.18004/compend.cienc.vet.2015.05.02.23-31
ARTICULO ORIGINAL
EFECTO DEL ESTRÉS SALINO EN LA GERMINACIÓN Y VIGOR DE SEMILLAS DE Panicum maximum Jacq. VARIEDADES TANZANIA Y MOMBASA
EFFECT OF SALT STRESS ON SEED GERMINATION AND VIGOR Panicum maximum Jacq. VARIETIES TANZANIA AND MOMBASA
*Salomón J1, Samudio A2
1Facultad de Ciencias Agrarias, Universidad Nacional de Asunción. San Lorenzo-Paraguay
2Centro Multidisciplinario de Investigaciones Tecnológicas. Universidad Nacional de Asunción. San Lorenzo-Paraguay
RESUMEN.
La salinidad en los suelos es uno de los factores que limitan la productividad de los cultivos agrícolas y forrajeros, por lo que el estudio de la tolerancia a la salinidad es importante para la agricultura sostenible. Durante los meses de diciembre de 2012 y enero de 2013, fue conducido el experimento, con el objetivo de evaluar el efecto de diferentes concentraciones de cloruro de sodio (NaCl) en el sustrato sobre el potencial germinativo y el vigor de semillas de dos variedades de Panicum maximum. Las semillas de dos variedades de P. maximum (Tanzania y Mombasa) fueron sembradas en sustratos humedecidos con soluciones de diferentes concentraciones salinas de NaCl (0; 8,6; 16,6 y 22,3 mS.cm-1). El diseño experimental factorial (4x2) estuvo constituido por 4 tratamientos y 4 repeticiones para cada variedad. Se determinaron el porcentaje de germinación, la velocidad y el índice de velocidad de germinación, además la longitud de la parte aérea y radicular. La germinación se vio significativamente reducida con el incremento de la salinidad, para ambas variedades. De la misma manera, la velocidad de germinación y el índice de velocidad de germinación se vieron influidos negativamente por la salinidad. Las dos variedades estudiadas presentan un cierto grado de sensibilidad, siendo la Tanzania más tolerante que la Mombasa.
Palabras clave: germinación, vigor, salinidad, cultivar, Panicum maximum, Tanzania y Mombasa.
ABSTRACT.
Soil salinity is one limiting factor in agricultural productivity and feed crops, this is why is important for sustainable agriculture to go deep into the study of salt tolerance. The experiment was conducted in the Laboratorio de Análisis de Calidad de Semillas de la Facultad de Ciencias Agrarias of the Universidad Nacional de Asunción, during the months of December 2012 and January 2013, with the objective of evaluating the effect of different concentrations of sodium chloride (NaCl) in the substrate over the germination potencial and vigor of seeds of two varieties of Panicum maximum. The seeds of two varieties of P. maximum (Tanzania and Mombasa) were seeded in moist substrates with salt solutions of different concentrations of NaCl (0; 8,6; 16,6; 22,3 mS.cm-1). The experimental design was factorial (4x2), which consisted of four treatments and four replications for each variety. The germination percentage, germination speed and germination speed rate, plus the length of the aerial part and root were determined. Germination was significantly reduced with increasing salinity, for both varieties. Likewise, the germination speed and germination speed rate were negatively influenced by salinity. Both studied varieties have a certain rate of sensibility, Tanzania being most tolerant than Mombasa.
Keywords: germination, vigor, salinity, cultivar, Panicum maximum, Tanzania y Mombasa.
INTRODUCCIÓN.
En los últimos años se ha producido una expansión de la actividad ganadera a expensas de la superficie ocupada por vegetación propia de la zona del Chaco paraguayo. La introducción de gramíneas del género Panicum ha permitido incrementar la receptividad de los potreros chaqueños, cuyos suelos son de moderada a muy alta fertilidad y el pH nunca es tan bajo como para producir toxicidades relacionadas con la acidez. El régimen hídrico, la textura del suelo, la disponibilidad de nitrógeno y el nivel de salinidad son los factores que determinan fundamentalmente la adaptación ambiental de las diferentes pasturas (1).
La germinación de las semillas es un proceso de importancia para el establecimiento y sobrevivencia de las plantas en condiciones naturales. Después de que una semilla haya germinado, las plántulas son extremadamente vulnerables a los cambios ambientales y su destino depende de que las condiciones sean propicias para llegar a la madurez. Por esto, normalmente se considera que la variación de los mecanismos que regulan la germinación de las semillas está bajo fuertes presiones selectivas, y la variabilidad dentro y entre las variedades de la misma especie constituye adaptaciones locales o regionales al clima o a condiciones específicas de su hábitat (2).
El recurso clave para iniciar los cambios fisiológicos que conducen a la germinación es el agua, que resulta indispensable para activar el metabolismo y el crecimiento de las células vivas de los tejidos de las semillas (2, 3). Tanto la germinación como la velocidad a la que ésta se produce están determinadas principalmente por los gradientes de potenciales hídricos entre la semilla y el medio (2, 4).
Durante el desarrollo, las semillas son las primeras en enfrentar las condiciones de estrés, particularmente la salinidad afecta la reanudación del crecimiento activo del embrión como el crecimiento inicial de la plántula, a través de su influencia sobre diferentes procesos fisiológicos y bioquímicos, principalmente por su efecto sobre las relaciones hídricas así como la toxicidad de los iones (5).
Todos los suelos contienen sales solubles, algunas de las cuales son esenciales para el crecimiento de las plantas. La salinidad puede ser definida como la concentración excesiva de sales solubles en el suelo, que limitan el crecimiento de las plantas. Esta es mayor a medida que aumentan las concentraciones de sales llegando incluso a provocar la muerte de la planta. La principal sal que participa en la salinización es el cloruro de sodio (6).
El estrés salino es el mayor factor limitante de la productividad de los cultivos agrícolas y forrajeros, por lo que profundizar en el estudio de la tolerancia a la salinidad es un objetivo importante para la agricultura sostenible. El estrés salino es un complejo abiótico en el cual, está implicado un componente iónico y un componente osmótico, muchos de los iones salinos son tóxicos para las células vegetales cuando se presentan a altas concentraciones externas e internas (7).
En este trabajo de investigación se buscó determinar la respuesta germinativa y el comportamiento de los estadios iniciales de crecimiento, en función a diferentes concentraciones salinas de NaCl en dos variedades de Panicum maximum.
MATERIALES Y MÉTODOS.
El experimento se llevó a cabo en el Laboratorio de Análisis de Calidad de Semillas dependiente de la Facultad de Ciencias Agrarias (FCA), situado en el Campus Universitario de la Universidad Nacional de Asunción (UNA), San Lorenzo, en el periodo comprendido entre diciembre del 2012 y enero del 2013.
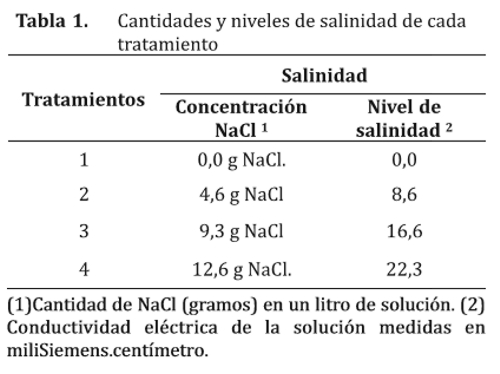
Se utilizaron semillas de Panicum maximum, de las variedades Mombasa y Tanzania, obtenidas de la producción local y proveídas por semillerías nacionales, estas corresponden a zafras del 2011 a 2012. En la Tabla 1 se puede observar la concentración de NaCl y el nivel de salinidad de los diferentes tratamientos.
Este trabajo de investigación se realizó teniendo en cuenta las normas internacionales de la Asociación Internacional de Análisis de Semillas (ISTA), Reglas para Análisis de semillas (MAPA 2009) y Vigor de Semillas; Conceptos y pruebas (8, 9, 10).
Las soluciones se obtuvieron mediante la utilización de cloruro de sodio. Primeramente se colocó en cada vaso precipitado de 1.000 ml, la sal de NaCl p.a. que se empleó para simular la conductividad eléctrica. Posteriormente, se le adicionó agua destilada para disolver la sal. Finalmente se trasvasó en un matraz aforado y se completó con agua destilada hasta obtener 1 L de solución. Estas soluciones fueron utilizadas antes y después de la siembra, para humedecer el papel de filtro fue colocado en la base de las placas gerbox (11).
Las semillas fueron colocadas sobre una superficie lisa y esterilizada para proceder al muestreo de forma manual de cada lote, que luego del análisis de pureza, fueron clasificados en tres componentes: semillas puras; otras semillas y material inerte.
Para la determinación de la viabilidad se seleccionaron 100 semillas puras de cada variedad, las cuales fueron colocadas en una placa de Petri envueltas en papel filtro y agua, luego colocadas por 18 h en una estufa de fotoperiodo a 20°C. Transcurrido ese tiempo se procedió al corte de las semillas para practicar una incisión trasversal sin quebrar por completo, posteriormente se sumergieron en la solución de bromato de tetrazolio al 1% por 3 h en una estufa, con una temperatura de 40°C, se procedió al corte total de las semillas para realizar la lectura a través del estereoscopio, y siguiendo los parámetros de coloración del manual (8), se establecieron las semillas viables. Para evaluar la tinción se utilizó un estereoscopio de aumento 35 X. A través del software informático del estereoscopio se procedió al registro y análisis de las imágenes.
Fueron consideradas como viables aquellas semillas con todas las estructuras del embrión intacto, túrgido y con tejidos que demostraron atributos normales y consistentes.
Para la evaluación de la germinación se sembraron en placas tipo gérbox esterilizadas con hipoclorito al 10%, a fin de minimizar los errores posibles por contaminación. Como sustrato fue utilizado papel absorbente esterilizado en estufa a 105°C durante 20 min. La siembra se realizó utilizando 100 semillas por placa y el sustrato fue humedecido con las soluciones a capacidad de campo.
Las placas sembradas fueron transferidas a una cámara de germinación y mantenidas a una temperatura constante de 25°C por 28 días.
La evaluación de la germinación se efectuó mediante el cálculo de porcentaje de germinación de semillas, realizando observaciones y registrando la proporción de semillas que fueron consideradas como plántulas normales. Se realizó el cálculo de medias porcentuales de cada tratamiento, debido a que las placas contenían 100 semillas. El conteo de plántulas se registró a diario en una planilla, a partir del quinto día y se extrajeron de las placas, aquellas plántulas que demostraron atributos normales.
Los datos de velocidad e índice de velocidad de germinación de semillas, fueron computadas en las plántulas normales, cuyos registros fueron diarios. Posterior a los 28 días fueron calculados mediante una adaptación de la metodología propuesta por Sader & Silveira y Queiroz (12).
Para la evaluación de la longitud de plántulas se utilizó como guía el manual de Vigor de Semillas; Conceptos y Test (9), el procedimiento fue realizado empleando placas tipo gerbox, las cuales contenían 10 semillas, cada una con cuatro repeticiones por tratamiento. Las placas estuvieron dispuestas de forma inclinada con un ángulo mayor a 45°. Cada unidad experimental fue irrigada a capacidad de campo. La longitud de la radícula y de la parte aérea se midió de forma separada realizando una medición con ayuda de una regla milimetrada a cada plántula, y fue expresada en milímetros por plántula (pl.d-1). La longitud de la radícula y la altura se determinaron a los 10 días después de la siembra (DDS) midiéndose todas las plántulas normales germinadas mediante una regla milimetrada y expresándose los valores en mm pl-1.
Los valores obtenidos fueron sometidos a ANOVA y las medias de cada tratamiento, para cada uno de los parámetros evaluados fueron comparadas entre sí por el Test de Tukey con un nivel de significancia del 95%.
RESULTADOS Y DISCUSIÓN
Porcentaje de germinación del lote de semillas de Panicum maximum.
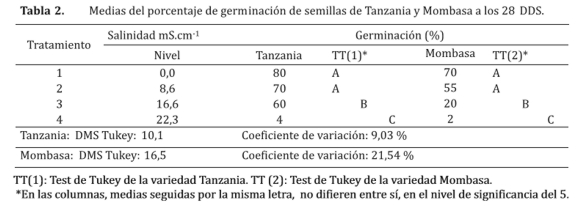
El análisis de varianza reveló un efecto significativo del nivel de salinidad sobre el porcentaje de germinación en los dos cultivares evaluados (Tabla 2). En el efecto de la salinidad en ambas variedades, se observaron diferencias estadísticas entre los diferentes niveles, de los cuales los niveles de salinidad 0,0 y 8,6 mS.cm-1 obtuvieron los mayores porcentajes de germinación para la variedad Tanzania con un 80% y 70%. Estos fueron estadísticamente significativos a los niveles de salinidad mayores, entre los que también se observa una variación de más de 55% de germinación.
En cuanto a la variedad Mombasa, el tratamiento testigo y el segundo nivel 8,6 mS.cm-1 no hubo diferencias estadísticas en el porcentaje de germinación, arrojando medias del 70 y 55% respectivamente. El tercer nivel presentó diferencia estadísticamente significativa entre los distintos niveles.
Las altas concentraciones de NaCl en la solución incidieron en el bajo porcentaje de germinación, este resultado coincide con el resultado obtenido por Bliss et al. (1984), quienes indican que los efectos dañinos de las sales en las membranas celulares son mayores durante la germinación, ya que afectan diversas funciones de éstas, como la permeabilidad y el transporte de solutos orgánicos e inorgánicos, pudiendo causar alteraciones en la composición de la membrana (13).
Las dos variedades estudiadas presentan un cierto grado de sensibilidad, siendo la Tanzania la más tolerante, pues no ha presentado importantes variaciones en las medias porcentuales de germinación, hasta el nivel de salinidad de 16,6 mS.cm-1. La variedad Mombasa por su parte tuvo un comportamiento diferente en comparación con la variedad Tanzania. Ruiz (2010), menciona una conducta favorable en la germinación de semillas de Tanzania ante la presencia moderada de sales en los sustratos, bajo condiciones de invernadero (14)
Dodd & Donovan (1999), indicaron que un incremento en la salinidad generalmente reduce la germinación, dos procesos regulan esta disminución: los efectos osmóticos debidos a una disminución del potencial de solutos del suelo, creando un estrés hídrico para la planta; y, los efectos iónicos debidos a la absorción y/o acumulación de iones por las semillas o las plántulas (15).
Ruiz & Terenti (2012) estudiaron el efecto de diferentes concentraciones de distintas sales sobre la germinación de semillas de Panicum coloratum, concluyeron que, en condiciones de estrés salino, su comportamiento no fue favorable, pero indican tolerancias moderadas de concentraciones de NaCl y bajas de las sales KCl, Na2SO4, y K2SO4 (16).
La presencia de otras sales tales como KCl, Na2SO4, y K2SO4, en la germinación de semillas, tendría un aumento del efecto tóxico a nivel celular por la diferencia osmótica, debido a la liberación de los iones a nivel intracelular, esto explica la baja tolerancia con estas sales (16)
Velocidad de germinación de semillas de Panicum maximum
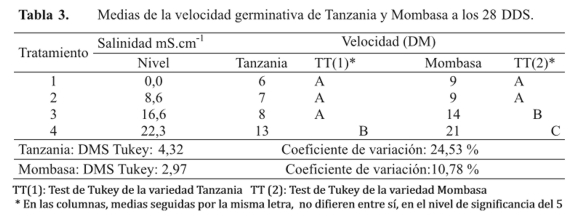
En la tabla 3, se observa las medias de la velocidad de germinación, de semillas de P. maximum de las variedades Tanzania y Mombasa, a los 28 DDS, expresados en días medios (DM).
Los distintos niveles de salinidad provocaron velocidades de germinación similares para la variedad Tanzania. Con un nivel de 0,0 mS.cm-1, registró un promedio de velocidad germinativa de 6 DM, al aumentar el nivel a 8,6 y 16,6 mS.cm-1, las velocidades se redujeron de manera significativa, en 1 y 2 DM respectivamente, mientras que para el nivel de 22,3 mS.cm-1, se registró el mayor número de días, siendo13 DM.
Las semillas de la variedad Mombasa se comportaron de manera similar, en los dos primeros tratamientos, se obtuvieron 9 DM, en el tercer tratamiento se produjo un considerable incremento, el cual superó en 5 DM en función a los primeros tratamientos, aunque la significancia se obtuvo en el último nivel de salinidad 22,3 mS.cm-1 con una diferencia de 12 DM con respecto a los primeros niveles y 7 DM en relación al tercer nivel.
Las medias de las velocidades demostraron mayor cantidad de días para la germinación con altas concentraciones de NaCl, este comportamiento concuerda con Ávila (2007), quien afirmó que el estrés hídrico provocado por la salinidad generalmente contribuye a la disminución de la velocidad y el porcentaje de germinación de las semillas, existiendo para cada especie un valor del potencial hídrico en el suelo por debajo del cual la germinación no ocurre, con una gran variación de la respuesta entre las especies (17).
La salinidad induce a un retraso en la velocidad de germinación y una reducción de semillas geminadas. Tobe (2000), señaló que la disminución en el proceso de absorción de agua y la entrada de iones en una cantidad suficiente para causar toxicidad a la semilla, especialmente Na+ y Cl- se indican como las principales causas de reducción de la velocidad de los procesos fisiológicos y bioquímicos (18).
Hester (2001), asoció fuertemente a la morfología de la planta, tamaño de las hojas y la biomasa en general, con tolerancia a la sal en Panicum hemitomon, además mencionó que un incremento en los niveles de salinidad, generalmente arrojó resultados significativos, una reducción de la asimilación neta de dióxido de carbono CO2, expansión de las hojas, la presión del xilema foliar (19).
Índice de velocidad de germinación de semillas de Panicum maximum
Las medias del índice de velocidad de germinación de las semillas de P. maximum de las variedades Tanzania y Mombasa, evaluados en plantas por día (pl.d-1), a los 28 DDS, se detallan en la tabla 4, respectivamente.
En esta variable, para la variedad Tanzania se percibió la respuesta de las semillas sin variación estadísticamente significativa en los primeros tratamientos, el nivel 0,0 mS.cm-1, presentó un mayor índice de velocidad en la germinación, con un valor de 13 pl.d-1, en el siguiente nivel se redujo en 2 plantas, con relación al anterior. La tendencia se fue repitiendo en los últimos niveles, alcanzando valores significativos, para el nivel 16,6 mS.cm-1 la reducción fue de 5 plantas con relación al testigo, mientras que 22,3 mS.cm-1, el índice disminuyo en 12 plantas.
Los índices de la variedad Mombasa mostraron diferencias estadísticas entre las diferentes concentraciones. El testigo exhibió mayor cantidad de plántulas por día: 9 pl.d-1, el segundo tratamiento se redujo en 2 plantas posteriormente los dos últimos tratamientos tuvieron bajos índices, reduciéndose a 7 plantas. Para el tercer y último tratamiento, con relación al testigo 8 plantas.
Oliveira (2009), indicó que en general, las variables afectadas negativamente por el efecto que provocan las soluciones de NaCl, aplicadas a un sustrato son el porcentaje de germinación, la tasa de la velocidad de la germinación y el tiempo medio de germinación, demostrando así que el déficit hídrico de una plántula y el exceso de sales de una solución proporcionan una reducción significativa en el vigor de las semillas (20).
En un estudio sobre el efecto de diferentes niveles de salinidad en la germinación y vigor de semillas, Ruiz (2008), indicó que la variedad Tanzania presentó un mayor índice de velocidad frente a otras especies de gramíneas (14).
Longitud de la radícula de Panicum maximum
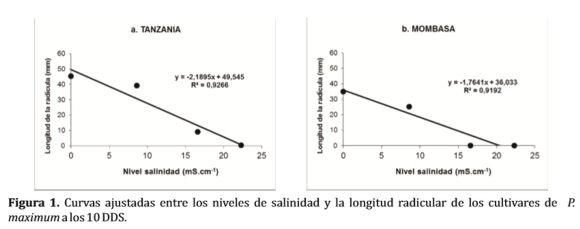
Las siguientes curvas ajustadas relacionan el nivel de salinidad y las longitudes radiculares experimentadas de las variedades Tanzania y Mombasa, donde se encontraron diferencias estadísticamente significativas.
Para la variedad Tanzania (Figura 1a), entre los niveles 15 y 25 mS.cm-1 las longitudes radiculares medias también describieron comportamientos similares, con respecto a los promedios longitudinales de los hipocotílos (Figura 1).
En la Figura 1 puede ser observado el efecto negativo de los tratamientos donde se aprecia de manera contundente en los últimos niveles de salinidad, las longitudes medias radiculares de la Mombasa (Gráfico b), que revelan escasa longitud radicular en los primeros niveles y nulos en los finales (1).
Ramírez et al (1998) detectaron daños por salinidad en plántulas. A los 10 días de la siembra contabilizaron el número de semillas germinadas, midieron la altura de las plántulas, la longitud de la radícula y la acumulación de masa seca. Los resultados indicaron un aumento significativo de la inhibición de la germinación, la altura de las plántulas y la longitud de la radícula con el incremento de los niveles de salinidad (21).
Los solutos disueltos en la zona radicular reducen el potencial osmótico, y a su vez el potencial hídrico del agua. El equilibrio hídrico total de la planta se ve afectado debido a que las hojas necesitan desarrollar un potencial hídrico más negativo para mantener un gradiente favorable entre el suelo y las hojas, estas conclusiones de Taiz & Zeiger (2006), explican el motivo del comportamiento de la parte aérea (22).
Laynez (2008), observó un menor crecimiento de la altura de la plántula y la longitud de la radícula con el aumento de la concentración salina en una gramínea. La longitud de la raíz y del hipocótilo son los indicadores importantes para la respuesta al estrés salino, porque las raíces están en contacto directo con el sustrato, por ende absorben el agua y el hipocótilo lo conduce al resto de la plántula. La inhibición del crecimiento de la plántula por la salinidad puede deberse al efecto inhibitorio de los iones y también a la absorción más lenta del agua por las semillas (23).
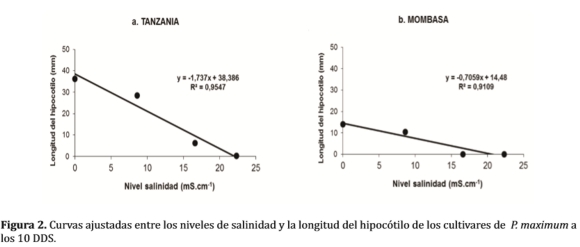
La Figura 2, describe las curvas ajustadas entre la longitud del hipocótilo y el nivel de salinidad, encontrandose diferencias significativas en las dos variedades. En ambas figuras se observan una relación lineal decreciente: a medida que se incrementa el nivel de salinidad, decrecen las longitudes expresadas en milímetros.
La representación gráfica señala una disposición de forma negativa, debido al efecto negativo del estrés salino sobre la emergencia de las plántulas, el comportamiento de la Tanzania (figura a), con relación al hipocótilo, denota una actitud sensible ante el aumento de los niveles salinos considerados extremos para su desarrollo, entre 15 y 25 mS.cm-1 describe un descenso en las medias de sus longitudes.
Describiendo la figura 2(b), se destaca un bajo desempeño de la medias longitudinales en los niveles iniciales, frente a la Figura 2(a), las medias de longitud del hipocótilo en la Mombasa se han reducido drásticamente, inclusive terminaron mostrando nulos resultados a partir del tercer nivel, en tal sentido se percibio una mayor susceptibilidad en los estadios iniciales del crecimiento, en los últimos tratamientos.
El comportamiento de la parte aérea denota una reducción de longitud a mayores niveles de salinidad. Ayers (1997), mencionó que si la absorción de agua por las raíces se reduce mucho, las plantas disminuyen su crecimiento y llegan a presentar síntomas de sequía. Estos síntomas varían con los estados fenológicos de los cultivos, siendo más notable durante las primeras etapas del crecimiento (24).
Martínez et al (1987), indicaron que los síntomas más comunes, en la mayoría de las especies, son la reducción de altura de planta, disminución de la producción y retraso en su ritmo de crecimiento, también se produce una reducción en el número de tallos y hojas, otros efectos causados por la salinidad son: la disminución del tamaño de estomas, el aumento en el número de éstos y el obscurecimiento del color verde de las hojas (25).
La acumulación de sales en el suelo influye negativamente en el potencial hídrico de la solución de suelo, causando una disminución del mismo, dificultando el proceso de absorción por las raíces, y en el caso de las semillas, afectando la imbibición de las mismas, pues el agua se mueve de mayor potencial hídrico a menor potencial hídrico (26, 27).
CONCLUSIÓN.
* Las dos variedades estudiadas presentan un cierto grado de sensibilidad, siendo Tanzania más tolerante que Mombasa.
* Las semillas responden negativamente a mayor concentración de NaCl en la solución, reduciéndose la germinación.
* La velocidad y el índice de velocidad de germinación de las semillas de Tanzania y Mombasa disminuyen considerablemente con el aumento de NaCl en las concentraciones.
* La altura de la parte aérea y la longitud de la radícula, muestran una disminución progresiva con el aumento de los niveles salinos.
Se sugiere continuar con este estudio, en otros cultivares de Panicum y en otras especies de gramíneas forrajeras, además de la utilización de otras sales para determinar con mayor exactitud el efecto de la salinidad en la germinación de las semillas
Se podría proseguir con esta investigación, utilizando sustrato como arena lavada en macetas o en las placas, las cuales simularían mejor las condiciones de campo, para poder demostrar de manera más exacta los efectos del estrés salino en el vigor de las semillas.
BIBLIOGRAFÍAS.
1. Glatzle A. 2008. Gramíneas y leguminosas para el Chaco: adaptación, potencialidades. [monografía en Internet]. Asunción: INTTAS; 2008. [acceso 22 de marzo de 2013]. Disponible en: http://www.produccion-animal.com.ar [ Links ]
2. Bewley JD, Black M. Seeds : physiology of development and germination. 2a ed. New York : Plenum; 1994. [ Links ]
3. Bewley JD. Sedd : germination and reserve mobilization. En: Nature Publishing Group. Encyclopedia of life Sciences. Washington: Wiley; 2001. [ Links ]
4. Bradford KJ. 1995. Water relations in seed germination. En: Kigel J, Galili G, editor. Seed development and germination. New York: Marcel Dekker; 1995. p. 351 – 396. [ Links ]
5. Camejo D, Torres W. La salinidad y su efecto en los estadios iniciales del desarrollo de dos cultivares de tomate. Cultrop (Hav). 2000; 21 (2): 23 – 26. [ Links ]
6. Maas EV, Goffman GJ. 1977. Crop salt torance: revaluation of existing data. J. Irrig. Drain Eng (Vir.) 103: 115 – 134. [ Links ]
7. Montoliu VA. Respuestas fisiológicas de los cítricos sometidas a condiciones de estrés biótico y abiótico aspectos comunes y específicos [tesis doctoral]. Universitat Jaume I.; 2010. [ Links ]
8. ISTA. International Seed Testing Assiation. International rules for seed testing. Switzerland; 2005. [ Links ]
9. Ministerio da Agricultura, Pecuária e Abastecimento. Regras para análise de sementes. Brasilia: MAPA; 2009. [ Links ]
10. Krzyzanowski F., Viera R, Franca J. Vigor de sementes: conceitos e testes. Londrinas: Associacao Brasileira de Tecnología de Sementes ; 1999. [ Links ]
11. Queiroz S, Nakagawa J. Estudos preliminares sobre os efeitos da salinidade na germinacao de sementes de arroz. Científica (Br). 19 (1): 247 – 256. [ Links ]
12. Sander R. Silvera M. 1991. Maduacao fisiológica e retardamento de colheita de sementes de girasol (Helianthus annus L.). Cientifica (Br). 19 (21): 247 – 256 p. [ Links ]
13. Bliss E, Platt-Alloia K, Thomson W. 1984. Effect of salt on cell membrane of germinating sedes. Calif. Agric. (Cal). 20 (1): 43 – 50. [ Links ]
14. Ruiz S. Efecto de diferentes niveles de salinidad en la germinación y vigor de semillas de cinco gramíneas forrajeras (monografía en internet). Mexico : Buenavista; 2010. (acceso 10 de abril de 2013). Disponible en: http://www.aeped,es/protocolos/dermatologia/index.htm [ Links ]
15. Dodd G, Donovan L. Water potential and ionic effects in germination and seedling growth of two cold desert shrubs. Amer. J. Bot. (revista en Internet). 1999. (acceso 23 de junio de 2013) ; 86 (8): 1146 – 1153. Disponible en http://amjbot.org/content/86/8/1146.full.pdf [ Links ]
16. Ruiz M, Terenti O. Evaluación comparativa de cuatro especies forrajeras bajo condiciones de estrés hídrico y salino durante la germinación. Agriscientia. (revista en Internet) 2012. [acceso 24 de mayo de 2013]; 29 (2) . Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttextpid=S1668-298X2012000200004 [ Links ]
17. Avila M, Braccini A, Scapim C. Fagliari J, Dos Santos J. Influenica do estresse hídrico simulado com manitol na germinacao de sementes e crescimento de plántulas de canola. Rev. Bras. de Sementes. (revista en Internet). 2007. 29 (1): 98 106 . (acceso 22 de marzo de 2013). Disponible en: http://www.scielo.br/ [ Links ]
18. Tobe K, Li X, Omasa K. Seed germintation and radicle growth of a halophyte, Kalidium caspicum (Chenopadiaceae). Oxf J (revista en Internet) 2013 (acceso 11 de junio de 2013). Disponible en: http://aob.oxfordjournals.org/content/85/3/391.full.pdf [ Links ]
19. Hester M. Species and population variation to salinity stress in panicum hemitomon, Spartina patens and Spartina alterniflora: morphological and physiological constraints. (monografía en Internet). Luisiana: Louisiana States University; 2001. (acceso 11 de junio de 2013). Disponible en: http://champs.cecs.ucf.edu/.../42_Hester_et_al_Species_an [ Links ]
20. Olivera A. 2009. Germinacao e vigor de sementes de sorgo forrageiro sob estresse hídrico e salino. (monografía en Internet). Londrina: (s.n.); 2009. (acceso 12 junio 2013). Disponible en: http://dx.coi.org/10.1590/S0101-31222009000300005 [ Links ]
21. Ramírez O, Hernández A, Carneiro S, Pérez J, Enriquez J, Quero A, Herrera J, Cervantes A. 1998. Acumulación de forraje de crecimiento y características estructurales del pasto Mobasa (Panicum máximum Jacq.) cosechado a diferentes intervalos de corte. Téc Pec Méx. (revista en Internet) 2009 [acceso 20 de abr. 2013]; 47 (2): 203-2013. Disponible en: http://www.redalyc.org/articulo.oa?id=61312116008 [ Links ]
22 . Taiz L, Zeiger E. Fisiología vegetal . Castelló de la Plana: Universitat Jaume; 2006. (acceso 11 junio de 2013). Disponible en: http://books/about/fisiología_vegeal.html?hl=es&id [ Links ]
23. Laynez Garsaball J. Efecto de la salinidad y del tamaño de la semilla sobre la germinación y crecimiento de plántulas de maíz (Zea mays L.) bajo condiciones de laboratorio. Revista especializada en ciencias químico-biológicas [revista en Internet] 2008. (acceso 22 de marzo de 2013) 11(1): 17-25. Disponible en: http://www.revistas.unam.mx/index.php/tip/article/view/43189/39205 [ Links ]
24. Ayers A, Argon J. Seed germination as affectd by soil moisture and salinity. Madison: (s.n.); 1987. [ Links ]
25. Martínez C, Aragües R, Royo A. Tolerancia de la cebada (hordeum vulgare L.) a la salinidad (monografía en Internet). Madrid: INIA; 1987. (acceso 24 de mayo de 2013). Disponible en: http:// digital.csic.es/bitstream/.../1/Martinz-CobA_comunicINIA68_1987.pd [ Links ]
26. Fernández G, Johnston M. Fisiología vegetal experimental San José CR: IICA; 1986. [ Links ]
27. Barelo Coll J., Rodrigo G., Sabater García B, Sánchez Tamés R. Fisiología vegetal. 6ª ed. Madrid: Pirámide; 1992. [ Links ]
*Dirección para correspondencia: Ing. Agr. Antonio Samudio - Centro Multidisciplinario de Investigaciones Tecnológicas - Casilla de Correo N° 1061 - Ruta Mcal. Estigarribia Km 10,5- Campus Universitario - San Lorenzo- Paraguay.
E-Mail: asamudio@rec.una.py
Recibido: 10 de octubre 2015 / Aceptado: 06 de noviembre de 2015