Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Compendio de Ciencias Veterinarias
On-line version ISSN 2226-1761
Compend. cienc. vet vol.3 no.1 San Lorenzo June 2013
TRABAJO DE INVESTIGACION
SEMILLAS DE Moringa oleífera CULTIVADAS EN EL CHACO CENTRAL COMO FUENTE DE ENZIMAS PARA ALIMENTACION ANIMAL
Moringa oleífera SEEDS CULTURED IN CHACO CENTRAL AS A SOURCE OF ENZYMES FOR ANIMAL FEED
*Yubero F¹
1Dpto. de Fisicoquímica. Facultad de Ciencias Químicas. Universidad Nacional de Asunción
RESUMEN
La moringa (Moringa oleífera) se cultiva en Paraguay con altos rendimientos y sus hojas constituyen uno de los forrajes más completos pues poseen un alto contenido de proteínas, vitaminas y minerales. Así mismo, los tenores de factores antinutricionales, como taninos y saponinas, son mínimos, prácticamente despreciables y no se han encontrado inhibidores de tripsina ni de lectina. En nuestro país no se han realizado estudios de evaluación del contenido de enzimas que puedan contener estos vegetales. Sin embargo, en 1987, Dahot y Memon habían demostrado la presencia de actividad lipasa en las semillas de este vegetal que tambien crece en el continente asiatico. En este sentido este trabajo se desarrollo con el fin de determinar la actividad de enzimas (lipasa, ureasa y a- amilasa) presentes en las semillas de Moringa oleífera cultivadas en la Región del Chaco Central paraguayo con vista a su utilización en la industria de aditivos para alimentación animal. Los resultados demostraron que el extracto de semillas de Moringa obtenido a pH 7 presentó actividad lipasa, a-amilasa y ureasa mayor que a pH 5 sobre todo para a-amilasa y ureasa (Prueba t para muestras independientes p < 0,05) comparado con los estudios a pH 5 desarrollados por otros investigadores. Los resultados de la actividad de enzimas obtenidos con los extractos de semillas cultivadas en nuestro país se corresponden con el mayor porcentaje de nitrogeno soluble obtenido por Vázquez y Yubero en el an~o 2009 a pH 7. Este trabajo permitió conocer el alto potencial que tienen las semillas de Moringa cultivadas en el Paraguay a fin de utilizarlas como fuente de producción de enzimas, principalmente de lipasa y a-amilasa como suplemento de la alimentación animal.
Palabras clave: Moringa oleífera – semillas - enzimas – alimentación animal
ABSTRACT
Moringa (Moringa oleifera) is grown in Paraguay with high yields and its leaves are one of the most complete fodder because they have a high content of proteins, vitamins and minerals. Likewise, the tenors, such as tannins, saponins and anti-nutritional factors, are minimal, almost negligible and not found inhibitors of trypsin or lectin. In our country do not have been evaluation studies of the content of enzymes that may contain these vegetables. However, in 1987, Dahot and Memon had shown the presence of lipase activity in the seeds of this plant that also grows on the Asian continent. In this sense, this work was developed in order to determine the activity of enzymes (lipase, a-amylase and urease) present in Moringa oleifera seeds grown in the region of the central Chaco Paraguayo with a view to its use in feed additives industry. The results showed that the seeds of Moringa extract obtained at pH 7 presented lipase, a-amylase and urease activity greater than at pH 5 for a-amylase and urease (Independent samples t-test p < 0,05) compared with studies at pH 5 developed by other researchers.. The results of the enzymes activities obtained with extracts of seeds that are grown in our country correspond to the highest percentage of soluble nitrogen obtained by Vazquez and Yubero in 2009 at pH 7. This work allowed to know the high potential have the Moringa seeds grown in the Paraguay in order to empower them as a source of production of enzymes, mainly of lipase and a-amylase as a feed supplement.
Key words: Moringa oleífera – seeds - enzymes- animal feed
INTRODUCCIÓN
La Moringa es un vegetal con numerosas especies distribuidas por zonas áridas y semiáridas de Asia, Africa y Madagascar. La especie más conocida es Moringa oleífera y su principal utilidad es de complemento alimenticio. Es un árbol de crecimiento muy rápido, resistente a la sequia, aunque con tendencia a perder las hojas en periodos de estres hídrico. En Paraguay, se cultiva desde el año 2004 con buenos rendimientos la variedad de Moringa oleífera Lamb. (1).
Las hojas de Moringa constituyen uno de los forrajes más completos, ricas en proteínas, vitaminas y minerales, con buena palatabilidad, que favorece el consumo por los diferentes animales de renta como cerdos, aves, incluso carpas, tilapias y otros peces herbivoros. La Moringa posee cualidades nutricionales sobresalientes, y es considerada como uno de los mejores vegetales perennes como alternativa de ingrediente para sustituir parcialmente la harina de pescado en alimentos balanceados para tilapia por su alto contenido en proteínas y carbohidratos, estudios similares fueron realizados en tilapias cultivadas en agua de mar (2).
Los tenores de factores antinutricionales, como taninos y saponinas, son mínimos, prácticamente despreciables y no se ha demostrado la presencia de inhibidores de tripsina y de lectina. En materia seca contiene un 10% de azúcares y la energia metabolizable en las hojas es de 9.5 MJ/kg masa seca (1).
En ensayos realizados en diversos estudios con ganado vacuno, porcino, ovino, caprino u avicola son coincidentes en la mejoria importante en el rendimiento de la ganancia de peso y en la producción de leche. Estos resultados han sido más eficientes en animales con dieta deficiente comparada con otros estudios similares en animales con dieta equilibrada. El extracto de semillas de la especie oleífera del Asia posee actividad lipasa (3), una enzima hidrolítica cuya acción es desdoblar los enlaces ester de los triacilgliceridos principalmente.
De acuerdo a la resolución Nº 84/93 del Mercado Común del Sur (4) las enzimas o preparaciones enzimáticas son sustancias de origen animal, vegetal o microbiano que actuan como coadyuvantes tecnológicos favoreciendo las reacciones químicas deseables en alimentos. En este sentido, la búsqueda de nuevas fuentes de enzimas con aplicaciones industriales como mejoradores de alimentos hace posible la utilización de recursos naturales existentes en el pais como la Moringa oleífera.
Las enzimas son catalizadores biológicos de alta eficiencia, que participan en la degradación de sustratos como los almidones o etilcarbamatos y actuan como mejoradores de los caracteres organolépticos y físicos de un alimento (5). Numerosas semillas de vegetales pueden contener actividad amilolitica o lipasica como las leguminosas por ejemplo. Algunas enzimas amiloliticas industriales pueden incrementar la digestibilidad in vitro del almidón y es posible usarlas como aditivos en dietas con una concentración mediana o alta de granos para rumiantes a fin de evaluar cambios en la respuesta productiva y la fermentación ruminal en borregos alimentados con grano de sorgo tratado con amilasas industriales (6).
Las enzimas tienen aplicaciones en la industria de bebidas, como en la transformación y producción de aromas y de productos intermedios. Entre las enzimas más utilizadas se encuentran las a-ß amilasa, invertasa, proteasa, glucosa isomerasa, lipasa, lactasa, glucosa oxidasa, pectinasa y otras. Son catalizadores de interés en la industria alimentaria las lipasas, amilasas y ureasas, utilizadas con diversos fines (5).
Los alimentos ricos en almidón, como frutas (plátano), tuberculos (papas) y cereales (trigo, arroz, maíz, cebada, sorgo, avena, mijo y centeno), contienen un gran número de enzimas, cuya actividad continúa aun después de cosechados y almacenados; entre las más importantes se encuentran varias hidrolasas, tales como proteasas, lipasas y carbohidrasas, que forman parte de los sistemas metabólicos propios de cada especie.
Entre estas enzimas se destaca a las amilasas como componentes de las proteínas citoplasmáticas divididas en dos grandes grupos: la a-amilasa y la ß-amilasa. El tratamiento de granos de sorgo con glucoamilasa de Aspergillus niger ha incrementado la digestión ruminal del almidón (7).
En los cereales se han determinado por electroforesis más de diez moleculas con actividad amilolitica, indicativo de que estas enzimas poseen varias isoenzimas. La a-amilasa es una endohidrolasa con acción aleatoria sobre los enlaces internos a (1,4) de la amilosa y de la amilopectina con lo cual se producen dextrinas; se le otorga la denominación de enzima licuante por inducir o favorecer la rápida reducción de la viscosidad de las soluciones de almidón. presencia provoca la rápida reducción de la viscosidad de las soluciones de almidón. Es capaz de romper las uniones glucosidicas adyacentes a ambos lados del enlace a (1,6) de la amilopectina, aunque no ataca específicamente este enlace. Por su parte la a-amilasa hidroliza los enlaces a (1,4), actividad que la clasifica como una exoenzima.
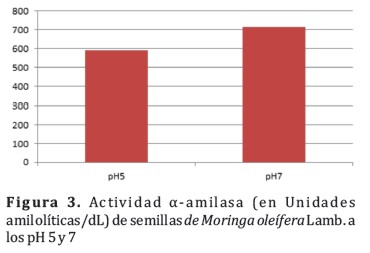
Una de las funciones más importantes de estas enzimas es la transformación del almidón durante el proceso de la panificación; su acción se inicia al mezclar todos los ingredientes en estado húmedo, produciendo maltosa y en menor cantidad glucosa debido a que la harina de trigo contiene más ß que a-amilasa. Estos monosacaridos y disacaridos sirven como sustrato para las levaduras en la producción de anhidrido carbónico y de etanol, así como para efectuar las reacciones de oscurecimiento no enzim´tico durante la cocción confiriendo la coloración caracteristica a los panificados. Ambas enzimas se inactivan en la etapa del horneado, pero la a-amilasa es más termorresistente que la ß-amilasa y ambas contribuyen a la textura del alimento.(Tabla1)
Las lipasas o triacyl-glycerol acylhydrolasas (EC 3.1.1.3) son un grupo de enzimas versatiles cuya actividad se presenta en los tejidos embrionarios de semillas especialmente en aquellas que presentan gran cantidad de triacilgliceroles y su actividad en las semillas de plantas aumenta rápidamente durante la germinación. Si bien las enzimas pueden obtenerse de varias fuentes, animales, vegetales o de microorganismos, el aprovechamiento del extracto de las fuentes vegetales se puede lograr eliminando previamente los factores antinutricionales que favorecerian la digestibilidad de otros cereales.
Las enzimas exógenas de interés industrial favorece la eliminación de factores antinutricionales, y el incremento del valor nutricional por degradación de los componentes de cereales (glucanasas, xilanasas) y suplementación de enzimas digestivas propias del animal (proteasas, amilasas, glucanasas, galactosidasas, fitasas). Como resultado en alimento destinado para las aves se evidencia, a) un aumento de la flexibilidad en la formulación de dietas, b) incremento del valor energético de los cereales y c) incremento de la digestibilidad, crecimiento y conversión del alimento (5).
La investigación se realizó a fin de determinar la actividad de enzimas (lipasa, ureasa y a-amilasa) presentes en las semillas de Moringa oleífera Lamb. cultivadas en la Región del Chaco Central paraguayo con el propósito de implementar su utilización en la industria de aditivos para alimentación animal.
MATERIALES Y MÉTODOS
Las semillas de Moringa oleífera Lamb. fueron colectadas a partir de cultivos procedentes de la región de Loma Plata, región central del Chaco Paraguayo. Las semillas separadas se conservaron en recipientes de plástico y en forma manual se procedió a separar la cascarilla que rodea a las mismas. Luego de este procedimiento, fueron pesadas y molidas empleando molino manual, de 100 g de semillas secas de Moringa las que luego fueron puestas en contacto con 300 mL de una solución de fosfato tamponado 100 mM, a pH 7 a temperatura ambiente (9). Bajo las condiciones señaladas se procedió a una agitación de 5 minutos en agitador orbital Cole Parmer Mod. 51704 y sonnicación con un equipo de ultrasonido SONICOR Mod. SC-152TH respectivamente. De aquí el extracto se centrifugo en una centrifuga refrigerada Sigma Mod. 2K15. Así mismo se prepararon extractos en 100 mM de buffer acetato a pH 5 y a temperatura ambiente.
Los valores de pH 5 y 7, fueron elegidos debido a que se pudo observar que a un pH cercano a 7 se obtiene un mayor rendimiento en la extracción de nitrógeno soluble de las semillas. A este pH entonces, se podría obtener una mayor rentabilidad en la extracción de las proteínas contenidas en la semilla de Moringa oleífera por el método de solubilización para su utilización en la industria alimentaria (1).
De los extractos obtenidos a pH 5 y 7 fueron tomados alicuotas del sobrenadante a fin de evaluar la actividad lipasa por el método turbidimétrico en presencia de 10 mM de deoxicolato de sodio a pH 9 en el cual se produce la hidrólisis de la trioleina en presencia de lipasa (10). Para las medidas de actividad lipasa se utilizó una solución buffer de deoxicolato 10 mM agregando 1 mL de trioleina agitando el sistema a fin de lograr una emulsión homogénea. Se leyeron las absorvancias de esta emulsión (buffer deoxicolato + sustrato trioleina). Todos los reactivos utilizados durante los ensayos experimentales fueron de calidad analítica. La actividad lipasa fue expresada en U/L.
Las medidas de la actividad de la ureasa de las semillas de Moringa oleífera Lamb. se determinaron por el método discontinuo para lo cual se prepararon tubos correspondientes al blanco de reactivo, estándar de ureasa y muestra que en este caso consistía en el extracto crudo obtenido tanto a pH 5 y 7. Las medidas de actividad se expresaron en Absorvancia/min. Cabe resaltar que las medidas de actividad ureasa son un indicador en el control de calidad de la harina de soja. La disminución de la actividad ureasa está altamente correlacionada con la eliminación de los inhibidores de tripsina y de otros factores antinutritivos (11).
Para determinar las medidas de la actividad a-amilasa de las semillas de Moringa oleífera Lamb. se siguió el método de Caraway modificado por el cual la muestra fue incubada con un sustrato de almidón y se determinó la disminución del color azul, después de agregar yodo comparando con un control siendo proporcional a la actividad de la amilasa de la muestra (12). Las medidas de actividad se expresaron en Unidades Amiloliticas/dL.
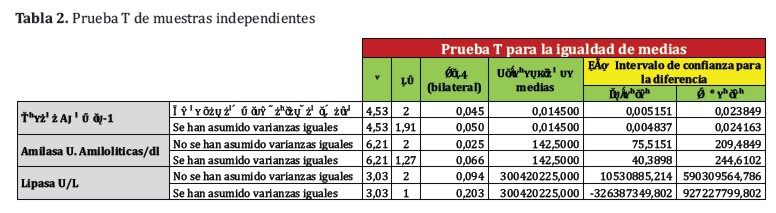
Las muestras de extracto fueron determinadas por duplicado para cada medida de actividad enzimática aplicándose la prueba de Kolmorogov-Smirnov para comprobarla distribución normal de los datos seguido de la prueba t para muestras independientes.
RESULTADOS Y DISCUSIÓN
La medición de las actividades de la lipasa, ureasa y a-amilasa a pH 5 – 7, realizadas minimamente por duplicado con las muestras de extracto crudo sometidas a la homogeneización en tiempos de 5 y 60 minutos, fueron iguales en ambos casos, razón por la cual, se decidió trabajar con tiempo de 5 minutos tanto para la agitación y sonnicación en la obtención del extracto crudo. Todas las actividades de enzimas fueron determinadas tanto a pH 5 y 7.
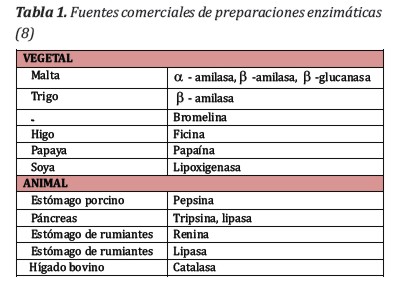
La medición de la actividad de la lipasa fue realizada utilizando diluciones 1:1000 para los extractos iniciales a pH 5 y 7. Los resultados se observan en la Figura 1.
A partir de la harina de las semillas sin cascarilla de la especie vegetal Moringa oleífera se obtuvo un extracto crudo en buffer fosfato 100 mM, pH 7 y a pH 5 a 25°C pues de acuerdo a estudios realizados previamente por Dahot y colaboradores la mayor actividad lipasa se daba a pH 5. Este estudio sin embargo determinó que los extractos acuosos de las semillas presentaron una mayor actividad a pH 7 aunque las diferencias encontradas a pH 5 y 7 no fueron significativas (prueba t para muestras independientes p< (0,05).
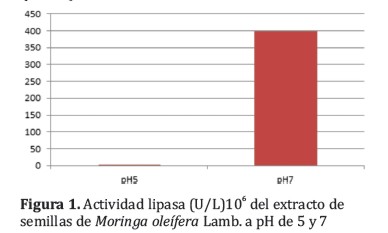
Así mismo, para las medidas de actividad ureasa fueron realizadas diluciones 1:10 para las determinaciones a pH 5 y pH 7, los resultados se demuestran en la Figura 2.
La actividad ureasa es baja lo que indica que la concentración de factores antinutricionales a pH 5 y pH 7 es baja y difieren significativamente uno de otro valor de pH (prueba t para muestras independientes p< 0,05).
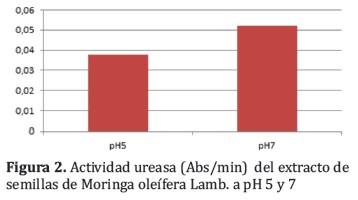
La actividad de la a-amilasa a pH 7 fueron mayores comparando con las demás actividades enzimáticas, objetos del estudio, determinadas en la dilución 1:1000 como se observa en la Figura 3 (prueba t para muestras independientes p< 0,05).
En todos los ensayos se encontró una mayor actividad de enzimas lipasa, ureasa y a-amilasa en los extractos a pH 7, aunque estas diferencias fueron significativas en el caso de las determinaciones de a-amilasa y ureasa (Tabla 2). Es probable que se requieran más muestras para demostrar la diferencia significativa existente tambien con la actividad lipasa a pH 5 y 7 aunque resulta claro que a pH 7 se obtienen desde el punto de vista industrial las mejores condiciones de extracción. La actividad ureasa fue baja lo que constituye un indicador del bajo contenido de factores antinutricionales.
De conformidad a estudios realizados por otros investigadores, la actividad enzimática es variable en función al clima, especie o región en donde se desarrolla el vegetal en estudio.
Basado en los resultados obtenidos considerando la alta actividad enzimática de la lipasa y amilasa permite que los extractos puedan ser utilizados como materia prima para aditivos o suplementos alimenticios destinados a la alimentación de los animales con el objeto de mejorar la digestibilidad. La Moringa es de hecho un vegetal con escaso contenido de antinutrientes (1) por lo que sus proteín as, entre estas las enzimas podrían favorecer la textura de los alimentos como así tambien aportar materia prima de alto valor biológico con el aporte de los extractos de la semilla.
CONCLUSIÓN
Fueron obtenidos extractos acuosos de las semillas de Moringa oleífera Lamb. a pH 5 y 7 condiciones favorecidas por la mayor cantidad de nitrógeno soluble (1). Las actividades enzimáticas de la lipasa, ureasa y a-amilasa fueron mayores a pH 7 que a pH 5 y significativamente superior para la ureasa y la a-amilasa (prueba t para muestras independientes p< 0,05).
A pH 7 los valores de actividad lipasa fueron en promedio 200.106 U/L, 0,052 Abs/min para la actividad ureasa y 717 Unidades Amiloliticas/dL de actividad a-amilasa. Por otro lado, al considerar que las semillas utilizadas fueron las cultivadas en la región central del Chaco Paraguayo la información obtenida con este estudio brinda la posibilidad de aplicar estos extractos bajo condiciones suaves y económicas de pH 7 al mejoramiento de la textura y palatabilidad de alimentos para animales tal como se aplica en los estudios realizados por Rivas-Vega y col, 2012 y otros investigadores.
BIBLIOGRAFÍA
1. Vázquez Falcón R D, Yubero F. Extracción de las proteinas solubles de semilla de moringa oleífera a diferentes pH y elaboración de la curva de solubilidad respectiva. Tesis (Licenciada en Ciencia y Tecnologia de Alimentos). San Lorenzo, Paraguay : Facultad de Ciencias Quimicas, Universidad Nacional de Asunción; 2009. [ Links ]
2. Rivas-Vega y colaboradores. Sustitución parcial de la harina de sardina con moringa oleífera en alimentos balanceados para juveniles de tilapia cultivada en agua de mar: (Oreochromismossombicus x Oceochromisniloticus). Biotecnia(S.l.). 2012. 14(2): 3-10. [ Links ]
3.Dahot MU, Memon A R. Properties of moringa seed lipase. Jour. of Scie. and Ind. Res. (Pakistan). 1987. 30 (11): 832-838. [ Links ]
4.Resolución Nº 84/93 del Mercado Común del Sur (MERCOSUR) Definición de Funciones de Coadyuvantes de Tecnologia. [ Links ]
5.Grebechova R, Prieto Contreras L. Biosíntesis de las enzimas pectoliticas a partir de hongos de aspergillus niger y aspergillus foetidus para aplicación en industria de alimentos. Rev. de Inves. (Col.) 2006; 6 (002): 153-162. [ Links ]
6.Mora-Jaimes G, Barcena-Gama R, Mendoza-Martinez G D,González-Muñoz S S, Herrera-Haro J G. 2002. Respuesta productiva y fermentación ruminal en borregos alimentada con grano de sorgo tratado con amilasas: especialidad de ganaderia. Revista Agrociencia. (Mex.). 2002; 36: 31-39. [ Links ]
7. Buendia-Rodriguez G, Mendoza Martinez G, Barcena Gama R, Ortega Cerrillo, M E, Solis Hernandez J, Lara-Bueno A. Efecto de la glucoamilasa de aspergillus niger en la digestibilidad in vitro de maiz´ y sorgo, y en la productividad de borregos. Agrociencia. (Mex.). 2003; 37 (004): 317-322. [ Links ]
8. Badui Dergal S. Quimica de los alimentos. 3ª ed. Mexico: Pearson Educación; 2000. [ Links ]
9.Yubero F, Garcia M, Romero C. Derivado enzimático de lipasa de moringa oleífera inmovilizada sobre soporte de silica-glutaraldehido. San Lorenzo: Dirección General Cientifica y Tecnológica : Facultad de Ciencias Quimicas, UNA; 2008. [ Links ]
10. Shihabi Z, Bishop C. Simplified turbidimetric assay for lipase activity.Clinical Chemistry. (E.E.U.U.). [199?]; 17 (12) [ Links ]
11. Dudley-Cash WA. Calidad de la harina de soja. In: American Soybean Association. IV Jornadas sobre Control de calidad de la harina de soja y soja integral.; 2003. [ Links ]
12. Ruíz Bedolla E, Suárez Rocha J T, Moreno Ruiz G. Evaluación de cuatro métodos para la determinación de amilasa sérica. Rev. Mex. de Pat. Cli. (Mex.). 1990; 37 (3). [ Links ]
*Dirección para correspondencia: Prof. Dra. Fatima Yubero. Facultad de Ciencias Quimicas, Universidad Nacional de Asunción, Ruta Mcal. Estigarribia km 10,5 - Campus Universitario - San Lorenzo - Paraguay
E-Mail: fyubero@qui.una.py