Introducción
Los peligros para la salud humana originados por los productos alimentarios pueden derivar de las materias primas utilizadas, de la manipulación y de todas las fases de elaboración, transporte, almacenamiento y venta de los alimentos (Botsoglou & Fletouris, 2001; Fajardo et al., 2011). Entre los principales peligros figuran la contaminación microbiana, los aditivos alimenticios, los contaminantes ambientales y los residuos de plaguicidas y de medicamentos de uso veterinario (Montalvo et al., 2004; Takeda & Akiyama, 1991). Los residuos de antibióticos en alimentos de origen animal pueden provocar reacciones alérgicas en individuos hipersensibles, pero, sobre todo, la administración de bajos niveles de antibióticos puede dar lugar a bacterias resistentes, que pueden llegar al ser humano a través de dichos alimentos (Cancho et al., 2000; García et al., 2005). Por todas estas razones los organismos encargados de la vigilancia de la salud pública, en muchos países, han desarrollado normativas de control de los Límites Máximos de Residuos (LMR) en tejidos animales destinados al consumo humano. El LMR representa aquella concentración permitida de un principio activo en alimentos de origen animal (músculo, hígado, riñón, grasa, leche, huevo, etc.) que al ser ingerida por el ser humano no constituye ningún riesgo para su salud (Alm El Dein & Elhearon, 2010; Farré & Barceló, 2012).
La contaminación, de los alimentos de consumo humano, se venía produciendo de manera natural, pero con la necesidad de las nuevas prácticas y de nuevos procedimientos industriales, han ido apareciendo nuevos tipos de contaminación, la seguridad de los alimentos que consumimos se ha convertido en una prioridad fundamental tanto para los consumidores como para las industrias productoras, esta atención denota la cobertura de las necesidades alimentarias de la población con productos de valor nutricional adecuado y en un rango de costes asumible (Montalvo et al., 2004; Mottier et al., 2003).
El uso de los antibióticos en veterinaria para el tratamiento de enfermedades en el ganado y sector avícola destinado al consumo humano, así como su utilización como aditivos en granjas industriales, han dado como resultado que deba considerarse su presencia potencial en alimentos de origen animal, cuando se utilizan de forma fraudulenta, indiscriminada y abusiva, existe la posibilidad de que residuos de dichos compuestos persistan en el alimento y pasen a la cadena de alimentación humana (Yorke & Froc, 2000; Verdon et al., 2005). Pero como ocurre en medicina humana, los antibióticos son empleados en veterinaria con la finalidad no sólo de curar (terapéutica), sino también de prevenir enfermedades (Stolker & Brinkman, 2005; Balizs & Hewitt, 2003). Además, en el caso de la veterinaria, los antibióticos son empleados como promotores del crecimiento, así como en horticultura y en agricultura. Los antibióticos pueden mejorar los rendimientos de la explotación ganadera, al incrementar la ganancia de peso y el índice de conversión de los alimentos, que van desde un 3-5% en pollos, un 4-5% en cerdos y terneros, hasta más de un 10% en vacuno de carne (Yoshida et al., 2009; Butaye et al., 2003).
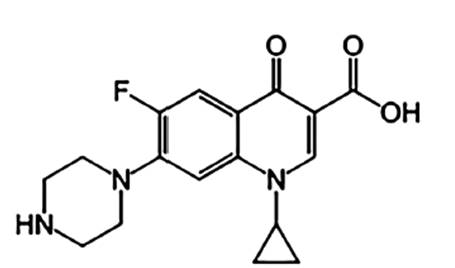
Unos de los antibióticos utilizado de uso veterinario y en seres humano es la Ciprofloxacina (Gorla et al., 1997; Nadezhda et al., 2012). Este compuesto pertenece a la clase de antibiótico llamada fluoroquinolona de la segunda generación y posee un amplio espectro de acción, según el nivel de actividad se lo utiliza para tratar o prevenir determinadas infecciones bacterianas. Su nombre químico es 1-ciclopropil-6-fluoro-1,4-dihidro- 4-oxo-7-(1-piperazinil)-3-quinolinocarboxílico-clorhidrato (Griggs et al., 2005; Macarov et al., 2012). Tiene la siguiente estructura química que vemos en la Figura 1.
Su fórmula molecular es C17H18FN3O3.HCl, posee un peso molecular de 367.82 g/mol (Gorla et al., 1997; Griggs et al., 2005). La Ciprofloxacina en su estado puro es un polvo de color amarillo pálido, ligeramente higroscópico y cristalino; soluble en agua y muy ligeramente en alcohol deshidratado, ligeramente soluble en metanol, es prácticamente insoluble en acetona, diclorometano y en acetato de etilo. En una solución de 2.5 % en agua tiene un pH de 3.5 a 4.5 (Griggs et al., 2005; Sorensen et al., 1999). En las aves, pollos de engorde y pavos, actúa contra enfermedades causadas por microorganismos Gram positivos, Gram negativos y My- coplasmas susceptibles a la Ciprofloxacina como neumonía e infecciones gastrointestinales (Gharieb & Atti, 2011; Kowalski, 2008). En este trabajo de investigación se ha desarrollado y validado una metodología analítica para la determinación y cuantificación de la Ciprofloxacina en huevos de gallinas que son comercializados en la zona metropolitana de Asunción utilizando para ello la cromatografía de líquido de alta resolución HPLC y la extracción líquido-líquido para extraer el analito de la matriz.
Materiales y métodos
Productos químicos y reactivos
Para los ensayos correspondientes se han utilizado reactivos de grado analítico. El patrón de Ciprofloxacina fue suministrado por la casa comercial Sigma-Aldrich (St. Louis, MO). La solución madre del analito fue preparada una sola vez a una concentración de 500 µg. mL-1 y fue almacenado a -20°C en una botella de vidrio oscuro. El acetonitrilo que se utilizó para la preparación de la fase móvil y la extracción del analito fue de grado cromatográfico de la marca J.T. Baker (CAS Nº 75-05-8), el agua destilada utilizada fue obtenida del equipo (QUIMIS, Brasil) y posteriormente purificada en un equipo Barnstead ™ MicroPure ™. La Trietilamina de la marca Fluka (CAS: 121-44-8), el acetato amónico (CAS 631-61-8) de la Marca Merck , el ácido fosfórico (CAS: 7664-38-2) Merck de 85% de pureza, ácido acético de la marca Merck (CAS 64-19-7).
Instrumentación y software
Para la extracción de la Ciprofloxacina de la matriz estudiada se utilizó una la técnica de extracción líquido-líquido, también conocida como extracción con solventes o extracción con disolventes, para ello se utilizó una variedad de materiales de vidriería como vasos de precipitados, embudos, varilla de vidrio entre otros. Un vortex marca LW Scientific y una centrífuga de mesa de la marca Presvac DCS-16 RV. Para la detección y cuantificación del analito se utilizó un cromatógrafo líquido de alta resolución HPLC - FLD. La detección se realizó con fluorescencia a longitudes de onda de 294 nm (excitación) 500 nm (emisión). La separación cromatográfica del analito en estudio se obtuvo utilizando una columna ZORBAX Eclipse XDB-C18 (4.6 mm × 150 mm; 5 µm). El manejo del instrumento, la detección de los picos y la integración de los mismos se llevaron a cabo utilizando el software LCsolution. exe (versión 1.0). Se utilizó una balanza analítica RADWAG (modelo 310.R2) made in Polan (EU) para realizar el peso del estándar, reactivos y las muestras. Se utilizó un software Statgraphics Plus versión 5.0 (Manugistics, Rockville, MD, EE. UU., 2000) para el tratamiento estadístico de los datos. Paquetes Microsoft® Office: Word®, Excel® y PowerPoint® 2010.
Toma y Preparación de las Muestras
La técnica de muestreo utilizada fue el no probabilístico del tipo conveniencia. Los huevos de gallinas fueron muestreados de supermercados que se encuentran en el área metropolitana de Asunción, se adquirieron tres diferentes marcas comerciales y huevos de procedencia casera que se utilizó como blanco. Cada muestra contó con 6 huevos que fueron tratadas. Primeramente, se determinó la cantidad del contenido por cada huevo y el promedio total por marca, luego se realizó un pull de cada marca agregando las yemas y las claras en un recipiente. Una vez determinada el contenido de cada huevo, el promedio y el pull de todas las marcas, se traspasó en tubos Falcon (Fig. 2), se identificaron las marcas y fueron guardadas en el refrigerador a una temperatura de 4°C para evitar su descomposición hasta el momento de su análisis. La técnica de extracción utilizada fue la de líquido-líquido. Se pesó 1 gramo de cada pull de las marcas de huevos estudiadas, todas por triplicado. A cada muestra de le adicionó 4 mL de una solución de ácido acético/etanol absoluto, en una proporción 1:99 y fueron agitadas durante 5 minutos en un vortex. Posteriormente se le agregó 500 µL de ACN y se agitaron otros 5 minutos. El extracto fue centrifugado durante 20 minutos a 3220 g el sobrenadante fue filtrado por filtro minisart de 0,45 µm y traspasadas a un vial de vidrio de HPLC para su posterior lectura cromatográfica.
Preparación de las muestras patrones
Primeramente, se preparó una disolución patrón de Ciprofloxacina a partir de 50 mg que se disolvieron en un matraz de 100 mL (500 µg/mL) con fase móvil, seguidamente se traspasaron 10 mL a un matraz de 100 mL (50 µg/mL) a partir de esta última disolución patrón se prepararon 6 disoluciones más diluidas de concentraciones 1, 2, 4, 6 y 8 µg/mL (3 réplicas por cada nivel):
2 mL de solución patrón de Ciprofloxacina de 50 µg/mL en 100 mL con fase móvil (1 µg/mL).
4 mL de solución patrón de Ciprofloxacina de 50 µg/mL en 100 mL con fase móvil (2 µg/mL).
4 mL de solución patrón de Ciprofloxacina de 50 µg/mL en 50 mL con fase móvil (4 µg/mL).
6 mL de solución patrón de Ciprofloxacina de 50 µg/mL en 50 mL con fase móvil (6 µg/mL).
8 mL de solución patrón de Ciprofloxacina de 50 µg/mL en 50 mL con fase móvil (8 µg/mL).
Optimización de las condiciones cromatográficas
HPLC
Para la optimización del método cromatográfico del HPLC se empleó una disolución de la Ciprofloxacina en fase móvil a una concentración de 6 µg/mL. En primer lugar, se fijó la detección del analito en el equipo que fue del tipo fluorescencia a unas longitudes de onda de excitación de 294 nm y de emisión 500 nm. En el desarrollo de la metodología propuesta se empleó la cromatografía en fase reversa (fase estacionaria menos polar que la fase móvil). Se seleccionó una columna con relleno ZORBAX Eclipse XDB-C18 (4.6 mm × 150 mm; 5 µm) de dimensiones y tamaño de partícula; todo ello de acuerdo a la afinidad, la muy buena resolución y las características fisicoquímicas del analito con la misma.
Se ensayaron las principales variables que afectan a la separación cromatográfico y a la intensidad de la señal, se evaluaron diferentes fases móviles de acuerdo a la naturaleza del analito, se ensayaron mezclas de acetonitrilo y una solución acuosa ajustada a pH 4 con ácido cítrico 50 mM y trietilamina, las diferentes proporciones ensaya- das fueron (50:50), (30:70) y (10:90). También se evaluó el efecto del caudal, la temperatura de la columna y volúmenes de inyección en la detección de la Ciprofloxacina. Se ensayaron velocidades de flujo isocrático desde 1 a 2,5 mL.min-1; las tempe raturas de la columna de 30 °C a 50 °C. Finalmente se evaluó el volumen de inyección desde 5 a 30 µL.
Validación del método analítico
Para la validación del método analítico propuesto en este trabajo de investigación se siguieron las recomendaciones de la “Guía de validación para métodos bioanalíticos” propuesta por la FDA. Los parámetros de validación que fueron evaluados a partir del calibrado son: linealidad, límites de detección y cuantificación, rango dinámico lineal, sensibilidad analítica y exactitud del método expresada en términos de precisión y veracidad (USP 29, 2005).
Los requisitos de la validación del método analítico se establecieron de la siguiente manera: (a) Linealidad, el coeficiente de determinación (R2) debe ser igual o mayor que 0,999 y la desviación residual máxima debe ser menor al 25%. (b) La pre cisión, expresada como desviación estándar relativa DER (precisión entre días) debe ser ≤ 30%. (c), la veracidad, expresada como recuperación media, debe estar en el rango 70 a 120%. (d) El límite de cuantificación (LC) debe cumplir con los requisitos
(b) y (c). Estos requisitos se ajustan a la Decisión 2002/657 / CE de la Comisión de la Comunidad Europea (Benítez-Villalba et al., 2013).
La calidad, confiabilidad y consistencia de un método analítico validado se determina en base a la sensibilidad, linealidad, límite de detección (LD), límite de cuantificación (LC), exactitud y precisión del analito estudiado. Para ello se han preparado 5 disoluciones estándar partiendo de la solución madre de concentración de 500 µg/mL para obtener otras disoluciones de concentraciones de 1 - 2 - 4 - 6 - 8 y 10 µg/mL utilizando como disolvente la fase móvil detallado su preparación en el ítem Preparación de las muestras patrones. Cada parámetro de validación se define como sigue: linealidad que es la capacidad de un método analítico de obtener resultados proporcionales a la concentración del o los analitos en una muestra dentro de un intervalo determinado; límite de detección LD es la cantidad más baja del analito en una muestra que puede ser detectada por una única medición, con un nivel de confianza determinado, pero no necesariamente cuantificada con sensibilidad analítica de un método analítico o sensibilidad de la calibración mide la relación entre la señal instrumental y la concentración del analito, y viene dada por la pendiente de la recta de calibración (González et al., 1996); la exactitud es la cercanía del acuerdo entre el valor que se acepta ya sea como un valor verdadero convencional o un valor de referencia aceptado y el valor encontrado; y la precisión es la cercanía del acuerdo entre una serie de mediciones obtenidas de múltiples muestras de una homogénea muestra en las condiciones prescritas.
Los parámetros de validación fueron calculados de la siguiente manera: la linealidad se calculó a partir de seis concentraciones de los estándares en un rango de concentración de 1 - 10 µg/mL; para evaluar la linealidad, se construyó un gráfico de la señal producida por el analito en función de la concentración del mismo y la regresión lineal se calculó por el método de los mínimos cuadrados. Calculando el coeficiente de correlación y el intercepto para la Ciprofloxacina. El límite de detección se determinó mediante la fórmula LD = 3.3 x So y el Límite de cuantificación se determinó mediante la fórmula LC = 10 x So, donde
(Sy/x = desviación estándar de la regresión, b = pendiente, n = puntos de calibración (Benítez-Villalba et al., 2018).
El Rango Dinámico Lineal (RDL) se estableció entre el límite de cuantificación del método y el límite superior del intervalo de concentraciones en la que fue aplicado al método. La sensibilidad de un método analítico o sensibilidad de la calibración se propuso como la sensibilidad analítica un valor exacto; límite de cuantificación LC es la cantidad más baja de un analito en una muestra (SAnalitica) que se calcula por el cociente entre la que puede ser cuantitativamente determinada con exactitud aceptable; Rango Dinámico Lineal (RDL) es la que se establece como el intervalo de concentraciones que comprenden entre el límite de cuantificación de los métodos y el límite superior del intervalo de concentraciones en el que se ha aplicado al método analítico (IUPAC 1978); la desviación estándar de la regresión (Sy/x) y la pendiente del calibrado (b), según la ecuación SAnalítica= Sy/x / b (Benítez-Villalba et al., 2021; Mandel & Stiehler, 1954).
Exactitud del Método, Precisión y Veracidad, para establecer la exactitud del método propuesto, se ha estudiado la veracidad del mismo en términos de recuperación con muestras dopadas y su precisión en términos de variabilidad inter e intradía. Para el estudio de exactitud del método en términos de veracidad se llevó a cabo un estudio de recuperación a tres niveles de concentración (4, 6, 8 µg/mL).
Tabla 1. Valores óptimos de las condiciones cromatográficas
| Fase estacionaria | Zorbax (C18) 250 mm x 4.5 mm x 5 µm |
| Fase móvil | Acetonitrilo:Agua ácido cítrico 50 mM, ajustado a pH 4 con trietilamina (10:90) |
| Modalidad | Isocrática |
| Flujo | 2 mL/min |
| Volumen de inyección | 20 µL |
| Temperatura de la columna | 30 oC |
| Detección | Fluorescencia: 294 nm (excitación) 500 nm (emisión) |
Las muestras fueron analizadas empleando el procedimiento operatorio descrito a lo largo del artículo y la concentración del analito se determinó por interpolación a la curva de calibrado dentro del rango dinámico lineal. Los valores de recuperación se obtuvieron por comparación con la cantidad de analito que fue añadida a las muestras de huevo casero (blanco), previamente fueron cuantificada la Ciprofloxacina realizando todo el procedimiento de extracción (Benítez Villalba et al., 2018). Cada analito se expresó como porcentaje y se calculó mediante la ecuación: recuperación (%) = S1 / (S2 + S3) × 100, donde S1 = cantidad encontrada (μg/mL) en la muestra enriquecida, S2 = cantidad presente originalmente en la muestra no enriquecida, y S3 = cantidad (μg/mL) de analito agregado a la muestra.
Para evaluar la exactitud del método en términos de precisión, se estudió la repetibilidad (precisión “intra-día”) y la reproducibilidad (precisión “inter- día”) (Benítez Villalba et al., 2013). Para ello, se realizaron diversas réplicas de los análisis llevados a cabo en el estudio de veracidad, durante un mismo día y durante tres días consecutivos. Cada muestra dopada o enriquecida fue extraída y analizada por triplicado (previamente cuantificada la Ciprofloxacina), es decir tres réplicas de cada punto en el mismo día para evaluar la variabilidad “intra-día” y se repitió en tres días consecutivos para evaluar la precisión, expresada como desviación estándar relativa (DER) (Norma ISO 5725 1994; European Commissio, 2002; Massart et al., 1997).
Resultados y discusión
Condiciones del cromatográficas HPLC
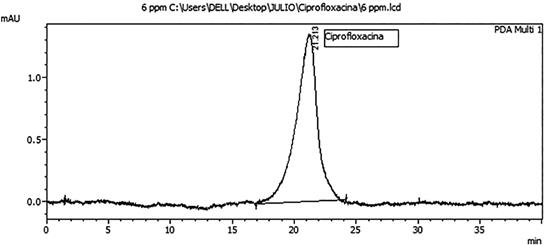
De las condiciones cromatográficas que fueron optimizadas en el cromatógrafo de líquidos de alta resolución HPLC la fase móvil seleccionada fue el Acetonitrilo : Agua ácido cítrico 50 mM, ajustado a pH 4 con trietilamina (10:90) por dar una muy buena señal analítica; la velocidad de flujo óptimo fue el de 2 mL/min ya que mejoró significativamente la resolución y la forma del pico, la intensidad de respuesta y tiempo de retención; la temperatura optima de la columna fue 30 °C que mostró una muy buena forma del pico mientras que el volumen de inyección optimo fue de 20 µL y la detección fluorescencia fue de 294 nm (excitación) 500 nm (emisión). Los resultados de los valores óptimos se pueden observar en la Tabla 1 así como el cromatograma obtenido a partir de estas condiciones óptimas en la Fig. 3.
Validación del método analítico
A continuación, se detallan los resultados obtenidos de la validación del método analítico para la determinación y cuantificación de la Ciprofloxacina en muestras de huevos que son comercializados en centros comerciales de la Gran Asunción. Se realizó la extracción del analito mediante la técnica de extracción líquido-líquido; a continuación, la validación del método analítico y seguido la detección
y cuantificación de la Ciprofloxacina por la técnica de cromatografía de líquido de alta resolución HPLC. En la Tabla 2 se observan los resultados de los parámetros de calibración de la técnica analítica en estudio, donde R2 (%) es el coeficiente de correlación, n = puntos de calibración, b = pendiente, Sb = desviación estándar de la pendiente, a = intercepto, Sa = desviación estándar del intercepto, Sy/x = desviación estándar de la regresión, % plof = valor P de prueba de falta de ajuste, LD = límite de detección, LC = Limite de cuantificación, RDL = rango dinámico lineal (Benítez Villalba et al., 2013; Mandel & Stiehler, 1954).
Tabla 2. Parámetros de calibración en la técnica analítica HPLC
| Linealidad | |
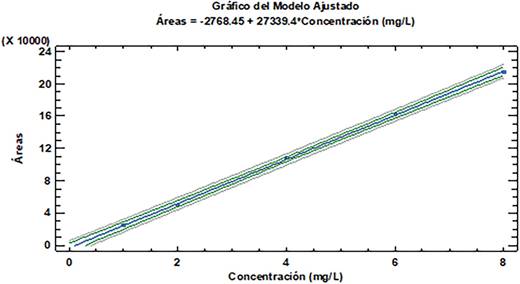
| Ecuación de la recta | Y=27342*X - 2772.4 |
| R2(%) | 99.95 |
| n | 15 |
| b(µg/mL) | 27339.4 |
| Sb | 845.816 |
| A | -2768.450 |
| Sa | 171.937 |
| Sy/x | 1705.550 |
| %plof | 0.978 |
| LD(µg/mL) | 0.180 |
| LC(µg/mL) | 0.601 |
| Sensibilidad | 0.0624 |
| RDL(µg/mL) | 0.601-8 |
Linealidad: Dos aspectos importantes y fundamentales se examinaron en esta validación del método analítico, el Límite de Detección (LD) y el Límite de Cuantificación (LC) cuyos resultados fueron respectivamente de 0.180 µg/mL y 0.601 µg/ mL demostrando en este sentido que en el método propuesto es altamente sensible y puede ser utilizado en la detección y cuantificación del analito en esta matriz. Se detalla también el Rango Dinámico Lineal (RDL) del analito en el calibrado que va de 0.601-8 µg/mL. El valor obtenido del Coeficiente de Correlación %R2 de la curva de calibrado fue de 99.95 demostrando que existe linealidad en los intervalos estudiados; además la sensibilidad del método analítico o sensibilidad de la calibración que se ha medido mediante la relación entre señal instrumental y la concentración del analito del rango lineal que viene dada por la pendiente de la recta de calibrado fue de 0.0624 µg/mL. En la Figura 4 se observa el gráfico de la curva de calibrado de la Ciprofloxacina.
Exactitud del Método Analítico: se realizó el estudio de recuperación de la técnica analítica de extracción mediante la fortificación de una disolución patrón a las muestras de huevo casero (que previamente analizada no contiene la Ciprofloxacina) a tres niveles de concentración diferentes 4 - 6 y 8 µg/mL (por triplicado). Los cálculos se realizaron de acuerdo a la metodología que esta descrito en el ítem de validación del método analítico. En las Tablas 3 y 4 se muestran los valores de recuperación obtenido en esta técnica.
Se logró obtener recuperaciones inter e intra día entre 81% y 85% para la Ciprofloxacina en esta ma triz lo que nos lleva a deducir que el procedimiento de extracción es eficiente y el método veraz. Por otro lado, el valor obtenido en esta técnica analítica la DER fue menor al 2%. Este dato se encuentra dentro de los límites aceptables para cumplir los requisitos establecidos en la guía de validación empleada, según la cual se considera aceptable valores iguales o inferiores al 15% en general y al 20 % en la zona próxima al límite de detección del método, por lo que se puede concluir que el método propuesto de la técnica de extracción líquido - líquido cumple con los requisitos de precisión (Cuadros Rodríguez et al., 1993). Se trata por tanto de un método veraz, preciso y por tanto exacto.
Aplicación del método analítico
Al finalizar el desarrollo y la validación del método analítico se procedió a determinar y cuantificar el contenido de la Ciprofloxacina en las muestras de huevos que fueron procesadas de acuerdo a la preparación de las muestras utilizando la curva de calibrado descrito en la metodología. Los resultados obtenidos de la extracción de este analito en las muestras de huevos se pueden observar en la Tabla 5.
Tabla 3 Ensayos de recuperación para la determinación de la exactitud en términos de veracidad del método utilizando la técnica de extracción líquido-líquido.
| Ensayo Intra - día | ||||||
| Analito | Dopado µg/mL | Observado µg/mL | DE | Recuperación % | DER % | n |
| Ciprofloxacina | 4 | 3.39 | 0.0304 | 84.75 | 0.1471 | 3 |
| 6 | 4.99 | 0.0658 | 83.21 | 0.0574 | 3 | |
| 8 | 6.67 | 0.0075 | 83.33 | 0.0357 | 3 | |
Tabla 4 Ensayos de recuperación para la determinación de la exactitud en términos de precisión del método utilizando la técnica de extracción líquido-líquido.
| Ensayo Inter - día | ||||||
|---|---|---|---|---|---|---|
| Analito | Dopado µg.mL-1 | Observado µg.mL-1 | DE | Recuperación % | DER % | n |
| Ciprofloxacina | 4 | 3.2552 | 1.1279 | 81.38 | 0.0371 | 3 |
| 6 | 4.9591 | 1.1811 | 82.65 | 1.1344 | 3 | |
| 8 | 6.4915 | 1.0932 | 81.14 | 1.1092 | 3 | |
Como se puede observar en la Tabla 5, la Ciprofloxacina se encontró y cuantificó en las tres marcas de huevos analizadas que fueron muestreadas en supermercados del Gran Asunción, a unos intervalos de concentraciones comprendidos de 40.34 y 46.09 µg/Huevo, es decir se ha obtenido los siguientes resultados (Marca 1 = 40.47 µg/Huevo, Marca 2 = 46.09 µg/Huevo y Marca 3 = 40.34 µg/Huevo). Por otro lado, el antibiótico objeto de estudio no ha sido detectado en las muestras de huevos caseros, la explicación a este hecho puede radicar en que la Ciprofloxacina se haya metabolizado de forma natural en esta matriz o se encuentre por debajo del límite de cuantificación o que dicho antibiótico no se encuentre dentro de la dieta del animal en los piensos etc.
Conclusión
La presencia de antibióticos en el medio ambiente y la vida cotidiana se ha convertido en los últimos años en un asunto delicado e importante. La mayor parte de estas sustancias se acumulan en nuestro organismo y entran a través de la medicación y otras veces en la alimentación. Por este motivo es necesario el estudio de estas especies químicas en animales y productos que derivan de ellas ya que estos medicamentos son probablemente uno de los grupos más ampliamente utilizados en medicina veterinaria para el tratamiento de enfermedades en animales de producción. En nuestro país, el registro de los fármacos tiene autorizado el uso de fluoroquinolonas en pollos en crecimiento. Por otro lado, no contamos con un control sobre el uso extra etiqueta, por lo que no podemos asegurar el no uso de estos fármacos en estas aves y por lo tanto la ausencia de residuos de antimicrobianos en huevos destinados a consumo de la población.
Tabla 5 Concentración de la Ciprofloxacina encontradas en las muestras. ND: no detectado (valor inferior al LD); D: detectado, pero no cuantificado (valor entre el LD y el LC).
| Concentración de la Ciprofloxacina en muestras de huevos µg.g-1 | ||||
| Marcas | Muestras | Concentraciones µg.g-1 | Promedio µg.g-1 | µg/Huevo |
| Marca 1 | Mtra 1 | 0.8677 | 0.8432 | 40.47 |
| Mtra 2 | 0.8411 | |||
| Mtra 3 | 0.8208 | |||
| Marca 2 | Mtra 1 | 0.7813 | 0.8768 | 46.09 |
| Mtra 2 | 0.8391 | |||
| Mtra 3 | 1.0099 | |||
| Marca 3 | Mtra 1 | 0.8247 | 0.7498 | 40.34 |
| Mtra 2 | 0.7722 | |||
| Mtra 3 | 0.6524 | |||
| Casero | Mtra 1 | ND | ND | ND |
| Mtra 2 | ND | |||
| Mtra 3 | ND | |||
Hemos podido demostrar con nuestra técnica analítica desarrollada la presencia de este compuesto a concentraciones de 40.34 µg/Huevo, 40.47 µg/ Huevo y 46.09 µg/Huevo en las diferentes muestras de las marcas de huevos de gallinas estudiadas. Para ello en este trabajo de investigación se ha desarrollado y validado un método analítico para la determinación y cuantificación de la Ciprofloxacina (antibiótico de uso veterinario) en un tipo de muestra muy compleja como es la del huevo con límites de detección muy satisfactorios. Se ha puesto a punto un método analítico, que incluye una etapa de extracción en fase líquida, previa a su detección y cuantificación mediante cromatografía de líquidos de alta resolución HPLC. El método ha sido validado y utilizado con éxito para la determinación y cuantificación de la Ciprofloxacina en muestras de huevos obtenidas de supermercados del Gran Asunción. El método analítico ha demostrado ser altamente sensible en la detección de esté antibiótico en las muestras de huevos, con límite de detección inferior a 0,18 µg.g-1. El método analítico desarrollado ofrece una importante innovación científica, ya que en la actualidad son muy pocos los métodos publicados sobre estudios de estos compuestos en matrices biológicas, principalmente en huevos de gallina












 uBio
uBio