La Stevia (Stevia rebaudiana Bertoni) conocida en guaraní como ka'a he'ê (hierba dulce); es una planta nativa de nuestro país, específicamente del valle del río Monday, donde crece en suelos arenosos cerca de las corrientes de agua (Madan et al., 2010; Brandle et al., 1998; Yadav et al., 2011). Es resistente a las bajas temperaturas, aunque el ritmo al que crece es mayor en estaciones cálidas (Aranda González et al.,2014; Curi et al., 1986; Melis, 1995). Es un arbusto que puede alcanzar hasta los 65 cm de altura. Sus hojas (Fig. 1a) son lanceoladas y oval-lanceoladas, dispuestas de forma opuesta y son sésiles. Éstas se encuentran serradas en su tramo medio y presentan tricomas en su superficie de diferentes tamaños: grandes, los cuales oscilan entre los 4- 5 µm, y pequeños, de aproximadamente 2,5 µm. Sus flores son pequeñas (7-15 mm) y de color blanco, dispuestas en una inflorescencia cimosa irregular. La semilla es un aquenio con vilano de aproximadamente 3 mm (Wöelwer-Rieck, 2012; Kujur et al., 2010).
.
Nuestro país se destaca con una superficie sembrada de 2.300 hectáreas que produjeron en el año 2014 aproximadamente 3.680 toneladas ocupando el segundo lugar detrás de China en cuanto a la venta del Ka’a He’e. Los departamentos paragua- yos que tienen mayor rendimiento (kilogramos por hectárea) son San Pedro, Caaguazú, Itapúa y Alto Paraná (Woelwer Rieck et al., 2010; Yong Heng et al., 2014; Shukla et al., 2011).
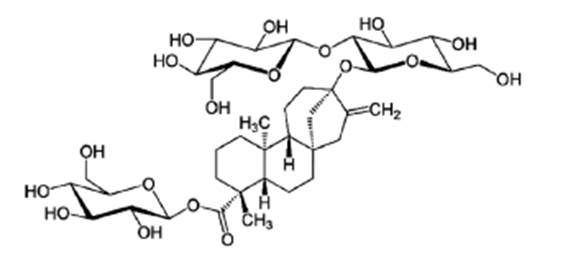
Existen unas 261 especies aceptadas que forman parte del género Stevia, pero la Stevia rebaudiana Bertoni es una de las especies productoras de glucósidos de esteviol (The Plant List 2013) que genera mayor potencial edulcorante (Brandle et al., 1998). Los compuestos responsables de la propiedad edulcorante de la planta, son los glucósidos diterpenos derivados de esteviol. En las variedades generalmente cultivadas de Stevia, los principales compuestos glucósidos de esteviol son cuatro: esteviósido, rebaudiósido A, dulcósido A y rebaudiósido C, entre los cuales destacan en cantidad los primeros dos (Lewis, W.H. 1992). El esteviósido (Fig. 2) es 250 - 300 más dulce que el azúcar, aunque con un sabor ligeramente amargo, mientras que el Rebaudiósido A (Fig. 3) tiene mayor capacidad edulcorante (350-450 veces más que el azúcar) y sin resabio amargo (Goyal et al., 2009; Jackson et al., 2009). En menor cantidad, se pueden encontrar el rebaudiósido C y dulcósido A junto con estevolbiósido, rubusósido, rebaudiósido B, D, E y F (Woelwer Rieck et al., 2009; Brandle, 1999).
Debido a las características que contiene la planta, la Stevia ha sido objeto de estudio desde principios del siglo XX, tanto para su producción y su comercio por lo que se han visto incrementa- dos con las mejoras de los procesos de extracción y refinamientos de sus glucósidos (Bridel et al., 1931; Wood et al., 1931). La mayoría de las investigaciones han realizados estudios para mejorar el rendimiento en los procesos de obtención de tales glucósidos, así como la optimización de las extracciones acuosas, más sencillas y económicas que las extracciones con otros disolventes. (Kaneda et al., 1977; Sakamoto, 1977)
.
.
El consumo de Stevia es cada vez mayor, por lo cual se debe investigar y desarrollar una alter- nativa de extracción económica y socialmente viable, favoreciendo así su consumo regional y nacional. Además, existen motivos a nivel salud para su consumo, por ejemplo: puede ser consumida por personas con diabetes, obesidad, ayuda a la prevención de caries, etc. (Anton et al., 2010). La planta ha llamado la atención en un momento de incremento en la demanda de los alimentos alternativos bajos en calorías y se ha demostrado resultados prometedores en investigaciones médicas en el tratamiento de la obesidad y presión arterial (Barba et al., 2014). La Stevia no tiene ningún efecto en el azúcar en sangre, y es por esta razón, que resulta un edulcorante natural atractivo para el uso de pacientes diabéticos y los que se encuentran bajo dietas con control de hidratos de carbono (Millones, 2014).
En este trabajo de investigación se tiene como objetivo la determinación y cuantificación de los principales compuestos glucósidos del esteviol de las hojas de Stevia comercial (Fig. 1b) para ello se ha utilizado una técnica de extracción sólido-líquido para separar los glucósidos de la matriz y desarrollar una metodología analítica para la determinación y cuantificación de los analitos mediante la cromato- grafía de líquidos de alta resolución HPLC.
Materiales y métodos
Productos químicos y reactivos
Para los ensayos correspondientes se han utilizados reactivos de grado analítico. El patrón de Stevia que se ha utilizado fue una materia prima certificada. La solución madre del analito fue preparada una sola vez a una concentración de 1000 µg. mL-1 y se almacenó a -20 °C en una botella de vidrio oscuro. El acetonitrilo que se utilizó para la preparación de la fase móvil fue de grado cromatográfico (Merck, Darmstadt, Alemania). Los reactivos carbonato de sodio y sulfato de sodio empleados fueron de calidad analítica (Merck, Darmstadt, Alemania). El agua destilada se obtuvo en un equipo (QUIMIS, Brasil) y posteriormente purificada en un equipo Barnstead ™ MicroPure ™.
Instrumentación y software
Para la extracción de los glucósidos del steviol de la matriz estudiada se utilizó un equipo de extracción Soxhlet, una variedad de materiales de vidriería como vasos de precipitados, embudos, varilla de vidrio, soporte universal, bomba al vacío, equipo de reflujo soxhlet entre otros. Una centrífuga de mesa de la marca Presvac DCS-16 RV. La separación cromatográfica de los analitos en estudio se obtuvo utilizando una columna ZORBAX Eclipse XDB-C18 (4.6 mm × 150 mm; 5 µm). El manejo del instrumento, la detección de los picos y la integración de los mismos se llevaron a cabo utilizando el software LCsolution. exe (versión 1.0). Se utilizó una balanza analítica RADWAG (modelo 310.R2) made in Polan (EU) para realizar el peso del estándar, reactivos y las muestras. Se utilizó un software Statgraphics Plus versión 5.0 (Manugistics, Rockville, MD, EE. UU., 2000) para el tratamiento estadístico de los datos. Paquetes Microsoft® Office: Word®, Excel® y PowerPoint® 2010.
Elaboración del extracto
Primeramente, se procedió a la obtención del extracto a partir de las hojas de Stevia que fueron adquiridas de un supermercado ubicada en el Área Metropolitana de Asunción. Para ello se pesaron 1 gramo de las hojas secas de Stevia comercial previamente triturados en un mortero (por triplicado), se llevó a reflujo con 10 mL de agua destilada durante 30 minutos a (100 ˚C) en un equipo de reflujo soxhlet. Los extractos se dejaron enfriar a temperatura ambiente y se centrifugaron a 2500 rpm por 10 minutos. Del extracto se tomó una alícuota de 300 µL y se transfirió en un matraz aforado de 10 mL, se diluyó y se llevó a volumen con agua destila- da. Se filtró con una jeringa y filtro teflón 0,45 µm en un vial de 2 mL para luego inyectarlo al equipo de HPLC.
Preparación de las muestras patrones
Se ha preparado una disolución madre de Stevia, a partir de 25 mg de la materia prima (Ka´a he´e polvo) se disolvieron en un matraz aforado de 25 mL en agua destilada (1000 µg.mL-1). A partir de esta solución madre, se prepararon 5 disoluciones más diluidas de concentraciones de 10, 25, 50, 75, 200, 500 y 1000 µg.mL-1 de Stevia:
1 mL de solución madre de Stevia de 1000 µg.mL-1 /100 mL de agua destilada (10 µg.mL-1 ).
5 mL de solución madre de Stevia de 1000 µg.mL-1/200 mL de agua destilada (25 µg.mL-1).
mL de solución madre de Stevia de 1000 µg.mL-1 /20 mL de agua destilada (50 µg.mL-1).
1,5 mL de solución madre de Stevia de 1000 µg.mL-1/20 mL de agua destilada (75 µg.mL-1).
5 mL de solución madre de Stevia de 1000 µg.mL-1 /25 ml de agua destilada (200 µg.mL-1).
5 mL de solución madre de Stevia de 1000 µg.mL-1 /10 ml de agua destilada (500 µg.mL-1).
Las condiciones cromatográficas fueron optimizadas.
Para la optimización del método cromatográfico del HPLC se empleó una disolución acuosa que contenía los glucósidos del steviol a una concentración de 50 µg.mL-1. Dadas las características de los analitos, en el desarrollo de la metodología propuesta se ha empleado la cromatografía en fase reversa (fase estacionaria menos polar que la fase móvil). Se seleccionó una columna con relleno ZORBAX Eclipse XDB-C18 (4.6 mm × 150 mm; 5 µm) de dimensiones y tamaño de partícula de acuerdo a las características fisicoquímicas de los analitos. Se estudiaron las principales variables que afectan a la separación cromatográfico y la intensidad de la señal, fueron evaluados diferentes fases móviles de acuerdo a la naturaleza de los analitos, se ensayaron mezclas de acetonitrilo y solución amortiguadora de fosfato de sodio (10 mmol/L, pH 2.6) a diferentes proporciones (70:30), (80:20) y (90:10). También se evaluó el efecto del caudal, la temperatura de la columna y volúmenes de inyección en la detección los glucósidos del steviol. Se ensayaron velocidades de flujo isocrático de 0,5 a 1,5 mL.min-1. Se ensayaron temperaturas de la columna de 30 °C a 50 °C. Finalmente se evaluó el volumen de inyección desde 5 a 30 µL. La detección de los analitos fue mediante un detector UV a 210 nm.
Validación del método analítico
Los parámetros de validación que fueron evaluados son la linealidad, límites de detección, límites de cuantificación, rango dinámico lineal, sensibilidad analítica y exactitud del método expresada en términos de precisión y veracidad (USP 32, 2009). Los requisitos de la validación del método analítico se establecieron de la siguiente manera: (a) Linealidad, el coeficiente de determinación (R2) debe ser igual o mayor que 0,999 y la desviación residual máxima debe ser menor al 25%. (b) La precisión, expresada como desviación estándar relativa DER (precisión entre días) debe ser ≤ 30%. (c), la veracidad, expresada como recuperación media, debe estar en el rango 70 a 120%. (d) El límite de cuantificación (LC) debe cumplir con los requisitos (b) y (c). Estos requisitos se ajustan a la Decisión 2002/657 / CE de la Comisión (14).
La calidad, confiabilidad y consistencia de un método analítico validado se determina en base a la sensibilidad, linealidad, límite de detección (LD), límite de cuantificación (LC), exactitud y precisión de cada uno de los glucósidos estudia- dos. Para ello se han preparado 5 disoluciones estándar partiendo de la solución madre de concentración de 1000 µg.mL-1 para obtener otras disoluciones de concentraciones de 10 - 25 - 50 - 75 - 200, 500 y 1000 µg.mL-1 utilizando agua como disolvente detallado mejor en el ítem "Preparación de las muestras patrones".
Cada parámetro de validación se define como sigue: linealidad que es la capacidad de un método analítico de obtener resultados proporcionales a la concentración del o los analitos en una muestra dentro de un intervalo determinado; límite de detección LD es la cantidad más baja del analito en una muestra que puede ser detectada por una única medición, con un nivel de confianza determinado, pero no necesariamente cuantificada con un valor exacto; límite de cuantificación LC es la cantidad más baja de un analito en una muestra en las condiciones prescritas.
Los parámetros de validación fueron calculados de la siguiente manera: la linealidad se calculó a partir de sietes concentraciones de los estándares en un rango de concentración de 10 - 1000 μg.mL-1; para evaluar la linealidad, se construyó un gráfico de la señal producida por los analitos en función de la concentración de los mismos y la regresión lineal se calculó por el método de los mínimos cuadrados. Además, los coeficientes de correlación y el intercepto fueron calculados para cada glucósido. El límite de detección se determinó mediante la fórmula LD = 3.3 x So y el Límite de cuantificación se determinó mediante la fórmula LC = 10 x So, donde
(Sy/x) = desviación estándar de la regresión, b = pendiente, n = puntos de calibración). Rango Dinámico Lineal (RDL) se establece entre el límite de cuantificación del método y el límite superior del intervalo de concentraciones en la que se aplica al método.
La sensibilidad de un método analítico o sensibilidad de la calibración se propuso como que puede ser cuantitativamente determinada con exactitud aceptable; Rango Dinámico Lineal la sensibilidad analítica (SAnalitica) que se calcula por el cociente entre la desviación estándar de (RDL) es la que se establece como el intervalo de concentraciones que comprenden entre el límite de la regresión (Sy/x) y la pendiente del calibrado cuantificación de los métodos y el límite superior del intervalo de concentraciones en el que se ha aplicado al método analítico (IUPAC 1978); la sensibilidad analítica de un método analítico o sensibilidad de la calibración mide la relación entre la señal instrumental y la concentración del analito, y viene dada por la pendiente de la recta de calibración (González, A., et al., 1996); la exactitud es la cercanía del acuerdo entre el valor que se acepta ya sea como un valor verdadero convencional o un valor de referencia aceptado y el valor encontrado; y la precisión es la cercanía del acuerdo entre una serie de mediciones obtenidas de múltiples muestras de una homogénea muestra (b), según la ecuación SAnalítica = Sy/x / b (Mandel & Stiehler, 1954).
Exactitud del Método, Precisión y Veracidad, para establecer la exactitud del método propuesto, se han estudiado la veracidad del mismo en términos de recuperación con muestras dopadas y su precisión en términos de variabilidad inter e intra-día ). Para el estudio de exactitud del método en términos de veracidad se ha llevado a cabo un estudio de recuperación a tres niveles de concentración (75, 200, 500 µg. mL-1. Las muestras fueron analizadas empleando el procedimiento operatorio descrito a lo largo del artículo y la concentración en los analitos se deter minó por interpolación a las curvas de calibración dentro de los rangos dinámico lineal. Los valores de recuperación se obtuvieron por comparación con las cantidades de analito conocidas que fueron añadidas, previamente fueron cuantificadas los glucósidos realizando todo el procedimiento de extracción (Benítez Villalba, J.C., et al, 2018). Cada analito se expresó como porcentaje y se calculó mediante la ecuación: recuperación (%) = S1 / (S2 + S3) × 100, donde S1 = cantidad encontrada (μg.mL-1) en la muestra enriquecida, S2 = cantidad presente originalmente en la muestra no enriquecida, y S3 = cantidad (μg.mL-1) de analito agregado a la muestra.
Para evaluar la exactitud del método en términos de precisión, se estudió la repetibilidad (precisión “intra-día”) y la reproducibilidad (precisión “inter-día”). Para ello, se realizaron diversas réplicas de
análisis llevados a cabo en el estudio de veracidad, durante un mismo día y durante tres días consecutivos. Cada muestra dopada fue extraída y analizada por triplicado (previamente los glucósidos fueron cuantificados), es decir tres réplicas de cada punto en el mismo día para evaluar la variabilidad “intra-día” y se repitió en tres días consecutivos para evaluar la precisión, expresada como desviación estándar relativa (DER) (Norma ISO 5725 1994; Commission Decision 2002/657/ EEC 2002; Massart, D.L. et al., 1997).
Resultados y discusión
HPLC
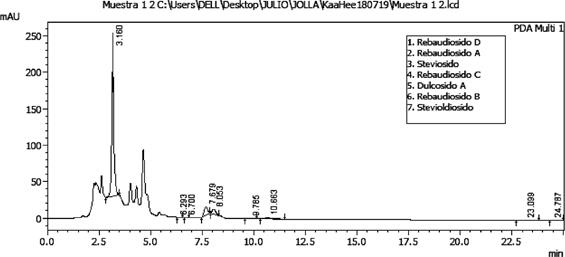
De las condiciones cromatográficas que fueron optimizadas en el HPLC la fase móvil seleccionada fue de acetonitrilo y solución amortiguadora de fosfato de sodio (10 mmol/L, pH 2.6) (30:70) por dar una mejor señal analítica; la velocidad de flujo óptimo fue el de 1 mL.min-1 ya que mejoró significativamente la resolución y las formas de los picos, la intensidad de respuesta y tiempo de retención; la temperatura optima de la columna fue de 30 °C que mostró una muy buenas forma de los picos mientras que el volumen de inyección optimo fue de 20 µL y la detección UV a una longitud de onda de 210 nm. Los resultados en los picos de una muestra de Stevia comercial se pueden observar en la Fig. 4.
Validación del método analítico
Seguidamente se detalla los resultados obtenidos de la validación del método analítico para la de- terminación y cuantificación de los glucósidos del Steviol de una muestra comercial. Se ha realizado la extracción de los analitos mediante la extracción reflujo en Soxhlet y validado el método analítico, seguida de la detección y cuantificación de los glucósidos por la técnica de la cromatografía de líquido de alta resolución HPLC. En la Tabla 1 se observan los parámetros de calibración de la técnica analítica en estudio, donde R2 (%) es el coeficiente de correlación, n = puntos de calibración, b = pendiente, Sb = desviación estándar de la pendiente, a = intercepto, Sa = desviación estándar del intercepto, Sy/x = desviación estándar de la regresión, % plof = valor P de prueba de falta de ajuste, LD = límite de detección, LC = Limite de cuantificación, RDL = rango dinámico lineal (Mandel & Stiehler, 1954).
Tabla 1. Parámetros de calibración en las técnicas analíticas espectrofotométrico y cromatográfico
| Steviolbiosido | Esteviósido | Rebaudiósido A | Rebaudiósido B | Rebaudiósido C | Rebaudiósido D | Dulcósido A | |
| R 2 (%) | 999.494 | 991.263 | 99.714 | 99.466 | 994.263 | 992.151 | 998.469 |
| n | 21 | 21 | 21 | 21 | 21 | 21 | 21 |
| b (µg. mL-1) | 176.508 | 150.929 | 120.432 | 173.879 | 312.636 | 504.143 | 1303.29 |
| sb | 0.17759 | 0.63367 | 0.28845 | 0.56977 | 106.206 | 200.534 | 228.264 |
| a | -817.532 | 280.293 | 229.160 | 109.726 | -1058.35 | 911.243 | -1765.85 |
| sa | 765.015 | 2.729.580 | 1.242.550 | 2.454.320 | 4574.86 | 8638.12 | 9832.59 |
| sy/x | 159.307 | 568.410 | 258.748 | 511.090 | 9526.72 | 17988.1 | 20475.4 |
| % plof | 0.0772 | 0.8589 | 0.8777 | 0.8747 | 0.8942 | 0.8620 | 0.9188 |
| LD (µg. mL-1) | 0.01039447 | 0.007424621 | 0.01039447 | 0.025243712 | 0.01039447 | 0.01187939 | 0.01187939 |
| LC (µg. mL-1) | 0.03464823 | 0.024748737 | 0.03464823 | 0.084145707 | 0.03464823 | 0.03959798 | 0.03959798 |
| Sensibilidad | 902.548.326 | 3.766.075.439 | 214.849.873 | 2.939.342.876 | 304.722.424 | 356.805.509 | 157.105.479 |
| RDL (µg. mL-1) | 0.034 - 1000 | 0.024 - 1000 | 0.034 - 1000 | 0.084 - 1000 | 0.034 - 1000 | 0.039 - 1000 | 0.039 - 1000 |
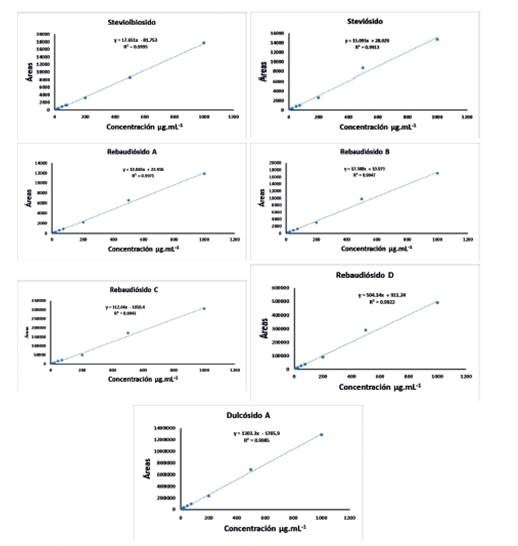
Linealidad: Dos aspectos importantes y fundamentales se examinaron en esta validación del método analítico, el Límite de Detección (LD) y el Límite de Cuantificación (LC) cuyos resulta- dos se pueden observar en la Tabla 1. Para todos los analitos los LD y LC obtenidos en el método propuesto han sido lo suficientemente bajos como para poder ser utilizados en la detección y cuanti- ficación de estos compuestos en esta matriz. De la misma manera se detallan también los valores del Rango Dinámico Lineal (RDL) propuestos para cada analito en esta matriz estudiada. Los valores obtenidos de %R2 de las curvas de calibrado fueron próximos al 100% en todos los casos, demostrando que existe linealidad en los intervalos estudiados para todos los analitos; además la sensibilidad del método analítico o sensibilidad de la calibración que se ha medido mediante la relación entre señal instrumental y la concentración de los analitos del rango lineal viene dada por la pendiente de la recta de calibrado. En la Fig. 5 se observan los gráficos de las curvas de calibrado para cada glucósido de steviol.
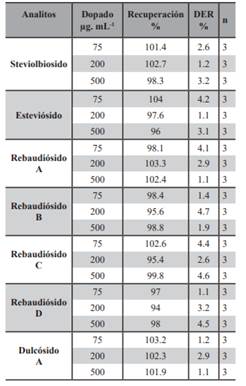
Exactitud del Método Analítico: los estudios de recuperación de la técnica analítica se reanalizaron mediante la fortificación de la disolución patrón (que contienen los glucósidos previamente cuantificadas) en la muestra comercial en tres niveles de concentraciones diferentes 75 - 200 y 500 µg.mL-1 (por triplicado). Los cálculos se realizaron de acuerdo a lo descrito en la metodología en el ítem de validación. Se ha obtenido recuperaciones de inter e intra día entre 94.0 % y 104.3 % para todos los glucósidos de steviol estudiado lo que nos lleva a deducir que el procedimiento de extracción es eficiente y el método veraz. Por otro lado, los valores obtenidos en esta técnica analítica la DER fueron menor 5% en todos los casos. Estos datos se encuentran dentro de límites aceptables para cumplir los requisitos establecidos en la guía de validación empleada, según la cual se consideran aceptables valores iguales o inferiores al 15 % en general, y al 20 % en la zona próxima al límite de detección del método, por lo que se puede concluir que el método propuesto de la técnica de extracción a reflujo con soxhlet cumple con los requisitos de precisión (Cuadros Rodríguez, L., et al., 1993). Se trata por tanto de un método veraz, preciso y por tanto exacto. En las Tablas 2 y 3 se muestran los valores de recuperación obtenidos para ambas técnicas analíticas.
Tabla 2. Ensayos intra-día de recuperación para la determinación de la exactitud en términos de veracidad del método utilizando la técnica de extracción líquido-líquido.
Aplicación del método analítico en una muestra real
Una vez finalizada el desarrollo y la validación del método analítico se procedió a la determinación y cuantificación de los respectivos glucósidos del Steviol a partir de la extracción por soxhlet de una muestra comercial, utilizando las curvas de calibra- dos descrito en la metodología analítica.
Los resultados obtenidos de la extracción de esta técnica analítica para la determinación y cuan tificación de los glucósidos del Steviol se pueden observar en la Tabla 4. Los componentes con mayor cantidad en las muestras que fueron analizadas son la Rebaudiosido A, Steviosido y el Rebaudiosido C, con concentraciones de 14.2 %, 7.35 % y 1.59 % respectivamente, mientras que para los demás glucósidos del steviol las concentraciones con menor cantidad fueron el Stevioldiosido 0.16 %, Rebaudiosido B 0.23 %, , Rebaudiosido D 0.86 %, mientras que el Dulcosido A no ha sido detectado en esta técnica analítica ya que la misma podría ser que se encuentre por debajo de los límites de detección.
Tabla 3. Ensayos inter-día de recuperación para la determinación de la exactitud en precisión de veracidad del método utilizando la técnica de extracción líquido-líquido.

Conclusión
En este trabajo de investigación se ha puesto a punto y validado un método analítico, que incluye una etapa de extracción de los analitos del material vegetal por la técnica sólido-líquido a reflujo con Soxhlet demostrando ser muy eficiente y optima ya que se ha observado un buen rendimiento a la hora de la extracción de los mismos, seguida de la determinación y cuantificación de estos Glucosidos del Steviol de una muestra comercial mediante la Cromatografía de Líquido de alta Resolución HPLC.
En este vegetal se encuentran números compuestos que se extraen de sus hojas entre ellos los glucósidos de steviol que contienen un total de 4 a 20 % de estos compuestos totales expresados en base seca. El Steviosido, Reabaudiosido A y Rebaudiosido C son los glucósidos que tienen mayor presencia en la Stevia y eso se ha podido corroborar en este estudio realizado observando las concentraciones correspondientes de los mismos en las muestras estudiadas.
El método por Cromatografía de Líquido de Alta resolución (HPLC) para la cuantificación de los Glucosidos del steviol en la planta Stevia rebaudiana Bertoni de uso comercial cumplieron en su totalidad todos los parámetros de calidad estudiado como la R2, los Límites de Detección y Cuantificación, la Exactitud, Precisión, el Rango Dinámico Lineal y la Sensibilidad del Método Analítico demostrando con todo ello que el método cromatográfico es aceptable.
La principal contribución de este trabajo de investigación es el aporte de la metodología analítica para la determinación y cuantificación de los Glucósidos del Steviol en muestras de Stevia que no solo puede ser utilizado con el fin analizarlos en muestras de origen comercial, sino también con diferentes tipos de especies que contienen los analitos.












 uBio
uBio