Introducción
El Glifosato es un pesticida no selectivo sistémico, de post-emergencia más vendido en el mundo, y representa alrededor del 25% del mercado global de herbicidas, el mismo actúa en todos los vegetales inhibiendo la actividad de enzimas que sintetizan aminoácidos aromáticos, los cuales son necesarios para la fotosíntesis y por ello las plantas, al no poder sintetizarlos, mueren o frenan considerablemente su crecimiento (Williams et al., 2016; Labrada et al., 1996). Fue citado por primera vez como herbicida en 1971, y según la U.S Enviromental Protection y la O.M.S, el Glifosato no presenta efectos mutagénicos ni cancerígenos (International Programme on Chemical Safety, 1994).
Según la Tomlin (1994), se comercializan tres tipos de glifosatos, el glifosato-isopropilamonio que es el más empleado en la elaboración de los herbicidas, el glifosato-sesquisódio y glifosato- trimesium que no son muy utilizados.
Existen estudios que sugieren que herbicidas a base de glifosato podrían poseer actividades tóxicas sobre varios otros organismos. Un análisis llevado a cabo al tejido hepático y eritrocitos de Leptodactylus latinasus, detectó el aumento de la formación de micronúcleo y anormalidades nucleares en los eritrocitos (Pérez-Iglesia et al., 2016), así también se evidenció el daño en el ADN, generando efecto clastogénico y aneugénico, los cuales fueron comprobados mediante la utilización de la línea celular HepG2 (Kašuba et al., 2017), también estudiando el efecto del glifosato sobre el ADN y la regulación de expresión génica de células mononucleares de sangre periférica se determinó que hay posibles daños en el ADN, debido a una regulación negativa en la expresión del gen p53, lo cual activa protooncogenes o secuencias retrotransponibles (Kwiatkowska et al., 2017).
Otras investigaciones realizadas en medula ósea de ratas (Mus musculus), encontraron que el Roundup® poseía el mismo nivel de genotoxicidad que el control positivo (Ciclofosfamida), en el mismo estudio también se detectó que a concentraciones recomendadas para el ejercicio de la agricultura, promovía en un 100% la hemólisis de eritrocitos humanos, labilizando la membrana plasmática de los mismos (Rodrigues et al., 2011). Utilizando células del hígado, pulmonares y nerviosas del humano (HepG2, A549 y SH-SY5Y), no se detectaron citotoxicidad relevante (Hao et al., 2019) y con el uso de Mus musculus, de la línea Vk*MYC, se logró apreciar el desarrollo de anomalías hematológicas progresivas y neoplasias de células plasmáticas como esplenomegalia, anemia e IgG sérica elevada, lesiones óseas líticas y daño renal. En los Mus musculus de tipo salvaje, se generaron gammapatía monoclonal benigna con aumento de IgG sérica, anemia y presencia de células plasmáticas en el bazo y la médula ósea. (Wang et al., 2019).
También se observaron daños tóxicos en organismos vegetales de menor escala evolutiva como los briófitos, afectando su fisiología, y por ende ocasionando a largo plazo un desequilibrio ecológico, como pérdida de microhábitats las cuales cumplen un rol importante en la retención natural de humedad y la regulación de erosión de suelos (Narváez Parra et al., 2013).
Paraguay actualmente presenta un gran crecimiento en la agricultura industrializada con el consecuente uso intensivo y masivo de todo tipo de plaguicidas, según menciona Benítez- Leite et al. (2009) más de 24 millones de litros de pesticidas al año se emplean en los campos de cultivo en Paraguay, siendo desde el año 2003 para la FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura) parte de la lista de países preocupantes en cuanto al uso de los mismos en el mundo.
La exposición continua sin las medidas correctas de bioseguridad puede generar riesgos colaterales sobre la salud no solo humana sino también de la vida salvaje, así como poner en riesgo el equilibrio del ecosistema, es por esto que en esta investigación se propone como objetivo principal evaluar el potencial genotóxico de distintas diluciones de tres herbicidas a base de glifosato en imagos de D. melanogaster empleando el bioensayo SMART (Test de mutación y recombinación somática).
Materiales y métodos
Preparación de diluciones
Se prepararon las diluciones según uso popular, para ello se realizó una solución stock de 10 mg.mL-1 de tres herbicidas a base de glifosato (GBH1 con composición g.L-1: 48 g de sal isopropilamonio de N-(fosfonometil) glicina, coadyuvantes e inertes 100 mL; GBH2 con composición g.L-1: 48 g de sal N-(fosfonometil) glicina, 52 g de inertes; GBH3 con composición g.L-1: 48 g de sal isopropilamonio de N-(fosfonometil) glicina), la preparación se llevó a cabo con las medidas de bioseguridad sugeridas para su manejo. De la solución stock se obtuvieron diluciones correspondientes a 1 mg.mL-1, 0,1 mg.mL-1 y 0,01 mg.mL-1 mediante diluciones seriadas de cada solución, según uso popular.
Test de mutación y recombinación somática en alas de Drosophila melanogaster
Se obtuvieron hembras vírgenes de cepas puras de Drosophila melanogaster (flr 3 /In(3LR)TM3, ri p p sep I(3)89Aa bx 34e y Bd S , y ORR/ORR; flr 3 /In(3LR) TM3, ri p p sep I(3)89Aa bx 34e y Bd s ) las cuales se encontraban bajo condiciones normales de tem peratura ambiente (22°-24° C) y medio de cultivo convencional (harina de maíz 42 g, Agar-agar 6 g, sacarosa 24 gramos, levadura 26,5 g, agua destilada 500 mL, 2 mL de Ácido propiónico-Ácido orto- fosfórico 1:1 y 2 mL de solución nipagin al 10%). También se obtuvieron, de frascos con medio de cultivo convencional, machos de cepa pura mwh/ mwh de D. melanogaster. El cruce estándar (SC) se realizó depositando en cada frasco 80 hembras vírgenes cepa flr 3 /In(3LR) TM3, ri p p sep I(3)89Aa bx 34e y Bd S con 40 machos de la cepa mwh/mwh, por 72±5 horas (Graf et al., 1984).El cruce de alta bioactivación (BC) se llevó a cabo depositando en cada frasco 80 hembras vírgenes cepa ORR/ORR; flr 3 / In (3LR) TM3, ri p p sep I(3)89Aa bx 34e y Bd s con 40 machos de la cepa mwh/mwh, todas las cruzas fueron cultivadas en un medio ovopositor por 72±5 horas a temperatura ambiente 22°-24° C
Transcurridas las 72±5 horas se procedió a la extracción de cien larvas de tercer estadio de cada frasco, las cuales fueron depositadas en diferentes contenedores con medio instantáneo preparado en el momento de traspaso, para un tratamiento vía oral por 72 horas, los mismos contenían 1,5 gramos de puré de papa instantáneo rehidratado con 5 mL de las diluciones preparadas 0,01 mg.mL-1, 0,1 mg.mL-1, 1 mg.mL-1 y 10 mg.mL-1 de los herbicidas GBH1, GBH2 y GBH3, de agua destilada como control negativo (diluyente) y Ciclofosfamida como agente mutágeno de referencia (Graf et al., 1984). Todos los tratamientos se realizaron por triplicado. Una vez eclosionados los imagos fueron seleccionados al azar 10 individuos trans-heterocigotas mwh+/+flr 3 de cada tratamiento (5 individuos de cada sexo), de las cuales se extrajeron las alas con ayuda de una lupa estereoscópica Motic® y montadas en las láminas microscópicas con solución de Faüre (goma arábica 300 g, glicerol 20 mL, hidrato de cloral 50 g y agua destilada 50 mL).
La observación de las láminas se realizó con ayuda de un microscopio óptico compuesto donde se observaron las regiones A, B, C´, C, D´, D, E, y también los márgenes que separan a las mismas (Rodrigues de Andrade et al., 2004).
Se cuantificó el número de clones mutantes en las alas observadas y se los clasificó según el tipo de marcador expresado; Manchas Simples Pequeñas (MSP) con una o dos células (mwh o flr 3 ), Manchas Simples Grandes (MSG) con tres o más células (mwh o flr 3 ) y Manchas Gemelas (MG) con un área mwh y otra flr 3 adyacente (Graf et al., 1984; Rodrigues de Andrade et al., 2004).
Análisis estadístico
Los datos obtenidos se analizaron mediante tablas estadísticas de acuerdo con Frei y Würgler (1988), que corresponde a un modelo estadístico Binomial Condicional (Test de Kastenbaum-Bowman), con niveles de significancia α = β = 0,05 (Kastenbaum & Bowman, 1970), donde las frecuencias de mutacio nes se utilizaron directamente en la determinación del valor mínimo de mutaciones. Los gráficos estadísticos fueron realizados empleando el programa MS Excel 2016 (Microsoft Windows, USA).
Resultados y discusión
Los resultados hallados en el ensayo del cruce estándar para el herbicida GBH1 en concentraciones de 10, 1, 0,1 y 0,01 mg.mL-1, fueron en un total de 7, 5, 4 y 4 de clones mutantes respectivamente; siendo el clon mutante de mayor cantidad la mancha simple pequeña (MSP) con un total de 6 clones para el tratamiento con 10 mg.mL-1 del herbicida, 5 man- chas mutantes para el tratamiento con 1 mg.mL-1 y 4 clones tanto para los tratamientos de 0,1 y 0,01 mg.mL-1. Para el marcador mutante mancha simple grande (MSG) solo se registró una mancha mutante para los tratamientos de 10, 0,1 y 0,01 mg.mL-1, no se observaron clones mutantes de mancha gemela (MG) en las alas de los individuos tratados (Tabla 1, Figura 1).
Tabla 1 Análisis estadístico del potencial genotóxico de los herbicidas a base de Glifosato: GBH1, GBH2 y GBH3. a) Diagnóstico estadístico de acuerdo con Frei y Würgler (1988): +, positivo; -, negativo; i, inconclusivo. m, factor de multiplicación a fin de evaluar los resultados significativamente negativos. Niveles de significancia α = β = 0,05. b) Incluso las manchas simples flr 3 raras. c) Considerando los clones mwh para las manchas simples mwh y para las manchas gemelas.
| Tratamiento (mg.mL-1) | Número de alas | MSP | MSG | MG | TM | |||||||||
| (1-2 céls)b | (>2 céls)b | m=5 | m = 2 | |||||||||||
| m = 2 | m = 5 | |||||||||||||
| CRUCE ESTÁNDAR | ||||||||||||||
| Control negativo | 20 | 0,70 | (07) | 0,1 | 1 | 0 | 0 | 0,8 | 8 | |||||
| Ciclofosfamida 2,61 | 20 | 4,40 | (44) | + | 1,3 | 13 | + | 0,5 | -5 | + | 6,2 | 62 | + | |
| GBH1 | ||||||||||||||
| 0,01 | 20 | 0,30 | (03) | - | 0,1 | 1 | i | 0 | 0 | i | 0,4 | 4 | - | |
| 0,1 | 20 | 0,30 | (03) | - | 0,1 | 1 | i | 0 | 0 | i | 0,4 | 4 | - | |
| 1 | 20 | 0,50 | (05) | i | 0 | 0 | i | 0 | 0 | i | 0,5 | 5 | - | |
| 10 | 20 | 0,60 | (06) | i | 0,1 | 1 | i | 0 | 0 | i | 0,7 | 7 | i | |
| GBH2 | ||||||||||||||
| 0,01 | 20 | 0,80 | (08) | i | 0,2 | 2 | i | 0 | 0 | i | 1 | 10 | i | |
| 0,1 | 20 | 0,30 | (03) | - | 0,1 | 1 | i | 0 | 0 | i | 0,4 | 4 | - | |
| 1 | 20 | 0,70 | (07) | i | 0,1 | 1 | i | 0 | 0 | i | 0,8 | 8 | i | |
| 10 | 20 | 2,90 | (29) | + | 0,2 | 2 | i | 0 | 0 | i | 3,1 | 31 | + | |
| GBH3 | ||||||||||||||
| 0,01 | 20 | 0,30 | (03) | - | 0,1 | 1 | i | 0 | 0 | i | 0,4 | 4 | - | |
| 0,1 | 20 | 0,40 | (04) | - | 0,3 | 3 | i | 0 | 0 | i | 0,7 | 7 | i | |
| 1 | 20 | 0,20 | (02) | - | 0 | 0 | i | 0,1 | -1 | i | 0,3 | 3 | - | |
| 10 | 20 | 0,50 | 05 | i | 0 | 0 | i | 0 | 0 | i | 0,5 | 5 | - | |
| CRUCE DE ALTA BIOACTIVACIÓN | ||||||||||||||
| Control negativo | 20 | 0,60 | 6 | 0,2 | 2 | 0 | 0 | 0,8 | 8 | |||||
| Ciclofosfamida 0,78 | 20 | 15,00 | 150 | + | 5 | 50 | + | 0,2 | -12 | + | 21 | 212 | + | |
| GBH1 | ||||||||||||||
| 0,01 | 20 | 0,50 | 05 | i | 0 | 0 | i | 0 | 0 | i | 0,5 | 5 | - | |
| 0,1 | 20 | 0,10 | 01 | - | 0 | 0 | i | 0 | 0 | i | 0,1 | 1 | - | |
| 1 | 20 | 0,30 | 03 | - | 0,2 | 2 | i | 0 | 0 | i | 0,5 | 5 | - | |
| 10 | 20 | 0,40 | 04 | i | 0 | 0 | i | 0 | 0 | i | 0,4 | 4 | - | |
| GBH2 | ||||||||||||||
| 0,01 | 20 | 0,0 | 0 | - | 0 | 0 | i | 0 | 0 | i | 0 | 0 | - | |
| 0,1 | 20 | 0,1 | 1 | - | 0 | 0 | i | 0 | 0 | i | 0,1 | 1 | - | |
| 1 | 20 | 0,7 | 7 | i | 0,2 | 2 | i | 0,1 | -1 | i | 1 | 10 | i | |
| 10 | 20 | 0,1 | 1 | - | 0 | 0 | i | 0 | 0 | i | 0,1 | 1 | - | |
| GBH3 | ||||||||||||||
| 0,01 | 20 | 0,50 | 5 | i | 0 | 0 | i | 0 | 0 | i | 0,5 | 5 | - | |
| 0,1 | 20 | 0,40 | 4 | i | 0 | 0 | i | 0 | 0 | i | 0,4 | 4 | - | |
| 1 | 20 | 0,90 | 9 | i | 0 | 0 | i | 0,1 | -1 | i | 1 | 10 | i | |
| 10 | 20 | 0,80 | 8 | i | 0 | 0 | i | 0,1 | -1 | i | 0,9 | 9 | i | |
En los tratamientos con 10, 1, 0,1 y 0,01 mg.mL-1 del herbicida GBH2, se pudieron registrar un total de clones de 31, 8, 4 y 10 respectivamente, siendo el total de mutaciones contabilizadas del clon mancha simple pequeña (MSP) 29, 7, 3 y 8 respectivamente, para el clon mancha simple grande (MSG) 2, 1, 1 y 2 respectivamente, tampoco se registraron marcadores mutantes del tipo mancha gemela (MG) en las alas observadas de los individuos tratados con este herbicida.
En el tratamiento con el herbicida GBH3 a diluciones de 10 mg.mL-1, 1 mg.mL-1, 0,1 mg.mL-1 y 0,01 mg.mL-1 se registraron un total de manchas mutantes de 5, 3, 7 y 4 respectivamente, las manchas simples pequeñas (MSP) 5, 2, 4 y 3 respectivamente, a su vez las manchas simples grandes (MSG) fueron registrados 3 y un clon mutantes para los tratamientos de 0,1 y 0,01 mg.mL-1 respectiva- mente, se registró un clon mutante del tipo mancha gemela para el tratamiento con 1 mg.mL-1 de este herbicida. A su vez en el cruce de alta bioactivación con los tratamientos de 10 mg.mL-1, 1 mg.mL-1, 0,1 mg.mL-1 y 0,01 mg.mL-1 de GBH1 se observaron un total de 4, 5, 1 y 5 clones mutantes, las manchas simples pequeñas (MSP) se registraron en mayor cantidad siendo estas de 4, 3, 1 y 5 clones respectivamente, mientras que los clones del tipo mancha simple grande (MSG) solo se registraron para el tratamiento de 1 mg.mL-1 2 manchas mutantes, no se registraron manchas gemelas en las alas observadas. En los tratamientos con 10, 1 y 0,1 mg.mL-1 del herbicida GBH2 en el cruce de bioactivación, se registraron un total de manchas mutantes de 1, 10 y 1 para los primeros tres tratamientos sin embargo no se observó ningún tipo de clon mutante para el tratamiento de 0,01 mg.mL-1, el total de mutaciones del tipo mancha simple pequeña (MSP) fueron de 1, 7 y 1 respectivamente, en cuanto al clon mancha simple grande (MSG) fue de 2 clones para el tratamiento de 1 mg.mL-1, también para el mismo tratamiento se registró un clon del tipo mancha gemela (MG)
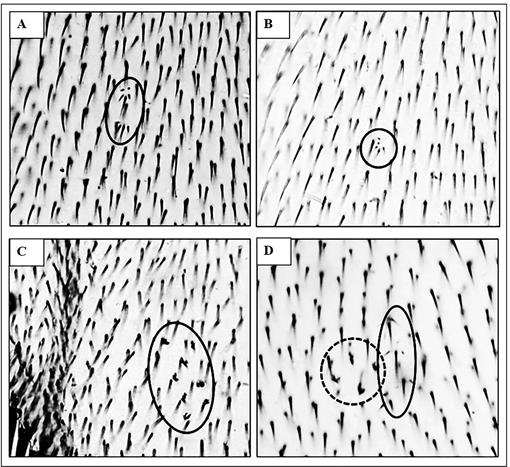
Figura 1: Clones mutantes encontrados en alas de Drosophila melanogaster tratadas. A y B: Mancha simple pequeña (MSP) marcador mwh (círculo de línea solida) con GBH1 0,1 mg.mL-1. C: Mancha simple grande (MSG) marcador flr 3 (círculo de línea solida) tratamiento con GBH2 10 mg.mL-1. D: Mancha gemela (MG) marcadores mwh (círculo de línea solida) y flr 3 (círculo de línea punteada) tratamiento con GBH3 1 mg.mL-1. Aumento: 400X.
Para los tratamientos de 10, 1, 0,1 y 0,01 mg.mL-1 del herbicida GBH3 se registraron en total 9, 10, 4 y 5 clones mutantes, siendo la de mayor frecuencia los clones del tipo mancha simple pequeña (MSP) siendo esta de 8, 9, 4 y 5 clones respectivamente, no se registraron mutaciones del tipo mancha simple grande (MSG), sin embargo, se observó un clon mutante del tipo mancha gemela (MG) para los tratamientos con 10 y 1 mg.mL-1 del herbicida. Es importante también destacar que fueron encontrados los tres tipos de clones mutantes, siendo estas en mayor cantidad en el tratamiento con el agente mutágeno Ciclofosfamida, tanto para el cruce estándar y el cruce de alta bioactivación (Figura 1, Figura 2, Tabla 1).
Los resultados obtenidos en los tratamientos con las diluciones de GBH1, demostraron frecuencias relativamente bajas para el clon mutante tipo mancha simple pequeña (MSP) comparadas con el agente mutágeno de referencia, siendo las diluciones de 0,1 mg.mL-1 y 0,01 mg.mL-1 las que presentaron resultados con diagnóstico negativo, donde se evidenciaron frecuencias menores a las observadas en el control negativo y el tratamiento con la Ciclofosfamida, las diluciones de 1 mg.mL-1 y 10 mg.mL-1 presentaron frecuencias de mutaciones similares a las observadas en el control.
Para el clon mutante de mancha simple grande (MSG) y mancha gemela (MG) se evidenciaron frecuencias similares a las halladas en el control. En cuanto al total de manchas (TM) encontradas en los individuos observados presentaron frecuencias bajas comparadas con las del control negativo y del agente mutágeno, evidenciando de esta manera un resultado negativo para las diluciones 1, 0,1, y 0,01 mg.mL-1, a su vez con la dilución de 10 mg.mL-1 se observaron frecuencias estadísticamente similares a las del control.
A su vez los tratamientos con GBH2 mostraron resultados positivos para el marcador MSP a la concentración de 10 mg.mL-1, siendo esta frecuencia mayor a la del control negativo, y negativo a concentración de 0,1 mg.mL-1, para el marcador MSG y MG los resultados fueron similares a las del control; en cuanto al total de manchas se observó también que la mayor concentración (10 mg.mL-1) fue significativamente mayor.
Los tratamientos con GBH3 no evidenciaron resultados positivos para la actividad genotóxica con ninguna de las diluciones con ningún de los marcadores, la mayoría de ellas presentaron frecuencias semejantes a las del control. Los tratamientos con GBH2 y GBH3 no poseen una tasa de frecuencia significativa en comparación con la observada en el control. Sin embargo, se puede observar ligera actividad genotóxica positiva a 10 mg.mL-1 con GBH2, en cuanto al total de manchas y los clones de manchas simples pequeñas (MSP).
En cuanto a los resultados encontrados en el cruce de alta bioactivación no se evidenció resultados positivos para ninguno de los tratamientos con GBH1, siendo para el clon mutante de mancha simple pequeña (MSP) y el total de manchas (TM) significativamente menor en comparación con el control. Los tratamientos llevados a cabo con GBH2 no demostraron cantidades significativas de clones mutantes MSP y el total de manchas (TM) en comparación con el control. Así también los tratamientos con GBH3 demostraron frecuencias de clones mutantes similares a los observados en los controles.
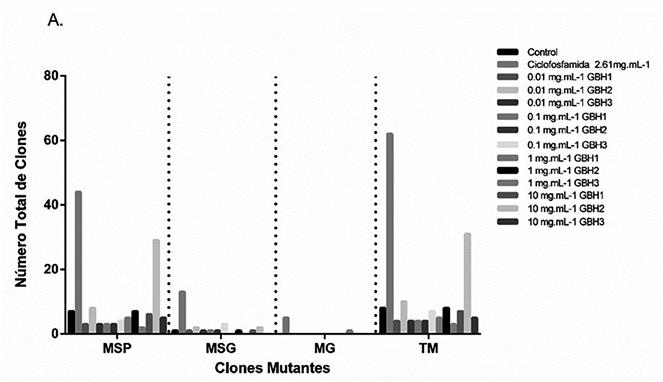
Figura 2: Número total de clones mutantes encontrados en las alas de Drosophila melanogaster. A: Cruce estándar. B: Cruce de alta bioactivación.
Dichos resultados se ajustan a los datos recaba- dos por Kier & Kirkland (2013) donde la mayoría de las investigaciones llevadas a cabo con el glifosato y herbicidas a base de glifosato no evidenciaron actividades genotóxicas tanto en ensayos con organismos procariotas y eucariotas animales. También Williams et al. (2016) mencionan que el peso total de los resultados hallados en los estudios realizados con el glifosato y herbicidas a base de glifosato no representa un riesgo genotóxico ni carcinógeno y sugieren el cambio de la clasificación del Grupo 2A al mencionado herbicida. Igualmente, Brusick et al. (2016) mencionan los resultados obtenidos por un panel de expertos del análisis de las evidencias expuestas en investigaciones acerca de la actividad genotóxica del glifosato y sus formulaciones, donde los mismos concluyeron que el glifosato, las formulaciones del glifosato y el Ácido Aminometilfosfo nico (AMPA) no representan un riesgo genotóxico. El trabajo de de Aguiar et al. (2016), quienes trataron a individuos de la especie D. melanogaster con una dieta a diferentes concentraciones de glifosato, demostraron una activación temprana del sistema de defensa antioxidante lo cual puede prevenir daños posteriores causados por especies reactivas de oxígeno (ROS). Así mismo, Brito Rodrigues et al. (2017) sometieron a larvas de Danio rerio (pez zebra) a tratamientos de diferentes tipos de herbicidas a base de glifosato, no encontrando efectos genotóxicos significativos. Del mismo modo, Pahwa et al. (2019) afirman que no hay una relación del uso del glifosato y el linfoma no Hodgkin.
Sin embargo, contrastando con los resultados encontrados en esta investigación, Kaya et al. (2000) mediante el test de mutación somática y de recombinación evidenciaron que el glifosato posee efectos mutagénicos a concentraciones de 2 mM (0,33 mg.mL-1), 5 mM (0,85 mg.mL-1) y 10
mM (1,69 mg.mL-1) en Drosophila melanogaster. Así también estudios realizados por Alvarez-Moya et al. (2014) realizando estudios in vitro e in vivo sugieren que el glifosato presenta acciones genotóxicas dependiendo del tiempo de exposición y las concentraciones empleadas en los ensayos. En nuestro estudio GBH2 indujo la formación de manchas simples pequeñas a concentración de 10 mg.mL-1, sugiriendo que a esta concentración este herbicida es genotóxico por acción directa con el ADN, coincidiendo con el estudio de Kaya et al.(2000).
Estos resultados coinciden con la revisión realizada por Mensah et al. (2015) que indican que el glifosato y sus formulaciones comerciales poseen propiedades genotóxicas, citotóxicas y generan alteraciones endocrinas. Investigaciones como las de Schaumburg et al. (2016), reportaron resultados con un aumento estadísticamente significativo en el daño del ADN inducido para todas las concentraciones superiores a 100 μg del glifosato por huevo en embriones de Salvator merianae (lagarto tegu) y finalmente, Galin et al. (2019), demostraron la reducción de la vida útil de las moscas macho y el número de pupas e imago en la progenie de D. melanogaster de la población natural y la cepa Oregon-R usando una concentración de glifosato igual a 2.8 mg.mL-1.
Conclusiones
Los ensayos evidenciaron que el herbicida GBH2 produce mutaciones de forma directa en los individuos de Drosophila melanogaster a la concentración de 10 mg.mL-1. El resto de los tratamientos con las distintas diluciones de los herbicidas a base de glifosato empleados, no presentaron efectos mutagénicos en las cruzas realizadas con cepas de D. melanogaster. Se observó un ligero aumento en la cantidad de clones mutantes a medida que aumenta las concentraciones, sin embargo, no fueron estadísticamente significativos.
Agradecimientos
Expresamos nuestros sinceros agradecimientos a la Facultad de Ciencias Exactas y Naturales (FACEN), por permitirnos el uso de la infraestructura y los equipamientos necesarios y a la Dra. Gloria Rodrigo de la Universidad Mayor de San Andrés (La Paz, Bolivia) por su predispoción y ayuda en la elaboración del artículo, también agradecemos a la Lic. Talia Appleyard y la Univ. María Luisa Paniagua por el apoyo durante el desarrollo del trabajo. Este trabajo fue finnanciado por la Dirección General de Investigación Científica y Tecnológica de la Universidad Nacional de Asunción (DGICT-UNA), convocatoria 2014 (FACEN/03/14)












 uBio
uBio 


