Introducción
Los pecaríes son artiodáctilos pertenecientes a la familia Tayassuidae, exclusivos del Neotrópico. Se distribuyen a lo largo de Sudamérica, desde México hasta Argentina (Oliver, 1993). En Paraguay coexisten las tres especies conocidas: el pecarí labiado (Tayassu pecari), el pecarí de collar (Pecari tajacu) y el tagua (Catagonus wagneri). El pecarí labiado vive en zonas de bosques húmedos, aunque también está presente en ambientes xerofíticos, como los típicos bosques espinosos del Chaco Seco (Redford & Eisenberg, 1992). Se caracteriza por ser una especie social, cuyas manadas oscilan entre 20 a más de 300 individuos (Sowls, 1984; Bodmer, 1997; Fragoso, 1997). Utilizan los cuerpos de agua que encuentran en las zonas boscosas para revolcarse en el lodo para regular su temperatura (Donkin, 1985). Es por ello que el pecarí labiado requiere una heterogeneidad espacial a nivel de paisaje para sobrevivir (Fragoso, 1999). El pecarí de collar habita bosques, como los chaqueños, amazónicos, sabanas y matorrales (Bodmer, 1997; Romero-Muñoz et al., 2007). Viven en grupos de cinco hasta 20 individuos, que, con frecuencia, pueden dividirse en subgrupos (Robinson & Eisenberg, 1985). Esta especie presenta una gran plasticidad ecológica, ya que es capaz de habitar en una gran variedad de ambientes con diferentes condiciones climáticas, desde bosque primarios, hábitats nativos y cultivos (Bodmer & Sowls, 1993; Sowls, 1997).
Los pecaríes se alimentan de frutos, semillas y nueces que caen de los árboles, principalmente de palmeras (Kiltie, 1981; Painter, 1998; Fragoso, 1998). Son la presa principal de grandes felinos como el jaguar (Panthera onca) y el puma (Puma concolor) (Aranda, 1994). Desde el punto de vista ecológico, son considerados tanto dispersores como depredadores de semillas (Kiltie, 1982; Bodmer, 1991; Beck, 2005), manteniendo la diversidad florística de los bosques (Sowls, 1997; Keuroghlian & Eaton, 2009). Tienen la capacidad de modificar los suelos debido al hecho de que cavan buscando raíces, también compactan los suelos de las aguadas, haciendo que el agua se conserve por más tiempo (Beck, 2006; Reyna-Hurtado, 2009).
T. pecari se encuentra listado en la categoría Vulnerable tanto a nivel regional según la Lista Roja la Unión Internacional para la Conservación de la Naturaleza (UICN 2021) como a nivel Nacional según el Ministerio del Ambiente y Desarrollo Sostenible (MADES -Resolución Número 632/2017) y el Libro Rojo de los Mamíferos del Paraguay. P. tajacu ocupa la categoría de Preocupación menor, tanto a nivel regional (IUCN 2021) como nacional (MADES -Resolución Número 632/2017). Las principales amenazas que enfrentan estas especies son la cacería furtiva, fragmentación de su hábitat y cambio de uso de suelo debido, principalmente, a la producción agropecuaria (Altrichter et al., 2012). El Chaco Seco se caracteriza por presentar un bosque subtropical, semideciduo y xerofítico con las temperaturas más altas del continente (Rumbo, 2010). Esta ecorregión, se encuentra sufriendo cambios de uso de suelos acelerados debido a la producción agropecuaria, la implantación de pasturas (Causarano & Spiridonoff, 2006).
En el país existen vacíos de información en cuanto a la distribución de estas especies, preferencia de hábitat y comportamiento, lo que dificulta plantear estrategias de conservación efectivas. Por ello esta investigación tuvo como objetivos:
(1) contribuir al conocimiento de la distribución y ocupación de sitios por T. pecari y P. tajacu en relación a características del paisaje, (2) describir los patrones de actividad diaria de T. pecari y P. tajacu en paisajes ganaderos del Chaco Seco.
Materiales y métodos
Área de estudio
El estudio se llevó a cabo en la Estancia Montania, ubicada 50 Km al norte de la ciudad de Filadelfia, Departamento de Boquerón, Paraguay, (21°,57´29´´S; 60°04´56’’W), perteneciente al Chaco Seco (Figura 1). El establecimiento cuenta con 37.098 ha, de las cuales 10.410 ha corresponden al área de reserva conformado por bosques xerofíticos espinosos en donde las especies que predominan son: Aspidosperma quebracho-blanco (quebracho blanco), Schinopsis lorentzii (coronillo) y Ceiba chodatii (samu’ũ). Además de 22.440 ha de pasturas implantadas de Panicum maximum (Gatton panic). Las pasturas están conformadas por módulos de 100 ha, rodeados de cortinas forestales de vegetación nativa. La Estancia se dedica a cría, recría y engorde de ganado vacuno.
Fototrampeo
Se analizaron los registros de T. pecari y P. tajacu durante los años 2015 al 2017. Se utilizaron seis cámaras trampa de la marca Velleman modelo CAMCOLVC-26 y 39 Bushnell modelo TRO- PHY CAM HD, las cuales fueron situadas en 45 estaciones de muestreo dentro del establecimiento agropecuario (Figura 2). Las cámaras fueron insta- ladas en senderos a unos 50 cm del suelo, con una distancia mínima de 1,5 km entre cada estación, cuyas coordenadas fueron registradas mediante el uso de GPS (GARMIN MAP 64s) y los datos asentados en planillas. No se utilizaron cebos y atrayentes. Las cámaras fueron programadas para funcionar las 24 horas del día y tomar una secuencia de tres fotografías consecutivas con intervalos de un segundo, cuatro fueron programadas para grabar un video de 10 segundos seguido de las capturas fotográficas. Las mismas fueron revisadas cada mes y medio para reemplazar baterías y extraer los datos.
Análisis de datos
Los datos generados mediante fototrampeo fueron clasificados siguiendo la metodología propuesta por (Harris et al., 2010). Los análisis fueron efectuados utilizando la metodología propuesta por (Sanderson & Harris, 2013) basada en los programas DataOr ganize y DataAnalyze.
Uso de Hábitat
Mediante el análisis de imágenes satelitales (Landsat 8), utilizando el software QGIS 3.10 se establecieron los porcentajes de cobertura forestal en un radio de 500 metros alrededor de cada cámara trampa. Los sitios fueron agrupados en dos categorías, con más de 50% de cobertura boscosa (23 sitios) y con menos del 20% de cobertura boscosa (22 sitios).
Para evaluar el uso de hábitat de los pecaríes en ambas categorías de cobertura boscosa se calculó la tasa de visita a las estaciones utilizando el paquete RAI (Mandujano, 2019). El cálculo para establecer la tasa de visita fue: tasa de visitas [Número de eventos/total de días] X 100 (Mandujano & Hernandez, 2019). Mediante el análisis estadístico T-student se evaluó la influencia de la cobertura boscosa en el uso del hábitat para ambas especies.
Patrones de actividad
Para determinar el patrón de actividad y estimar los valores de abundancia de ambas especies se utilizaron registros independientes con un intervalo de 60 minutos para considerar las fotografías independientes (Briones-Salas et al., 2016). El patrón de actividad diario fue generado a partir de las horas de registro de cada fotografía y videos mediante el método de curvas de densidad de Kernel (Ridout & Linkie, 2009). Dicho análisis fue realizado con el paquete Overlap en el programa RStudio versión 3.0.1.
Resultados y discusión
Fototrampeo
El esfuerzo total de muestreo fue de 4.611 días trampa, totalizando 7.239 capturas efectivas (fotos y vídeos) de ambas especies, 3.798 de T. pecari y 3.441 de P. tajacu.
Uso de Hábitat
Los resultados del uso de hábitat se presentan en la Tabla 1. De los 45 sitios evaluados en el presente estudio, 48.8% estuvieron ocupados por Tayassu pecari y 77.7 % por Pecari tajacu. En cuanto al hábitat ocupado por las especies, en función a la cobertura boscosa, P. tajacu mostró patrones de ocupación similares, mientras que para T. pecari la ocupación disminuyó de 0,8 en hábitat con cober tura boscosa mayor 50% a 0,2 en hábitat con cobertura boscosa menor 20%. Las tasas de visita reflejan resultados similares, un mayor uso de hábitat por parte de Tayassu pecari cuando la cobertura boscosa es superior al 50 % (p=0.01) y una diferencia menos marcada para Pecari tajacu, la cual no arroja valores significativos (p= 0.15) (Figura.3).
Los resultados obtenidos indican una fuerte dependencia de bosques para T. pecari, lo cual reafirma la importancia del bosque para la especie, ya mencionada por varios autores con anterioridad (Donkin, 1985; Fragoso, 1999; Reyna-Hurtado et al., 2009). Esta dependencia a zonas boscosas puede estar asociada a la dificultad de hallar alimentos (Fragoso, 1998; 1999), ya que son principalmente frugívoros (Kiltie & Terborgh, 1983; Sowls, 1984), e incluyen raíces, tubérculos y cactáceas en las zonas áridas como la del Chaco seco (Olmos 1993). Los resultados hallados para P. tajacu coinciden con los de otros autores. Esta especie presentó una ocupación de hábitat entre 0,7 y 0,8 a pesar de la variación en la cobertura forestal entre los sitios. Esto indica una alta tolerancia a la reducción en cobertura boscosa, ya mencionada por otros autores (Altrichter & Boaglio, 2004), resaltando la plasti cidad del hábitat de la especie (Bodmer & Sowls, 1993; Sowls, 1997). En cuanto a la tasa de visita entre ambientes, esta se mantuvo sin diferencias significativas entre sitios con distinta cobertura boscosa, indicando la alta tolerancia de la especie a ambientes modificados (Cullen et al., 2000).
Patrones de actividad
La evaluación de patrones de actividad de T. pecari se basó en 173 registros independientes, mientras que para P. tajacu se utilizaron 265 registros. Con 92% de solapamiento en sus patrones de actividad diaria, ambas especies de pecaríes presentaron actividad nocturna y matutina. La actividad de ambas especies inicia luego de medianoche, abarca el alba y aumenta durante el día y presenta un pico de actividad entre las 9:00 y las 10:00 hs. Además, se pudo observar que hacia el mediodía los valores descienden a mínimos y vuelven a iniciar sus actividades entrada la noche. (Figura 4).
Tabla 1. Número de estaciones en las que las especies fueron registradas y tasa de visitas a las estaciones de muestreo en relación a la cobertura boscosa.
| Especie | Cobertura Boscosa >50% (23) | Cosbertura Boscosa <20% (22) | ||||
| Número de Sitios Visitados | Ocupacion Naive | Tasa de Visita | Número de Sitios Visitados | Ocupacion Naive | Tasa de Visita | |
| Tayassu pecari | 19 | 0,82 | 5,5 | 3 | 0,13 | 0,3 |
| Pecari tajacu | 19 | 0,82 | 5,7 | 16 | 0,72 | 3,4 |
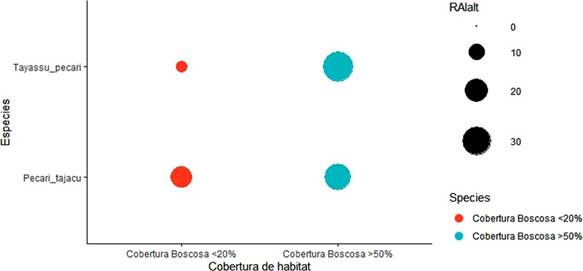
Figura 3 Índice de Abundancia Relativa (IAR) de las especies con relación al uso de la cobertura boscosa.
Nuestros resultados concuerdan con otros estudios en los que estos pecaríes tienen actividad principalmente diurna, aunque pueden adecuar su actividad a horarios nocturnos (Maffei et al., 2002; Tobler et al., 2009; Wallace et al., 2010; Moreira-Ramirez et al., 2015). En cuanto al pico de actividad de las especies, nuestros resultados en el chaco seco difieren de los resultados del chaco húmedo argentino, donde P. tajacu presentó picos de actividades nocturnas (Huck et al., 2017). Casi no se registraron actividades, para ninguna de las especies, durante las horas más calientes del día (12:00 a 17:00 h.), esto puede constituir una estrategia de reserva energética y esas horas estarían dedicadas principalmente al descanso ( Taber et al., 1994; Wallace et al., 2010).
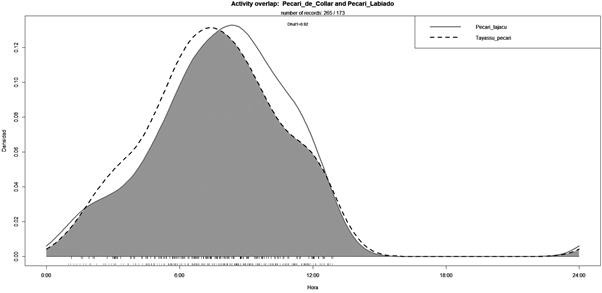
Figura 4 Patrones de actividad de T. pecari (Pecarí labiado) y P. tajacu (Pecarí de collar) estimados mediante densidades de Kernel.
Las actividades de los pecaríes responden en parte a la disponibilidad de alimentos y contra el ataque de depredadores (Fragoso, 1998; 1999). Es probable que, al estar activos en la noche y el mediodía, los pecaríes realicen desplazamientos en busca de alimentos y visiten cuerpos de agua (Moreira-Ramírez, 2009). Sin embargo, no hay que perder de vista que las acciones humanas tienen el potencial de promover el comportamiento nocturno en los animales silvestres (Gaynor et al., 2018).
Conclusión
El uso de hábitat de T. pecari en ambientes agropecuarios está fuertemente influenciado por la cobertura boscosa, los sitios con cobertura boscosa menor al 20% prácticamente no son ocupados por la especie, mientras que P. tajacu utiliza tanto ambientes modificados como mejor conservados. Estos datos sugieren una segregación espacial parcial entre las especies. En cuanto a los patrones de actividad diaria, existe un solapamiento de más del 90% entre las especies. La actividad inicia luego de la puesta del sol y presenta picos de actividad matutina y descansos prolongados desde mediodía hasta la puesta del sol. Esto podría ser también parte de una estrategia para evitar el contacto con el hombre y el ganado, factores que deberían ser investigados.
Contribución de los autores
Los autores contribuyeron manera equitativa en la elaboración de este artículo.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Agradecimientos
Estos resultados fueron generados como parte del “Proyecto 14-INV-187- Determinación del valor de paisajes ganaderos en la conservación de la biodiversidad del Chaco seco paraguayo”, cofinanciado por la Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de Asunción (FACEN-UNA) y el Consejo Nacional de Ciencia y Tecnología (CONACYT). A todas las personas que de algún modo colaboraron con esta investigación, traducción al inglés (D. Tabilo). Este trabajo forma parte del Programa de Iniciación Científica de la FACEN-UNA.












 uBio
uBio 




