Introducción
Por lo general el chaco paraguayo se caracteriza en presentar una superficie plana, y pendientes suaves en algunas regiones y relieves poco ondulados en otras. El ambiente adverso y la evaporación a través del tiempo, en gran manera, produjo formaciones de evaporitas, haciendo así que el suelo sea halófito y xerofítico, ocasionando la formación de los saladares (Gómez Duarte, 1986).
Los vegetales adaptados a este tipo de ecosistema halófito tienen mecanismos adaptativos para resistir los factores abióticos. Este es el caso de Sarcocornia neei (Lag.) M.Á. Alonso & M.B. Crespo (basiónimo: Salicornia neei Lag.) un vegetal halófito, ampliamente distribuido, puede soportar altas concentraciones de sal acumulándola, además, es empleada en la gastronomía y se ha reportado cualidades farmacéuticas (Patel, 2016).
A las plantas se asocian bacterias que pueden ser endofíticas y rizobacterias (bacterias del interior del tejido vegetal y bacterias del suelo circundante a las raíces de las plantas) estos microorganismos pueden establecer asociaciones simbióticas con las plantas, son benéficas ya que estimulan el crecimiento vegetal, produciendo una variedad de sustancias, como las enzimas hidrolíticas en defensa contra patógenos protegiendo a la planta y adaptándola al ambiente (Ryan et al., 2008).
Estas enzimas hidrolíticas que producen las bacterias son de gran importancia comercial con aplica ciones biotecnológicas en las industria alimenticia, agroindustrial y farmacéutica (Olanrewaju et al., 2017; Amoozegar et al., 2019; Corral et al., 2019). Las bacterias son fuentes ideales para producir enzimas hidrolíticas, debido a su fácil producción, por requerir poco espacio para el cultivo, crecimiento rápido, escalable en la industria y flexibilidad muchas veces para la manipulación genética (Sivakumar et al., 2009). Algunas de las enzimas hidrolíticas producidas por las bacterias son celulasa, pectinasa, proteasa, amilasa entre otras. Las celulasas, proteasas y amilasas se utilizan para la preparación de detergente para acelerar el proceso limpieza.
Las celulasas microbianas se producen comercialmente, pues estas se complementan con los detergentes para la eliminación de la suciedad sin dañar y aumentar la suavidad de los tejidos. Las bacterias, especialmente las del genero Bacillus, secretan enzimas extracelulares como amilasas, proteasas y lipasas con potenciales valores comerciales (Mukesh et al., 2012).
Las proteasas de los microbios son enzimas industriales importantes y representan aproximada- mente el 40-60% de las ventas totales de enzimas en todo el mundo (Vijay et al., 2011; Ramkumar et al., 2018).
Las proteasas son enzimas que catalizan la hidrólisis de los enlaces peptídicos de las proteínas mediante la adición de agua a través de los enlaces peptídicos, y se encuentran ampliamente en plantas, animales y microorganismos (Niyonzima & More, 2015).
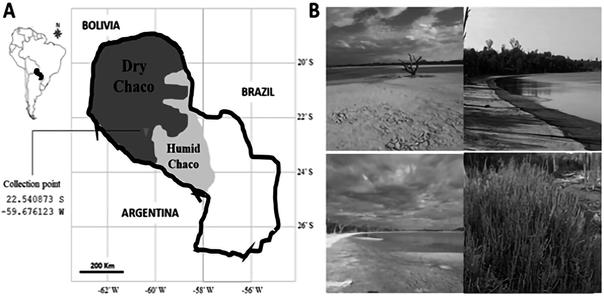
Figura 1 Localidad de muestreo. A) Ubicación geográfica del sitio de muestro. B) Saladares del Chaco Seco Laguna Capitán (imágenes propias).
Debido a sus amplias aplicaciones, muchas proteasas de microorganismos se han estudiado en las últimas décadas, la mayoría de ellas se encuen tran en cepas de Bacillus y Pseudomonas (Rahman et al., 2010).
Otra enzima de importancia industrial con varias aplicaciones biotecnológica es la pectinasa, se emplea en la industria de producción de biocombustibles, papel de pulpa, alimentos para animales, textiles, fibra (Rebello et al., 2017).
Los microorganismos han proporcionado una variedad de metabolitos secundarios con interesantes actividades biológicas notables que actúan como biorreguladores, moléculas de señalización detección de quórum, fármacos antimicrobianos entre otros beneficios industrial, debido a todas estas cualidades este trabajo tuvo como objetivo analizar el potencial biotecnológico que pudieran tener las bacterias de la rizosfera y raíces de Sarcocornia neei aisladas de los saladares chaqueños.
Métodos
Zona de muestreo, aislamiento bacteriano y condiciones de cultivo
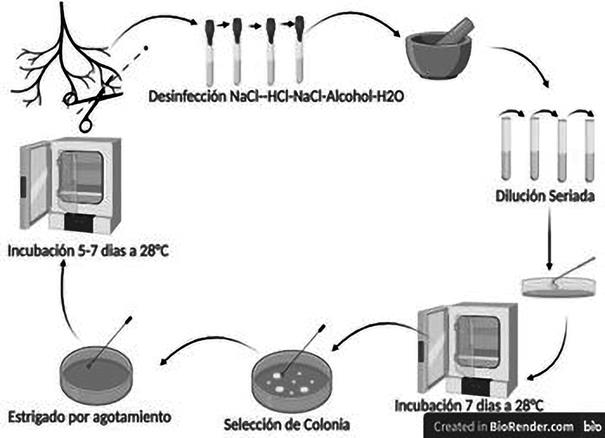
El muestreo se realizó en el Departamento de Boquerón Chaco, en las cercanías de la Laguna Capitán, en las coordenadas -22.540873 S, -59.676123 W. Se escogió este sitio de muestreo por la ubicación de las lagunas saladas y por ser un ambiente halófito y xerofítico (Figura 1). Para el aislado de bacterias de la rizósfera, las muestras de raíces y suelo circundante fueron colectadas por conveniencia durante períodos comprendido entre abril y agosto de 2019.
Para cumplir con la cantidad de muestra representativa se decidió colectar de manera aleatoria 10 plantas de Sarcocornia neei, según el recorrido de cuadrícula a 17 metros de las orillas de la laguna salada (Atlas et al., 1998).
Muestras provenientes de la Rizosfera
Se utilizó 0,1 g de suelo provenientes de la rizósfera, se agregó agua estéril, se procedió a mezclar de forma enérgica y constante por unos segundos, siendo el procedimiento con modificaciones propuestas por Felestrino et al. (2013), luego se tomó 100 μl de esta solución y se introdujo en medio liquido Luria-Bertani (LB), se incubó por 24 horas. Posterior a la incubación con el método de dilución 10-1 a 10-4, se tomó 100 μl de la dilución 10-4 y se plaqueó en cajas de Petri 90x15 mm con medio Luria-Bertani Agar (LBA). A continuación, se incubaron a 28 °C por 10 días. Las colonias que se desarrollaron con diferentes formas y tamaños fueron transferidas en nuevas placas de Petri con medio LBA, para su posterior aislamiento. Posteriormente a cada aislado se le realizó la tinción de Gram. Todos los aislamientos fueron conservados en glicerol al 15% y almacenados a -20 °C.
Muestras de Raíces Provenientes de S. neei
Se tomaron cinco fragmentos de las raíces de plantas S. neei, de aproximadamente 1,0 - 0,5 cm. Las muestras de raíces fueron desinfectadas mediante una secuencia de soluciones: 9 g/L NaCl - 2 min, 70% de alcohol - 2 min, 2,5%, ácido clorhídrico (HCl)- 2 min y tres lavados de agua destilada, se tomó una raíz para control de esterilidad en medio líquido.
Las raíces fueron maceradas en un mortero, para depositar en un medio líquido LB, se incubó a 28
°C durante 24 horas (Felestrino, 2013).
A continuación, una alícuota de 100 μl, se inoculó en medio selectivo LBA que contenía clotrimazol, para evitar la formación de hongos. Todas las placas se incubaron a 28 °C durante un período de hasta 10 días, las bacterias que fueron desarrollándose durante los días de crecimiento fueron aislados en nuevas placas con LBA selectivo. Las bacterias aisladas fueron teñidas según el procedimiento para la tinción de Gram. Todos los aislamientos fueron catalogados, conservados en glicerol al 15% y almacenados en - 20 °C (Figura 2).
Producción de Enzimas hidrolíticas
La actividad enzimática se determinó en placas de Petri 90x15 mm, que contenían medio base con (K2HPO4 2 g/l, KHPO4 2g/l, agar 15 g/l, extracto de levadura 1 g/l) suplementado con 2 g / l (car- boximetilcelulosa, almidón, pectina y caseína) con el pH ajustado a 6,0. Para la visualización de la degradación enzimática se empleó el rojo congo y lugol para la determinación de la producción de amilasas, celulasas, pectinasas y proteasas, por triplicado para cada uno de los ensayos (Feoli et al., 1997).
Antagonismo microbiano
Para el ensayo de inhibición del crecimiento de patógenos, se realizaron pruebas con los siguientes microorganismos Fusarium solani (Cepa no refe- renciada, identificada y aislada), Staphylococcus aureus meticilino resistente (ATCC 43300) y Klebsiella pneumoniae (ATCC 700603), utilizando el método de arrastre, en placas de Petri con medio
YPD agar (Yeast extract peptone dextrose), donde el patógeno se agregó en el centro de la placa y por el método de arrastre a las bacterias en estudio, luego se incubo a 28°C, y 37°C para Klebsiella pneumoniae, luego del 6to día hasta el 12mo día se observó el crecimiento de ambos organismos, las bacterias de interés frente a los patógenos (Tabla 1).
Tabla 1. Microorganismos de referencia utilizados para el ensayo de antagonismo, que provocan daños a su hospedador.
| Organismo | Hospedador |
|---|---|
| Fusarium Solani | Solanum tuberosum |
| Klebsiella pneumoniae | Homo sapiens |
| Staphylococcus aureus | Homo sapiens |
Resultados y discusión
Tinción de Gram y morfología bacteriana
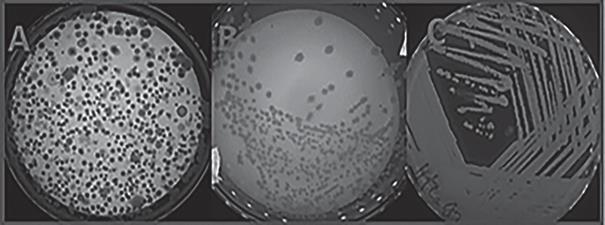
A partir de las raíces de S. neei y el suelo circundante a las raíces, se obtuvo un total de 83 aislados bacterianos, fueron aislados en medio LBA por agotamiento de asa, hasta obtener cultivos puros a partir de colonias basados en la variedad de formas y tamaño (Figura 3).
La morfología celular se observó al microscopio óptico, mediante tinción de Gram, las bacterias aisladas de las raíces como de la rizosfera se dividieron en Gram positivas con un total de 80 (96,3%) y Gram negativas solo 3 (3,6%) aislados, de las cuales 50 (60,2%) corresponde al suelo circundante (rizosfera) de las raíces de las plantas y 33 (39,7%) de las raíces (endófitas) de S. neei, mientras que el trabajo publicado por Szymańska et al. (2016), encontraron un 77,3%-87,5% de los aislados eran Gram positivos, de igual manera reportaron que el 50% de los aislados bacterianos cultivables pertenecían a las rizobacterias y el otro 50% a los endófitos proveniente de Sarcocornia sp.
Passari et al. (2017) reportaron que el número máximo de aislados bacterianos endofíticos de una planta con propiedades medicinales fue de 46,7%. En el trabajo de Huang et al. (2019) encontraron mayor número de aislados en la rizosfera, con un 63,3%, mientras que el 36,3% provenían del interior de las raíces de Platycodon grandiflorum.
Rodríguez et al. (2020) reportaron que Pseudomonas segetis proveniente de Salicornia europea, producen compuestos que aumentan la capacidad para defenderse contra patógenos y capaces de pro- ducir enzimas hidrolíticas: Celulasas, pectinasas, amilasas y proteasas (Figura 4).
Una de las enzimas hidrolíticas que producen las bacterias son las celulasas, las celulasas representan el grupo más destacado a nivel mundial en cuanto a enzimas, ya que tienen varias aplicaciones industriales (Kuhad et al., 2011).
En los aislados obtenidos en este trabajo (Figura 5) fueron capaces de formar halos que evidencia producción de celulasas 34 (40,9%), de las cuales el 82,3% son bacterias endofíticas, el 17,6% de los aislados provienen de la rizosfera (Figura 5B). Szymańska et al. (2016) reportaron que el 50% fueron endófitos y el 36,8% fueron rizobacterias provenientes de Salicornia sp., en el estudio de Pereira & Castro (2014), encontraron que el 62,5% de los aislados presentaron actividad endocelulítica. Liu et al. (2019), demostraron que un grupo diverso de bacterias coloniza el tejido interior de la planta L. ruhenicum una halófita medicinal, donde el 32,1% de endófitos presentaron capacidad celulolíticas.
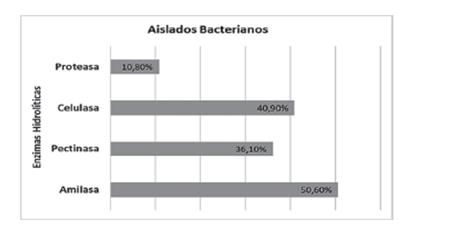
Figura 4 Representación porcentual de los aislados bacteria- nos que demuestran la capacidad de producción de enzimas hidrolíticas.
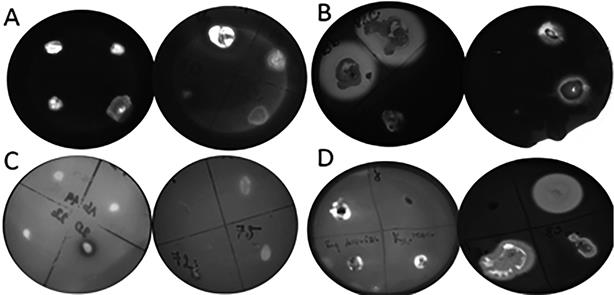
Figura 5 Aislamiento bacteriano: A) Aislamiento bacteriano con capacidad de producción de amilasa. B) Aislamiento bacteriano con capacidad de producción de celulasa. C) Aislados con capacidad de producción de pectinasa. D) Aislamiento bacteriano con capacidad de producción de proteasas.
Mientras que en el estudio de Mukhtar et al. (2019), obtuvieron más del 40% de sus aislados con capacidad hidrolítica, provenientes de la rizosfera de un vegetal halófito.
Los resultados obtenidos en este trabajo, en relación con la producción de celulasas en condiciones de ensayo cualitativo, se obtuvo aislados bacterianos con producción de celulasas, esto es corroborado por Menéndez et al. (2016), donde han identificado genes relacionados con la actividad celulósica en cepas pertenecientes al género Rhizobium, así como en numerosas actinobacterias de los géneros Actinosynnema, Cellulomonas y Streptomyces, entre otros (Koeck et al., 2014).
Otra enzima producida por las bacterias son las pectinasas, estas son empleadas para producción de jaleas, zumo de frutas, jugos de frutas y vino, pues mejora la extracción, la filtración y la clarificación del zumo de frutas, mejorando las cualidades del producto final, (Kashyap et al., 2001).
También las industrias de biocombustibles demandan esta enzima junto con las xilanasas, pues mejorar la sacarificación de la biomasa vegetal, durante la producción de biocombustible (Thite & Nerurkar, 2019).
En este ensayo cualitativo los aislados bacterianos que presentaron un halo visible de hidrólisis, fueron un total de 30 (36,1%), dato similar al trabajo de Hasan et al. (2020), encontraron que el 37,2% de los aislados bacterianos proveniente de Corchorus olitorius, con capacidad de producir pectinasa y xilanasa de manera conjunta. En cuanto al origen de los aislados según relación con S. neei se ob- tuvieron endofíticas 76,6%, las bacterias aisladas provenientes de la rizosfera 23,3% (Figura 5C).
En la literatura varias bacterias producen simul- táneamente xilanasas y pectinasas como Bacillus sp. y Streptomyces sp., que son empleadas para la producción industrial (Kashyap et al., 2001).
La aplicación de enzimas pectinolíticas crudas en diversos procesos industriales hace que estas enzimas sean comercialmente valiosas y un proceso de producción sea rentable, las cepas de Bacillus safensis y Bacillus altitudinis se estudiaron para la producción de pectinasas (Thite et al., 2020).
Para determinar la actividad proteolítica se empleó la técnica cualitativa de difusión en placas de agar y caseína, los aislados que producen proteasas presentan un halo visible de hidrólisis. Del total de los aislados fueron capaces de formar halos 9 (10,8%) aislados (Figura 5D).
El 77,7% de las bacterias con actividad de hidrolisis fueron endofíticos y el 22,2% fueron bacterias provenientes de la rizosfera, en el trabajo de Mukhtar et al. (2019), encontraron que el 47% de las bacterias aisladas presentaron actividad proteolítica y amilolítica de la rizosfera de Atriplex amnicola una planta halófita.
Encontramos que el 50,6% de los aislados bacterianos presentaron actividad amilolítica (Figura 5A), cifras similares a la encontrada en este estudio fueron reportados también por Carrim et al. (2006), donde el 60% de los aislados producían amilasa, también en el trabajo de Caneschi et al. (2018), encontraron que el 55% de las bacterias producían amilasas, aisladas de diferentes plantas.
En este estudio 7 aislados fueron capaces de producir las tres enzimas hidrolíticas estudiadas, mientras que Ben et al. (2019), lograron aislar 12 bacterias endofíticas capaces de producir siete enzimas probadas (proteasa, gelatinasa, quitinasa, celulasa, amilasa, pectinasa y glucanasa) [Tabla 2]. Existen aún pocos trabajos en la literatura sobre bacterias productoras de enzimas en nuestro país, provenientes de plantas xerofíticas y halófitos, este es nuestro aporte a la información, que puede ser punta pie para futuras investigaciones enfocadas a la producción de enzimas y escalabilidad en la industria. La mayoría de los reportes de estas enzimas son observados en aislados bacterianos como fúngicos, (Oumer, 2017).
En estudios anteriores, sugieren que las bacterias halófitas producen enzimas con aplicaciones industriales y de investigación, debido a su naturaleza termoestable y tolerante a la sal, características óptimas para aplicaciones como producción de biocombustible, aditivos, detergentes (Corral et al., 2019; Amoozegar et al., 2019).
Las bacterias que crecen en simbiosis a S. neei podrían ser explotadas por sus capacidades enzimáticas en la industria textil, biocombustible, biofertilizantes y agentes de biocontrol frente a una amplia variedad de tensiones abióticas y bióticas.
Antagonismo microbiano
A lo largo de los años se han ido encontrando bacterias que producen metabolitos secundarios, antibióticos capaces de inhibir el crecimiento de microorganismos, entre las bacterias más estudiadas se encuentran Bacillus, Streptomyces ssp, Pseudomonas spp., (Rojas Badía et al., 2017; Huang et al., 2019). El sistema inmune de los vegetales tiene un sistema complejo de producción de metabolitos que proporciona una defensa aumentando la capacidad para expresar una resistencia, lo que permite una respuesta más rápida y fuerte frente a los patógenos. Las rizobacterias y endofíticas promotoras del crecimiento vegetal inducen la resistencia sistémica frente a los patógenos del suelo (D’Alessandro et al., 2014; Lioussanne, 2010).
Tabla 2. Capacidad de producción de los aislados, con producción (+) y sin producción (-).
| CARACTERÍSTICAS MORFOLÓGICAS | ACTIVIDAD HIDROLÍTICA | |||||
| Aislados | Morfología | Gram | Amilasa | Pectinasa | Celulítica | Proteasa |
| 5R | Bacilo | + | + | - | + | - |
| 18E | Bacilo | + | + | + | + | - |
| 58E | Bacilo | + | + | + | + | - |
| 64E | Bacilo | + | + | + | + | - |
| 70E | Bacilo | + | + | + | + | - |
| 75E | Bacilo | + | + | + | + | - |
| 80E | Bacilo | + | + | + | + | - |
| 83E | Bacilo | + | + | + | + | - |
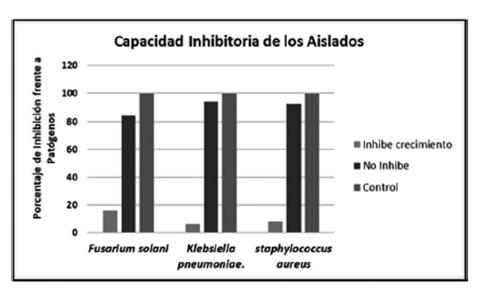
Los aislados que formaron un halo inhibitorio frente a Fusarium solani fueron unas 9 (13.8%). Mientras que frente a Klebsiella pneumoniae 3(4.61%) de los aislados fueron capaces inhibir el crecimiento del patógeno (Figura 6).

Figura 6 Inhibición del crecimiento en patógeno a 37°C de incubación. A) Inhibición en el crecimiento de Klebsiella pneumoniae de las bacterias aislada. B) Observación de halos en la inhibición en el crecimiento contra Fusarium solani. C) Inhibición del crecimiento en S. aureus.
En el trabajo realizado por Sharma et al., (2019) identificaron una rizobacteria halotolerante que tiene efecto de estimulación de crecimiento en el maní, en los ensayos in vitro demostraron la activación de genes involucrados en la producción de etileno y la señalización de defensa contra Aspergillus flavus, esto demuestra que podría existir bacterias que resisten concentraciones elevadas de NaCl que están asociadas con plantas capaces de inhibir patógenos, es por esta razón se escogió trabajar con una planta halotolerante como S. neei.
En trabajos similares realizados por Cao et al., (2018), caracterizaron dos aislados de Bacillus velezenis asociados a la rizosfera que producen tres compuestos de lipopéptidos responsables de la actividad antimicrobiana frente a Fusarium oxysporum y Ralstonia solanacearum, diversos autores reportan actividad antimicrobiana frente a Fusarium solani por parte de bacterias aisladas como por ejemplo Streptomyces sp. (Ezra et al., 2004; El-Gendy & El-Bondkly, 2010).
En otro estudio realizado por Passari et al., (2017), el 47% de los aislados de una planta me- dicinal mostraron actividad antimicrobiano contra diversos patógenos como E. coli, C. albicans, solo el 0.59% mostró actividad antimicrobiana frente a S. aureus, muy diferente al este ensayo realizado donde se obtuvo 7.8% (Figura 7), de los aislados demostraron actividad antimicrobiana frente a S. aureus con características meticilino resistente, lo cual demuestra que estos aislados podrían tener una gran perspectiva en las industrias agrícola y farmacéutica.
Conclusión
En el análisis de la actividad enzimática, se obtuvieron un total de 83 aislados, siendo Gram positivas mayoritariamente, las cuales provienen del suelo circundante (rizosfera) 60,2% y de las raíces de las plantas 39,7% (endófitas) de S. neei.
Los aislados capaces de producir enzimas hidrolíticas fueron para celulasas 40,9%, amilasas 50,6%, pectinasas 36,1% y proteasas 10,8% aislados. Los aislados bacterianos capaces de producir enzimas hidrolíticas fueron mayoritariamente bacterias endofíticos, de los cuales siete aislados fueron capaces de producir tres enzimas hidrolíticas de las cuatro enzimas estudiadas. Por último, las bacterias capaces de inhibir el crecimiento de Fusarium solani fueron 13,8%, el 4,6% de los aislados fueron capaces inhibir el crecimiento de Klebsiella pneumoniae y solo el 0,6% mostró actividad antimicrobiana frente a S. aureus. Finalmente creemos que este tipo de trabajos puede contribuir a la investigación, en la búsque da de nuevas fuentes de enzimas, sustancias o metabolitos con potencial biotecnológico y valor económico.












 uBio
uBio