INTRODUCCIÓN
Las lesiones en la piel siguen siendo un gran problema de salud pública en términos de morbilidad y discapacidad a largo plazo en todo el mundo. La agresión a la piel, afecta su función de barrera normal, permitiendo de este modo la colonización microbiana, lo que constituye una fuente de infección que afecta al sistema inmunológico (Troche et al., 2017).
La prescripción y consumo de antibióticos son un factor importante en la curación y control de las infecciones. La incidencia de infecciones en la piel es mayor en relación a otras lesiones traumáticas, debido a la pérdida de la barrera cutánea que constituye la primera defensa del organismo. La incorrecta utilización de los antibióticos puede ocasionar la resistencia microbiana y disminución de la eficacia terapéutica. (Mediavilla et al., 2014). Los trabajos publicados previamente demostraron que el sobrenadante de cultivo de Lactobacillus plantarum (LAPS) inhibe in vitro la adhesión, crecimiento, señales de quorum sensing, biofilm y factores de virulencia de P. aeruginosa (Ramos et al., 2010). También se comprobó que LAPS inhibe, crecimiento, formación de biofilm y disrumpe biofilm preformado de: S. aureus, S. epidermidis, S. pyogenes, E. faecalis y S. marcesens. Estas cepas están presentes en el 80% de los aislamientos clínicos de úlceras crónicas en la provincia de Tucumán, Argentina (Lindon et al., 2016). Del mismo modo en Paraguay, las infecciones bacterianas más frecuentes que fueron aisladas, son de bacterias Gram (-) como Pseudomonas aeruginosa multirresistentes y dentro de los gram positivos, S. aureus (Balmelli et al., 2018).
A partir de un profundo análisis de las propiedades biológicas y químicas de LAPS, se determinó su composición completa de metabolitos y enzimas. Basados en las propiedades ya demostradas para estos componentes, se hipotetizó un mecanismo de acción en heridas crónicas. Los metabolitos responsables de las propiedades antipatogénicas y pro-cicatrizantes de LAPS, actúan de manera sinérgica, lo que posiciona a esta mezcla compleja, como un único IFA de origen biológico (Ramos et al., 2015).
Dadas las propiedades pro-cicatrizantes directas e indirectas y la seguridad en el uso demostrada pre- viamente, se diseñaron formas farmacéuticas para facilitar la administración en humanos (Cabrera et al., 2016). Todo ello avala el uso de LAPS como IFA en el diseño de medicamentos tópicos dirigidos al tratamiento de úlceras crónicas de elevado volumen de exudado. En este caso específicamente, el interés radica en vehiculizar un principio activo de origen biológico en un sistema de administración transdérmica de fármacos (STT) de liberación controlada y de esta forma obtener un producto final, es decir un medicamento que reúna las características fundamentales de seguridad, calidad y eficacia. Y de este modo mejorar la calidad de vida de los pacientes que padecen de úlceras, ya que la presencia de elevados volúmenes de exudado contribuye al retraso en la cicatrización, los estadios inflamatorios, así como también un sitio favorable para adquirir infecciones.
MATERIALES Y MÉTODOS
Producción del ingrediente activo farmacéutico (IFA) e implementación de metodologías de producción más limpia (P+L)
Medios de cultivo
A fin de exacerbar la actividad inductora del Biofilm fueron preparados cuatro medios de cultivo diferentes (MRS, SCM1, MRST y MRSTC) para la producción de LAPS.
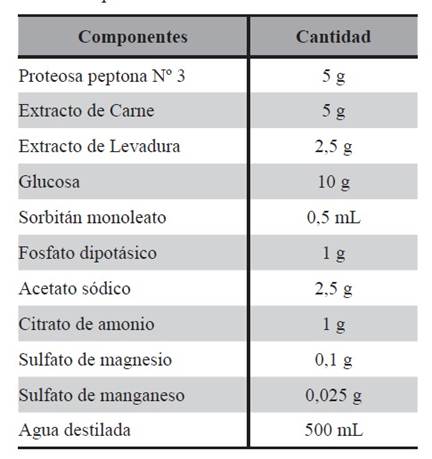
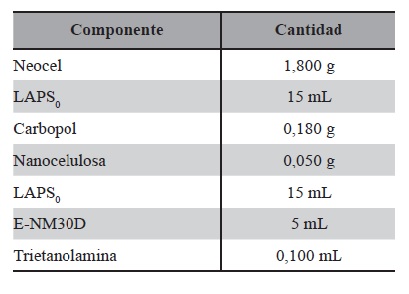
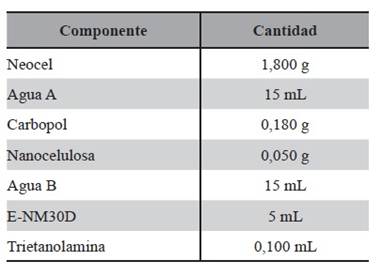
Medio MRS (Man, Rogosa y Sharpe) comercial: medio de cultivo como base para el diseño y posterior modificación de composición de SCM1, MRST y MRSTC y como patrón de control. Este medio se utilizó para obtener LAPS0, cuya composición se detalla en la Tabla 1.
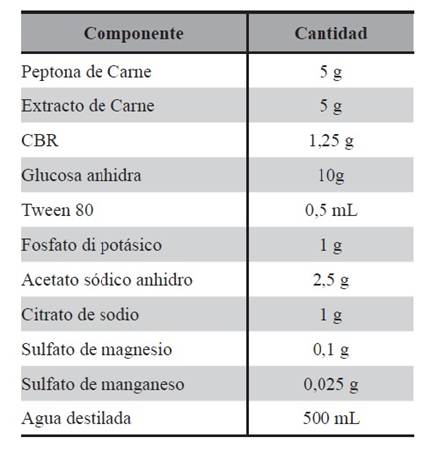
Medio SCM1: medio de cultivo en el cual fue reemplazado totalmente el extracto de levadura por CBR (células bacterianas residuales) secas y lisadas. En el marco de la filosofía de P+L, se reemplazaron las fuentes de proteínas. Este medio se utilizó para obtener LAPSa, cuya composición se detalla en la Tabla 2.
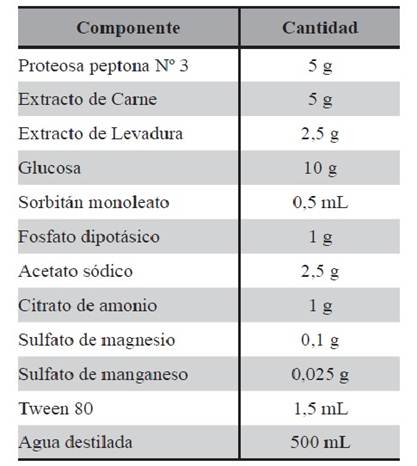
Medio MRST: Al medio MRS comercial fue adicionado Tween 80, debido a que el mismo posee elevado poder disruptor de biofilm. Este medio se utilizó para obtener LAPSb, cuya composición se detalla en la Tabla 3.
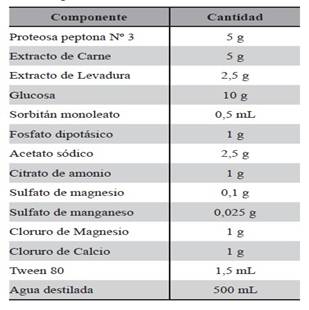
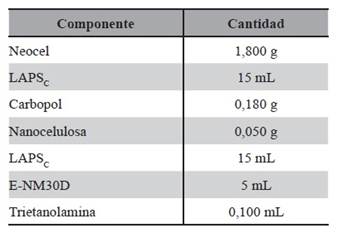
Medio MRSTC: Se adicionó cationes calcio, magnesio y Tween 80, al medio MRS. Con la adición de los mismos se potenció la capacidad disruptora de biofilm, debido a que los cationes bivalentes rompen el biofilm. Este medio se utilizó para obtener LAPSc, cuya composición se detalla en la Tabla 4.
Preparación de medios de cultivo estárter
Para L. plantarum: Las cepas de L. plantarum ATCC 10241 utilizadas, fueron conservadas en el Laboratorio de Estudios Farmacéuticos y Biotecnología Farmacéutica de la Universidad Nacional de Tucumán desde el 07/12/2018, en medio LEL compuesto por leche, extracto de levadura y glucosa con glicerol al 30%, en viales almacenados en freezer a -22 °C. Para obtener el cultivo estárter del mismo se preparó medio MRS. Según Ficha Técnica del medio BHI.
Para P. aeruginosa: Para obtener el cultivo estárter del mismo se preparó medio Luria Bertani (LB).
Para S. aureus: Para obtener el cultivo estárter del mismo se preparó medio BHI. Según Ficha Técnica del medio BHI.
Proceso de producción del IFA
En este trabajo se utilizó el protocolo de elaboración del IFA estandarizado.
Parámetros de calidad del IFA
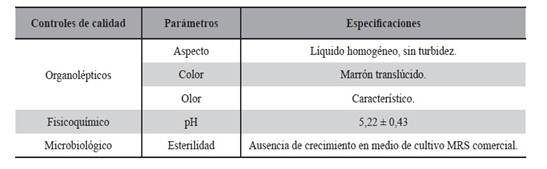
Fueron establecidos los parámetros de calidad para el IFA biológico, según Tabla 5.
Determinación de la actividad antimicrobiana
Inhibición del crecimiento: las cepas patógenas de P. aeruginosa y S. aureus se cultivaron en caldo LB y BHI respectivamente, durante 12 horas a 37 °C. Se prepararon las suspensiones DO600 ≈ 0,150 usando medio fresco de LB y BHI como diluyente y blanco.
En microplacas de poliestireno de 96 pocillos, fueron sembrados: 100 μL de cada medio de crecimiento (LB para P. aeruginosa y BHI para S. aureus), 100 μL de cada inhibidor: LAPSo, LAPSa, LAPSb y LAPSc y 50 μL de suspensión bacteriana. Fueron utilizados como control de actividad antimicrobiana original, 50 μL de gentamicina (8 μg/mL) como control antimicrobiano positivo y 50 μL de los medios LB o BHI como controles de crecimiento, 50 μL de la solución fisiológica como control antimicrobiano negativo. Las microplacas se incubaron durante 12 horas a 37 °C. Las curvas de crecimiento se obtuvieron a partir de la medición de la DO600 cada una hora, en lectora de microplacas (Multiskan Go - Thermo Scientific). Cada curva se realizó por quintuplicado y cada punto se expresó como la media ± desviación estándar.
Inhibición de formación de biofilm: para poder estudiarlo se descartó el contenido de los pocillos de la microplaca del ensayo anterior, de inhibición de crecimiento. Los pocillos fueron lavados 3 veces con suero fisiológico al 0,9%. La biomasa remanente adherida se tiñó durante 15 min con 250 μL de cristal violeta al 0,1% (m/V). Se descartó el contenido y se lavó suavemente suero fisiológico al 0,9%. Las células muertas y adheridas se solubilizaron con 250 μL de etanol y se midió la DO540 en lectora de microplacas (Multiskan Go - Thermo Scientific). La medida de la DO es directamente proporcional a la biomasa formada. Los resultados se expresaron como la media ± desviación estándar por quintuplicado.
Capacidad de disrupción de biofilm: se preparó la suspensión de cada cepa patógena siguiendo el mismo protocolo que en el ensayo para inhibición del crecimiento. En microplacas de poliestireno de 96 pocillos, se sembró: 100 μL de cada medio de crecimiento y 50 μL de las suspensiones bacterianas. Se incubó a 37 °C durante 6 horas. Luego, se agregaron 100 μL de LAPSo, LAPSa, LAPSb y LAPSc como control de actividad original, gentamicina (8 μg/mL) como control antimicrobiano positivo, medio LB o BHI como control de crecimiento, solución fisiológica como control antimicrobiano negativo. Se incubó nuevamente a 37 °C durante 6 horas. Se descartó el contenido de los pocillos y se lavó tres veces con solución fisiológica al 0,9%. El proceso de tinción se realizó según se indicó en la inhibición de formación de biofilm. Los resultados se expresaron como la media ± desviación estándar.
Desarrollo de un medicamento biológico de uso tópico para elevado volumen de exudado.
Estudios de pre formulación. Evaluación de las propiedades tecnológicas de los STT diseñados
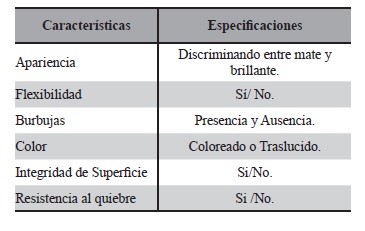
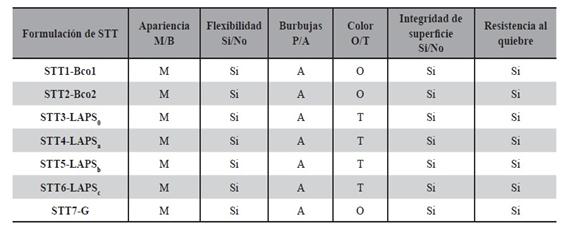
Se evaluaron las siguientes características. Según lo descripto en Tabla 6.
Capacidad de hinchamiento.
Según (Alagusundaram et al., 2011; Noguez et al., 2014), se tomaron muestras de 1,5 cm x 1,5 cm de cada STT diseñado y se pesaron en balanza analítica (Radwag AS220R2). Se utilizó PBS de pH 7,2 reportado en literatura como el pH del tejido cutáneo en heridas. Según estudios previos, permitieron identificar que este valor de pH de 7,2 se repite en el mayor número de pacientes con úlceras crónicas, tomándose como el máximo valor de pH alcanzado por una úlcera cronificada. Se colocó en una caja de Petri una solución de PBS en volumen de 10 mL y se mantuvo durante 24 h con agitación orbital. Las lecturas de peso, se realizaron luego de agotar el volumen remanente de agua. El aumento de peso por absorción de PBS se registrará a las 0, 4, 6 y 24 h. Con los valores registrados se calculará el índice de hinchamiento como:
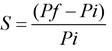 (1).
(1).
En donde, Pi es el peso registrado antes del hinchamiento y Pf el peso registrado al final del ensayo.
Con los valores obtenidos del índice de hinchamiento se calculará la capacidad de absorción de agua por cm2 de área del STT, el porcentaje de retención de agua del STT diseñado en comparación con un STT sin NCB que se utiliza como control. También se evaluó la estabilidad de las formulaciones en medio acuoso.
Uniformidad de peso
Según (Noguez et al., 2014). Se pesó el STT completo en balanza analítica (Radwag AS220R2). Se secó a 60 °C. Se registró el peso hasta las 4 h, 8 h o hasta peso constante. Se trabajó por triplicado. El promedio de los pesos y desviación estándar se calculó a partir de los pesos individuales.
Porcentaje de absorción de humedad.
Según (Kusum et al., 2003; Noguez et al., 2014). Se cortaron muestras de STT de 1,5 x 1,5 cm. Se pesaron en balanza analítica (Radwag AS220R2). Se ubicaron las muestras en un recipiente hermético con 100 mL de solución saturada de KCl (mantiene la humedad relativa en 84%) a 25 °C. Luego de 3 días los STT fueron retirados y se pesaron. El porcentaje de absorción de humedad se calculó con la siguiente fórmula: 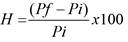 (2)
(2)
En donde, Pi es el peso registrado antes de la absorción y Pf el peso registrado al final del ensayo.
pH superficial
Según (Alagusundaram et al., 2011). Se cortaron muestras de STT de 1,5 cm x 1,5 cm. Se dejaron hinchar en 2 mL de agua durante 15 min. El pH de la superficie se midió usando una tira universal de pH (Biopack) en contacto con el STT hinchado.
Liberación del ingrediente farmacéutico activo desde la matriz portadora.
Para evaluar la liberación del IFA, se modificó el ensayo de liberación in vitro reportado en Sesto et al., 2015. La modificación se debe a que el portador es un sólido en forma de parche y el equipo y método, se adaptaron para la medición de difusión desde una matriz semisólida.
Este ensayo se llevó a cabo utilizando celdas verticales de difusión tipo Franz. (Sesto et al., 2014). Cada celda cuenta con un compartimento receptor de 10 mL de capacidad y un compartimento donador, donde se coloca la muestra. Ambas celdas están separadas por la membrana del STT estudiado de 1,8 cm2, productos cuyo objetivo es aplicar tópicamente. Las celdas receptoras se cargan con solución fisiológica. En total, el sistema consiste en 16 celdas que se agitan a 100 rpm (FBR Shaker) y mantienen a 32 ± 0,5 ºC (temperatura de la piel sana). La determinación del compuesto de interés se realiza en el fluido receptor. (Sesto et al., 2015). Se cortó 1 cm2 de STT para cada recipiente, se pesaron en balanza analítica (Radwag AS220R2) y los mg registrados se utilizaron para los cálculos de concentración de LAPS liberado al medio.
-Se registraron los valores de absorbancia a tiempo 0, 30, 60, 90, 120, 180, 240, 300, 360 minutos.
Con los datos obtenidos se graficó una curva de concentración por cm2 de área del STT liberado en el tiempo.
Con la solución remanente se hizo un seguimiento de pH en cada lectura de absorbancia.
La concentración del analito liberado se identificó por barrido UV-visible en espectro- fotómetro. Se identificó un pico de máxima absorbancia a 230 nm, coincidente con lo discutido en Sesto et al., 2015.
Formulación de STT de liberación prolongada para elevado volumen de exudado
Fue seleccionado el sistema EC5 como se indica en la Tabla 7 como Blanco1 por tener las características apropiadas para las formulaciones en desarrollo. A continuación, para elaborar un STT de 112,5 cm2 se detallan las fórmulas cuali-cuantitativa de cada uno, de las Tablas 7 , 8, 9, 10, 11,12 y 13.
Tablas 8: Composición cuali-cuantitativa de STT. Tabla 8 [ arriba]) Composición cuali-cuantitativa de STT 2 Blanco2.
RESULTADOS Y DISCUSIÓN
Producción del ingrediente activo farmacéutico (IFA) e implementación de metodologías de producción más limpia (P+L)
Medios de cultivo.
El medio comercial seleccionado fue el de Man Rogosa Sharpe (MRS). A partir de la misma, se diseñaron tres medios de cultivo alternativos al medio comercial de crecimiento para Lactobacillus plantarum ATCC 10241. Los medios obtenidos fueron: SCM1, MRST y MRSTC.
Medio de cultivo estárter.
El cultivo de L. plantarum ATCC 10241 en medio MRS, fue crecido durante 12 horas a 37 ºC. Como resultado del metabolismo normal del L. plantarum en el medio MRS, se obtuvo por mecanismos físicos de separación, un Ingrediente Farmacéutico Activo (IFA) de origen biológico denominado LAPS original. Este IFA original se utilizó posteriormente para la producción de formas farmacéuticas de uso tópico en forma de sistema de administración trasdérmica (STT) para el tratamiento de ulceras crónicas, por su probada actividad procicatrizante y anti patogénica.
Proceso de producción del IFA.
La Figura 1 muestra el proceso de obtención de LAPS original, por medio de la cual se determinó el número de etapas del proceso de producción, la recuperación y reutilización de las células bacterianas residuales (CBR). Además, se identificaron las etapas críticas del proceso de producción que son: la incubación de Lactobacillus plantarum ATCC 10241 y la filtración en vacío; que sirvieron para establecer los controles de calidad durante el proceso de producción a fin de verificar el cumplimiento de las condiciones requeridas para dar continuidad al proceso y mecanismos de disposición final de residuos.
Parámetros de calidad del IFA
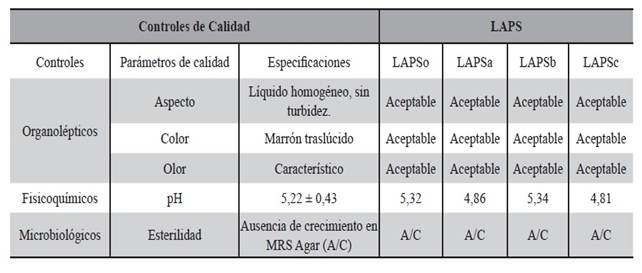
Los resultados de los controles de calidad realizados a todos los LAPS durante el proceso de producción se verifican en la Tabla 14, se indican con cada parámetro de calidad que las especificaciones han sido aceptables.
Tabla 14. Resultados de los controles de calidad realizados a todos los LAPS durante el proceso de producción. Se indica con cada parámetro de calidad las especificaciones aceptables.
Determinación de la actividad antimicrobiana Inhibición del crecimiento
La Figura 2 muestra la inhibición de crecimiento de P. aeruginosa ATCC 27853. Para el ensayo se utilizó la bacteria patógena con crecimiento en medio de cultivo LB durante 12 horas a 37 ºC.
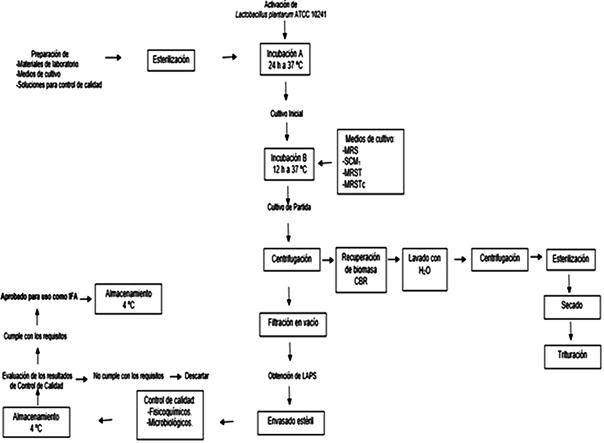
Figura 1. Diagrama de flujo del proceso de obtención de los sobrenadantes (LAPS), el procedimiento de recuperación y reutilización de residuos de biomasa involucrado hasta la producción de la forma farmacéutica final.
Se utilizó como control positivo de crecimiento al medio de cultivo Luria Bertani y como control negativo de crecimiento al antibiótico Gentamicina de concentración (8μg/mL). En todos los casos LAPS, LAPSa, LAPSb y LAPSc mostraron inhibición total del crecimiento de P. aeruginosa cuando se compararon las DO600 con respecto al control positivo de crecimiento. Cuando los valores de las DO600 obtenidas se contrastaron con los valores obtenidos con Gentamicina (Genta=0,031±0,005), en concentración inhibitoria mínima (CIM), todos los IFAs fueron significativamente diferentes para: (LAPS= 0,001 ± 0,002), (LAPSa= 0,000 ± 0,002), (LAPSb= 0,002±0,03), (LAPSc=0,001±0,001).
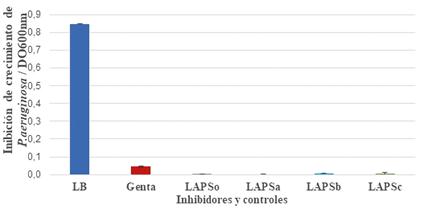
Figura 2. Inhibición de crecimiento de Pseudomonas aeruginosa ATCC 27853 frente a los ingredientes farmacéuticos activos.
La Figura 3 muestra la inhibición de crecimiento de S. aureus ATCC 25933. Para el ensayo se utilizó la bacteria patógena con crecimiento en medio de cultivo BHI durante 12 horas a 37ºC. Se utilizó como control positivo de crecimiento al medio Brain Heart Infussion y como control negativo de crecimiento al antibiótico Gentamicina en concentración (8μg/mL). En todos los casos LAPS, LAPSa, LAPSb y LAPSc mostraron inhibición del crecimiento de S. aureus cuando se compararon las DO600 con respecto al control positivo de crecimiento. Cuando los valores de DO600 obtenidas se contrastaron con los valores obtenidos con Gentamicina (Genta= 0,015 ± 0,005), en concentración inhibitoria mínima (CIM), todos los IFAs fueron significativamente diferentes y mostraron inhibición del crecimiento de S. aureus: (LAPS= 0,010 ± 0,008), (LAPSa = 0,010 ± 0,009), (LAPSb = 0,249 ± 0,015) y (LAPSc = 0,068 ± 0,014).
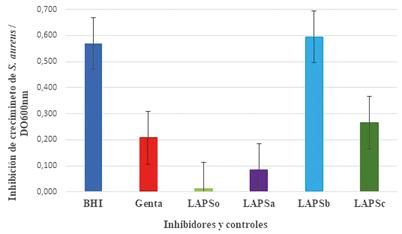
Figura 3. Inhibición de crecimiento de Staphylococcus aureus ATCC 25933 frente a los ingredientes farmacéuticos activos.
Inhibición de formación de biofilm
Se testeó la inhibición de formación de biofilm de bacterias patógenas aisladas en mayor porcentaje en heridas crónicas infectadas. Para cuantificar el biofilm formado en presencia del medio de crecimiento normal y en presencia de los inhibidores de formación, se descartaron los cultivos contenidos en las placas de 96 pocillos y se colocaron 250 μL de cristal violeta. Luego de descartar el cristal violeta se retomó la tinción adherida al biofilm remanente con alcohol de 96º. Los valores de concentración de cristal violeta leídos a una DO540, son una medida indirecta de la concentración de biofilm presente en cada uno de los pocillos.
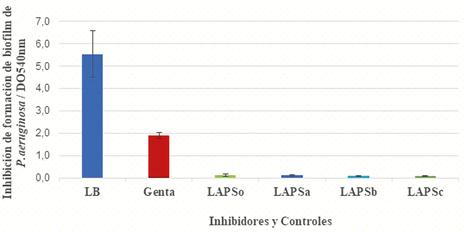
Figura 4. Inhibición deformación de biofilm de Pseudomonas aeruginosa ATCC 27853 frente a los ingredientes farmacéuticos activos.
La Figura 4 muestra la inhibición de formación de biofilm cuando se colocó el inhibidor (IFA) en contacto directo con el crecimiento de P. aeruginosa ATCC 27853 en medio de cultivo Luria Bertani a 37 ºC durante 12 horas. En todos los casos LAPS, LAPSa, LAPSb y LAPSc mostraron una inhibición significativa respecto a los controles negativos de inhibición de formación de biofilm (LB) y de inhibición de crecimiento (Gentamicina).Cuando los valores de las DO540 obtenidas se contrastaron con los disruptores se dejó crecer a las cepas patógenas en sus medios de crecimiento normales y luego de 6 horas se agregaron los disruptores LAPS, LAPSa, LAPSb y LAPSc.
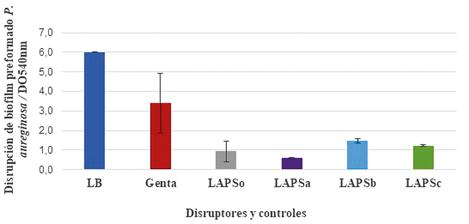
Figura 6. Disrupción de biofilm de Pseudomonas aerugimsa ATCC 27853 frente a los ingredientes farmacéuticos activos.
La Figura 6 muestra que en todos los casos los IFAS mostraron disrupción del biofilm de P. aeruginosa cuando se compararon las DO540 con respecto valores obtenidos con Gentamicina (Genta=1,912 ± 0,1270), en concentración inhibitoria mínima al control positivo. Cuando los valores de las DO540 (CIM), todos los IFAs fueron significativamente diferentes para: (LAPS= 0,128 ± 0,0497), (LAP- Sa= 0,106 ± 0,0214), (LAPSb= 0,090 ± 0,0149), (LAPSc= 0,085 ± 0,0125).
La Figura 5 muestra la inhibición de formación de biofilm cuando se colocó el inhibidor (IFA) en contacto directo con el crecimiento de S. aureus ATCC 25933 en medio de cultivo Brain Heart Infussion a 37 ºC durante 12 horas. En todos los casos LAPS, LAPSa, LAPSb y LAPSc mostraron una inhibición significativa respecto a los controles tanto negativo de inhibición de formación de biofilm (BHI) y de inhibición de crecimiento (Gentamicina).Cuando los valores de las DO540 obtenidas se contrastaron con los valores obtenidos con Gentamicina (Genta=0,360±0,039), en concentración inhibitoria mínima (CIM), todos los IFAs fueron significativamente diferentes para: (LAPS= 0,075 ± 0,008), (LAPSa= 0,094 ± 0,008), (LAPSb= 0,080 ± 0,007), (LAPSc= 0,080 ± 0,004).
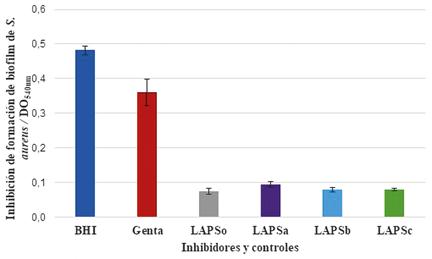
Figura 5. Inhibición de formación de biofilm de Staphylo- coccus aureus ATCC 25933 frente a los ingredientes farmacéuticos activos
Capacidad de disrupción de biofilm
Se testeó la capacidad de disrupción de biofilm preformado de bacterias patógenas aisladas en mayor porcentaje en heridas crónicas infectadas. Para cuantificar el biofilm pre formado, en ausencia de obtenidas se contrastaron con los valores obtenidos con Gentamicina (Genta=3,409±1,511), todos los IFAs fueron significativamente diferentes para: (LAPS= 0,929± 0,510), (LAPSa= 0,608 ± 0,030),
(LAPSb= 1,475±0,099), (LAPSc=1,228±0,061).
La Figura 7 muestra la disrupción del biofilm de S. aureus cuando se compararon las DO540 con respecto al control positivo. Cuando los valores de las DO540 obtenidas se contrastaron con los valores obtenidos con Gentamicina (Genta=0,401±0,019), todos los IFAs fueron significativamente diferentes para: (LAPS= 0,662± 0,013), (LAPSa= 0,439 ± 0,030), (LAPSb= 0,365±0,012), (LAPSc=0,356±0,012).
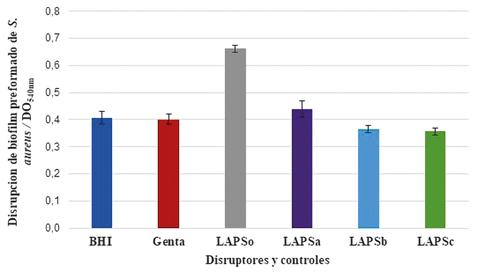
Figura 7. Disrupción de biofilm de Staphylococcus aureus ATCC 25933 frente a los ingredientes farmacéuticos activos.
Desarrollo de un medicamento biológico de uso tópico para elevado volumen de exudado
Estudios de pre formulación. Evaluación de las propiedades tecnológicas de los STT diseñados
La Tabla 15 muestra las características organolépticas registradas por observación directa de los STT obtenidos. Todas las formulaciones diseñadas y sus controles, fueron testeados organolépticamente en el tiempo t = 0 y t = 30 días, en todos los casos, los STT mostraron las características tecnológicas esperadas para este tipo de forma farmacéutica.
Capacidad de Hinchamiento
Cuando los STT se colocaron en el medio de hinchamiento, se verificó que los mismos permanecieran íntegros y no se desintegrarán durante la manipulación experimental. Con el valor del índice de hinchamiento promedio dentro de las 24 horas de ensayo, se calculó el volumen de agua absorbido por un cm2 de STT en 24 horas.
La diferencia de absorción entre ambas formulaciones se calculó como el valor de S promedio en 24 horas de medición calculado por centímetro cuadrado de área del STT. Obteniéndose valores de 0,8773 S/cm2 para el STT con la formulación original y un valor promedio de 1,4219 S/cm2. Además, se comprobó que la formulación diseñada con el añadido de NCB, es capaz de retener la humedad, al menos por 24 horas luego del estudio, mientras que el STT con la formulación original se deshidrata completamente en el mismo periodo de tiempo. Esta es una característica tecnológicamente deseable ya que, al momento de retirar el STT del área injuriada, la humedad del STT facilita el desprendimiento sin dolor. Cuando se calculó el % de retención de PBS del STT diseñado con NCB, su capacidad de retención fue superior en un 62% a la capacidad de absorción del STT original. Se encuentra reportado en literatura que la celulosa a escala nano, producida por bacterias, es capaz de retener hasta 200 veces su peso en agua (Karki et al., 2016).
Porcentaje de absorción de humedad
Cuando se testeó el porcentaje de absorción de humedad según Tabla 16, se registró aumento en peso de los sistemas de 2,25 cm2 como sigue y con estos datos se calculó también la humedad por centímetro cuadrado de área del STT.
No se observaron diferencias significativas en los valores de porcentajes de absorción de humedad. El incremento en peso dentro de las 72h del ensayo experimentado fue superior a los controles en todos los casos. Los valores de porcentaje de humedad obtenidos por cm2 de superficie del STT de H/cm2 mostraron que el sistema control con nanocelulosa adicionada, mejora la absorción de humedad por unidad de superficie. Los valores ligeramente superiores podrían deberse al cambio en los valores de pH entre un IFA y otro en particular, se destaca el STT7-G conteniendo Gentamicina, el mismo se diseñó con el propósito de realizar ensayos de actividad de la matriz farmacéutica diseñada.
Tabla 16. Absorción de humedad por centímetro cuadrado de área del parche (H/cm2) para STT: en 72h de ensayo.
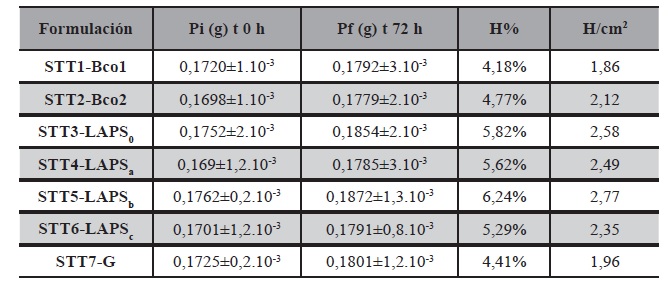
Los valores obtenidos en todos los casos, son aceptables y se encuentran dentro de los rangos óptimos. Sin embargo, un porcentaje de humedad inferior asegura la conservación en estante del STT. Se recomienda, tener en cuenta los valores obtenidos a la hora del diseño del empaque primario.
La Tabla 17 muestra los valores de porcentajes de absorción de cuando se testearon los STT almacenados en estante por 30 días. Los valores obtenidos a los 30 días de ensayo, son consistentes con los obtenidos previamente. Al someter a los STT diseñados a un ambiente de temperatura y humedad controladas se demostró la estabilidad del STT y su adecuado empaquetamiento durante el periodo de estante. Los estudios de estabilidad, son importantes a la hora de establecer la fecha de vencimiento del medicamento, una vez formulado. Un bajo índice de humedad durante el proceso de pre formulación y diseño, asegura que el contenido IFA se mantenga inalterado (Karki et al, 2016).
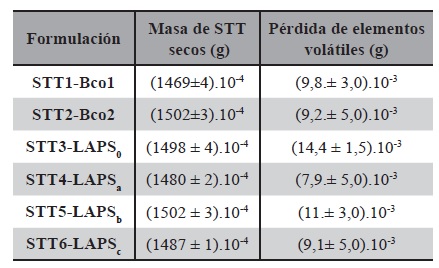
Uniformidad de peso
Se testeó la uniformidad en peso de todos los prototipos diseñados Tabla 18 (STT1-Bco1, STT2-Bco2, STT3-LAPS0, STT4-LAPSa, STT5-LAPSb, STT6-LAPSc, STT7-G). El peso constante promedio de al menos 5 STT de 2,5cm2 de área, se alcanzó a las 24 h de secado. Los valores de peso se registraron hasta peso constante a tiempo 0, 4, 6, 8, 24 y 25h. El valor de volátiles desprendidos en 24 h de secado, se calculó como la diferencia entre el peso final del STT y el peso inicial del STT a tiempo 0. La masa de los films secos de STT3-LAPS0 fue de: (1498 ± 4).10-4 g y la pérdida de elementos volátiles fue de (14,4 ± 1,5).10-3 g. En el caso de STT4- LAPSa, se registraron valores de (1480 ± 2).10-4 g para el film seco y una pérdida de elementos volátiles de (7,9.± 5,0).10-3 g. Cuando se calcularon los valores para STT5-LAPSb, se registraron valores de (1502 ± 3).10-4 g para el film seco y una pérdida de elementos volátiles de (11.± 3,0).10-3 g.
Tabla 17. Absorción de humedad por centímetro cuadrado de área del parche (H/cm2) para STT: en 30 días de ensayo.
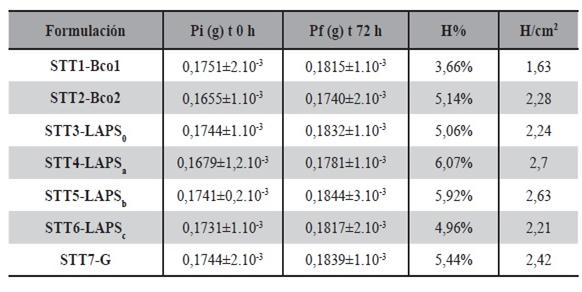
Los valores medidos para STT6-LAPSc, fueron de (1487 ± 1).10-4 g para el film seco y una pérdida de elementos volátiles de (9,1± 5,0).10-3 g. Para los controles el peso seco se registró en: (1469±4).10-4 g y la perdida de los volátiles fue de (9,8.± 3,0).10- 3g para STT1-Bco1 y (1502±3).10-4 y la perdida de volátiles se registró en (9,2.± 5,0).10-3g.
pH superficial
Se cortaron muestras de film de 1,5 cm x 1,5 cm. Se dejaron hinchar en 2 mL de agua durante 15 min. El pH de la superficie se midió con una tira universal de pH (Biopack) que se coloca sobre el film hinchado.
Los valores de pH obtenidos fueron consistentes con el valor de pH del agua destilada utilizada para los ensayos. Las mediciones se realizaron en tres semanas consecutivas y con tres ciclos de destilación consecutivos. Cuando el valor de pH del agua fue de 6.4, el valor de pH superficial de STT3-LAPS0, STT4-LAPSa, STT5-LAPSb, STT6-LAPSc, STT7-G y sus respectivos controles fue de 6. Cuando el valor de pH del agua fue de 5.9, el valor de pH superficial medido fue de 6. Cuando el valor de pH del agua 6.5 el valor de pH superficial se mantuvo en 6. Tabla 19
Tabla 19. pH superficial de STT promedio en tres semanas consecutivas y con tres ciclos de destilación de agua consecutivas.

Estos valores son consistentes con los valores de pH reportados para STT-control, este comportamiento nos permite inferir que el pH del STT aplicado sobre una ulcera no modificaría el valor de pH de la herida. Así mismo, resuelve un problema tecnológico surgido durante el diseño de formas farmacéuticas semisólidas, como cremas y geles, donde los valores de pH fueron de 5,2 a 5,4. Esto podría indicar que la combinación de los Ingredientes farmacéuticos no activos seleccionados para el diseño de STT es más adecuada para el tipo de IFA que se desea vectorizar. Los valores reportados se mantuvieron en el rango de los pH medidos a los 30 días de ensayo, este comportamiento es coincidente con el comportamiento de las otras formas farmacéuticas mencionadas. (Sesto et al., 2015).
Liberación del ingrediente farmacéutico activo desde la matriz portadora
La concentración acumulada en mg/cm2 (CA) en el seno de la solución aceptora, se registró en función del área de STT para el ensayo 1,80 cm2, cada STT se cortó con un sacabocado para mantener la superficie constante.
La CA calculada para todos los sistemas diseñados se muestra en la Figura 8. No se encontraron diferencias significativas en la liberación del IFA LAPS0, LAPSa, LAPSb, LAPSc en los sistemas: STT3, STT4, STT5, STT6. Pero cuando se contrastaron con los valores de CA en mg/cm2 obtenidos y publicados en Sesto et al., 2015, encontramos un aumento significativo en la CA al alcanzar su estado estacionario. Son necesarios más estudios, pero, los datos obtenidos indican que la forma farmacéutica solida STT, mejora significativamente la disponibilidad de LAPS en la superficie de la herida.
El estado estacionario del sistema, se alcanzó a las 8 h desde el inicio del experimento. El estado estacionario indica el tiempo máximo de liberación del sistema, por lo que se recomienda, cambiar al STT cada 8 h (Figura 8).
CONCLUSION
Se obtuvo un Ingrediente Farmacéutico Activo con características homogéneas, la escala alcanzada en condiciones de esterilidad, fue apropiada para obtener la cantidad suficiente de medicamento para realizar los estudios de pre formulación in vitro.
La metodología de P+L implementada facilitó el proceso de producción, al identificar los puntos críticos de control del proceso. Se demostró in vitro que los LAPS obtenidos a partir de los medios modificados podrían utilizarse en el tratamiento de heridas crónicas, ya que conservan las propiedades antimicrobianas, antipatogénicas y físicas previamente reportadas para LAPS original.
Los estudios de preformulación y control de calidad, brindaron la información suficiente para el diseño exitoso de un STT con nanocelulosa bacteriana para su utilización en pacientes con ulceras crónicas con elevado volumen de exudado.












 uBio
uBio