INTRODUCCIÓN
En las últimas décadas, los bosques tropicales han sufrido grandes cambios debido a las actividades humanas, cambios que han producido fragmentaciones o transformaciones de los hábitats naturales, provocando un gradiente de hábitats que favorecen a especies de roedores reservorios de enfermedades. Se ha observado que estos animales son abundantes y frecuentes en matrices seminaturales donde ocurren actividades humanas, paisajes en mosaico y agricultura intensiva (Suzán et al., 2008; Goodin et al., 2006). De forma general, los ensambles de pequeños mamíferos se ven ampliamente afectados por estas alteraciones, ocasionando una disminución en la diversidad o abundancia de los mismos y favoreciendo en gran medida a aquellas especies generalistas o de amplia distribución, provocando a su vez un empobrecimiento de la diversidad (Cebollada Pütz et al., 2012; Santos-Filho et al., 2012; García-Estrada et al., 2015).
En las décadas de los 80 y 90, la extensión de los bosques en el mundo sufrió disminuciones importantes, y a lo largo de 15 años se ha registrado una pérdida de casi 200 millones de hectáreas de bosques naturales en países en desarrollo, principalmente ocasionados por el desmonte para fines agrícolas. En las últimas dos décadas, América Central y del Sur han disminuido su superficie forestal, y la principal causa considerada fue la transformación de las mismas a la agricultura y urbanización, previéndose que estas transformaciones seguirán constantes debido a que la agricultura es la actividad más accesible para países en desarrollo, como los de América Latina (FAO 1997; FAO 2011).
El Bosque Atlántico ha sufrido una deforestación ininterrumpida, dejando menos del 8% de su extensión original hoy (Galindo-Leal & de Gusmão Câmara, 2003). En el caso particular de Paraguay, la mayor superficie boscosa en la Región Oriental es el Bosque Atlántico del Alto Paraná, y esta ha sufrido grandes pérdidas en las últimas décadas, registrándose las mayores superficies deforestadas en el Depto. de San Pedro, con cifras que alcanzan aproximadamente 3.979 hectáreas, y en el Depto. de Canindeyú con 2.690 hectáreas, entre los años 2013 y 2014 (WWF Paraguay, 2014).
La especie Akodon montensis (Thomas, 1913), es una especie de roedor bastante común en hábitats de bosque primario y secundario, y se lo ha encontrado cerca de bordes de cultivos y pastizales abiertos, siendo así una especie bastante generalista (Ernmons & Feer, 1990). Además, es una especie que se encuentra frecuentemente en hábitats perturbados (D’Elía & Pardiñas, 2015) y ha sido identificado como un persistente hospedero para el Hantavirus en el Bosque Atlántico Interior del este de Paraguay (Chu et al., 2009 Oliveira et al., 2014).
Los estudios presentan resultados variados en cuanto a la relación que pueda presentar con los diferentes factores ambientales, observándose por ejemplo que la abundancia y el movimiento o inmigración no se ven afectados por la pérdida de cobertura de los bosques ni por la fragmentación de los mismos, en comparación con especies más especialistas (Püttker et al., 2013). También se observó que en el Bosque Atlántico de Brasil se relaciona positivamente con diferentes características como helechos terrestres y troncos caídos (Melo et al., 2013), mientras que en algunos bosques secundarios no presenta aparente relación con alguna de las variables estudiadas del paisaje (Püttker et al., 2008a). En el Bosque Atlántico al este de Paraguay, se encontró que A. montensis se relaciona positivamente con herbáceas, bromeliáceas y arbustos leñosos, así como también con el dosel presente en los sitios estudiados (Goodin et al., 2009).
La relación que pueda existir entre los diferentes factores ambientales que hacen a los diferentes hábitats y microhábitats y la presencia de Akodon montensis, ayudaría a comprender mejor los facto- res relacionados a la abundancia y densidad de los individuos en el hábitat, y cómo afecta a su presencia los diferentes niveles de degradación de la vegetación que puedan presentarse en su entorno. Es así que el objetivo de este trabajo es determinar los factores ambientales de microhábitat relacionados con la presencia de Akodon montensis, y también analizar cómo la calidad del hábitat, clasificado en niveles de perturbación, afecta a la abundancia y densidad de los individuos.
MATERIALES Y MÉTODOS
Área de estudio
La Reserva Natural del Bosque Mbaracayú (RNBM) se localiza al noreste de la Región Oriental del Paraguay, en el Departamento de Canindeyú, y constituye el Área Nucleo de la Reserva de Biósfera Mbaracayú (Figura 1). La misma posee 64.405,7 hectáreas que se encuentran en un área de transición entre las ecorregiones Bosque Atlántico Interior y Cerrado (FMB/BM, 2005).
Debido al aumento de las actividades agropecuarias y forestales, y la falta de control y planificación, estas actividades han favorecido la deforestación en la Región Oriental, llegándose a registrar una tasa de 600 hectáreas por año en la zona de influencia de la RNBM en el periodo 1997 - 2002 (FMB/ BM, 2005).
Datos de vegetación y selección de las parcelas
Las parcelas utilizadas fueron seleccionadas en base a líneas de estudios previos, donde se encontraron roedores seropositivos para anticuerpo contra Hantavirus. Se colocaron seis parcelas de 12x12 estaciones, y cada estación fue localizada y ubicada utilizando un GPS calibrado en UTMs. Cada esta- ción fue identificada con una letra y un número, y se encontraron separadas por 10 metros de distancia. Dos trampas Sherman fueron colocados en el suelo en cada estación (Figura 2).
Las parcelas se evaluaron en base a las características estructurales de la vegetación que fueron medidos en cada estación, y seis características se incluyeron en los análisis, por ser importantes descriptores tanto de la calidad del bosque como del hábitat de los roedores: restos de madera en el suelo, la altura máxima del dosel, la distancia a los árboles más cercanos, porcentaje de cobertura de hierbas, árboles caídos cercanos y la presencia de árboles de naranja (una especie invasiva, indicación de degradación del bosque). Estos descriptores indican que los hábitats perturbados se relacionan con mayor porcentaje de cobertura de hierbas, presencia de árboles de naranja y árboles caídos cercanos, mientras que los hábitats menos perturbados se relacionan con mayor presencia de restos de madera en el suelo, mayor altura del dosel y distancias menores entre los árboles cercanos a cada estación.
Los promedios de estos datos fueron analizados mediante Principal Component Analysis (PCA) with Minimum Spanning Tree, y sobre la base de estos análisis se designaron 3 pares de parcelas de acuerdo a la calidad del hábitat, definidos en términos de perturbación: B y H (menos perturbado), A y D (medio perturbado), y C y G (más perturbado).
Diseño de muestreo y análisis de datos
El método utilizado fue el de captura-marca- recaptura para colectar los datos de los roedores y a cada individuo se le colocó un microchip sub- dérmico para su posterior identificación (Figura 3). Se anotaron los siguientes datos de cada individuo capturado: identificación específica, peso, sexo, edad y estado reproductivo (Figura 4). También se tomaron muestras de sangre, saliva, orina y heces para medir los niveles de anticuerpo contra Hantavirus. Se tomó muestra de la punta de la cola, aproximadamente 1-2mm, para realizar pruebas que ayuden a corroborar la identificación específica del roedor.

Figura 3. Colocación del microchip (izq.) y lectura del mismo (der.) para identificar a los individuos.

Figura 4. Pesaje (izq.) e identificación (der.) de un ejemplar de A. montensis. Tabla 1. Regresiones simples de número de capturas de ratones vs. variables ambientales de todas las estaciones.
Cada parcela fue muestreada por cinco noches seguidas, realizándose un esfuerzo de captura de 1.440 trampas-noche en cada parcela, durante los meses de Junio y Julio del año 2015.
La estimación de la abundancia en los diferentes niveles de perturbación se calculó por el método de captura-marca-recaptura de individuos vivos aplicando modelos que trabajan con poblaciones cerradas. El mismo se realizó con el software de estimación MARK. La estimación de la densidad poblacional, se calculó dividiendo la abundancia por el área efectiva de trampeo (Schnell et al., 1980). Se determinó la relación que pueda existir entre las diferentes variables del hábitat y la preferencia de la especie analizando los datos mediante regresiones simples y múltiples en el programa R utilizando los paquetes Rcmdr y BiodiversityR. Se utilizaron datos de presencia/ausencia como rasgos de preferencia de los individuos en cada estación y así relacionarlos con los datos de vegetación de cada una. Para de- terminar si las abundancias y densidades fueron diferentes entre los niveles de perturbación, se realizó un análisis de t de Student.
RESULTADOS
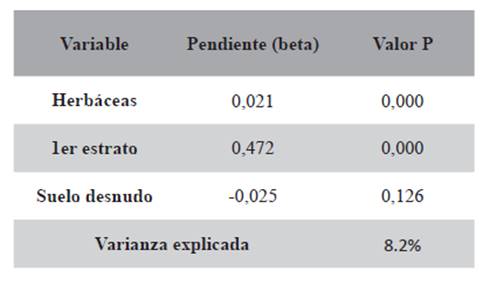
Las regresiones simples mostraron una relación positiva de la abundancia con la altura del primer estrato (P=0,000) y con las herbáceas (P=0,023), y una relación negativa con el suelo desnudo (P=0,014) (Tabla 1). Las regresiones múltiples con estas tres variables resultaron en una varianza explicada del 8,2% (Tabla 2).
Tabla 1. Regresiones simples de número de capturas de ratones vs. variables ambientales de todas las estaciones.
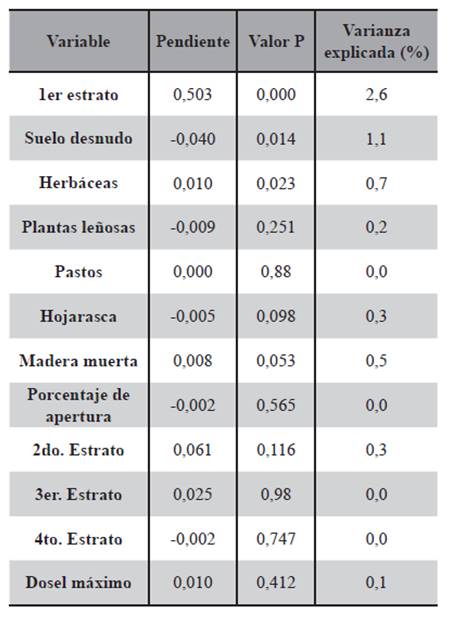
Tabla 2. Regresión múltiple de número de capturas de ratones vs. variables ambientales de todas las estaciones.
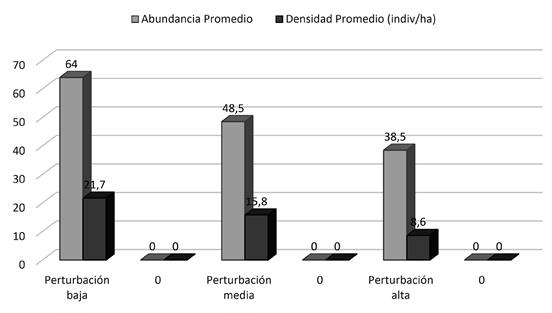
Entre los diferentes niveles de perturbación, según las pruebas t de Student las abundancias no mostraron diferencias significativas, con valores de P > 0,05. Se presentaron en los diferentes niveles de perturbación: parcelas con perturbación baja 64,0 individuos, parcelas con perturbación media 48,5 individuos y las parcelas con perturbación alta 43,5 individuos (Figura 5).
En cuanto a la densidad, las pruebas t de Student no mostraron diferencias significativas, con valores de P > 0,05. Las parcelas con perturbación baja mostraron un promedio de densidad de 21,8 ind/ha, parcelas con perturbación media 15,8 ind/ ha, y ambas parcelas con perturbación alta 8,6 ind/ ha (Figura 5).
DISCUSIÓN
Tanto en las abundancias como en las densidades, se observa una disminución a medida que aumenta la perturbación del hábitat.
Prácticamente todos los trabajos realizados, consideran a A. montensis como una especie generalista debido a que se encuentra en distintos hábitats y es asociada positivamente con diferentes factores del mismo (Goodin et al., 2009; Melo et al., 2013). En este trabajo en particular, se observó que se encuentra positivamente relacionado con el primer estrato y las herbáceas, y negativamente con el suelo desnudo. Estos resultados ayudan a entender que si bien puede relacionarse con diferentes factores, aparentemente esos son factores que pueden proveerle de alimentos (como el primer estrato y las herbáceas) y protección contra depredadores, y ser potenciales lugares de anidamiento, como sería la cobertura del suelo.
Esta especie también está presente en hábitats con característica vegetales de bosques perturbados (Püttker et al., 2008b), y se ha observado una mayor preferencia de la especie a zonas degradadas en términos de suelos antropogénicamente perturbados (Goodin et al, 2006), lo que difiere con los resultados de este trabajo en los que la especie está mucho más relacionada a hábitats con menor degradación. Los “suelos antropogénicamente perturbados” incluyen áreas de agricultura intensiva y mosaicos, lo que difiere de las áreas estudiadas que son áreas con perturbación del hábitat debido a la degradación de la vegetación, ocasionada por ejemplo por la tala que suele presentarse en esas zonas. Estos “suelos” podrían propiciar mejor acceso a fuentes de alimentos y mayor protección contra depredadores, mismas oportunidades que estarían disminuyendo en las áreas de hábitat natural per- turbadas por la degradación de la vegetación en los diferentes hábitats de este estudio.
Si se tiene en cuenta la degradación estructural a una microescala en los distintos bosques, se observa que esta involucra la pérdida de factores que son utilizados por los mamíferos (y otros animales) para cubrir requerimientos específicos como sitios de anidamiento, de refugio o descanso, y también como sustratos para la alimentación. Estos factores pueden estar dados por detalles casi imperceptibles como cavidades en árboles o raíces y corteza o follaje en el suelo, de modo que su pérdida puede reducir la disponibilidad de hábitat considerados de “buena calidad” para los animales, afectando las poblaciones de los mismos a diferentes escalas (Vergara et al., 2014).
CONCLUSIÓN
Si bien A. montensis es considerada generalista por sus requerimientos de hábitat, los resultados en este estudio visualizan que tanto la abundancia como la densidad son mayores en aquellos hábitats con un menor grado de perturbación. Esto se interpretaría como que en los hábitats con menor degradación aún se encuentran disponibles los elementos que brindan una “buena calidad” al hábitat para estos roedores, mientras que en los hábitats de mayor perturbación podría estar ocurriendo una pérdida gradual y extensiva de los mismos, lo que ocasiona una menor abundancia y densidad de las poblaciones.
Los resultados hallados en este estudio resaltan la importancia de analizar y evaluar el hábitat a diferentes escalas, ya que como se ha visto, aparentemente analizando las diferentes parcelas con las mismas variables medidas en cada estación, resultan no ser muy significantes. Sin embargo, analizando la relación con cada variable y estación por estación, si se encontró una significancia, indicando que Akodon montensis no “elige” precisamente su área por características promedias del hábitat en general, pero si por características más específicas de microhábitat.












 uBio
uBio