INTRODUCCIÓN
La proteinosis alveolar pulmonar (PAP) es una enfermedad difusa definida por la progresiva acumulación de surfactante en los alvéolos 1. Es una entidad rara que se presenta en tres formas: primaria (PAP autoinmune y hereditaria), secundaria (desordenes hematológicos, tumores malignos, síndromes de inmunodeficiencia, síndromes inflamatorios crónicos, infecciones crónicas, mutaciones de los fagocitos mononucleares y síndromes de inhalación tóxica) y congénita (mutaciones en las proteínas de surfactantes, en el transportador de lípidos y en el desarrollo pulmonar)2.La forma más frecuente es la autoinmune, antiguamente denominada idiopática, que ocurre debido a autoanticuerpos contra el factor de formadores de colonias de granulocitos y macrófagos (GM-CSF) 3.
Por otro lado, la lesión pulmonar asociada a uso de vapeo o cigarrillos electrónicos (EVALI) es una entidad descrita recientemente (2019) para la cual, la CDC ha establecido ciertos criterios: a) antecedentes de uso de cigarrillo electrónico o vapeo en los 90 días previos; b) síntomas respiratorios (disnea, tos, dolor torácico, dolor pleurítico o hemoptisis),gastrointestinales (nausea, vómito, diarrea o dolor abdominal) o sistémicos (fiebre, taquicardia o taquipnea) y hallazgos radiológicos sugestivos4. Hasta el 2020 se han reportado 2558 internaciones y 60 casos fatales por EVALI, siendo la mayoría hombres > 35 años con exposición diaria 5.La EVALI representa más bien un espectro amplio de enfermedades que oscila desde neumonitis leves hasta el síndrome de distres respiratorio agudo (SDRA) y algunos autores la catalogan como una neumonitis química que puede manifestarse como neumonía organizante, neumonitis fibrinosa aguda, neumonía eosinofílica y daño alveolar difuso al examen microscópico6.La evolución es variable y es llamativa la frecuencia de reinternaciones (2,7%) al 4to día en promedio (rango 2-20 días) con una tasa considerable de mortalidad (13,5%) 7.
Solo unos pocos reportes académicos mencionan a la PAP como expresión de EVALI. En este trabajo presentamos las características clínicas y terapéuticas de un paciente en el cual la confirmación diagnóstica de la enfermedad pulmonar difusa severa se asocia al antecedente de exposición así como también se exploran los potenciales mecanismos de esta entidad.
PRESENTACION DELCASO
Varón de 24 años, sin comorbilidades, que consulta por disnea progresiva y pérdida de peso gradual (10 kg aproximadamente) de 14 meses de evolución, acompañado de tos ocasional y expectoración blanquecina espesa. Niega fiebre. Desde hace 2 meses disnea de reposo y uso de oxigeno domiciliar. Antecedentes: refiere haber compartido dispositivo vapeador ajeno en ocasiones. Inmunización (dos dosis de vacunas anti SARS-COv2 y una anti influenza). Relata dos internaciones previas: una en nuestro hospital donde se realiza estudios moleculares en búsqueda de afección respiratoria por gérmenes (ADN de Streptococcus pneumoniae detectable en esputo que se consideró contaminante, negativo para Chlamydophilla pneumoniae, Legionella pneumoniae, Mycoplasma pneumoniae, Haemophilus influenzae, Moraxella catharralis, Bordetella pertussis, Bordetella parapertussis). Hisopado Nasofaríngeo negativo para SARS-Cov2. Alta sin diagnostico específico y con referencias de lavado pulmonar con 4 lts de suero fisiológico que induce mejoría parcial. Otra hospitalización reciente durante 15 días por sospecha de neumonía adquirida en la comunidad (COVID-19 negativo), sin identificación de germen causal. Uso de ATB y alta con mejoría parcial. Realiza una consulta por primera vez a Consultorio de Neumología del Hospital General de Luque, muy disneico. Signos vitales: frecuencia cardiaca 110xmin; frecuencia respiratoria 24xmin; Sat O2: 85% (prueba sentarse-levantarse). Examen físico: Acropaquia y signo de Schamroth (Figura 1a). Tiraje intercostal y crepitantes bilaterales. Datos laboratoriales: Leucocitos 9960/mm3(neutrófilos 74%, linfocitos 14%), PCR: 18,6mg/L(nl<5), gasometría paO2:71,7torr, paCO2:39torr; SatO2: 94%. Radiografía y tomografía computarizada de alta resolución de tórax (TACAR) (Figura 1b y 1e); Ecocardiografia: No hipertensión pulmonar. Broncoscopía: árbol bronquial normal y lavado broncoalveolar(BAL) de aspecto lechoso (Figura 1c) que resulta positivo a la tinción de ácidoperyodico de Schiff(PAS) y negativo para cultivo de micobacterias, hongos, nocardia y gérmenes comunes. Diagnostico final: Proteinosis Alveolar Pulmonar. Planificación terapéutica: Lavado Pulmonar total en quirófano. Manejo: Intubación con tubo orotraqueal de doble lumen y anestesia general. Lavado pulmonar unilateral: con16 lt infundidos (Figura 1d). Durante todo el procedimiento: ventilación unipulmonar con modalidad asistida controlada, volumen tidal de 250mL, PEEP 5cmH2O, FiO2 de 100% y frecuencia respiratoria de 14, resultando en presión pico de 40-45 cmH2O y SatO2 88-96%. Por hipotensión y valores de capnografia se decide detener el procedimiento. Es llevado a UCIA donde se constata síndrome de respuesta inflamatoria sistémica, edema agudo de pulmón e hipotensión. Es extubado después de 4 días de ARM constatándose notable mejoría clínica y radiológica (Figura 1f). Paciente va a domicilio donde día tras día refiere mejoría pudiendo desempeñar actividades diarias con SatO2 95% a aire ambiente al 5to día de alta. Se planifica lavado pulmonar del lado izquierdo en siguientes semanas.
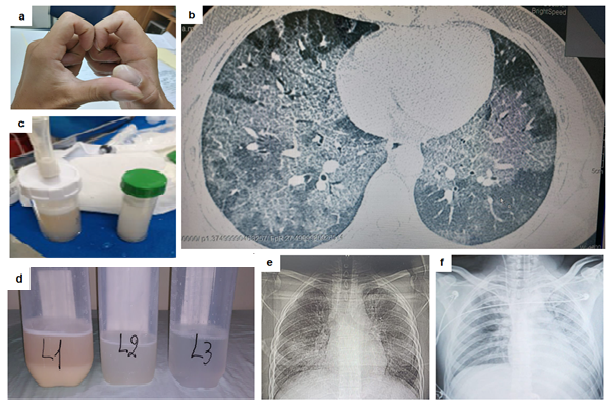
Figura 1. a. Acropaquia y signo de Schamroth (ausencia del espacio con forma de diamante al confrontar las uñas de dedos de la mano); b. TACAR de tórax que muestra opacidades en vidrio esmerilado bilaterales y espesamiento de septos interlobulares (patrón de empedrado o “crazypaving”); c. Aspecto lechoso del lavado broncoalveolar; d. Características secuenciales de muestras de líquido intrapulmonar obtenido posterior a infusión de alícuotas de suero fisiológico, notándose liquido con deposito grumoso y sobrenadante francamente turbio en el primer frasco (L1) que se va aclarando en los siguiente recipientes; e-Radiograma torácico previa a lavado pulmonar que denota opacidades bilaterales a predominio de campos medios; f-Radiografía torácica (UCIA) realizada 2 días después de terapéutica notándose mejoría del pulmón tratado.
DISCUSIÓN
Hemos encontrado apenas dos reportes sobre PAP asociados a antecedentes de uso de cigarrillos electrónicos. El primero menciona a una joven que consulta por historia de 10 días de disnea progresiva y tos con antecedentes de vapeodiario intenso durante un año (THC y en ocasiones contenido incierto). Pese a compromiso pulmonar severo e hipoxemia, la paciente respondió favorablemente a tratamiento con esteroides sin necesidad de lavado pulmonar 8. El segundo caso reporta un adulto fumador (10 cajas /año), que refería vapear ocasionalmente y que consulta por disnea progresiva e hipoxemia. El lavado broncoalveolar demostró niveles detectables de vitamina E. La falta de respuesta a tratamiento con esteroides llevó a lavado pulmonar luego del cual se consigue una dramática mejoría 9.
Debemos abordar algunos tópicos relativos a nuestro reporte. Existen relatos sobre PAP exacerbada por episodio de COVID-19 10, pero como los resultados laboratoriales del paciente aquí presentado no han demostrado infección por SARS-CoV-2 sumado al antecedente de inmunización, esta asociación nos parece improbable. En varios reportes, las infecciones se proyectan más como un epifenómeno a la PAP más que un agente causal 11,12. ¿Será que en realidad existe más bien una predisposición individual que hace emerger la PAP ante un disparador? El otro aspecto PAP como expresión de EVALI es el incierto tiempo de exposiciónal agente de inhalación. No obstante, es apenas una pretensión requerir el uso prolongado de una sustancia para generar lesiones pulmonares, graves. Glynos y cols reportan en modelos animales, que solo bastan tres días de exposición a cigarrillos electrónicos para corroborar un aumento en el recuento celular y macrófagico total, siendo de mayor intensidad que el evocado por humo de cigarrillo convencional 13. La intensidad de esta respuesta es diferente en animales de diferentes sexos, invocandoasí una variable condicionante 14.Desconocemos estudios masivos en el Paraguay que hayan analizado los agentes de inhalación en este grupo de dispositivos. Entonces, cuando se argumenta la variable tiempo de exposición, el caos se estructura cuando nos preguntamos: exposición a qué?.Otro ítem a considerar es la premisa epidemiológica: la PAP primaria suele darse en quinta década (en las autoinmunes) o entre los 5-8 años (en las hereditarias)2. La EVALI acomete en media a los 22 años4.
Uno de los diagnósticos diferenciales inmediatos es la neumonía lipoidea que puede presentarse con patrón de empedrado (crazypaving) a la TACAR torácicaen adultos pero la tinción PAS del BAL aleja esta alternativa15,16. Descartadas otras causas de infecciosas (Pneumocystisjirovecii, Mycobacterium tuberculosis, Nocardia, y virus), también se debe pensar en entidades como desórdenes hematopoyéticos, desregulación inmune, inhalación ocupacional de partículas, y exposición a medicamentos 3.
Los cigarrillos electrónicos son artefactos que permiten inhalar vapores que resultan del calentamiento de un líquido y sus efectos nocivos sobre la salud podrían derivarse de su misma estructura: a) el dispositivo en sí consiste en baterías recargables, cables conductores, atomizadores, mechas de fibras de vidrio y sitios de soldaduras capaces de originar explosiones y destrucción tisular17; b) liquido del cartucho que puede contener nicotina, propilenglicol, glicerol, tetrahidrocannabinol o THC, mentol, acido butírico, cinamato de metilo, aldehído c18 o gamma nonalactona, benzaldehído, diacetil, acetil-pirazina, acroleína, formaldehido y acetato de vitamina E 18; c) aerosol resultante que contiene los productos calentados del liquido ya citado a más de acetamida, cobre, arsénico, níquel, cromo,plomo, plata y partículas de silicato19.
Los agentes sospechosos relacionados a la EVALI son el propilenglicol, el acetato de vitamina E y algunos metales (arsénico y plomo)20. Sedestaca al acetato de vitamina E, constatada su presencia endispositivos analizados así como en muestras de líquidopulmonar 21. Sin embargo, es probable que aun sin la exposición a THC, acetato de vitamina E ni nicotina, puedan producirse lesiones pulmonares que incluyen espesamiento de la pared alveolar con focos de inflamación, congestión vascular, obliteración de espacios alveolares, acumulo de fibrina en bronquios y tapones de moco debido al calentamiento de aleaciones de níquel y cromo (presentes en algunos cigarrillos electrónicos) 22. Tal vez la PAP como EVALI, emule este mecanismo pues al comparar los efectos del humo de cigarrillo convencional versus propilenglicol y glicerina vegetal vaporizadas, se constata alteración en homeostasis de los lípidos pulmonares en los macrófagos alveolares (que acaban conteniendo fosfolípidos aberrantes) y en las células epiteliales (que aumentan su contenido de fosfolípidos asociados a surfactante).23.
La respuesta terapéutica de la PAP es variable. Se describen casos de resolución espontánea o respuestas parciales a tratamiento con esteroides, rituximab o plasmaféresis. Sin embargo los mejores desenlaces se logran utilizando el lavado pulmonar total y el uso inhalatorio del GM-CSF (molgramostim), fármaco muy costoso 2,3. Aún en vigencia de investigación y tratamiento, el paciente presentado aquí demostró una mejoría sustancialcon el lavado y creemos que representa un tipo de EVALI, entidad que actualmente es subvalorada ya que se reportan solo las formas más severas24.
CONCLUSIÓN
La PAP es una enfermedad infrecuente resultante de una anormal homeostasis del surfactante que genera acumulación de material lipoproteináceo en los alveolos. Entre varias causas adscritas solo un par de publicaciones menciona al daño por cigarrillos electrónico. Creemos que este reporte constituye el primer caso de PAP y EVALI en nuestro país.















