INTRODUCCIÓN
La corioamnionitis (CA) es una condición caracterizada por la inflamación de las membranas y corion de la placenta; implica presencia de respuesta inflamatoria, y no siempre está asociada a infección. Por ese motivo los expertos actualmente prefieren que se emplee el término triple I (Infección, inflamación, intraamniótica). Además, como también puede comprometer el amnios, el feto, y el cordón umbilical, esta denominación parece más apropiada1.
La CA se observa con una frecuencia de 3 a 10% en embarazos a término. Esta complicación del embarazo se asocia a resultados adversos tanto en la madre (infecciones postparto, sepsis), como en el recién nacido (RN), y a corto como a largo plazo. Entre ellas se citan: nacidos muertos, nacimiento prematuro, sepsis neonatal, enfermedad pulmonar crónica, e injuria cerebral que puede conducir a parálisis cerebral y otras alteraciones del neurodesarrollo2.
Según las normas del CDC (Centro de Control de Enfermedades y Prevención) y la Academia Americana de Pediatría del 2010, todos los RN con antecedente de CA materna deben recibir evaluación laboratorial, hemocultivo e iniciar tratamiento antibiótico3. Sin embargo, la ocurrencia de sepsis en RN a término o cercano al término expuestos a CA es muy baja, de 0,5 a 0,7 por mil nacidos vivos2,4. Por lo tanto, esta conducta lleva a la exposición innecesaria a antibióticos de muchos pacientes, con todas las consecuencias derivadas de ello: la alteración de la microbiota; la separación de la madre, dificultad para el éxito de la lactancia materna; la prolongación de la estancia hospitalaria; y el aumento de costos en salud5,6,7.
El reconocimiento temprano de los RN que desarrollan sepsis es un desafío, ya que las manifestaciones clínicas son inespecíficas y la utilidad del laboratorio como apoyo para el diagnóstico, es limitada.
Teniendo en cuenta todos estos aspectos, consideramos necesario conocer la prevalencia de sepsis neonatal en embarazos a término con CA en nuestro medio hospitalario; así como las características clínicas de las madres y los recién nacidos; además evaluar la utilidad para el diagnóstico precoz de sepsis neonatal de una escala empleada en el Servicio, llamada escala de sepsis.
METODOLOGÍA
Se efectuó un estudio descriptivo, de prevalencia, retrospectivo. Se incluyeron RN a término de madres con CA clínica, nacidos e internados en el Servicio de Neonatología del Hospital Nacional, Paraguay, en el periodo comprendido entre enero del 2013 a junio del 2016.
Se excluyeron los mortinatos; RN con infecciones del grupo STORCH; Los RN derivados a otro centro antes de la semana de edad; y aquellos que no contaban con hemocultivo. El muestreo fue no probabilístico, de casos consecutivos.
Las variables medidas en los RN fueron: sexo, peso de nacimiento, edad gestacional, Apgar al minuto y cinco minutos, presencia o no de asfixia perinatal, o depresión al nacer, presentación o no de síntomas, resultado de la escala de sepsis (escala de Rodwell y PCR), tiempo de realización del mismo, hemocultivo, cultivo de líquido cefalorraquídeo (LCR), diagnóstico, y estado clínico al alta.
Se consideró al RN con diagnóstico de sepsis ante la presencia de hemocultivo o cultivo de LCR positivo; y sospecha clínica de sepsis o sepsis probable en caso de desarrollar signos o síntomas compatibles con sepsis, con hemocultivo negativo8.
La escala de sepsis incluyó datos aportados por el hemograma, los datos fueron medidos según escala de Rodwell, calificados con un valor de 0 punto de ser normal y 1 punto de ser anormal, cada uno de los elementos, como se ve en la Tabla 1 9. A lo cual se sumó dato aportado por la PCR, a la que se adjudicó un valor de cero punto de ser negativa, 1 si resultó positiva con valor de 1 a 2 mg/dl, y 2 puntos si resultó con un valor igual o mayor a 3 mg/dl (Tabla 2). Se consideró la escala positiva o con probabilidad de sepsis neonatal de contar con un total de 3 puntos o más.
Las variables medidas en las madres fueron: edad, paridad, número de control prenatal, cribaje para estreptococo del grupo B, presencia o no de rotura de membranas, tiempo de rotura de membranas, tratamiento antibiótico recibido y duración del mismo, vía de nacimiento y motivo de cesárea.
Se efectuó el diagnóstico de CA en la madre si contaba con dos o más de los siguientes signos y/o síntomas: fiebre materna, taquicardia materna, taquicardia fetal, líquido amniótico fétido o purulento, hipersensibilidad uterina, leucocitosis10.
La recolección de datos se realizó a partir de las Historias Clínicas, previa autorización del Jefe de Servicio de Neonatología del Hospital.
Las variables fueron organizadas en una planilla Microsoft Excel, de modo a facilitar el análisis de los datos con el programa Epi-Info 2003. El instrumento fue validado con un pretest.
Las variables cuantitativas se expresaron como media y mediana según corresponda; y las variables nominales, categóricas como proporciones. Se analizó la utilidad de la escala de sepsis con el cálculo del valor predictivo positivo y negativo.
Se respetó el derecho a la privacidad de los pacientes, ya que para identificarlos se emplearon códigos numéricos.
Tabla 1: Sistema de escala hematológica
| Variables | Puntaje |
|---|---|
| Aumento de relación NI/NT >0,2 | 1 |
| Aumento (>5.400mm3) o disminución (<1.800mm3) de PMN Presencia de formas inmaduras | 1 2 |
| Aumento de relación NI/NM ≥ 0,3 | 1 |
| Aumento de NI (>600mm3) | 1 |
| Aumento de GB (≥30.000mm3) o disminución (<5000mm3) | 1 |
| Cambios degenerativos en PMN (vacuolas, granulaciones tóxicas, cuerpos de Dohle) | 1 |
| Disminución de plaquetas (<150.000 mm3) | 1 |
Fuente Rodwell et al.9
NI/NT= neutrófilos inmaduros sobre neutrófilos totales; PMN= Polimorfonucleares; NI/NM= neutrófilos inmaduros sobre neutrófilos maduros; NI= neutrófilos inmaduros; GB= glóbulos blancos.
RESULTADOS
En el periodo de enero del 2013 a junio del 2016 se reclutaron 71 RN a término, con antecedente materno de CA, que cumplieron con los criterios de inclusión.
Las madres que desarrollaron CA fueron adolescentes y adultas jóvenes 70 (98,5 %); nulíparas y primíparas, 67 (94 %); contaban con control prenatal suficiente en número 52 (73,2 %); y la vía de nacimiento fue vaginal en 46 (64,8 %) y cesárea 24 (35,2 %). Los motivos más frecuentes de cesárea fueron el sufrimiento fetal agudo y la dilatación estacionaria que se presentó en 17 (69,8 %) de las pacientes. La bolsa amniótica se hallaba rota al ingreso en 68 (95 %), y el tiempo de rotura fue superior a 18 horas en 34 (47,8 %); 3 (4,2 %) de las madres tenían bolsa íntegra. En 3 (4,2 %) se realizó búsqueda de colonización con estreptococo del grupo B, y una de ellas fue positiva (Tabla 4).
Tabla 4: Características de la población materna. n=71
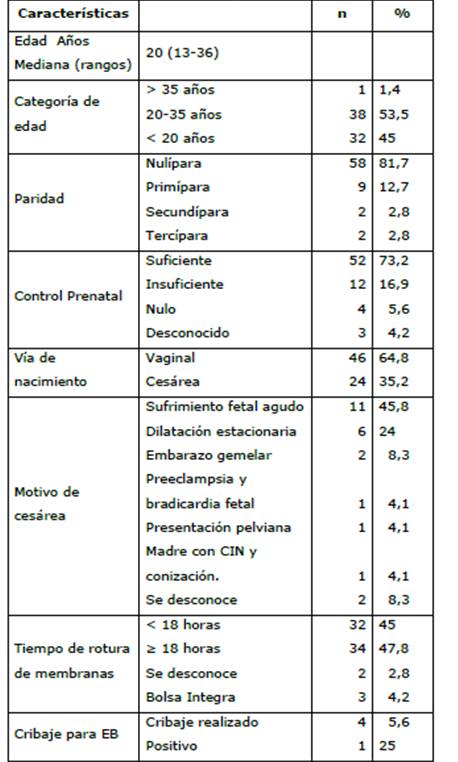
n= Número; %= Porcentaje, EB= estreptococo B.
Entre los RN existió un leve predominio del sexo femenino, 40 (56,3 %), con una mediana de peso de 3150 gr, rango de 1950 a 4650 gr; 22 (31 %) con depresión al nacer; y 11 (15,4 %) desarrollaron sepsis, de los cuales 3 fueron confirmadas. En 2 casos se aisló Staphylococcus epidermidis y en uno E. coli. Ninguno de ellos desarrolló meningitis Tabla 5.
Tabla 5: Características de los recién nacidos incluidos. n=71
| Características | n | % | |
|---|---|---|---|
| Sexo | Femenino Masculino | 40 31 | 56,3 43,7 |
| Peso de nacimiento(gr) Mediana y rangos | 3150 (1950-4650) | ||
| Apgar al minuto Media y DS | 7,9±1,02 | ||
| Apgar a los 5 minutos Media y DS | 8,7±0,61 | ||
| Depresión al nacer | Sí No | 22 49 | 31 69 |
| Con sepsis | Sí No | 11 60 | 15,4 84,5 |
n= Número, %= Porcentaje, gr=gramo, Media y DS= Media y desvío estándar, La sepsis fue confirmada en 3 casos; Se aisló en 2 Staphylococcus epidermidis, y en uno Escherichia coli.
De los 11 RN con sepsis, 7 presentaron depresión al nacer; 10 fueron sintomáticos y uno de ellos asintomático con hemocultivo positivo ( Tabla 6).
Tabla 6: Características de los recién nacidos con sepsis. n=11
| Carácterísticas | n | |
|---|---|---|
| Sexo | Femenino Masculino | 8 3 |
| Categoría de peso | < 2500 gr ≥ 2500 gr | 0 11 |
| Depresión al nacer | Con depresión Sin depresión | 7 4 |
| Presencia o no de síntomas de sepsis | Sintomáticos Asintomáticos | 10 1 |
| Clasificación de sepsis | Confirmada Sospecha clínica | 3 8 |
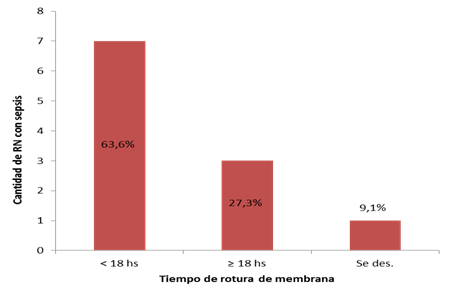
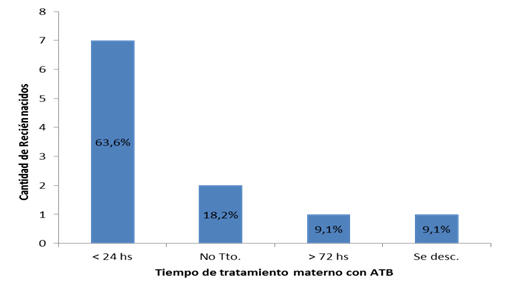
En el grupo de pacientes que desarrolló sepsis neonatal, 7 (63,6 %) tuvieron un tiempo de rotura de membranas menor a 18 horas, y el tiempo de tratamiento antibiótico antes del nacimiento fue menor a 24 horas. Gráfico 1 y Gráfico 2 .
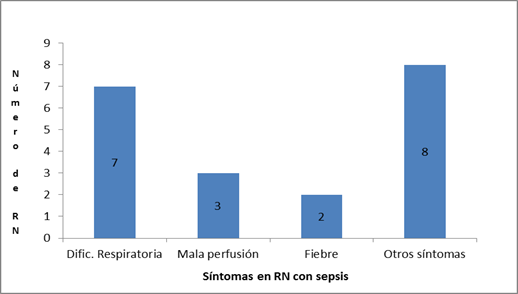
El síntoma predominante en los RN con sepsis fue la dificultad respiratoria, que se presentó en 7/10, siguiendole en frecuencia los signos de mala perfusión en la piel, en 3/10, y la fiebre en 2/10. En menor proporción se observaron otros síntomas; como se puede ver en el Gráfico 3.
Bajo la denominación de otros síntomas se hallaban los siguientes: apnea, convulsión, distención abdominal, hipoglucemia, hipotonía, vómito, irritabilidad y acidosis metabólica; que se observaron en un caso cada uno de ellos.
En el servicio se emplea, para orientación diagnóstica, una escala que incluye la determinación de hemograma y Proteína C Reactiva (PCR). El hemograma es valorado con la escala de Rodwell, y a ella se suma el resultado obtenido con la PCR, que se analiza según se mencionó anteriormente en el apartado de Metodología. La primera determinación se efectuó en una media de 3,8 ± 1,8 horas de vida y la segunda en una mediana de 45,5 horas, con rango de 14 a 48 horas de vida. En 10 pacientes los estudios laboratoriales se repitieron pasadas las 72 horas de vida, por lo que no se han incluido, resultando 61 pacientes los que contaban con la segunda escala realizada a tiempo, y que fueron analizados (Tabla 3).
La escala resultó con mayor frecuencia positiva en los RN con sepsis en la segunda determinación, en 3 de 11; con respecto a la primera determinación, en 1 caso de los 11. En ambas determinaciones la escala fue en mayor proporción negativa en los RN sin sepsis, es decir los laboratorios fueron normales, en 98,2 % y 96,1 % respectivamente.
El valor predictivo positivo de la escala de sepsis en la población, para la primera y segunda determinación fue de 50 y 60 % respectivamente. En cambio, el valor predictivo negativo fue de 85 y 87 % (Tabla 7).
Tabla 7: Resultado de la escala de sepsis en recién nacidos.
| Resultados | 1er Escala. n=71 | 2do Escala. n=61 | ||
|---|---|---|---|---|
| RN con sepsis | RN sin sepsis | RN con sepsis | RN sin sepsis | |
| Positivo | 1(9 %) | 1(1,7 %) | 3(30 %) | 2(3,9 %) |
| Negativo | 10(90,9 %) | 59(98,2 %) | 7(70 %) | 49(96 %) |
| Valor Predictivo + | 50% | 60% | ||
| Valor Predictivo - | 85% | 87% | ||
| Tiempo de vida al realizar escala | 3,8 ± 1,8 horas | 45,5 (14-48) horas | ||
DISCUSIÓN
El Hospital Nacional es un centro de referencia del Ministerio de Salud Pública y Bienestar Social de Paraguay, con un promedio de 3 mil nacimientos anuales, siendo prematuros aproximadamente el 15 %. En el periodo de estudio se hallaron 71 nacimientos a término con antecedente materno de CA que reunieron los criterios de inclusión. La frecuencia de CA en embarazos a término hallado en el presente trabajo sería aproximadamente de 0,79 %. La prevalencia de CA en embarazadas a término descripta en las publicaciones es muy variable, de 1 a 13 %, dependiendo de los criterios diagnósticos empleados11-13.
Las embarazadas que desarrollaron CA eran principalmente adolescentes y adultas jóvenes, 70 (97,5 %). Semejante a lo hallado en un estudio efectuado en Estados Unidos, en que 87 % de las mujeres que desarrollaron CA tenían una edad comprendida entre 18 y 35 años14.
Esto podría deberse a que en este grupo etario de mujeres las relaciones sexuales se realizan con mayor frecuencia generalmente, y es probable que dicho hábito se mantenga durante el embarazo. La literatura señala que el coito al final del embarazo es un factor predisponente para el desarrollo de CA en los embarazos a término15. Pues la actividad sexual durante el embarazo puede ser un medio facilitador para el ascenso de gérmenes desde el canal vaginal, aunque también podría contribuir como fuente de infección. Ya que la vía de infección en la CA frecuentemente es la ascendente, a partir del canal vaginal, ya sea a través de la membrana rota o intacta; y más raramente por vía hematógena16.
Entre los factores que predisponen al desarrollo de CA en embarazos a término se cita la vaginosis. La existencia de vaginosis es un factor predisponente; y el riesgo para el desarrollo de CA ante la presencia de vaginosis es 1,85 veces más frecuente. Ciertas bacterias tienen mayor tendencia a ascender a través del canal vaginal o atravesar la membrana amniótica; entre las que se hallan el Ureaplasma, Micoplasma, Chlamydia, algunos anaerobios, estreptococo del grupo B (EB), Escherichia coli, entre otros17. En el presente estudio en uno de los 3 casos confirmados se aisló Escherichia coli. El cambio en la etiología de la sepsis neonatal precoz puede deberse al empleo de la profilaxis antibiótica contra el estreptococo B por un lado, y también a que la población de recién nacidos prematuros en las salas de Neonatología es mayor en la actualidad, debido a la sobrevida de los mismos18. Y es conocida la vulnerabilidad de los prematuros a desarrollar infección por gram negativos; la E. coli es frecuentemente responsable de ocasionar sepsis temprana en prematuros, sobre todo en los de muy bajo peso. En cambio, en los RN de término los gérmenes más frecuentemente causantes de sepsis precoz continúan siendo los gram positivos, como el estreptococo grupo B, Staphylococcus aureus, Staphylococcus epidermidis y enterococo19,20. Se atribuye la persistencia de sepsis a EB, aún con profilaxis administrada, a que la misma no se administró a tiempo, menos de 4 horas antes del nacimiento.
Aunque gran proporción de la población materna incluida en el trabajo que estamos analizando contaba con control prenatal suficiente en cantidad, solo en 4 (5,6 %) se había efectuado el cribaje para EB. Muchas de las pacientes fueron derivadas de otros centros, y no en todos los servicios se dispone de laboratorio para esta determinación. Por ello, la importancia de efectuar la profilaxis para infección por EB en forma dirigida en la población.
En el presente estudio 58 (81,7 %) de las embarazadas con CA fueron nulíparas. Este es un factor de riesgo para el desarrollo de CA en embarazadas a término mencionado por la literatura16-20. La nuliparidad aumenta 1,8 veces el riesgo de desarrollar CA y funisitis21.
Cabe mencionar que el factor nuliparidad se halla asociado con el trabajo de parto prolongado, que es considerado factor de riesgo para el desarrollo de CA. Relacionado con la duración del trabajo de parto, el número de tactos vaginales efectuados a la embarazada es señalado como un factor de riesgo para CA en embarazos a término (21. Si bien estos aspectos no fueron analizados en el presente estudio, lo que se ha visto es que gran proporción de la población materna estuvo constituida por nulíparas.
Otro factor predisponente es la rotura precoz de membrana o rotura prolongada de membrana, que si es de 24 a 48 h, el riesgo para desarrollar CA aumenta 1,7 veces21. En el presente estudio se halló que 34 (47,8 %) de la población de madres tenía más de 18 h de rotura de membrana.
Los recién nacidos, productos de madres con CA clínica, fueron de peso adecuado, una mediana de 3150 gr; 22 (31 %) de los mismos estaban deprimidos al nacer, y la distribución por sexo fue semejante, con un leve predominio del sexo femenino 40 (56,3 %). Esto es parecido a lo hallado en el estudio de Malloy et al.14, en el que la media de peso de los RN con CA materna fue de 3447 ± 458 gr; edad gestacional de 39,4 ± 1,3 semanas; y el Apgar a los 5 minutos menos de 4 se observó en 1,4 % de la población, comparado al grupo sin CA que lo presentaron en 0,4 %, resultando la diferencia significativa.
La depresión neonatal en casos de CA se atribuye a la acción de las citoquinas liberadas como respuesta inflamatoria, que producen depresión del miocardio fetal, disminución de la presión arterial media y descenso del flujo cerebral22. Aunque algunos autores atribuyen a la fiebre materna la causa de depresión neonatal, se ha comprobado que la encefalopatía hipóxico isquémica ocurre 5,4 veces más frecuentemente en los casos de fiebre materna con CA que sin ella23.
De los 71 RN hijos de madre con CA, 11 (15,4 %) desarrollaron sepsis; en 3 de ellos la sepsis fue confirmada con cultivo. En una investigación realizada en embarazadas de más de 35 semanas de gestación se ha visto que la frecuencia de CA fue de 4 %, y la de sepsis neonatal temprana de 0,6 por 1000 nacidos vivos24. En otro estudio que incluyó embarazos pretérmino y a término se vio que la frecuencia de CA fue de 10,3 %, la de sepsis neonatal precoz confirmada 0,2 % y la de sepsis sospechada 6,4 %25. Otra investigación con una cohorte de 1.823.114 embarazadas, de ellas 34.873 fueron embarazos de más de 37 semanas complicados con CA. Se realizó una comparación con el grupo de pacientes que no desarrollaron CA, y se vio que la sepsis neonatal se presentó 6,82 veces más en el grupo de madres con CA26 (que no se analizaron en este estudio)
Al evaluar el tiempo de rotura de membrana en la población con diagnóstico de sepsis neonatal, se halló que 45 % tenía menos de 18 horas de bolsa rota, y en 4,3 % se hallaba íntegra. Sin embargo, varios estudios mencionan que el tiempo de rotura de membrana superior a 18 horas predispone al desarrollo de sepsis precoz en RNT. Este hallazgo probablemente se deba a que un solo factor no es el determinante del desarrollo de sepsis temprana, sino que es necesario que existan otros factores asociados como la colonización materna con gérmenes capaces de ocasionar la infección, o la existencia de vaginosis, el número de tactos vaginales realizados, entre otros27; que no se analizaron en este estudio.
Un dato llamativo fue que 63,6 % de las madres de RN que desarrollaron sepsis recibieron menos de 24 h de tratamiento antibiótico, y 18,2 % no lo recibieron. Relacionado a este hallazgo, un estudio que investigó los resultados neonatales en madres con CA que recibieron tratamiento antibiótico durante el trabajo de parto desarrollaron sepsis neonatal en menor frecuencia que aquellos cuyas madres lo recibieron al pinzar el cordón27. Los RN que desarrollaron sepsis no tenían bajo peso; solo dos contaban con una edad gestacional límite, 37 semanas; y no existió predominio del sexo masculino entre ellos. Coincidiendo con trabajos previos realizados en RNT expuestos a CA, en los que ni el peso de nacimiento, ni la edad gestacional presentó diferencia significativa entre los que desarrollaron sepsis y los que no lo hicieron28,20.
Sin embargo, destacó la preponderancia de depresión al nacer en el grupo de niños con sepsis, 7 de 11 pacientes. Igual hallazgo se tuvo en un estudio caso control de factores predictores de sepsis neonatal de comienzo temprano, en el que se constató que la asfixia perinatal estaba asociada en forma significativa al desarrollo de sepsis neonatal precoz, OR=6,729. En forma paralela, en otra investigación se ha visto que la presencia de funisitis, que es un indicador de infección fetal, se asocia a pH bajo en sangre de cordón, es decir acidosis30.
Un aspecto llamativo fue que de 11 pacientes infectados, 10 presentaron síntomas. Esto apoya la recomendación establecida por otros autores que la ausencia de síntomas en RN disminuye el riesgo de desarrollar sepsis neonatal, como se comprobó en un estudio de 2785 RN con peso igual o superior a 2000 gr31. Sin embargo las investigaciones señalan la existencia de casos de sepsis confirmada en RN productos de madre con CA, que pueden permanecer asintomáticos incluso las primeras 72 horas de vida20. Y en el estudio actual, un RN con sepsis confirmada permaneció asintomático. De allí la necesidad de contar con una herramienta que permita predecir la existencia de sepsis en esta población.
Con respecto al empleo del laboratorio para orientar el inicio de tratamiento antibiótico en los RN con sepsis; varios estudios señalan la utilidad limitada del hemograma y la Proteína C Reactiva (PCR). Pues ambos pueden estar alterados por procesos no infecciosos; sin embargo su valor predictivo negativo es elevado, alrededor de 99 %, para la PCR efectuada a las 8 y 24 h de vida32.
Aunque la población estudiada fue pequeña, en el presente trabajo se ha hallado un valor predictivo positivo de 50 y 60 % para la escala de sepsis efectuada al RN dentro de las primeras 6 horas y entre 14 a 48 horas de vida respectivamente. En cambio, el valor predictivo negativo fue de 85 y 87 % en el periodo de tiempo mencionado. Resultado semejante a otro estudio en que el valor predictivo positivo de una escala que toma en cuenta datos aportados por el hemograma fue de 85 % y el negativo de 90,5 %33.
Considerando lo mencionado antes, varios investigadores sugieren orientar el manejo de los RN asintomáticos de término y cercano a término con riesgo sepsis precoz, empleando una monitorización clínica cuidadosa para detectar la aparición de síntomas y signos34,35.
CONCLUSIONES
La prevalencia de sepsis neonatal en RN de término con antecedente de CA materna fue de 15 %, siendo confirmada en 3 de 11 pacientes. Todos fueron RN con peso adecuado, la mayoría presentó depresión al nacer y fueron sintomáticos; la dificultad respiratoria fue el síntoma más frecuente.
La escala de sepsis (Hemograma y PCR) realizada a los RN, aunque no fue útil para confirmar la presencia de sepsis, sirvió de ayuda para descartarla, ya que su valor predictivo negativo fue de 85 y 87 % respectivamente.
Las embarazadas a término con CA fueron 98,5 % adolescentes y adultas jóvenes; 94 % nulíparas y primíparas. La vía de nacimiento predominante fue la vaginal, en 64,8 %. Los motivos de cesárea fueron el sufrimiento fetal agudo y la dilatación estacionaria en 69,8 % de los casos.