Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista del Nacional (Itauguá)
Print version ISSN 2072-8174
Rev. Nac. (Itauguá) vol.8 no.1 Itauguá June 2016
https://doi.org/10.18004/rdn2016.0008.01.043-061
Artículo de Revisión
Restricción selectiva del crecimiento intrauterino en la gestación gemelar monocorial: diagnóstico y manejo
Selective intrauterine growth restriction in monochorionic-diamniotic twins: diagnosis and management
Miguel Ruoti Cosp1
RESUMEN
La Restricción Selectiva del Crecimiento Intrauterino se produce en 10 a 19% de los gemelos monocoriónicos, y se asocia con un aumento importante de la mortalidad y la morbilidad perinatal. La evolución clínica está dada en gran parte por la presencia de anastomosis vaculares y la distribución placentaria asimétrica. Se propuso una clasificación en tres tipos según el Doppler de la arteria umbilical del gemelo más pequeño, la que sé que se correlaciona con distintos comportamientos clínicos y características de la placenta, lo que ayuda en el asesoramiento y conducta obstétrica. Los del tipo I tienen un pronóstico favorable por el resultado perinatal satisfactorio por lo que se recomienda un seguimiento cercano por ecografía y Doppler. Los de tipo II tienen un mal pronóstico y el tipo III un pronóstico intermedio e impredecible. En estos dos últimos se puede realizar un manejo expectante hasta que se observe deterioro del feto pequeño, considerando la posibilidad de la coagulación con láser o la oclusión del cordón (feticidio selectivo). Ambas conductas aparentemente aumentan las posibilidades de supervivencia del feto de peso normal.
Palabras claves: restricción selectiva del crecimiento intrauterino, diagnóstico, manejo, Gemelos monocoriales, doppler, terapia fetal
ABSTRACT
Selective intrauterine growth restriction occurs in 10-19% of monochorionic twins, and is associated with increased mortality important and perinatal morbidity. The clinical course is given largely by the presence of placental vascular anastomosis and asymmetric distribution. It classified into three types according to the proposed Doppler umbilical artery smaller twin, the one that correlates with different clinical behaviors and characteristics of the placenta, which helps in counseling and obstetric conduct. The type I have a favorable prognosis for satisfactory perinatal outcome so closely monitored by ultrasound and Doppler is recommended. The type II has a poor prognosis and type III intermediate and unpredictable prognosis. In these last two you can make an expectant management until deterioration of the small fetus is observed, considering laser coagulation or cord occlusion (selective feticide). Both behaviors appear to increase the chances of survival of the fetus of normal weight.
Keywords: Selective intrauterine growth restriction, Diagnosis, Management Monochorionic twins, Doppler, Fetal therapy
INTRODUCCIÓN
Los embarazos gemelares monocigóticos provienen de un solo óvulo que se divide después de la fecundación. Si la división se presenta dentro de las primeras 72 horas el resultado serán dos fetos, dos placentas (bicorial, BC) y dos bolsas amnióticas (biamniótico BA) y cada feto tendrá su propio sistema vascular.
Si la división ocurre entre el 4º y 8º día los fetos compartirán placenta (monocoriales, MC) pero aún tendrán dos bolsas amnióticas (MC/BA), y si se dividen entre el 9º y 13º día compartirán también bolsa amniotica (monoamnioticos MA).
El embarazo gemelar MC se presenta en uno de cada 250 embarazos y representa cerca del 20% de los gemelares y el 70% de los monocigóticos1. Son responsables de una proporción significativa de morbi-mortalidad perinatal en los embarazos gemelares2. La tasa de mortalidad perinatal es aproximadamente 2 veces mayor que la de los BC y 4 veces mayor que la de los embarazos únicos. En cuanto a la tasa de morbilidad neurológica es de 4 a 5 veces más alta que la de los BC y por lo tanto de 25 a 30 veces más alta que la de los únicos3.
De todos los embarazos monocigoticos más del 70% son MC/BA y la mayoría presentara comunicaciones intervasculares placentarias que unen las circulaciones de ambos gemelos.
El 70% de todos los gemelares MC/BA cursarán el embarazo sin complicaciones4 y los restantes desarrollaran algún tipo de alteración, ya seaRestricción Selectiva en el Crecimiento Intrauterino (RCIUs), Síndrome de Transfusión Feto-Fetal (STFF), o secuencia TRAP (Twin Reversal Arterial Perfusion), mejor conocido como síndrome del feto acardico.
En un estudio de más de 1200 pares de gemelos en lo que examinaron las placentas, hallaron que la incidencia de 1 pequeño para la edad gestacional era dos veces mayor en las gestaciones MC en comparación con DC (placentas fusionadas o separadas) (13,7% vs. 7,3%)5.
En el presente artículo, revisaremos los aspectos diagnósticos y el manejo de la RCIUs.
Diagnóstico de la corionicidad
Para el diagnóstico de la corionicidad de un embarazo gemelar se debe realizar idealmente antes de las 14 semanas de gestación. Este parámetro es aún más importante que la cigocidad6,7. Debemos tener en cuenta los siguientes aspectos.
- Antes de las 10 semanas, la presencia de dos sacos gestacionales identifica dos fetos, dos bolsas y dos placentas; estos fetos son BC, independientemente de que sean mono o bicigoticos.
- La presencia de dos sacos vitelinos dentro de un mismo saco gestacional sugiere un embarazo gemelar MC/BA.
- Entre las 10 y 16 semanas de gestación la corionicidad se identifica con ultrasonido por la presencia del signo lambda o del signo T. Un signo T representa dos membranas amnioticas y es característico de un gemelar MC/BA. El signo lambda se debe a la inserción placentaria de dos membranas amnioticas y entre ellas el corion de ambas, es característico de un gemelar BC/BA.
La placenta en el embarazo monocorial
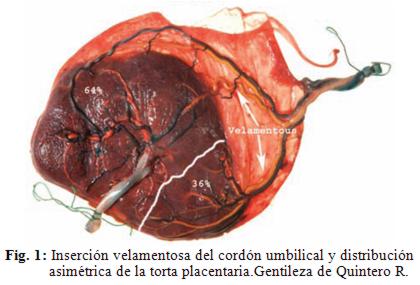
Típicamente la placenta de este tipo de gestaciones monocoriales tienen una mayor incidencia de inserción marginal o velamentosa del cordón umbilical (hasta 45% de los casos) (Fig.1), una distribución desigual delos territorios placentarios, con anastomosis arteriovenosas desequilibradas que llevan a producir mecanismos compensatorios consiguientes, haciendo de cada placenta monocoriónica única y atípica8.
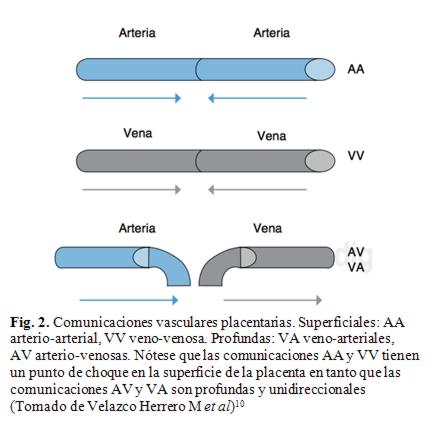
Sin embargo, la característica fundamental de los embarazos gemelares MC es la presencia de anastomosis vasculares placentarias, las cuales pueden ser arterio-arterial (AA), veno-venosa (VV) o arterio-venosa (AV)5,6(Fig. 2).
Las comunicaciones VV y AA son bidireccionales, se presentan en la superficie de la placenta, por lo que se les denomina superficiales y en ellas ambas circulaciones chocan en sentidos opuestos. Las comunicaciones AV/ VA son unidireccionales, una arteria de un gemelo irriga un cotiledón común de donde sale una vena que llega al otro feto. Si bien el recorrido de la arteria y vena son superficiales, el intercambio de sangre se realiza en los capilares del cotiledón, se les llama profundas5.Las anastomosis pueden ocasionar las complicaciones del MC por sí mismas o por combinación con otros factores, tales como discordancia de los territorios placentarios y/o malformaciones fetales6.
DEFINICION Y DIAGNOSTICO
Se define ecográficamente por una estimación ponderal por debajo del percentil 10 en uno de los gemelos5,aunque no es una definición universalmente establecida es la más aceptada y tiende a ser el método más sencillo para fines prácticos y de investigación.
Se han utilizado también otros criterios como el de la circunferencia abdominal discordante superior al 10%5, que surgió de una cohorte que incluyó 1001 gestaciones enroladas en el estudio ESPRiT (Evaluation of Sonographic Predictors of Restrictedgrowth in Twins)6 concluyendo que la diferencia mayor al 10% en la circunferencia abdominal se comportaba como un marcador de mal pronóstico perinatal.
Otros lo consideran como la diferencia de tamaño entre ambos gemelos superior al 25%7, obtenida mediante la fórmula:(Peso fetal estimado [PFE] del gemelo mayor - PFE del gemelo menor) x 100 / PFE del gemelo mayor8,tomando como base un estudio retrospectivo de cohorte8 que incluyo 2161 gestaciones gemelares de 9 centros asistenciales ingleses evaluados durante 10 años, determinando mediante regresión logarítmica y curva ROC, que la diferencia de peso superior a dicho valor aumentaba la mortalidad y morbilidad de ambos gemelos.
Sin embargo, cualquier discordancia significativa en el crecimiento o el tamaño en los gemelos monocoriales, que genéticamente tienen el mismo potencial de crecimiento, debe ser considerada como patológica8. Por lo tanto, una discordancia significativa, incluso si el gemelo más pequeño está por encima del percentil 10, debe alertar al clínico.
Como analizaremos más adelante una de las principales causas es la mala distribución del territorio placentario, pero lamentablemente la ecografía prenatal no puede estimarla. Sin embargo, el sitio de inserción del cordón se puede determinar de forma confiable9, y la combinación de una inserción del cordón velamentosa y la otra inserción central puede servir como un marcador de intercambio placentario desigual, y por lo tanto identificar un grupo de gemelos monocoriónicos de alto riesgo para crecimiento discordante17.
INCIDENCIA
La RCIUs se presenta en aproximadamente el 10 a 19% de los embarazos MC3,13, dependiendo de los criterios diagnósticos utilizados. La prevalencia de RCIUs basado en el peso fetal por debajo del percentil 10 se estima entre el 10 a 15%10,11, en tanto que utilizando la discordancia de más del 25% entre los fetos, entre 11,3 a 19% de las gestaciones monocoriales12,13.
ETIOPATOGENIA
La causa principal para el desarrollo de RCIUs en gemelos MC es el inadecuado intercambio placentario. La relación entre el territorio de la placenta desigual y discordancia de peso al nacer se ha puesto de manifiesto en varios estudios13,14,15 demostrando que la misma aumenta con el incremento de discordancia del territorio placentario.
Recientemente Van Winden et al26 examinaron los pesos placentarios en fresco de 91 placentas de gestaciones MC/BA con diagnóstico de STFF y RCIUs y los compararon con 64 gestaciones con diagnósticos de STFF solamente, todas fueron sometidas a cirugía láser. Reportaron menor peso placentario total en el grupo STFF y RCIUs (687 ± 224 vs 608 ± 163 gr, p = 0,012), así como menor peso placentario del feto donante (291 ± 124 vs 237 ± 91 gr, p = 0,002) pero no registraron diferencias entre los pesos del feto receptor (396 ± 133 g vs 371 ± 109 gr, p = 0,211). Finalmente, cuando compararon las proporciones placentarias del feto donador, hallaron nuevamente diferencias al reportar menor proporción placentaria en aquellos afectados por RCIUs (42,3 ± 9,8% vs 38,7 ± 9,6%, p = 0,029).
La asimetría placentaria es a menudo asociado a la inserción del cordón muy excéntrica o velamentosa16, aunque no está claro si la inserción velamentosa es una mera consecuencia del desplazamiento asimétrico del ecuador vascular o si tiene alguna implicancia en la fisiopatología.
Además de la discordancia del territorio placentario, un segundo factor que influye en gran medida la discordancia de peso fetal y la historia natural de RCIUs en gemelos MC, es la presencia de anastomosis vasculares en el placenta17,18, las cuales tienen una fuerte injerencia en la evolución. La cantidad y el tipo de flujo interfetal cambia en función del número y tipo de anastomosis, lo cual determinará una amplia variación en el comportamiento clínico.
Estas comunicaciones en la superficie placentaria se mantienen en equilibrio hasta que las condiciones hemodinámicas de un gemelo (presión, frecuencia cardiaca) descompensan dicha estabilidad, modificando el balance hemodinámico y desplazando el punto de choque de ambas circulaciones hacia uno de los fetos. Lo anterior conlleva a que el feto de menor tamaño tenga un menor intercambio de nutrientes en la placenta y que el feto mayor "transfiera" una cantidad mínima de su sangre al territorio placentario del gemelo menor. Esto da como resultado que uno de los fetos no alcance su potencial de crecimiento.
Diversos autores han intentado demostrar las causas que llevan a la RCIUs además de los aspectos ya resaltados. Así, Chang et al19 plantearon mecanismos de activación mitocondrial o bien, Yinon et al20 reportaron factores angioénicos disminuidos en el suero materno en gestantes gemelares complicadas con RCIUs, como el vascular endothelialgrowth factor receptor-1 (sVEGFR-1), placental growth factor (PLGF), and soluble endoglin (sEng), lo que demostró por primera vez un estado anti-angiogénico en este tipo de gestaciones ya que otros autores lo habían hecho en aquellas complicadas con STFF21.Los sistemas de péptidos natriuréticos, como el péptido natriurético cerebral (BNP) o su precursor el N-terminal cerebro pro-péptido natriurético (NT-proBNP), que se comportan como marcadores de disfunción cardíaca e hipotensión neonatal22, han demostrado ser activados en las gestaciones MC/BA complicadas por el STFF y tienen un papel importante en la aparición de manifestaciones clínicas23.
Fujioka et al24 analizaron el suero al nacer de 73 gemelos MC/BA, 16 con RCIUs y 57 sin ella (grupo control), reportando altos niveles séricos de NT-pro BNP al nacer en ambos gemelos en el grupo RCIUs comparándolas con el grupo control (4520 pg ml-1 vs 1270 pg ml-1; p<0,0001). Además, en este grupo observaron un aumento significativo de complicaciones cardíacas, incluyendo disfunción cardíaca, persistencia del conducto arterioso, uso de catecolaminas o necesidad de transfusiones. Todo ello indicaría una sobrecarga cardiaca intrauterina en fetos con RCIUs.
Otros mecanismos moleculares descritos relacionan los hallazgos en fetos únicos con restricción del crecimiento intrauterino.
Algunos autores25,26 reportaron que la proteína PHLDA2 formaría parte del mecanismo de presentación de la RCIU en gestaciones únicas. Shiet al27 reportaron 10 gestaciones MC sin RCIUs y las compararon con 10 MC con RCIUs, hallando mayores niveles tanto de ARNm y de proteína PHLDA2 en las placentas de fetos con RCIUs (P < 0,05).
Otro de los mecanismos propuesto es la autofagia o muerte celular programada, proceso catabólico utilizado por las células eucariotas para reciclar proteínas y lípidos de vida larga y eliminar proteínas agregadas28. La actividad de autofagia es aumentada por el hambre, la privación del factor de crecimiento y la hipoxia29. Hung et al30 demostraron una mayor actividad de autofagia en las placentas de embarazos únicos con RCIU mediante la cuantificación de la proteína placentaria LC3-II. En tanto Chang et al31 de un total de 40 gestaciones MC, 21 de ellas afectadas de RCIUs y otras 19 aparentemente sanas, reportaron mayores niveles de LC3-II en el grupo con RCIUs (2,26 vs 1,04 p=0,02) y además, de acuerdo a los hallazgos del Doppler, cuando este se encontraba alterado al cotejarlo con aquellas gestaciones consideradas como sin RCIUs, también había un incremento de la misma (2,58 vs 1,04 p<0,05).
Este mismo autor32, posteriormente comunico una serie de 11 gemelos sometidos a fotocoagulación laser por STFF, de los cuales en 5 casos posteriores a la terapia fetal desarrollaron RCIUs. En ambos grupos fueron evaluados los niveles de LC3-II reportando que no había diferencias significativas en ambos grupos analizados, concluyendo que la terapia laser permitió disminuir la autofagia causante de la RCIUs.
En tanto que He et al33 en un reciente trabajo postularon como posible causa la hipometilación del ADN y la hidroximetilación.
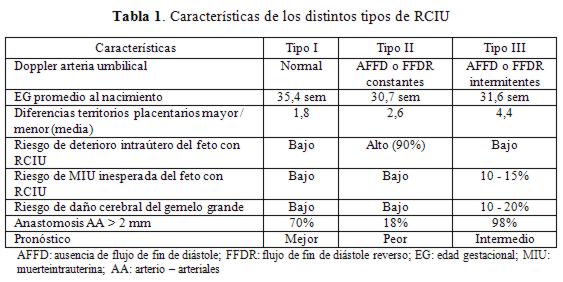
CLASIFICACION SEGÚN EL DOPPLER DE LA ARTERIA UMBILICAL
De acuerdo a las características del Doppler de la arteria umbilical (AU) del feto más pequeño, Gratacós et al34 propusieron tres patrones clínicamente bien definidos (Tabla 1), tipo I (Doppler de la arteria umbilical normal), tipo II (ausencia de flujo de fin de diástole - AFFD o flujo de fin de diástole reverso - FFDR, persistente) o de tipo III (AFFD - FFDR en forma intermitente, AFFD - FFDRi). La cantidad y el tipo de flujo interfetalcambian en función del número y tipo de anastomosis, lo cual determina una amplia variación en el comportamiento clínico de la RCIUs.
Cabe considerar que en las gestaciones únicas o gemelos DC, el Doppler de la AU es un parámetro clave para el diagnóstico y la vigilancia de los fetos con RCIU secundario a la insuficiencia placentaria35. Sin embargo, en los gemelos MC con RCIUs, los cambios observados en las formas de onda Doppler de la AU no pueden ser interpretados de la misma manera que en otros embarazos, ya que son una combinación de los efectos de la insuficiencia placentaria con los de las conexiones vasculares13,36,37.
Estos patrones de Doppler se pueden observar desde edades gestacionales tempranas, por lo general antes de la semana 20 y normalmente permanecen sin cambios hasta el nacimiento47,48. Se correlacionan con diferentes patrones de anastomoses y, más importante, parecen estar fuertemente asociados con marcadas diferencias en la evolución clínica45,47,38, lo que permite comprenderlas y predecirlas, a fin de planificar la mejor y más adecuada conducta terapéutica.
A continuación, describimos los tres tipos reportados de acuerdo al Doppler de la AU del gemelo pequeño.
Tipo I
El Doppler se presenta normal o con flujo diastólico presente durante todo el estudio.
Los patrones de anastomosis placentarias son similares a los MC no complicados. Si bien tienen territorios placentarios con distribución desigual, en el 70% de las gestaciones del tipo I se describe la presencia de una gran anastomosis arterio-arterial (> 2 mm) que juntamente con el alto número de anastomosis generan un buen intercambio bidireccional de flujo entre los fetos, lo que atenúa los efectos de la insuficiencia placentaria en el feto más pequeño, además del trabajo compensatorio que realiza el feto de tamaño normal permitiendo una transfusión de rescate inter-gemelar13,45,39
Por tal motivo, tienen buen pronóstico casi similar a los MC no complicados y muy bajo riesgo de muerte fetal intrauterina del feto pequeño (2 - 4%)45,40.
En una cohorte de 39 pares de gemelos de tipo I, no reportaron daño cerebral en los gemelos sobrevivientes45. Estos resultados fueron muy similares a un estudio en Japón51, en donde se encontraron anormalidades neurológicas a los 6 meses en 1 de 23 (4,3 %) de los casos del tipo I.
Se estima una tasa de sobrevida de ambos gemelos de alrededor del 90%.
Manejo del embarazo y seguimiento
En vista de la baja mortalidad como morbilidad y una vez que un caso se ha asignado al tipo I estos permanecen en esa categoría hasta el parto, se sugiere un manejo expectante y seguimiento ecográfico habitual (tamaños fetales y volumen de líquido amniótico) con Doppler cada 1 a 2 semanas de acuerdo con el criterio clínico para la detección precoz de posibles complicaciones (deterioro del Doppler, discrepancias significativas de líquido amniótico o STFF).
La mayoría de estos embarazos llegarán con Doppler normal o con aumento de resistencia hasta etapas avanzadas de la gestación, permitiendo una finalización electiva alrededor de la semana 35 con menor incidencia de deterioro del gemelo pequeño.
Tipo II
El Doppler presenta ausencia de flujo de fin de diástole (AFFD) o flujo de fin de diástole reverso (FFDR) en forma constante durante todo el estudio en el gemelo pequeño.
Al igual que en el tipo I, tienen una distribución de vasos comunicantes muy similares a los gemelos MC no complicadas, pero con un mayor territorio fetal placentario discordante12.
Además de esta desigualdad en los territorios placentarios, tienen menor dinámetro anastomótico (anastomosis AA pequeñas o ausentes) que compensa la gran discordancia de los territorios placentarios, pero por un corto tiempo. No tienen o es poco frecuente (18%) una anastomosis arterio-arterial grande (> 2 mm), por lo que el gemelo más grande tiene menos o ninguna oportunidad de ayudar al gemelo más pequeño mediante la transfusión de rescate inter-gemelar como sucede en el tipo I.
Esta particular situación de las anastomosis vasculares, conlleva a que estas gestaciones tengan el peor pronóstico, debido a que el 90% de los fetos pequeños se deterioran con el tiempo, al compararlos con las RCIU de gestaciones únicas o de gemelos DC41,42.
Las tasas de supervivencia son sólo del 60%. Presentan además muy bajo riesgo de lesión cerebral intrauterina del gemelo de peso normal.
Evolución clínica
Si bien la media de latencia desde el diagnóstico de AFFD o FFDR al parto es mucho mayor que en los embarazos únicos (54 vs 11 días)47, sea por insuficiencia placentaria particularmente severa y/o por intercambio insuficiente de flujo a través de las anastomosis, lo cierto es que dada una determinada edad gestacional, el feto pequeño comienza a deteriorarse y eventualmente se produce la muerte fetal intrauterina (MFIU) (10 al 50%)45,49.
La edad gestacional promedio al parto es de 29 semanas dadopor el deterioro del feto pequeño.
Esto puede plantear la difícil situación de tener que decidir entre la finalización precoz del embarazo (afectando a sí al gemelo "normal" por la prematurez) o continuar el seguimiento con el riesgo de muerte del pequeño y consecuente daño neurológico del sobreviviente.
Dos series clínicas, logrado con diferentes estrategias, ilustran el mal resultado asociado con casos de tipo II. Gratacós et al45 informaron el resultado de 30 gestaciones de tipo II, que mostraron una muy alta tasa de deterioro (90%), según los hallazgos del Doppler venoso anómalo o perfil biofísico fetal (PBF) alterado. El promedio de edad gestacional al momento del parto fue de 30 semanas y la tasa de daño cerebral neonatal del gemelo pequeño del 14,4%. El protocolo en este estudio consideraba la oclusión del cordón umbilical cuando el deterioro de los gemelos pequeños ocurría antes de las 28 semanas, y ésto se llevó a cabo en 9 de 30, por lo que no hubo casos de MFIU inesperada en este grupo.
Por su parte, Ishii et al51 informaron del resultado de 27 gestaciones del tipo II pero en contraste con el estudio anterior, el feticidio selectivo no se realizó y por lo tanto, este estudio proporciona una idea más acabada de la historia natural. La MFIU se produjo en el 29,6%8/27 en los gemelos con RCIUs y el 22,2%6/27 en los gemelos más grandes. La tasa de daño cerebral neonatal del gemelo pequeño a los 6 meses fue del 14,8%. El promedio de edad gestacional al momento del parto fue de 28 semanas.
Por otra parte, Quintero et al43 informaron del resultado de 17 gestantes con RCIUs tratadas de forma conservadora en comparación con 11 casos similares tratados por fotocoagulación láser placentaria. Aunque los autores no clasificaron los casos según la clasificación propuesta que describimos antes, la mayoría de los embarazos reportados tenían AFFD en la arteria umbilical. En los fetos con manejo expectante demostraron una tasa de MFIU del 41%, con una media de edad gestacional al parto de 30 semanas, y tasa de anormalidades cerebrales severas en el 13,6%3/22.
Manejo del embarazo y seguimiento
Como estas gestaciones tienen un mal pronóstico y tienden a presentar un deterioro intrauterino progresivo del feto más pequeño, éste conduce frecuentemente a la finalización del embarazo antes de las 31 semanas, lo que agrega mayor morbimortalidad por la prematurez.
Al igual que en los embarazos únicos, ciertos parámetros como la alteración del ductus venoso (DV), ayudaran a la toma de decisiones, en vista que, a diferencia de los gemelos DC o gestaciones únicas con restricción del crecimiento intrauterino, el Doppler de la AU no se puede utilizar como predictor de muerte fetal.
En consecuencia, se requiere un seguimiento frecuente (una veces por semana) si el Doppler venoso es normal, y un seguimiento más frecuente (dos veces por semana) cuando el índice de pulsatilidad del DV se eleva por encima de dos desviaciones estándar.
El PBF se puede incluir en el protocolo de seguimiento después de alcanzar la viabilidad (generalmente alrededor de las 28 - 30 semanas), es decir, cuando se plantea que los riesgos de MFIU de uno y daño neurológico del sobreviviente pueden ser mayores que la morbimortalidad asociada a la prematurez. Sin embargo, la evaluación de la cardiotocografía será de poca utilidad ya que la mayoría de estos casos ocurren en el segundo o principios del tercer trimestre, donde este tipo de estudios reporta una alta tasa de falsos positivos.
En un trabajo que incluyo 101 embarazos MC complicados con RCIUs49, intentaron hallar marcadores precoces de mortalidad, determinaron que los hallazgos que arrojaron diferencias estadísticamente significativas luego del análisis multivariado, fueron el tipo de Doppler de la arteria umbilical clasificado como RCIUs II y el oligoamnios aislado severo.
Las opciones de manejo dependen de la edad gestacional y el grado de deterioro del feto con RCIUs. Al momento del diagnóstico, si hay signos que sugieran muerte fetal inminente, la terapia fetal debe contemplarse para proteger el gemelo más grande de la muerte de su co-gemelo. Sin embargo, en la mayoría de los casos no existen tales signos, y el gemelo más pequeño tiene un Doppler de la AU anormal, pero conserva flujo auricular en el DV.
La conducta expectante puede ser considerada en esta situación en particular, con la opción de terapia fetal si el deterioro se produce antes de que se alcance la viabilidad o el parto electivo más allá de las 28 semanas. Sin embargo, algunos padres pueden solicitar terapia fetal electiva por razones del mal pronóstico esperado en estos casos.
Visentin et al44 analizaron 14 gestaciones con RCIUs tipo II, concluyendo que es posible el manejo expectante en este grupo de fetos, con o sin inserción velamentosa del cordón, para obtener un resultado neonatal favorable, pero tal decisión dependerá de la edad gestacional, el grado de deterioro fetal, las posibilidades de asistencia neonatal del hospital y el deseo de los padres. El beneficio de cada opción queda por ser evaluado en más estudios clínicos aleatorios.
A diferencia del STFF, en el que las indicaciones terapéuticas y las intervenciones intrauterinas se encuentran estandarizadas45, en la RCIUs no se ha definido aún las indicaciones de tratamientos ni las intervenciones más apropiadas.
La conducta activa puede considerar dos opciones, la oclusión del cordón umbilical o la fotocoagulación laser.
La oclusión del cordón umbilical o feticidio selectivo del gemelo pequeño46 con alto riesgo de muerte intrauterina tiene el objetivo de prevenir el posible daño neurológico del gemelo sobreviviente. Esta conducta no solo es aplicable en países donde la legislación lo permita sino que conlleva una serie de inconvenientes éticos47.
Sin embargo, es un procedimiento más sencillo y menos arriesgado, con supervivencia esperada para el gemelo normal 80 a 90%48.
Como se mencionó anteriormente, Gratacós et al45 realizaron el feticidio selectivo del gemelo con RCIUs con alteraciones del DV en 9 de 30 casos, antes de las 28 semanas, logrando la sobrevida de todos.
Una publicación reciente49 analizó 90 casos de feticidios selectivos (41 de ellos del tipo II), considerando los mismos parámetros citados, manifestaron una tasa de sobrevida del 93% del gemelo de tamaño normal, prologando la gestación más allá de las 32 semanas en más del 92% de los casos.
Por su parte, la fotocoagulación de las anastomosis placentarias mediante fetoscopía laser50,51, tiene por objeto transformar la placenta MC en una DC o sea "dicorionizar", de manera similar al tratamiento en el STFF para prevenir el posible daño neurológico del gemelo sobreviviente en caso de muerte del gemelo que presenta RCIUs. También prevendría el desarrollo de un STFF concomitante.
La fotocoagulación laser se puede llevar a cabo, pero conlleva mayores riesgos obstétricos y se asocia con un alto riesgo de desaparición del retraso del crecimiento intrauterino del feto en cualquier caso61, ya que el tratamiento interrumpe, por definición, la protección relativa proporcionada por la transfusión de interfetal.
Técnicamente, el láser es más difícil que cuando se lo realiza en el STFF, ya que la placenta no está aplanada por el polihidramnios grave que se presentan en el estadio I de Quintero52 y hay líquido amniótico en el saco del gemelo más pequeño que puede dificultar la visualización de todo el ecuador vascular53.
Peeva et al54 realizaron fotocoagulación laser a 405 gestaciones con diagnóstico de RCIUs tipo II mas STFF (385, 95% en estadío III de Quintero) y lo compararon con 142 gestaciones sin STFF, ya que el feticidio selectivo no estaba contemplado en el protocolo del centro hospitalario. Informaron una supervivencia del gemelo pequeño 39,5% (216) y del gemelo de peso normal del 69,3% (379). Además determinaron que los factores predictores de supervivencia en ambos fetos fueron los hallazgos del Doppler del DV en el gemelo pequeño, la edad gestacional al momento de realizar el láser y la longitud del cuello uterino pero no la co-existencia de STFF o los hallazgos del Doppler en el gemelo de peso mayor.
El láser podría estar asociado con un riesgo menor de muerte inexplicable del gemelo más grande, según lo reportado por Quintero et al61, en 1 de 11 casos de láseres llevados a cabo en las gestaciones complicadas con RCIUs tipo II y confirmada posteriormente por otros grupos, con un caso en 17 gestaciones de tipo III tratados con láser55.
Chalouhi et al56 compararon la terapéutica utilizada en 45 gestaciones complicadas con RCIUs tipo II y III, de las cuales 23 fueron sometidas a fotocoagulación laser selectiva de las anastomosis placentarias y 22 a fotocoagulación del cordón umbilical produciendo el feticidio selectivo, concluyeron que ambas fueron beneficiosas al considerar una supervivencia global de 52,17% y 45,45% respectivamente; sin embargo, al analizar la supervivencia del gemelo de tamaño normal, fue mayor en el grupo de coagulación del cordón umbilical (90,9% vs 74%) además de conseguir la sobrevida del gemelo pequeño en el 30% de los casos.
Por lo tanto, el láser en RCIUs es una opción viable, pero requiere un mayor nivel de experiencia y habilidades quirúrgicas que en el STFF, y el resultado es menos efectivo que con la oclusión del cordón.
La decisión final entre las opciones de tratamiento se verá influido por la gravedad de la restricción del crecimiento, las preferencias de los padres y los aspectos técnicos que pueden incluir la edad gestacional y la ubicación placentaria.
Por razones obvias, la probabilidad de deterioro fetal no será el mismo cuando la discordancia de peso fetal es 25% y hay flujo telediastólico ausente que en presencia de una discordancia del 50% y flujo diastólico final reverso. El deseo de los padres también tendrá una fuerte influencia y algunos pueden considerar la oclusión del cordón umbilical como una opción inaceptable.
Tipo III
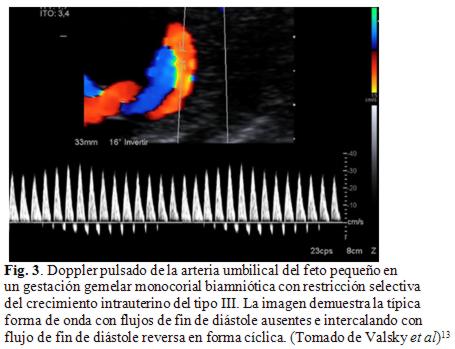
El Doppler presenta AFFD - FFDRi en el gemelo pequeño durante todo el estudio como se puede observar en la Figura 3.
Este tipo de señal Doppler no es patognomónica de gestaciones MC con RCIUs. Ocasionalmente pueden observarse en gestaciones MC sin complicaciones (cuando las inserciones de los cordones están muy próximos y hay grandes anastomosis AA) e incluso en embarazos complicados con STFF57.
El rasgo característico del patrón Doppler, es la alternancia de fases positivas del flujo de fin de diástole con fases del flujo diastólico ausente / inverso, normalmente, pero no siempre de manera cíclica. La observación de este signo indica la presencia de una gran anastomosis AA en la placenta48 que facilita la transmisión de las formas de onda sistólica de un gemelo en el cordón umbilical del otro. Observando el patrón de flujo bidireccional característico de las anastomosis AA, se comprende mejor que la AFFD - FFDRi, es un reflejo distante de un patrón de este tipo en el cordón umbilical del feto pequeño.
La transmisión del patrón de AA en la AU del gemelo más pequeño se explica por la gran discordancia de peso entre los gemelos, en combinación con una AA de gran diámetro, una distancia cercana entre los sitios de inserción del cordón placentario, o ambos48.
Sin embargo, este particular signo debe ser buscado activamente o de lo contrario, fácilmente puede no ser observado con la consecuente subdetección, particularmente en estudios retrospectivos. Esto puede explicar, en parte, las diferencias en la incidencia de fetos con AFFD - FFDRi en RCIUs (20 a 45%) en estudios prospectivos y es la razón de que en estudios retrospectivos no informen casos de este tipo de patón del Doppler en series relativamente grandes de gestaciones complicadas con RCIUs13.
Frecuentemente este signo es más pronunciado cerca de la zona de inserción del cordón placentario. Si es necesario, la respiración materna debe ser retenida durante la exploración Doppler para descartar cualquier influencia que altere las ondas de velocidad de flujo.
Es importante realizar un ajuste en la frecuencia de repetición de pulsos y utilizar bajas velocidades de barrido para identificar los cambios cíclicos menos pronunciadas, y permitir la observación de los cambios oscilatorios en velocidades sistólicas que acompañan a los cambios característicamente diastólicas13.
Fisiopatología y evolución clínica
Desde el punto de vista de la fisiopatología suelen ser los embarazos con mayor desigualdad en la distribución de la torta placentaria y presentan anastomosis AA grandes (> 2 mm) que compensan en gran parte la importante discordancia de los territorios placentarios.
Tienen una severidad intermedia (supervivencia del 80%) con bajo riesgo de deterioro hipoxico del feto con RCIUs, que normalmente sobrevive hasta = 32 semanas, pero son los más impredecibles.De alguna manera en los tipos descritos anteriormente, el largo período de latencia entre el diagnóstico y el desenlace de la gestación, en la mayoría de los casos, el efecto compensador de la gran anastomosis AA, permite la supervivencia del feto con RCIUs hasta etapas avanzadas del embarazo, sin mostrar claros signos de deterioro hipóxico. Este comportamiento puede ser similar al del tipo I. Sin embargo, al contrario, se asocian con un aumento significativo en el riesgo de MFIU inesperada del feto pequeño (15 - 20%) y lesión cerebral en el gemelo de tamaño normal (10 - 20%)48.
Estos resultados adversos explican el alto riesgo de accidentes hemorrágicos feto-fetales agudos a través de la anastomosis AA grande, lo que puede conducir a la muerte del gemelo más pequeño o hipovolemia aguda del otro.
Tales episodios de transfusión feto-fetal aguda pueden ocurrir en presencia de episodios de bradicardia transitoria en el gemelo más pequeño, y son facilitados por el gran diámetro de la anastomosis AA, permitiendo una transfusión directa y rápida en un corto período de tiempo. En las grandes conexiones AA, el aumento de diámetro de los vasos resulta en incrementos exponenciales en el flujo de volumen por segundo.
Bajoria et al58 informaron que el diámetro medio de las anastomosis AA fue más del doble en los casos que se presentan en la AU patrones de flujo AFFD - FFDRi, en comparación con aquellos sin este signo (4,3 mm vs 2,1 mm). A veces, este incremento de dos veces el diámetro del vaso resultada en un aumento de 4 veces y por consiguiente aumenta el flujo de volumen por segundo. Por lo tanto, incluso un corto episodio de bradicardia o hipotensión en el gemelo pequeño puede resultar en un considerable intercambio de sangre en pocos segundos, en comparación con los casos con menor diámetro de las anastomosis AA59.
En una serie clínica de 65 casos de RCIUs tipo III, el 89% de fetos con RCIUs progresaron hasta las 32 semanas o más tarde sin Doppler venoso anómalo o un PBF sin alteraciones sugestivas de deterioro fetal. A pesar de esta evolución aparentemente benigna, el 15,4% de los fetos con RCIU murió inesperadamente horas o días después de un examen normal. Además, incluso si los dos gemelos estaban vivos, el gemelo más grande tenía una incidencia significativamente mayor (19%) de imágenes con lesiones cerebrales neonatales anormales, lo que sugiere lesión de sustancia blanca.
Estos resultados fueron confirmados luego en una serie japonesa51, donde las fetos con RCIUs de tipo III se asociaron con el 15,4% de MFIU en el gemelo más pequeño y el 38,5% de los sobrevivientes de los gemelos de tamaño mayor, mostraron daño cerebral a los 6 meses.
Por lo tanto, la causa más probable de la trasfusión aguda es la aparición de un episodio de bradicardia/hipotensión en uno de los gemelos, donde el "donante agudo" estará expuesto a un alto riesgo de lesión cerebral por isquemia o muerte. A su vez, el "receptor agudo" puede tolerar la transfusión repentina o morir a causa de la hipervolemia.
La muerte fetal puede ser tanto la causa como la consecuencia de una transfusión feto-fetal aguda. Por lo tanto, cuando se diagnostica una muerte fetal única o doble en gemelos MC, normalmente es imposible saber lo que paso en primer lugar.
El gran intercambio de sangre entre gemelos en el tipo III es, por lo tanto, un arma de doble filo, ya que promueve la supervivencia y el crecimiento del gemelo pequeño con una pequeña parte de la placenta, pero esto no está exento de riesgos para el gemelo mayor y los cambios masivos pueden ocurrir en caso de bradicardia o muerte del gemelo más pequeño.
Por otra parte, uno de cada cinco casos del tipo III, el gemelo más grande presenta cardiomegalia, con aumento del grosor de la pared ventricular, muy probablemente causado por la sobrecarga de la perfusión de una parte del territorio de la placenta del gemelo más pequeño. Estos cambios cardíacos hipertróficos parecen que no están asociadas con un resultado perinatal malo60.
Manejo del embarazo y seguimiento
Su manejo representa un verdadero desafío por lo inesperado de su evolución. De una manera similar a lo que se ha discutido para el tipo II, no hay una única opción y a diferencia de éste, la mayoría de los fetos permanecerán estables.
El mayor inconveniente es el alto riesgo de muerte inesperada del gemelo pequeño ante la ausencia de signos ominosos del Doppler y de daño neurológico del co-gemelo.
Si se opta por el tratamiento expectante, el seguimiento debe ser similar a lo descrito anteriormente para los casos de tipo II, es decir, control semanal si el Doppler venoso es normal, y seguimiento más estrecho o conducta activa si se altera el mismo.
Lamentablemente, en el tipo III el feto pequeño rara vez muestra signos de deterioro fetal en el Doppler venoso, y por lo tanto una opción razonable puede ser el nacimiento electivo alrededor de las 32 semanas de gestación.
Esto es claramente una decisión arbitraria y no se fundamenta en ninguna evidencia sino en la opinión de algunos autores13, pero tiene sentido, para permitir ajustar el tiempo del nacimiento de acuerdo al flujo intermitente. Por lo tanto, donde se observa claramente el flujo inverso intermitente en combinación con una gran discordancia estimada peso fetal, una gran anastomosis AA se debe esperar y parece prudente interrumpir el embarazo a las 32 semanas completas. Las razones son probablemente similares a los reportadas para las decisiones en los embarazos MC/MA, es decir, reducir la posibilidad de resultados adversos inesperados.
En las gestaciones con tipo III y moderada discordancia de peso fetal, probablemente podría prolongarse la gestación hasta las 34 semanas.
En caso de considerar terapia fetal, la oclusión del cordón es una opción válida para conseguir la sobrevida del gemelo de tamaño normal y hasta parece razonable que esta terapia normalmente deba reservarse para los casos con formas extremas de AFFD - FFDRi y/o discordancia extrema de los pesos fetales, o si se observa deterioro fetal del feto pequeño.
Por su parte, la coagulación con láser también es factible en los embarazos de tipo III, pero se asocia con dificultades técnicas aún más que en el tipo II. En una pequeña serie clínica61, el procedimiento dio lugar a un riesgo 75% de MFIU para el feto más pequeño en la primera semana después de la apliación de la terapia.
Como compensación, esta terapeútica tiene efectos beneficiosos en el gemelo mayor con una reducción significativa en el riesgo de muerte concomitante de este gemelo después de la muerte intrauterina del feto pequeño72.
En cualquier caso, el láser es un procedimiento complejo y que incluso podría ser inviable, en particular cuando ciertos factores como una placenta anterior, una gran anastomosis AA y/o inserciones de cordón umbilical muy cercanas uno del otro. En realidad, cuando se identifican estos factores antes de la cirugía, sería conveniente reconsiderar la fotocoagulación con láser ya que las posibilidades de fracaso o graves complicaciones, como una perforación de vasos de la placenta, puede ser alta.
Por lo tanto, la fotocoagulación con láser en el tipo III debe ser realizado solamente por los cirujanos con trayectoria consolidada en las cirugías por fetoscopía en embarazos MC, y en cualquier caso, los padres deben ser informados de que la fotocoagulación de la placenta puede fallar. Sin embargo, puede constituir una alternativa razonable para los padres que permitan una conducta activa sin aceptar el feticidio selectivo.
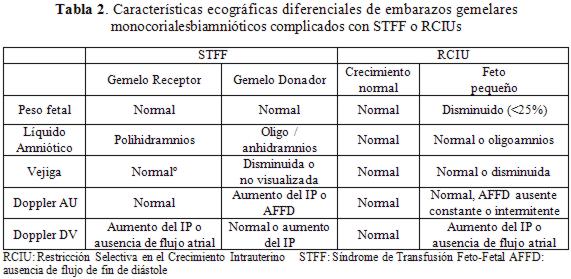
DIAGNOSTICO DIFERENCIAL
El diagnóstico diferencial más importante es con el STFF, dado que a veces se confunden y a veces coexisten62. Históricamente ha sido una fuente de desconcierto. Posiblemente, series no prospectivas de complicaciones de los embarazos MC incluyen proporciones variables de casos con diagnósticos erróneos, lo que sería la causa de las notables diferencias que se encuentran al revisar la literatura. Afortunadamente esta situación ha mejorado considerablemente en los estudios publicados en la última década. Sin embargo, algunas series de STFF manifiestan hasta un 50% de los casos la coexistencia de ambas entidades63.
Las características más importantes para diferenciar entre un STFF o una RCIUs son el líquido amniótico y la disparidad de peso. En el caso del STFF, en el gemelo receptor hay polihidramnios y aumento del tamaño de la vejiga; en caso de RCIUs, el gemelo mayor tendrá líquido amniótico y vejiga normal y una discordancia en el peso fetal (Tabla 2).
El uso del Doppler de la arteria umbilical, también aporta datos para diferenciar ambas entidades64. Sin embargo, se debe considerar la posibilidad que ambas entidades se presenten juntas, estimado en un 40% de las veces65,66 lo que modifica sustancialmente el propósito de sobrevida de ambos fetos73 especialmente en el donador.
En caso de no tener elementos claros para poder diferenciar entre ambas complicaciones se debe considerar como STFF ya que es la condición que presenta más riesgo.
MORBI-MORTALIDAD
La RCIUs se asocia con una mayor probabilidad de muerte fetal y perinatal en comparación con los gemelos que crecen normalmente67. Gao et al68 al analizar la RCIUs en gestaciones monocoriónicas y dicoriónicas, concluyeron que la monocorionicidad era una factor de riesgo para la restricción.
El feto con restricción tiene un mayor riesgo de muerte intrauterina y de daño neurológico al nacimiento69. El feto con crecimiento normal, tiene también un mayor riesgo de daño neurológico, probablemente por periodos de exanguinacion hacia el feto con RCIU, que comprometen la circulación cerebral. En caso de muerte del gemelo con RCIU, aumenta la posibilidad de exanguinacion del feto con crecimiento normal a través de las comunicaciones arteriales.
Inklaar et al70, en una reciente revisión sistemática demostraron luego del análisis de 11 estudios que la incidencia de lesión cerebral grave en los gemelos MC con RCIUs y/o peso fetal discordante, varía desde el 0% al 33%, con un promedio de aproximado del 9,7%45 a 57/661. La incidencia parece ser similar en comparación con el riesgo de lesión cerebral grave reportado en los gemelos bicoriales (8%) y baja en comparación con los gemelos MC tienen STFF (rango: 9% a 38%)71,72,73.
Además, reportaron que la mayor incidencia de lesión cerebral grave se informó en cohortes con menor mediana de edad gestacional en el nacimiento, en los estudios incluidos casos con MFIU de uno de los gemelos y finalmente, en los embarazos con resultados Doppler anormal de la arteria umbilical. Estos tres factores de riesgo son propensos a ser interdependientes.
Curiosamente, el riesgo de lesión cerebral es aproximadamente el doble en el gemelo más grande en comparación con el gemelo más pequeño. Dos teorías diferentes podrían explicar este hallazgo.
Según Gratacós et al45,72, el tipo III (Doppler AFFD - FFDR intermitente) fue identificado como el de mayor riesgo para MFIU del gemelo pequeño y daño neurológico en el gemelo más grande. Teóricamente, este grupo puede ser más propenso intraútero a transfusiones sanguíneas fetales a través de las grandes anastomosis A-A que resulta en lesión hipóxica, particularmente en el gemelo más grande.
Una teoría alternativa, recientemente postulada por Inklaar et al79, sugiere que la lesión cerebral en el gemelo más grande no se desarrolla principalmente en el útero, sino más bien después del nacimiento como resultado del (iatrogénico) parto prematuro por la consecuente inmadurez del cerebro.
Se requiere un análisis detallado de los momentos de la detección de la lesión cerebral grave para determinar si la lesión se debe principalmente a factores prenatales (tales como el Doppler anormal de la arteria umbilical y la perfusión cerebral alterada del cerebro fetal) o factores postnatales debido a la prematuridad.
La detección de la lesión cerebral temprana después del nacimiento (dentro de 1-2 semanas) sugiere una etiología prenatal, mientras que la detección tardía (= 2 semanas después del parto) sugiere una etiología postnatal.
Machado et al74 analizaron en una cohorte retrospectiva de 34 gestaciones gemelares MC/BA, 16 con RCIUs y 18 con restricción del crecimiento intrauterino de ambos gemelos (RCIUns), la mortalidad y morbilidad neonatal en ambos grupos. Reportaron que el grupo de RCIUs tenían una mayor frecuencia de intubación endotraqueal (p = 0,001), asistencia con ventilación mecánica (p = 0,0006) y un mayor tiempo de ayuno durante la hospitalización (p = 0,014), en comparación con los gemelos RCIUns. Además hallaron mayor frecuencia de Doppler de la AU similar para los hallazgos de los tipos II y III (p = 0,002). Sin embargo, no hubo diferencias significativas entre los grupos con respecto a la mortalidad neonatal (p = 0,09).
RCIUs TARDÍO
Se manifiesta luego de la semana 26 presentando crecimiento concordante en el segundo trimestre pero va a mostrar señales progresivas de discordancia a partir del tercer trimestre19. Su angioarquitectura placentaria y evolución clínica son diferentes cuando se comparan con el RCIUs temprano y tienen en general un buen pronóstico.
Presentan menor mortalidad (aproximadamente 5%) y Doppler umbilical generalmente normal. De esta forma, los desequilibrios hemodinámicos tienen más importancia que la discordancia entre los territorios placentarios y tienen menor incidencia de anastomosis AA grandes.
CONCLUSIONES
La gestación monocorial tiene mayor incidencia de malos resultados perinatales que la bicorial, principalmente por las complicaciones derivadas de las anastomosis vasculares placentarias interfetales y del reparto desigual de la placenta, que conducen al desarrollo del RCIUs.
Por ello es fundamental establecer de manera precoz un diagnóstico ecográfico correcto de la cigocidad, realizar un seguimiento cercano para determinar el crecimiento de ambos fetos, un diagnóstico oportuno, clasificarlo a partir del Doppler para establecer los riegos perinatales asociados a cada uno de ellos y aconsejar de la mejor manera a los padres sobre las posibilidades de sobrevida de uno o ambos fetos, así como la morbilidad que conlleva este tipo de gestaciones.
Una vez que tengamos estos datos, se podría planificar algún tratamiento prenatal, desde una conducta expectante a una activa; sin embargo, probablemente no será sencillo establecer criterios para terapia fetal porque no parece vislumbrarse una solución óptima y siempre dependerá de la evaluación de los riegos de muerte fetal y / o de daño neurológico (no siempre fácilmente cuantificables), los deseos y expectativas de los padres y la factibilidad técnica como la localización placentaria o la localización de los cordones.
REFERENCIAS
1. Oldenburg A, Rode L, Bodker B, Ersbak V, Holmskov A, Jorgensen FS, et al. Influence of chorionicity on perinatal outcome in a large cohort of Danish twin pregnancies. Ultrasound Obstet Gynecol. 2012;39:69-74. [ Links ]
2. Torres Torres C, Perez Borbon G, Benavides Serralde JA, Guzman Huerta ME, Hernandez Andrade E. Prevalencia y complicaciones del embarazo gemelar monocorialbiamniotico. GinecolObstetMex. 2010;78(3):181-6. [ Links ]
3. Lewi L, Gucciardo L, Van Mieghem T, De Koninck P, Beck V, Medek H, et al. Monochorionicdiamniotic twin pregnancies: natural history and risk stratification. Fetal DiagnTher. 2010;27(3):121-33. [ Links ]
4. D´AddarioV, Rossi C. Diagnosis of chorionicity: The role of ultrasound. Diagn Prenat 2014;25(2):58-64. [ Links ]
5. Sueters M, Oepkes D. Diagnosis of twin-to-twin transfusion syndrome, selective fetal growth restriction, twin anaemia-polycythaemia sequence, and twin reversed arterial perfusion sequence. Best Pract Res Clin Obstet Gynaecol 2014;28(2):215-26. [ Links ]
6. O'Connor C, McAuliffe FM, Breathnach FM, Geary M, Daly S, Higgins JR, et al. Prediction of outcome in twin pregnancy with first and early second trimester ultrasound. J Matern Fetal Neonatal Med 2013;26(10):1030-5. [ Links ]
7. Acosta-Rojas R, Becker J, Munoz-Abellana B, Ruiz C, Carreras E, Gratacós E, et al. Twin chorionicity and the risk of adverse perinatal outcome. Int J Gynaecol Obstet 2007;96(2):98-102. [ Links ]
8. Lewi L, Gucciardo L, Huber A, Jani J, Van Mieghem T, Done E, et al. Clinical outcome and placental characteristics of monochorionicdiamniotic twin pairs with early- and late-onset discordant growth. Am J Obstet Gynecol 2008;199(5):e1-7. [ Links ]
9. Sepulveda W, Rojas I, Robert JA, Schnapp C, Alcalde JL. Prenatal detection of velamentous insertion of the umbilical cord: a prospective color Doppler ultrasound study. Ultrasound Obstet Gynecol 2003;21(6):564-9. [ Links ]
10. Machado Rde C, BrizotMde L, Miyadahira S, Francisco RP, Krebs VL, et al. Intrauterine growth restriction in monochorionic-diamniotic twins. Rev Assoc Med Bras. 2014;60(6):585-90. [ Links ]
11. Lewi L, Van Schoubroeck D, Gratacos E, Witters I, Timmerman D, Deprest J. Monochorionicdiamniotic twins: complications and management options. Curr Opin Obstet Gynecol 2003;15(2): 177e94. [ Links ]
12. Arrieta S, de la Calle M, Omenaca F, Gonzalez A. Complicaciones fetales en las gestaciones gemelares monocorialesbiamnioticas: estudio de 94 casos. Rev Chil Obstet Ginecol 2012;77(5):347-54. [ Links ]
13. Lewi L, Jani J, Blickstein I, Huber A, Gucciardo L, Van Mieghem T, et al. The outcome of monochorionicdiamniotic twin gestations in the era of invasive fetal therapy: a prospective cohort study. Am J Obstet Gynecol 2008;199(5):514.e1-8. [ Links ]
14. Chang YL, Chang SD, Chao AS, Hsieh PC, Wang CN, Wang TH. Clinical outcome and placental territory ratio of monochorionic twin pregnancies and selective intrauterine growth restriction with different types of umbilical artery Doppler. Prenat Diagn 2009;29(3):253-6. [ Links ]
15. Van Winden KR, Quintero RA, Kontopoulos EV, Korst LM, Llanes A, Chmait RH. Decreased total placental mass found in twin-twin transfusion syndrome gestations with selective growth restriction. Fetal DiagnTher. 2016 Jan 20. [ Links ]
16. Machin GA. Velamentous cord insertion in monochorionic twin gestation. An added risk factor. J Reprod Med 1997;42(12):785-9. [ Links ]
17. Lewi L, Cannie M, BlicksteinI ,Jani J, Huber A, Hecher K, et al. Placental sharing, birth weight discordance, and vascular anastomoses in monochorionicdiamniotic twin placentas. Am J Obstet Gynecol 2007;197(6):587.e1-8. [ Links ]
18. Hack KE, Nikkels PG, Koopman-Esseboom C, Derks JB, Elias SG, van Gemert MJ, et al. Placental characteristics of monochorionicdiamniotic twin pregnancies in relation to perinatal outcome. Placenta 2008;29(11):976-81. [ Links ]
19. Chang YL1, Wang CN, Wei PC, Peng HH, Chao AS, Chang SD, et al. Mitochondrial activation in the growth - restricted fetus of monochorionic twins. Fertil Steril 2013;100(1):241-6.
20. Yinon Y, Ben Meir E, Berezowsky A, Weisz B, Schiffet E, Mazaki-Tovi S, et al. Circulating angiogenic factors in monochorionic twin pregnancies complicated by twin to twin transfusion syndrome and selective intrauterine growth restriction. Am J Obstet Gynecol. 2014;210(2):141.e1-7. [ Links ]
21. Fox CE, Lash GE, Pretlove SJ, Chan BC, Holder R, Kilby MD. Maternal plasma and amniotic fluid angiogenic factors and their receptors in monochorionic twin pregnancies complicated by twin to twin transfusion syndrome. Ultrasound Obstet Gynecol 2010;35(6): 695-701. [ Links ]
22. Moriichi A, Cho K, Mizushima M, Furuse Y, Akimoto T, Yamada T et al. B-type natriuretic peptide levels at birth predict cardiac dysfunction in neonates. Pediatr Int 2012; 54(1):89-93. [ Links ]
23. Van Mieghem T, Done E, Gucciardo L, Klaritsch P, Allegaert K, Van Bree R, et al. Amniotic fluid markers of fetal cardiac dysfunction in twin-to-twin transfusion syndrome. Am J Obstet Gynecol. 2010;202(1): 48 e1-7. [ Links ]
24. Fujioka K, Mizobuchi M, Sakai H, Iwatani S, Wada K, et al. N-terminal pro-brain natriuretic peptide levels in monochorionicdiamniotic twins with selective intrauterine growth restriction. J Perinatol. 2014;34(1):6-10. [ Links ]
25. Salas M, John R, Saxena A, Barton S, Frank D, Fitzpatrick G, et al. Placental growth retardation due to loss of imprinting of Phlda2. Mech Dev. 2006;10(121):1199-210. [ Links ]
26. Apostolidou S, Abu-Amero S, O´Donoghue K, Frost J, Olafsdottir O, Chavele KM, et al. Elevated placental expression of the imprinted PHLDA2 gene is associated with low birth weight. J Mol Med (Berl). 2007;85(4):379-87. [ Links ]
27. Shi X, He Z, Gao Y, Luo Y, Gou C, Fang Q. Placental expression of PHLDA2 in selective intrauterine growth restriction in monozygotic twins. Placenta. 2014;35(6):428-30. [ Links ]
28. Mehrpour M, Esclatine A, Beau I, Codogno P. Overview of macroautophagy regulation in mammalian cells. Cell Res. 2010;20(7):748-62. [ Links ]
29. Maiuri MC, Zalckvar E, Kimchi A, Kroemer G. Self-eating and self-killing: crosstalk between autophagy and apoptosis. Nat Rev Mol Cell Biol 2007;8(9):741-52. [ Links ]
30. Hung TH, Chen SF, Lo LM, Li MJ, Yeh YL, Hsieh TT. Increased autophagy in placentas of intrauterine growth-restricted pregnancies. PLoS One. 2012;7(7):e40957. [ Links ]
31. Chang YL, Wang TH, Chang SD, Chao AS, Hsieh PC, Wang CN. Increased autophagy in the placental territory of selective intrauterine growth-restricted monochorionic twins. Prenat Diagn. 2013;33(2):187-90. [ Links ]
32. Chang YL, Wang TH, Chang SD, Chao AS, Hsieh PC. Fetoscopic laser coagulation of intertwin anastomoses reduces discordant placental autophagic activities in discordant twin growth. Taiwan J Obstet Gynecol. 2015;54(5):580-2. [ Links ]
33. He Z, Lu H, Luo H, Gao F, Wang T, Gao Y, et al. The promoter methylomes of monochorionic twin placentas reveal intrauterine growth restriction-specific variations in the methylation patterns. Sci Rep. 2016;6:20181. [ Links ]
34. Gratacós E, Lewi L, Muñoz B, Acosta-Rojas R, Hernandez-Andrade E, Martínez JM, et al. A classification system for selective intrauterine growth restriction in monochorionic pregnancies according to umbilical artery doppler flow in the smaller twin. Ultrasound Obstet Gynecol. 2007;30(1):28-34. [ Links ]
35. Figueras F, Gratacós E. Update on the diagnosis and classification of fetal growth restriction and proposal of a stage-based management protocol. Fetal DiagnTher. 2014;36(2):86-98. [ Links ]
36. Vanderheyden TM, Fichera A, Pasquini L, Tan TY, Wee LY, Frusca T, et al. Increased latency of absent end-diastolic flow in the umbilical artery of monochorionic twin fetuses. Ultrasound Obstet Gynecol 2005;26(1):44-9. [ Links ]
37. Gratacós E, Lewi L, Carreras E, Becker J, Higueras T, Deprest J, et al. Incidence and characteristics of umbilical artery intermittent absent and/or reversed end-diastolic flow in complicated and uncomplicated monochorionic twin pregnancies. Ultrasound Obstet Gynecol. 2004;23(5):456-60. [ Links ]
38. Ishii K, Murakoshi T, Hayashi S, Saito M, Sago H, Takahashi Y, et al. Ultrasound predictors of mortality in monochorionic twins with selective intrauterine growth restriction. Ultrasound Obstet Gynecol. 2011;37(1):22-6. [ Links ]
39. Denbow ML, Cox P, Taylor M, Hammal DM, Fisk NM. Placental angioarchitecture in monochorionic twin pregnancies: relationship to fetal growth, fetofetal transfusion syndrome, and pregnancy outcome. Am J Obstet Gynecol. 2000;182:417-26. [ Links ]
40. Ishii K, Murakoshi T, Takahashi Y, Shinno T, Matsushita M, Naruse H, et al. Perinatal outcome of monochorionic twins with selective intrauterine growth restriction and different types of umbilical artery doppler under expectant management. Fetal DiagnTher. 2009;26(3):157-61. [ Links ]
41. Chauhan SP, Shields D, Parker D, Sanderson M, Scardo JA, Magann EF. Detecting fetal growth restriction or discordant growth in twin gestations stratified by placental chorionicity. J Reprod Med 2004;49(4):279-84. [ Links ]
42. Gratacos E, Carreras E, Becker J, Lewi L, Enríquez G, Perapoch J, et al. Prevalence of neurological damage in monochorionic twins with selective intrauterine growth restriction. Ultrasound Obst Gynecol. 2004;24:159-163 [ Links ]
43. Quintero RA, Bornick PW, Morales WJ, Allen MH. Selective photocoagulation of communicating vessels in the treatment of monochorionic twins with selective growth retardation. Am J Obstet Gynecol. 2001;185(3):689-96. [ Links ]
44. Visentin S, Macchi V, Grumolato F, Porzionato A, De Caro R, Cosmi E. Expectant management in type II selective intrauterine growth restriction and abnormal cord insertion in monochorionic twins. J Perinat Med. 2013;41(3):309-16. [ Links ]
45. Moise KJ Jr. Surveillance of monochorionic twins. Am J Perinatol 2014;31Suppl 1:S3-6. [ Links ]
46. Robyr R, Yamamoto M, Ville Y. Selective feticide in complicated monochorionic twin pregnancies using ultrasound-guided bipolar cord coagulation. BJOG. 2005;112(10):1344-8. [ Links ]
47. Ville Y. Fetal therapy: practical ethical considerations. Prenat Diagn. 2011;31(7):621-7. [ Links ]
48. Lewi L, Gratacos E, Ortibus E, Van Schoubroeck D, Carreras E, Higueras T, et al. Pregnancy and infant outcome of 80 consecutive cord coagulations in complicated monochorionic multiple pregnancies. Am J Obstet Gynecol. 2006;194(3):782-9. [ Links ]
49. Parra-Cordero M, Bennasar M, Martínez JM, Eixarch E, Torres X, Gratacós E. Cord occlusion in monochorionic twins with early selective intrauterine growth restriction and abnormal umbilical artery Doppler: A consecutive series of 90 cases. Fetal DiagnTher 2016;39(3):186-9.1 [ Links ]
50. Quintero RA, Bornick PW, Morales WJ, Allen MH. Selective photocoagulation of communicating vessels in the treatment of monochorionic twins with selective growth retardation. Am J Obstet Gynecol. 2001;185(3):689-96. [ Links ]
51. Has R, Kalelioglu I, CorbaciogluEsmer A, Ermis H, Dural O, Dogan Y, et al. Bipolar cord coagulation in the management of complicated monochorionic twin pregnancies. Fetal DiagnTher. 2014;36(3):190-5. [ Links ]
52. Quintero RA, Morales WJ, Allen MH, Bornick PW, Johnson PK, Kruger M. Staging of twin-twin transfusion syndrome. J Perinatol. 1999;19(8):550-5. [ Links ]
53. Ishii K, Nakata M, Wada S, Murakoshi T, Sago H. Feasibility and preliminary outcomes of fetoscopic laser photocoagulation for monochorionic twin gestation with selective intrauterine growth restriction accompanied by severe oligohydramnios. J Obstet Gynaecol Res. 2015;41(11):1732-7. [ Links ]
54. Peeva G, Bower S, Orosz L, Chaveeva P, Akolekar R, Nicolaides KH. Endoscopic placental laser coagulation in monochorionicdiamniotic twins with Type II Selective Fetal Growth Restriction. Fetal DiagnTher 2015;38(2):86-93. [ Links ]
55. Gratacos E, Antolin E, Lewi L, Martínez JM, Hernández-Andrade E, Acosta-Rojas R, et al. Monochorionic twins with selective intra- uterine growth restriction and intermittent absent or reversed end-diastolic flow (Type III): feasibility and perinatal outcome of fetoscopic placental laser coagulation. Ultrasound Obstet Gynecol. 2008;31(6):669-75. [ Links ]
56. Chalouhi GE, Marangoni MA, Quibel T, Deloison B, Benzina N, Essaoui M, et al. Active management of selective intrauterine growth restriction with abnormal Doppler in monochorionicdiamniotic twin pregnancies diagnosed in the second trimester of pregnancy. Prenat Diagn. 2013;33(2):109-15. [ Links ]
57. Wee LY, Taylor MJ, Vanderheyden T, Talbert D, Fisk NM. Transmitted arterio-arterial anastomosis waveforms causing cyclically intermittent absent/reversed end-diastolic umbilical artery flow in monochorionic twins. Placenta 2003;24(7):772-8. [ Links ]
58. Bajoria R, Wee LY, Anwar S, Ward S. Outcome of twin pregnancies complicated by single intrauterine death in relation to vascular anatomy of the monochorionic placenta. Hum Reprod 1999;14(8):2124-30. [ Links ]
59. Gratacos E, Carreras E, Becker J, Lewi L, Enríquez G, Perapoch J, et al. Prevalence of neurological damage in monochorionic twins with selective intrauterine growth restriction and intermittent absent or reversed end-diastolic umbilical artery flow. Ultrasound Obstet Gynecol 2004;24(2):159-63. [ Links ]
60. Muñoz-Abellana B, Hernandez-Andrade E, Figueroa-Diesel H, Ferrer Q, Acosta-Rojas R, Cabero L, et al. Hypertrophic cardiomyopathy-like changes in monochorionic twin pregnancies with selective intrauterine growth restriction and intermittent absent/reversed end-diastolic flow in the umbilical artery. Ultrasound Obstet Gynecol. 2007;30(7):977-82. [ Links ]
61. Gratacós E, Antolin E, Lewi L, Martínez JM, Hernandez-Andrade E, Acosta-Rojas R, et al. Monochorionic twins with selective intrauterine growth restriction and intermittent absent or reversed end-diastolic flow (Type III): feasibility and perinatal outcome of fetoscopic placental laser coagulation. Ultrasound Obstet Gynecol. 2008;31(6):669-75. [ Links ]
62. Simpson LL. What you need to know when managing twins 10 key facts. Obstet Gynecol Clin N Am 2015;42(2):225-39. [ Links ]
63. Van Winden KR, Quintero RA, Kontopoulos EV, Korst LM, Llanes A, Chmait RH. Perinatal survival in cases of twin-twin transfusion syndrome complicated by selective intrauterine growth restriction. J Matern Fetal Neonatal Med. 2015;28(13):1549-53. [ Links ]
64. Pasquini L, Conticini S, Tomaiuolo T, Sisti G, Seravalli V, Dani C, et al. Application of umbilical artery classification in complicated monochorionic twins. Twin Res Hum Genet. 2015;18(5):601-5. [ Links ]
65. Van Mieghem T, Eixarch E, Gucciardo L, Done E, Gonzales I, Van Schoubroeck D, et al. Outcome prediction in monochorionicdiamniotic twin pregnancies with moderately discordant amniotic fluid. Ultrasound Obstet Gynecol. 2011;37(1):15-21. [ Links ]
66. Urbano Ortiz J, Martínez JM, Eixarch E, Crispi F, Puerto B, Gratacos E. Complicaciones del embarazo gemelar monocorial: claves para el diagnóstico y tratamiento. Diagn Prenat. 2012;23(3):93-101. [ Links ]
67. Odibo AO, McDonald RE, Stamilio DM, Ural SH, MaconesGA.. Perinatal outcomes in growth- restricted twins compared with age-matched growth-restricted singletons. Am J Perinatol. 2005;22(5):269-73. [ Links ]
68. Gao Y, Zhiming He, Yanmin L, Sun H, Huang L, Li M, et al. Selective and non-selective intrauterine growth restriction in twin pregnancies: high risk factors and perinatal outcome. Arch Gynecol Obstet. 2012;285(4):973-8. [ Links ]
69. Blickstein I. Neurological morbidity of monochorionic twins. Diagn Prenat. 2014;25(2):43-7. [ Links ]
70. Inklaar MJ, van Klink JM, Stolk TT, van Zwet EW, Oepkes D, Lopriore E. Cerebral injury in monochorionic twins with selective intrauterine growth restriction: a systematic review. Prenat Diagn. 2014;34(3):205-13. [ Links ]
71. Lenclen R1, Paupe A, Ciarlo G, Couderc S, Castela F, et al. Neonatal outcome in preterm monochorionic twins with twin-to-twin transfusion syndrome after intrauterine treatment with amnioreduction or fetoscopic laser surgery: comparison with dichorionic twins. Am J Obstet Gynecol. 2007;196(5):450.e1-7.
72. Lopriore E, van Wezel-Meijler G, Middeldorp JM, Sueters M, Vandenbussche FP, Walther FJ. Incidence, origin, and character of cerebral injury in twin-to-twin transfusion syndrome treated with fetoscopic laser surgery. Am J Obstet Gynecol. 2006;194(5):1215-20. [ Links ]
73. Spruijt M, Steggerda S, Rath M, van Zwet E, Oepkes D, et al. Cerebral injury in twin-twin transfusion syndrome treated with fetoscopic laser surgery. Obstet Gynecol. 2012;120(1):15-20. [ Links ]
74. Machado Rde C, BrizotMde L, Miyadahira S, Francisco RP, Krebs VL, Zugaib M. Intrauterine growth restriction in monochorionic-diamniotic twins. Rev Assoc Med Bras 2014;60(6):585-90. [ Links ]
1. Cátedrade Ginecología y Obstetricia. Facultad de Ciencias Médicas. Universidad Nacional de Asunción. (San Lorenzo, Paraguay)
Correo electrónico: mruoticosp@gmail.com
Articulorecibido: 20 de febrero de 2016.Artículo aprobado: 12 de abril de 2016