Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista del Nacional (Itauguá)
Print version ISSN 2072-8174
Rev. Nac. (Itauguá) vol.7 no.1 Itauguá June 2015
https://doi.org/10.18004/rdn2015.0007.01.050-052
CASO CLÍNICO
Secuestro pulmonar extralobar infradiafragmático: a proposito de un caso
Extralobar Infradiaphragmatic Pulmonary sequestration: a case report
Juana Rafaela Torres Escobar1, Teresita De Jesús Santa Cruz Estigarribia2
RESUMEN
Se presenta un caso de secuestro pulmonar extralobar infradiafragmático como hallazgo ultrasonográfico prenatal, confirmado posteriormente por anatomía patológica.
Palabras claves: secuestro pulmonar extralobar infradiafragmático, malformaciones congénitas, ecografía.
ABSTRACT
We present a case of extralobar infradiaphragmatic pulmonary sequestration as prenatal ultrasonographic finding, subsequently confirmed by histopathology.
Keywords: extralobar infradiaphragmatic pulmonary sequestration, congenital malformations, ultrasonography.
INTRODUCCIÓN
Los secuestros pulmonares (SP) son malformaciones congénitas de origen mixto, bronquial y arterial, que se caracterizan por tener una zona de tejido pulmonar embrionario no funcionante, sin comunicación identificable con el árbol traqueobronquial normal, vascularizada a través de una arteria sistémica anómala1,2.
Existen dos variedades de SP dependiendo de la presencia de revestimiento pleural: intralobar y extralobar. En el SP intralobar, que representa del 75% al 85% de los casos diagnosticados en el adulto y raramente diagnosticado en el feto, la masa es contigua al parénquima pulmonar normal y se halla revestida por la pleura. Sin embargo, en el SP extralobar, que supone casi todos los SP diagnosticados prenatalmente, la masa se encuentra anatómicamente separada del tejido pulmonar normal, por fuera de la pleura visceral y recibe irrigación de la aorta torácica o abdominal3,4. Aproximadamente 90% de los SP extralobares ocurren en el hemitórax izquierdo y son generalmente asintomáticos durante el periodo neonatal5.
El SP extralobar puede tener una localización extratorácica, a nivel del diafragma o infradiafragmático, es excepcionalmente raro, tiene una incidencia estimada de 0,5% a 1,7%3,6.
Los avances en las técnicas ecográficas han permitido realizar el diagnóstico inicial del SP extralobar en la etapa prenatal. Se caracteriza por la presencia de una masa ecogénica, bien circunscripta, de forma lobular o triangular, de volumen extremadamente variable, con patrón quístico o pseudoumoral, de localización preferentemente izquierda y puede identificarse en el segundo trimestre3,7,8.
Una vez que se sospecha el diagnóstico se debe tratar de identificar la circulación arterial mediante Doppler color para exponer los vasos sistémicos que nutren el SP. Esto es de mucha importancia ya que las otras lesiones pulmonares (malformación adenomatoide quística, enfisema lobular y atresia bronquial) obtienen su irrigación de los vasos pulmonares9.
La resonancia magnética prenatal puede proporcionar una mejor resolución anatómica, pero por lo general sólo ayuda en la confirmación de los hallazgos ecográficos. En el periodo postnatal, la técnica de elección para caracterizar la lesión es la angiotomografía.
Una masa ecogénica suprarrenal en el abdomen izquierdo suele ser un SP extralobar, pero también puede sugerir una hemorragia suprarrenal o un neuroblastoma. Éste suele ser quístico, derecho y con mayor frecuencia se visualiza en el tercer trimestre3,10. Existen estudios que demuestran la frecuente asociación entre SP extralobar y la malformación adenomatoidea quística tipo II11.
La mayoría de los SP tienen un pronóstico favorable sin intervenciones prenatales y la disminución del tamaño es comúnmente observado, con una regresión espontánea del 68%12. El pronóstico difiere si existe hidropesía u otras anomalías estructurales importantes (hernia diafragmática congénita)13. Al parecer, los SP infradiafragmáticos no tienen influencia en la salud fetal, no se han asociado a hidrops y tienden a ser asintomáticos tras el nacimiento3.
En los SP infradiafragmáticos las opciones terapéuticas son la cirugía convencional y la laparoscópica, técnica segura y factible en recién nacidos y lactantes menores14. También se ha indicado a la embolización de la arteria nutricia como una alternativa terapéutica a la cirugía15. Otros autores descartan esta posibilidad dada la dificultad de distinguir entre SP y otra patología, el riesgo de infección y las complicaciones propias de la embolización arterial16.
PRESENTACIÓN DEL CASO
Paciente primigesta, de 19 años de edad, que acude al Servicio ecografía del Hospital Nacional para la realización de ecografía de las 11-14 semanas, donde se constata gestación única intrauterina, con marcadores cromosómicos dentro del rango normal.
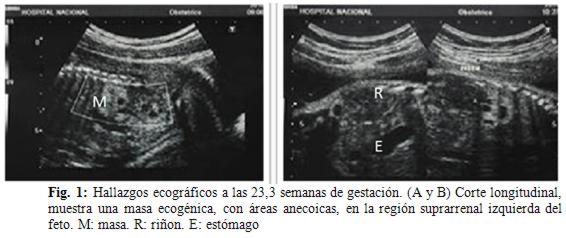
Posteriormente acude para control ecográfico morfológico a las 23,3 semanas, observándose en el polo superior del riñón izquierdo una masa ecogénica, con áreas anecoicas, que impresiona formar parte del riñón, mide 21 x 11 mm. Ausencia de otras alteraciones estructurales (fig. 1).
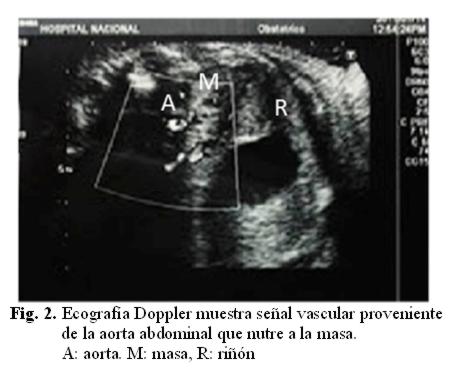
Se realizan controles ecográficos seriados, uno de ellos a las 32,4 semanas, donde se visualiza la misma imagen, suprarrenal izquierda, que mide 20 x 16 mm, al Doppler color señal vascular proveniente de la aorta abdominal. Glándula suprarrenal y riñón izquierdos bien delimitados. Se sugiere como diagnóstico secuestro SP infradiafragmático (fig. 2).
La paciente dio a luz, por parto cesárea, un recién nacido vivo, de sexo femenino, edad gestacional por Capurro de 37,5 semanas, con 2.700 g, Apgar 8/9, sin complicaciones.
Tomografía computada de abdomen a los 20 días de vida informa imagen hipodensa ovalada, de paredes finas, se ubica adosada a polo superior del riñón izquierdo, porción interna, en topografía de la suprarrenal de ese lado, la cual no se identifica. Se interpreta como probable masa suprarrenal.
A los 31 días de vida se realiza tratamiento quirúrgico, constatándose masa sólida por encima de la suprarrenal izquierda que llega hasta el diafragma, mide 3 x 2 x 1 cm, sin infiltrar el mismo.
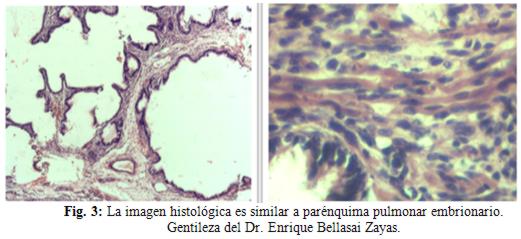
Diagnóstico anatomopatológico: la imagen histológica es similar a parénquima pulmonar embrionario (fig. 3).
Debido a la baja incidencia del SP extralobar infradiafragmático, consideramos útil la presentación de este caso para tenerlo en cuenta al momento de realizar diagnósticos diferenciales ante masas ecográficas abdominales prenatales.
REFERENCIAS
1. Berrocal T, Madrid C, Novo S, Gutiérrez J, Arjonilla A, Gómez-León N. Congenital anomalies of the tracheobronchial tree, lung, and mediastinum: embryology, radiology, and pathology. Radiographics. 2004 Jan-Feb;24(1):e17. [ Links ]
2. Shanmugam G, MacArthur K, Pollock JC. Congenital lung malformations--antenatal and postnatal evaluation and management. Eur J Cardiothorac Surg. 2005 Jan;27(1):45-52. [ Links ]
3. Goldstein RB. The thorax. In: Nyberg DA, McGahan JP, Pretorius DH, Pilu G. Diagnostics imaging of fetal anomalies. Philadelphia, PA: Lippincott Williams " Wilkins, c2003; p. 381-420. [ Links ]
4. Corbett HJ, Humphrey GM. Pulmonary sequestration. Paediatr Respir Rev. 2004 Mar;5(1):59-68. [ Links ]
5. Skrabski R, Royo Y, Di Crosta I, Pueyo C, Sempere T, Maldonado J. Extralobar pulmonary sequestration with an unusual venous drainage to the portal vein: preoperative diagnosis and excision by video-assisted thoracoscopy. J Pediatr Surg. 2012 Oct;47(10):e63-5. [ Links ]
6. Laje P, Martinez-Ferro M, Grisoni E, Dudgeon D. Intraabdominal pulmonary sequestration. A case series and review of the literature. J Pediatr Surg. 2006 Jul;41(7):1309-12. [ Links ]
7. Goldstein RB. A practical approach to fetal chest masses. Ultrasound Q. 2006 Sep;22(3):177-94. [ Links ]
8. Yildirim G, Güngördük K, Aslan H, Ceylan Y. Prenatal diagnosis of an extralobar pulmonary sequestration. Arch Gynecol Obstet. 2008 Aug;278(2):181-6. [ Links ]
9. Cameron HM. Fetal thoracic lesions. Fetal Matern Med Rev. 2003;14(1):23-46. [ Links ]
10. González de Agüero Laborda R, Sobreviela Laserrada M, Morollón Lóriz I, Fabre González E. Diagnóstico ecográfico de las malformaciones torácicas (excluidas las cardíacas). Cienc Ginecol. 2002 Mar; 6(2): 118-128. [ Links ]
11. Conran RM, Stocker JT. Extralobar sequestration with frequently associated congenital cystic adenomatoid malformation, type 2: report of 50 cases. Pediatr Dev Pathol. 1999 Sep-Oct;2(5):454-63. [ Links ]
12. Witlox RS, Lopriore E, Oepkes D. Prenatal interventions for fetal lung lesions. Prenat Diagn. 2011 Jul;31(7):628-36. [ Links ]
13. Tsao K, Albanese CT, Harrison MR. Prenatal therapy for thoracic and mediastinal lesions. World J Surg. 2003 Jan;27(1):77-83. [ Links ]
14. Joyeux L, Mejean N, Rousseau T, Couaillier JF, Piard F, Sapin E. Ectopic extralobar pulmonary sequestrations in children: interest of the laparoscopic approach. J Pediatr Surg. 2010 Nov;45(11):2269-73. [ Links ]
15. Chien KJ, Huang TC, Lin CC, Lee CL, Hsieh KS, Weng KP. Early and late outcomes of coil embolization of pulmonary sequestration in children. Circ J. 2009 May;73(5):938-42. [ Links ]
16. Cho MJ, Kim DY, Kim SC, Kim KS, Kim EA, Lee BS. Embolization versus surgical resection of pulmonary sequestration: clinical experiences with a thoracoscopic approach. J Pediatr Surg. 2012 Dec;47(12):2228-33. [ Links ]
1. Gineco-obstetra. Hospital San Pablo. Ministerio de Salud Pública y Bienestar Social (Asunción, Paraguay).
2. Gineco-obstetra. Departamento de Imágenes. Servicio de Ecografía. Hospital Nacional. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
Articulo recibido: 12 enero 2015. Artículo aprobado: 20 de abril de 2015.
Correo electrónico: chelat_@hotmail.com